Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Zapobieganie biegunkom występującym w przebiegu zdiagnozowanych zakażeń Cryptosporidium parvum, w gospodarstwach z potwierdzoną kryptosporydiozą. Podawanie produktu należy rozpocząć w ciągu pierwszych 24-48 godzin życia.
Zmniejszenie nasilenia biegunek występujących w przebiegu zdiagnozowanych zakażeń
Cryptosporidium parvum.
Podawanie produktu należy rozpocząć w ciągu 24 godzin od wystąpienia biegunki.
W obu przypadkach wykazano ograniczenie wydalania oocyst.
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
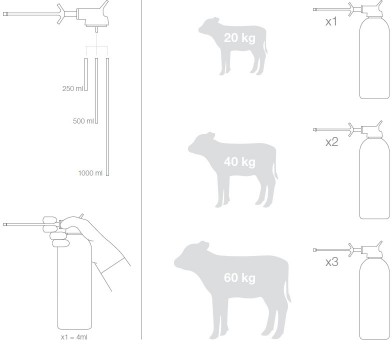
35 kg < cielęta ≤ 45 kg: 8 ml produktu, raz dziennie, przez 7 kolejnych dni
45 kg < cielęta < 60 kg: 12 ml produktu, raz dziennie, przez 7 kolejnych dni
Przykręcić pompkę dozującą do butelki.
Zdjąć nasadkę zabezpieczającą z dyszy.
Jeśli pompka dozująca jest używana po raz pierwszy (lub nie była używana przez kilka dni), ostrożnie naciskać, aż kropla roztworu pojawi się na dyszy.
Przytrzymać cielę i włożyć dyszę pompki dozującej do jamy ustnej zwierzęcia.
Nacisnąć do końca spust pompki dozującej w celu nabrania dawki wynoszącej 4 ml roztworu. Spust należy nacisnąć odpowiednio dwa lub trzy razy celem podania określonej ilości produktu (odpowiednio 8 ml dla cieląt ważących 35 kg - 45 kg oraz 12 ml dla cieląt ważących 45 kg - 60 kg).
Odkręcić pompkę dozującą od butelki.
Zakręcić butelkę.
Nacisnąć dwa lub trzy razy, aby opróżnić pompkę dozującą z pozostałości produktu.
Założyć nasadkę zabezpieczającą na dyszę.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne>
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Halofusol 0,5 mg/ml roztwór doustny dla cieląt
Każdy ml zawiera:
Substancja czynna:
Halofuginon 0,50 mg
co odpowiada 0,6086 mg mleczanu halofuginionu
Substancje pomocnicze:
kwas benzoesowy (E 210) 1,00 mg
tartrazyna (E 102) 0,03 mg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór doustny. Klarowny, żółty roztwór.
Bydło (nowonarodzone cielęta)
U nowonarodzonych cieląt:
Nie stosować na pusty żołądek.
Nie stosować w przypadku biegunki, trwającej ponad 24 godziny oraz u osłabionych zwierząt. Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Produkt należy stosować przy użyciu załączonej pompki dozującej, bądź innego, odpowiedniego urządzenia do podawania doustnego, wyłącznie po uprzednim podaniu siary, mleka lub preparatu mlekozastępczego. Nie stosować na pusty żołądek. Jeśli cielę nie wykazuje łaknienia należy podać produkt rozpuszczony w 0,5 litra roztworu elektrolitowego. Zgodnie z zasadami dobrej praktyki hodowlanej, zwierzęta powinny otrzymać odpowiednią ilość siary.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Osoby o znanej nadwrażliwości na substancję czynną lub substancje pomocnicze powinny stosować produkt leczniczy weterynaryjny z zachowaniem ostrożności.
Powtarzający się kontakt z produktem może prowadzić do wystąpienia objawów skórnych uczulenia. Należy unikać kontaktu produktu ze skórą i oczami. W przypadku kontaktu ze skórą lub oczami, należy narażoną powierzchnię przemyć dużą ilością czystej wody. Jeżeli podrażnienie oczu utrzymuje się, należy zwrócić się o pomoc lekarską. Podczas podawania produktu należy nosić rękawice ochronne. Po zakończeniu podawania produktu należy umyć ręce.
W bardzo rzadkich przypadkach obserwowano nasilenie biegunki u leczonych zwierząt. Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
4.7. Stosowanie w ciąży, laktacji lub w okresie nieśności
Nie dotyczy.
Nieznane
Podanie doustne cielętom, po karmieniu.
Dawka wynosi: 100 μg halofuginonu/kg masy ciała (m.c.)/raz dziennie, przez 7 kolejnych dni, tj. 4 ml produktu/20 kg m.c./raz dziennie przez 7 kolejnych dni.
Aby ułatwić leczenie z zastosowaniem produktu, proponuje się uproszczony schemat dawkowania:
Dla cieląt o mniejszej lub większej masie ciała, należy przeprowadzić dokładne wyliczenie (4ml/20 kg m.c.).
Aby zapewnić właściwe dawkowanie, niezbędne jest stosowanie pompki dozującej lub innego urządzenia odpowiedniego do podawania doustnego.
W przypadku użycia dołączonej pompki dozującej, butelki nie należy trzymać w odwróconej pozycji i należy postępować w następujący sposób:
Kolejne dawki produktu należy podawać o tej samej porze każdego dnia.
Po przeprowadzeniu leczenia u pierwszego cielęcia, wszystkie kolejne nowonarodzone cielęta muszą być systematycznie poddawane leczeniu, dopóki występuje zagrożenie biegunkami wywoływanymi przez C. parvum.
Objawy zatrucia mogą wystąpić po podaniu dawki dwukrotnie przekraczającej dawkę zalecaną, dlatego niezbędne jest ścisłe przestrzeganie zaleconego dawkowania. Objawami zatrucia są biegunka, występowanie krwi w kale, zmniejszenie ilości pobieranego mleka, odwodnienie, apatia, krańcowe wycieńczenie. Jeśli wystąpią objawy kliniczne przedawkowania należy natychmiast przerwać leczenie i podawać tylko mleko lub preparat mlekozastępczy, które nie zawierają substancji o działaniu leczniczym. Niezbędne może okazać się nawodnienie.
Tkanki jadalne: 13 dni.
Grupa farmakoterapeutyczna: inne środki przeciwpierwotniacze, halofuginon.
Kod ATC vet: QP51AX08.
Substancja czynna, halofuginon, jest środkiem przeciwpierwotniaczym z grupy pochodnych chinazolinonu (azotowe związki poli-heterocykliczne). Mleczan halofuginonu (RU 38788) jest solą, której właściwości przeciwpierwotniacze i działanie przeciwko Cryptosporidiumparvum wykazano zarówno w warunkach in vitro, a także w przebiegu doświadczalnie wywołanych oraz naturalnie występujących zakażeń. Substancja czynna wykazuje działanie kryptosporydiostatyczne wobec Cryptosporidium parvum. Najsilniejszą aktywność wykazuje przeciwko wolnym stadiom rozwojowym pasożytów (sporozoity, merozoity). Koncentracja hamująca rozwój 50% i 90% populacji pasożytów w teście in vitro wynosi odpowiednio IC50 < 0,1 μg/ml oraz IC90-4,5 μg/ml.
Biodostępność leku u cieląt po jednokrotnym podaniu doustnym wynosi około 80 %. Czas niezbędny do osiągnięcia najwyższego stężenia Tmax wynosi 11 godzin. Najwyższe stężenie w osoczu Cmax wynosi 4 ng/ml. Objętość dystrybucji wynosi 10 l/kg. Stężenia w osoczu halofuginonu po wielokrotnym podaniu doustnym są porównywalne z wartościami farmakokinetycznymi występującymi po jednokrotnym podaniu doustnym. Główną substancją występującą w tkankach jest niezmieniony halofuginon. Najwyższe stężenia oznaczano w wątrobie i nerkach. Jest on wydalany głównie z moczem. Okres półtrwania wynosi 11,7 godziny po podaniu dożylnym oraz 30,84 godzin po jednokrotnym podaniu doustnym.
Kwas benzoesowy (E 210) Tartrazyna (E 102)
Kwas mlekowy (E 270) Woda oczyszczona
Ponieważ nie wykonywano badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 30 miesięcy Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 6 miesięcy
Brak specjalnych środków ostrożności dotyczących przechowywania.
Biała butelka z polietylenu o wysokiej gęstości zamknięta zakrętką z polietylenu o wysokiej gęstości z dyskiem zgrzewanym indukcyjnie. Produkt leczniczy może być dostarczony z lub bez pompki składającej się z kilku elementów wykonanych z HDPE, LDPE, podziałki z LDPE, polipropylenu, stali nierdzewnej i silikonu.
Wielkości opakowań: Butelka 250 ml
Pudełko tekturowe zawierające 1 butelkę o pojemności 250 ml z pompką dozującą o pojemności 4 ml Pudełko tekturowe zawierające 1 butelkę o pojemności 250 ml
Butelka 500 ml
Pudełko tekturowe zawierające 1 butelkę o pojemności 500 ml z pompką dozującą o pojemności 4 ml Pudełko tekturowe zawierające 1 butelkę o pojemności 500 ml
Butelka 1000 ml
Pudełko tekturowe zawierające 1 butelkę o pojemności 1000 ml z pompką dozującą o pojemności 4 ml
Pudełko tekturowe zawierające 1 butelkę o pojemności 1000 ml Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Produkt nie powinien się przedostawać do cieków wodnych, ponieważ może być niebezpieczny dla ryb i innych organizmów wodnych. Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
LABORATORIOS KARIZOO, S.A.
Pol. Ind. La Borda, Mas Pujades 11-12 08140 Caldes de Montbui
Hiszpania
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy











