Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
Kabergovet 50 mikrogramów/ml roztwór doustny dla psów i kotów
Każdy ml zawiera:
Substancja czynna:
kabergolina 50 µg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór doustny
Jasnożółty, lepki, oleisty roztwór.
Psy, koty
Leczenie ciąży urojonej u suk. Zahamowanie laktacji u suk i kotek.
Nie podawać ciężarnym zwierzętom, ponieważ produkt może powodować poronienie.
Nie stosować razem z antagonistami dopaminy.
Kabergolina może powodować przejściowe obniżenie ciśnienia, nie należy jej stosować u zwierząt, którym jednocześnie podaje się leki obniżające ciśnienie. Nie używać bezpośrednio po zabiegu operacyjnym, gdy zwierzę jest jeszcze pod wpływem leków znieczulających.
Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
W ramach leczenia wspomagającego należy ograniczać spożywanie wody i węglowodanów oraz zwiększać wysiłek zwierząt.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Produkt leczniczy weterynaryjny należy podawać ostrożnie u zwierząt z zaburzeniami czynności wątroby.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Po użyciu produktu umyć ręce. Unikać kontaktu ze skórą i oczami. Natychmiast zmywać wszelkie
miejsca zachlapane produktem.
Kobiety w wieku rozrodczym i karmiące piersią nie powinny mieć kontaktu z produktem lub powinny nosić jednorazowe rękawice podczas podawania produktu.
W przypadku znanej nadwrażliwości na kabergolinę lub jakikolwiek inny składnik produktu, należy unikać kontaktu z tym produktem.
Nie pozostawiać wypełnionych strzykawek w obecności dzieci. W razie przypadkowego połknięcia, szczególnie u dziecka, niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
W bardzo rzadkich przypadkach może wystąpić przejściowe obniżenie ciśnienia. Możliwe działania niepożądane to:
-senność
-anoreksja
-wymioty
Wymienione działania niepożądane mają z reguły umiarkowany i przejściowy charakter. Wymioty pojawiają się zwykle tylko po podaniu pierwszej dawki leku. W takiej sytuacji nie należy wstrzymywać leczenia, jeżeli wymioty nie wystąpią ponownie po podaniu następnych dawek. Bardzo rzadko mogą wystąpić reakcje alergiczne, takie jak obrzęk, pokrzywka, zapalenie skóry i świąd.
Bardzo rzadko mogą wystąpić objawy neurologiczne, takie jak senność, drżenie mięśni, niezborność ruchów, nadpobudliwość i konwulsje.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
4.7. Stosowanie w ciąży, laktacji lub w okresie nieśności
Kabergolina może powodować poronienie w zaawansowanych stadiach ciąży i nie należy jej stosować u ciężarnych zwierząt. Należy dokonać prawidłowej diagnozy odnośnie występowania ciąży i ciąży urojonej.
Produkt jest przeznaczony do tłumienia laktacji: hamowanie wydzielania prolaktyny wskutek działania kabergoliny powoduje szybkie przerwanie laktacji i zmniejszenie rozmiarów gruczołów mlekowych. Produktu nie należy stosować u zwierząt karmiących, chyba że wymagane jest stłumienie laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Kabergolina hamuje wydzielanie prolaktyny przez przysadkę mózgową i hamuje procesy zależne od wydzielania prolaktyny, takie jak laktacja. Maksymalne działanie hamujące jest osiągane po 4-8 godzinach i utrzymuje się przez kilka dni w zależności od podanej dawki.
Kabergolina nie wywiera innego wpływu na układ endokrynny, oprócz hamowania wydzielania prolaktyny.
Kabergolina jest agonistą dopaminy w ośrodkowym układzie nerwowym poprzez selektywną
interakcję z dopaminergicznymi receptorami D2
Kabergolina wykazuje powinowactwo do receptorów noradrenergicznych, jednak nie powoduje to wpływu na metabolizm noradrenaliny i serotoniny.
Kabergolina ma działanie wymiotne, podobnie jak inne pochodne ergoliny (o sile porównywalnej do
bromokryptyny i pergolidu).
Właściwości farmakokinetyczne
Tmax = 1 godz. w dniu 1 i 0,5 – 2 godz. w dniu 28;
Cmax mieściło się w zakresie 1140-3155 pg/ml (średnia 2147pg/ml) w dniu 1 i w zakresie 455- 4217 pg/ml (średnia 2336 pg/ml) w dniu 28;
AUC (0-24 godz.) w dniu 1 mieściło się w zakresie 3896-10216 pg.h.ml-1 (średnia 7056 pg.h/ml), a w dniu 28 w zakresie 3231-19043 pg.h/ml (średnia 11137 pg.h/ml).
Eliminacja
Okres półtrwania w osoczu we krwi psów w dniu 1 ~ 19 godzin; w dniu 28 ~ 10 godzin
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Jako że kabergolina wywiera skutek terapeutyczny poprzez bezpośrednią stymulację receptorów dopaminy, produktu nie należy podawać równocześnie z lekami będącymi antagonistami dopaminy (takimi jak fenotiazyny, butyrenofenony, metoklopramid), ponieważ mogą one zmniejszyć działanie hamujące wydzielanie prolaktyny.
W związku z tym, że kabergolina może wywoływać przejściowe obniżenie ciśnienia, produktu nie
należy stosować u zwierząt, którym jednocześnie podaje się leki obniżające ciśnienie.
Produkt leczniczy weterynaryjny należy stosować doustnie, bezpośrednio lub mieszając z pożywieniem.
Dawka wynosi 0,1 ml/kg masy ciała (równowartość 5 mikrogramów kabergoliny/kg masy ciała) raz
dziennie przez 4–6 dni, w zależności od zaawansowania stanu klinicznego.
Jeżeli objawy nie ustępują po jednym cyklu terapii lub jeżeli powracają po zakończeniu leczenia,
można powtórzyć cały cykl.
Masa ciała leczonego zwierzęcia powinna być dokładnie określona przed podaniem leku.
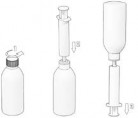
Jak pobrać zalecaną ilość produktu z butelki?
Dane eksperymentalne wskazują na to, że jednorazowe przedawkowanie kabergoliny może skutkować zwiększonym prawdopodobieństwem wystąpienia wymiotów po leczeniu i możliwym nasileniu hipotensji polekowej.
W celu usunięcia niewchłoniętego leku i utrzymania ciśnienia krwi należy – w razie potrzeby – stosować ogólne leczenie wspomagające. Jako odtrutkę można rozważyć pozajelitowe podanie antagonisty dopaminy, np. metoklopramidu.
Nie dotyczy.
Grupa farmakoterapeutyczna: inhibitor prolaktyny należący do grupy pochodnych ergoliny, działający jako agonista dopaminy.
Kod ATC vet: QG02CB03
Kabergolina jest pochodną ergoliny. Wykazuje działanie dopaminergiczne, co prowadzi do zahamowania wydzielania prolaktyny przez przedni płat przysadki mózgowej. Mechanizm działania kabergoliny badano w różnych warunkach in vitro i in vivo. Najważniejsze wyniki można podsumować następująco:
Brak dostępnych danych farmakokinetycznych dla zalecanego schematu dawkowania u psów i kotów. Badania farmakokinetyczne u psów były przeprowadzane z dawką dobową 80 µg/kg masy ciała (16- krotność zalecanej dawki). Psy leczono przez 30 dni; ocenę farmakokinetyczną przeprowadzono w 1 i 28 dniu.
Wchłanianie
Triglicerydy kwasów tłuszczowych o średniej długości łańcucha
Nie mieszać z innymi roztworami wodnymi (np. mlekiem).
Ponieważ nie wykonywano badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego
nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 30 miesięcy Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 28 dni
Przechowywać pojemnik w opakowaniu zewnętrznym w celu ochrony przed światłem.
Oranżowa butelka z PET o pojemności 15 ml (zawierająca 7 ml lub 15 ml produktu) zamknięta zakrętką z HDPE z korkiem z LDPE i uszczelką zabezpieczającą, dostarczana ze strzykawką doustną z PP z tłokiem z HDPE, o pojemności 3 ml.
Wielkości opakowań:
Pudełko tekturowe zawierające 1 butelkę o pojemności 7 ml i 1 strzykawkę doustną.
Pudełko tekturowe zawierające 1 butelkę o pojemności 15 ml i 1 strzykawkę doustną. Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
weterynaryjnego lub pochodzących z niego odpadów
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z
obowiązującymi przepisami.
Przedsiębiorstwo Wielobranżowe Vet-Agro Sp. z o.o. ul. Gliniana 32
20-616 Lublin Polska











