Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okresy karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ShutOut 2,6 g zawiesina dowymieniowa dla krów w okresie zasuszenia
ShutOut 2.6 g Intramammary Suspension for Dry Cows (AT, BE, BG, CY, CZ, DE, EL, ES, HU, IT, LU, MT, NL, PT, RO, SI, SK)
ShutOut Intramammary Suspension for Dry Cows (FR)
Cepralock 2.6 g Intramammary Suspension for Dry Cows (EE, HR, IE, LT, LV, UK) Cepralock vet. 2.6 g Intramammary Suspension for Cattle (DK, FI, IS, NO, SE)
Każda tubostrzykawka dowymieniowa 4 g zawiera:
Substancja czynna:
Bizmutu azotan zasadowy 2,6 g (co odpowiada 1,9 g bizmutu)
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Zawiesina dowymieniowa.
Biała do lekko żółtej, jednorodna zawiesina.
Bydło (krowy mleczne w okresie zasuszenia).
Zapobieganie nowym zakażeniom wewnątrzwymieniowym w okresie zasuszenia.
U krów uznanych za wolne od podklinicznego zapalenia wymienia, produkt może być stosowany samodzielnie w zarządzaniu krowami w okresie zasuszenia oraz w celu zapobiegania zapaleniu wymienia.
Nie stosować produktu jako jedynego leku u krów z podklinicznym zapaleniem wymienia w okresie zasuszenia.
Nie stosować u krów z klinicznym zapaleniem wymienia w okresie zasuszenia. Nie stosować u krów w okresie laktacji. Patrz punkt 4.7.
Nie stosować w przypadkach znanej nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
O zastosowaniu produktu powinna decydować przeprowadzona przez lekarza weterynarii ocena stanu klinicznego poszczególnych krów. Należy w niej uwzględnić historię zapaleń wymienia i odnotowywane liczby komórek somatycznych u poszczególnych krów lub wyniki badań na obecność zapaleń podklinicznych, wykonanych za pomocą odpowiednich, uznanych testów, bądź też badań bakteriologicznych pobranych próbek.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Dobrą praktyką jest regularne obserwowanie zasuszonych krów pod kątem wystąpienia objawów klinicznego zapalenia wymienia. Jeśli w uszczelnionej ćwiartce dojdzie do rozwoju klinicznego zapalenia wymienia, zainfekowaną ćwiartkę należy zdoić ręcznie, a następnie zastosować odpowiednie leczenie.
W celu ograniczenia ryzyka zanieczyszczenia nie należy zanurzać tubostrzykawki w wodzie. Tubostrzykawkę należy stosować wyłącznie jednokrotnie.
Ponieważ produkt nie ma właściwości przeciwbakteryjnych, istotne jest ścisłe przestrzeganie zasad aseptyki podczas jego podawania.
Po zastosowaniu nie należy podawać żadnego innego produktu dowymieniowego.
U krów, u których może występować podkliniczne zapalenie wymienia, produkt może zostać podany po zastosowaniu w zakażonej ćwiartce leczenia antybiotykowego odpowiedniego dla okresu zasuszenia.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Produkt może powodować podrażnienie skóry i oczu. Należy unikać kontaktu ze skórą lub oczami. W przypadku kontaktu ze skórą lub oczami, należy narażony obszar dokładnie przepłukać wodą.
Sole bizmutu mogą wywoływać reakcje nadwrażliwości. Osoby o znanej nadwrażliwości na sole bizmutu powinny unikać podawania tego produktu. Jeśli po ekspozycji pojawią się objawy, należy zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub etykietę.
Po podaniu należy umyć ręce.
Chusteczki dezynfekujące:
Chusteczki dezynfekujące zawierają alkohol izopropylowy i mogą powodować podrażnienia skóry i oczu. Należy unikać kontaktu z oczami oraz przedłużonego kontaktu ze skórą. Należy unikać wdychania oparów. W celu zapobieżenia podrażnieniom skóry należy nosić rękawiczki. Po podaniu należy umyć ręce.
Nieznane.
4.7. Stosowanie w ciąży, laktacji lub w okresie nieśności
Ciąża:
Ponieważ produkt nie ulega wchłanianiu po podaniu dowymieniowym, może być stosowany u zwierząt ciężarnych. Po wycieleniu uszczelnienie może zostać spożyte przez cielę. Spożycie produktu przez cielę jest bezpieczne i nie wywołuje działań niepożądanych.
Laktacja:
Produkt jest wskazany do stosowania u krów w okresie zasuszenia. W przypadku omyłkowego zastosowania u krowy w okresie laktacji, można zaobserwować niewielki (do 2-krotnego)
przemijający wzrost liczby komórek somatycznych. W takim przypadku należy zdoić wymię ręcznie, aby usunąć uszczelnienie. Żadne dodatkowe środki ostrożności nie są konieczne.
W badaniach klinicznych wykazano zgodność porównywalnej formulacji uszczelnienia wymienia zawierającej azotan zasadowy bizmutu jedynie z produktami do stosowania w okresie zasuszenia zawierającymi kloksacylinę.
Patrz także punkt 4.5 „Specjalne środki ostrożności dotyczące stosowania u zwierząt”.
Wyłącznie do podania dowymieniowego.
Produkt posiada dyszę z podwójną końcówką. Zatyczkę tubostrzykawki można usunąć częściowo lub całkowicie. Zaleca się chwycić strzyk u jego podstawy, ponieważ pomaga to umieścić pastę w zatoce strzykowej, by zamknąć kanał strzykowy od góry.
Opcja krótkiej końcówki: krótka końcówka umożliwia podanie produktu przez wprowadzenie końcówki jedynie do początkowego odcinka kanału strzykowego.
Opcja długiej końcówki: długa końcówka może ułatwić podawanie i pomaga uniknąć wysunięcia końcówki w przypadku leczenia nerwowych lub ruchliwych krów.
Krok 1: usunięcie odłamywanej części zatyczki Krok 2: wprowadzenie długiej lub krótkiej końcówki

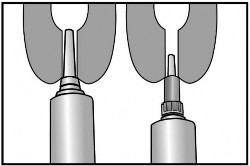
Wprowadzić zawartość jednej tubostrzykawki do każdej ćwiartki wymienia bezpośrednio po ostatnim doju w okresie laktacji (przy zasuszeniu). Nie masować strzyku ani wymienia po podaniu produktu, ponieważ ważne jest, aby produkt uszczelniający pozostał w samym strzyku i nie dostał się do wymienia.
Należy zachować ostrożność, aby nie wprowadzić patogenów do strzyka, co pozwoli zmniejszyć ryzyko zapalenia wymienia po infuzji.
Istotne jest, aby strzyk został dokładnie wyczyszczony załączonymi chusteczkami dezynfekującymi z alkoholem. Strzyki należy wycierać do momentu, gdy na chusteczce nie będzie widać żadnego brudu. Przed infuzją strzyki należy pozostawić do wyschnięcia. Wlew wykonać zgodnie z zasadami aseptyki, aby uniknąć zanieczyszczenia dyszy tubostrzykawki. Po wlewie zaleca się użycie odpowiedniego płynu do kąpieli strzyków lub aerozolu.
W niskich temperaturach produkt można ogrzać do temperatury pokojowej w ciepłym otoczeniu, aby ułatwić wstrzykiwanie.
Po podaniu krowom dwukrotnej dawki zalecanej nie obserwowano klinicznych działań niepożądanych.
Tkanki jadalne: zero dni. Mleko: zero godzin.
Grupa farmakoterapeutyczna: różne produkty do strzyków i wymion. Kod ATCvet: QG52X.
Wprowadzenie produktu do każdej ćwiartki wymienia tworzy fizyczną barierę przed wnikaniem bakterii, ograniczając częstość występowania nowych zakażeń wymienia w okresie zasuszenia. Produkt jest sterylny i nie ma działania przeciwbakteryjnego.
Zasadowy azotan bizmutu nie jest wchłaniany z gruczołu mlekowego, ale pozostaje w strzyku
zamykając jego światło do momentu fizycznego usunięcia (co wykazano u krów z okresem zasuszenia do 100 dni).
Parafina ciekła Glinu stearynian
Krzemionka koloidalna bezwodna
Nieznane.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata.
Brak specjalnych środków ostrożności dotyczących przechowywania tego produktu leczniczego weterynaryjnego.
Jednodawkowa tubostrzykawka dowymieniowa z LDPE, z odłamywaną zatyczką z LDPE, zawierająca 4 g pasty.
Wielkości opakowań:
Pudełko tekturowe zawierające 24 tubostrzykawki i chusteczki dezynfekujące, nasączone alkoholem. Wiaderko plastikowe zawierające 144 tubostrzykawki i chusteczki dezynfekujące, nasączone alkoholem.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady (w tym zużyte uszczelnienie) należy usunąć w sposób zgodny z obowiązującymi przepisami.
Intervet International B.V. Wim de Körverstraat 35 5831 AN Boxmeer Holandia
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy











