Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10 000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10 000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy,
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Pudełko tekturowe zawierające 1 blister z 10 tabletkami (10 tabletek).
Pudełko tekturowe zawierające 3 blistry z 10 tabletkami (30 tabletek).
Pudełko tekturowe zawierające 6 blistrów z 10 tabletkami (60 tabletek).
Pudełko tekturowe zawierające 10 blistrów z 10 tabletkami (100 tabletek).
Pudełko tekturowe zawierające 18 blistrów z 10 tabletkami (180 tabletek).
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Ficoxil 227 mg tabletki do rozgryzania i żucia dla psów
Ficoxil 227 mg chewable tablets for dogs (AT, BE, BG, CY, CZ, DE, DK, EL, ES, FI, FR HU, IE, IS, IT, LT, LV, NL, NO, PT, RO, SE, SI, SK, UK)
Ficoxil, 227 mg chewable tablets for dogs (EE)
Każda tabletka zawiera:
Substancja czynna:
Firokoksyb 227 mg
Substancje pomocnicze:
Tlenek żelaza czerwony (E172) 0,525 mg Tlenek żelaza żółty (E172) 0,225 mg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka do rozgryzania i żucia.
Obustronnie wypukła, różowawa, okrągła tabletka z dwiema liniami podziału po jednej stronie, bez
napisu.
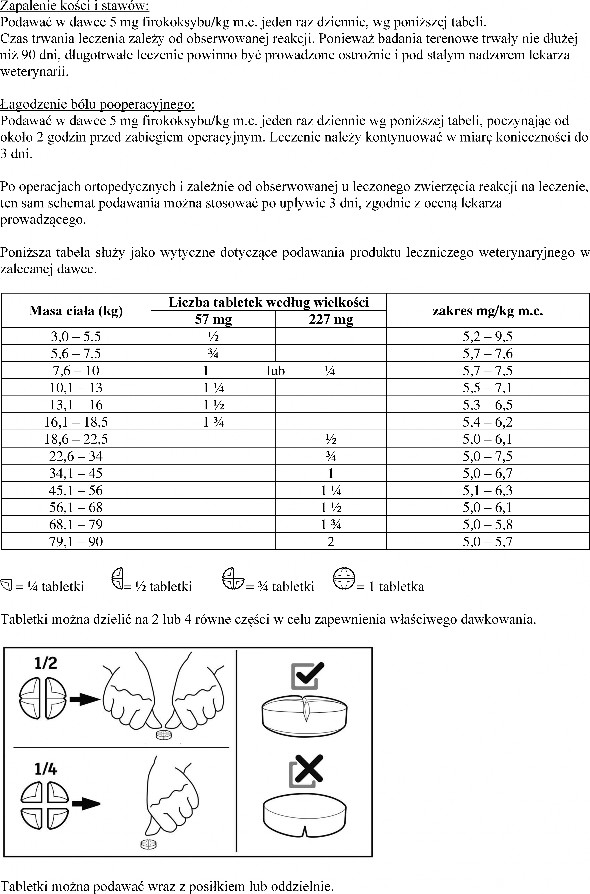
Tabletki mogą być podzielone na 2 lub 4 równe części.
Psy.
Łagodzenie bólu oraz stanu zapalnego spowodowanego zapaleniem kości i stawów u psów. Łagodzenie bólu pooperacyjnego oraz stanu zapalnego po operacjach tkanek miękkich oraz operacjach ortopedycznych i stomatologicznych u psów.
Nie stosować u ciężarnych lub karmiących suk.
Nie stosować u zwierząt w wieku poniżej 10 tygodni lub o masie ciała poniżej 3 kg.
Nie stosować u zwierząt z objawami krwawienia z żołądka i jelit, u psów o nieprawidłowym składzie
krwi oraz z zaburzeniami krzepliwości krwi.
Nie podawać jednocześnie z kortykosteroidami lub innymi niesteroidowymi lekami przeciwzapalnymi (NLPZ).
Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję
pomocniczą.
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Tabletki są smakowe, z tego względu należy je przechowywać w bezpiecznym miejscu niedostępnym dla zwierząt.
Nie należy przekraczać zalecanej dawki, wskazanej w tabeli z dawkowaniem.
Podawanie zwierzętom bardzo młodym lub zwierzętom, u których istnieje podejrzenie lub stwierdzono niewydolność czynnościową nerek, serca lub wątroby, może wiązać się z dodatkowym ryzykiem. Gdy u takich psów nie można uniknąć zastosowania produktu, muszą one pozostawać pod ścisłym nadzorem ze strony lekarza weterynarii.
Unikać stosowania u zwierząt odwodnionych, z hipowolemią lub z hipotensją w związku z możliwym ryzykiem zwiększenia objawów toksyczności wobec nerek. Należy unikać równoczesnego podawania leków o potencjalnym działaniu nefrotoksycznym.
Produkt należy stosować pod ścisłą kontrolą lekarza weterynarii w każdym przypadku gdy istnieje ryzyko krwawienia z przewodu pokarmowego lub jeśli u zwierzęcia wcześniej stwierdzono nietolerancję na NLPZ. W bardzo rzadkich przypadkach u psów, u których podawano produkt w dawkach zalecanych, obserwowano zaburzenia czynności nerek i (lub) wątroby. Możliwe jest, że w części z tych przypadków przed rozpoczęciem terapii występowały zaburzenia pracy nerek lub wątroby w postaci subklinicznej. Dlatego też, w celu określenia wyjściowych parametrów biochemicznych czynności nerek i wątroby, zaleca się przeprowadzanie właściwych testów laboratoryjnych przed rozpoczęciem leczenia oraz okresowo w czasie trwania terapii.
Należy przerwać leczenie w przypadku zaobserwowania któregokolwiek z następujących objawów: nawracająca biegunka, wymioty, krew utajona w kale, gwałtowna utrata masy ciała, anoreksja, osowiałość, pogorszenie biochemicznych wskaźników nerkowych i wątrobowych.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Produkt może być szkodliwy po przypadkowym spożyciu.
W celu uniemożliwienia dzieciom dostępu do produktu, tabletki należy podawać i przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Połówki lub ćwiartki tabletek należy umieścić z powrotem w blistrze i włożyć do pudełka.
Badania laboratoryjne na szczurach i królikach wykazały, że firokoksyb może potencjalnie wpływać na reprodukcję i powodować wady rozwojowe u płodów. Kobiety w ciąży lub kobiety planujące zajście w ciążę powinny zachować ostrożność podczas podawania produktu.
Po użyciu produktu należy umyć ręce.
Po przypadkowym połknięciu jednej lub więcej tabletek, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Wymioty i biegunkę obserwowano sporadycznie. Objawy te mają przeważnie charakter przemijający i ustępują w momencie zaprzestania terapii. W bardzo rzadkich przypadkach u psów, u których podawano produkt w dawkach zalecanych, obserwowano zaburzenia czynności nerek i (lub) wątroby. U leczonych psów rzadko obserwowano zaburzenia układu nerwowego.
W razie wystąpienia takich reakcji niepożądanych jak wymioty, nawracająca biegunka, krew utajona w kale, gwałtowna utrata masy ciała, anoreksja, osowiałość, pogorszenie biochemicznych wskaźników nerkowych i wątrobowych, należy zaprzestać podawania produktu i zasięgnąć porady lekarza weterynarii. Tak jak w przypadku innych niesteroidowych leków przeciwzapalnych, mogą wystąpić ciężkie działania niepożądane, które w bardzo rzadkich przypadkach mogą prowadzić do śmierci zwierzęcia.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Nie stosować u ciężarnych lub karmiących suk.
Badania laboratoryjne na królikach wykazały działanie toksyczne na organizm matki i płodu w
dawkach zbliżonych do dawek leczniczych zalecanych u psów.
Wcześniejsze podawanie innych substancji przeciwzapalnych może wywoływać dodatkowe lub nasilone objawy niepożądane. Dlatego też, na co najmniej 24 godziny przed rozpoczęciem leczenia produktem leczniczym weterynaryjnym należy zaprzestać stosowania tych substancji. Okres bez podawania leku powinien uwzględniać właściwości farmakokinetyczne stosowanych wcześniej produktów.
Nie wolno podawać produktu leczniczego weterynaryjnego jednocześnie z innymi NLPZ lub glikokortykosteroidami. U zwierząt otrzymujących NLPZ może nastąpić zaostrzenie stanu owrzodzenia przewodu pokarmowego po podaniu kortykosteroidów.
Jednoczesna terapia substancjami wpływającymi na przepływ nerkowy, np. diuretykami lub inhibitorami konwertazy angiotensyny (ACE), powinna odbywać się pod kontrolą kliniczną. Należy unikać jednoczesnego podawania leków o możliwym działaniu nefrotoksycznym, gdyż mogą one zwiększyć ryzyko działania toksycznego wobec nerek. Ze względu na to, że leki znieczulające mogą wpływać na przepływ nerkowy, należy rozważyć parenteralne podawanie płynów podczas zabiegu operacyjnego, aby zmniejszyć ryzyko wystąpienia powikłań ze strony nerek, szczególnie kiedy w okresie okołooperacyjnym podawane są niesterydowe leki przeciwzapalne.
Równoczesne podawanie innych substancji czynnych, charakteryzujących się wysokim stopniem wiązania z białkami może, na zasadzie konkurencyjności, uniemożliwiać wiązanie się firokoksybu i prowadzić do objawów toksyczności.
Podanie doustne.
odtrutki), jeśli konieczne
U psów, które miały dziesięć tygodni w momencie rozpoczęcia leczenia, po trzech miesiącach leczenia w dawkach równych lub wyższych niż 25 mg/kg m.c./dzień (5-ciokrotnie wyższych od zalecanej dawki) obserwowano następujące objawy toksyczne: utratę masy ciała i łaknienia, zmiany w wątrobie (odkładanie się tłuszczów), mózgu (wakuolizacja), dwunastnicy (owrzodzenie) i śmierć.
Podobne objawy obserwowano po stosowaniu przez okres sześciu miesięcy dawek równych lub wyższych niż 15 mg/kg m.c./dzień (3-krotnie wyższych od zalecanej dawki), jednakże ich nasilenie i częstość były mniejsze oraz nie stwierdzono owrzodzenia dwunastnicy.
Badania bezpieczeństwa stosowania przeprowadzone u zwierząt docelowych wykazały, że objawy kliniczne toksyczności ustępowały u niektórych zwierząt po zaprzestaniu leczenia.
U psów, które miały siedem miesięcy w momencie rozpoczęcia leczenia, po sześciu miesiącach leczenia z zastosowaniem dawek równych lub wyższych niż 25 mg/kg m.c./dzień (5-ciokrotnie większych od zalecanej dawki) obserwowano wystąpienie niepożądanych objawów żołądkowo- jelitowych, tj. wymiotów.
Nie prowadzono badań przedawkowania u zwierząt starszych niż 14 miesięcy.
W przypadku stwierdzenia objawów przedawkowania należy przerwać leczenie.
Nie dotyczy.
Grupa farmakoterapeutyczna: niesteroidowe leki przeciwzapalne i przeciwreumatyczne. Kod ATCvet: QM01AH90.
Firokoksyb jest niesteroidowym lekiem przeciwzapalnym (NLPZ) należącym do grupy koksybów, który działa poprzez selektywne hamowanie syntezy prostaglandyn, zachodzącej za pośrednictwem cyklooksygenazy-2 (COX-2). Cyklooksygenaza jest odpowiedzialna za wytwarzanie prostaglandyn. COX-2 jest izoformą enzymu, który, jak wykazano, jest indukowany przez czynniki prozapalne.
Uważa się także, że jest on głównym czynnikiem odpowiedzialnym za syntezę prostanoidowych mediatorów bólu, stanu zapalnego i gorączki. Dlatego też koksyby wykazują właściwości przeciwbólowe, przeciwzapalne i przeciwgorączkowe. Uważa się również, że COX-2 bierze udział w owulacji, implantacji i zamknięciu przewodu tętniczego Botalla oraz funkcjach ośrodkowego układu nerwowego (wywoływanie gorączki, odczuwanie bólu i funkcje poznawcze). W badaniach in vitro pełnej krwi u psów, firokoksyb wykazuje prawie 380-krotnie większą selektywność wobec COX-2 w porównaniu z COX-1. Stężenie firokoksybu niezbędne do zahamowania 50% enzymu COX-2 (tj.
IC50) wynosi 0,16 (± 0,05) μM, podczas gdy IC50 dla COX-1 wynosi 56 (± 7) μM.
Po doustnym podaniu psom zalecanej dawki 5 mg/kg masy ciała, firokoksyb wchłania się szybko, osiągając maksymalne stężenie w czasie 2,43 (± 1,04) godziny (Tmax). Stężenie maksymalne (Cmax) wynosi 1,11 (± 0,47) μg/ml, stężenie w osoczu-czas może wykazywać rozkład bimodalny z potencjalnym cyklem jelitowo-wątrobowym, pole powierzchni pod krzywą (AUCt-last) wynosi 8,88 (±3,66) μg x hr/ml, a biodostępność po podaniu doustnym osiąga 36,9 % (± 20,4%). Okres półtrwania w fazie końcowej (t½) wynosi 5,71 (± 1,51) godziny (średnia harmoniczna 5,33 godz.). Firokoksyb
wiąże się z białkami osocza w około 96 %. Po podaniu wielokrotnym dawek doustnych stan stacjonarny osiągany jest po podaniu trzeciej dawki dobowej.
Firokoksyb jest metabolizowany głównie w wątrobie, ulegając głównie dealkilowaniu oraz glukuronizacji. Jest wydalany głównie z żółcią oraz przez przewód pokarmowy.
Laktoza jednowodna Powidon Krospowidon
Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Magnezu stearynian
Aromat wołowiny
Tlenek żelaza czerwony (E172)
Tlenek żelaza żółty (E172)
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata.
Brak specjalnych środków ostrożności dotyczących przechowywania produktu leczniczego weterynaryjnego.
Pozostałą część tabletki należy ponownie umieścić w blistrze i zużyć przy kolejnym podaniu w ciągu
7 dni.
Przezroczysty blister PVDC-PE-PVC/aluminium lub blister PVC-aluminium-OPA/aluminium. Wielkości opakowań:
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z
obowiązującymi przepisami.
LIVISTO Int’l, S.L.
Av. Universitat Autònoma, 29
08290 Cerdanyola del Vallès (Barcelona) Hiszpania
/DATA PRZEDŁUŻENIA POZWOLENIA
10 DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy.











