Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10 000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10 000 leczonych zwierząt włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Vomend vet 10 mg tabletki do rozgryzania i żucia dla psów (BE, DK, FI, SE)
Metomotyl 10 mg chewable tablets for dogs (AT, DE, EE, HR, NL, NO, SI) Metomotyl 10 chewable tablets for dogs (FR)
Każda tabletka zawiera:
Substancja czynna:
Metoklopramid (jako chlorowodorek jednowodny) 8,92 mg
(co odpowiada 10,0 mg metoklopramidu chlorowodorku)
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka do rozgryzania i żucia
Jasnobrązowa z brązowym plamkami, okrągła i wypukła tabletka o średnicy 7 mm z linią podziału w kształcie krzyża po jednej stronie.
Tabletki można podzielić na 2 lub 4 równe części.
Psy
Złagodzenie objawów, takich jak częste wymioty, rozszerzenie żołądka, przewlekłe zapalenie żołądka, refluks dwunastniczo-żołądkowy i biegunka związane z obniżoną perystaltyką przewodu pokarmowego.
Nie stosować w przypadkach krwawienia z przewodu pokarmowego, perforacji lub niedrożności przewodu pokarmowego.
Nie stosować u zwierząt ze stwierdzoną nadwrażliwością na substancję czynną lub na dowolną substancję pomocniczą.
Nie stosować u psów o masie ciała poniżej 10 kg.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Unikać podawania zwierzętom z zaburzeniami drgawkowymi, np. padaczką, lub urazem głowy. Ponieważ metoklopramid może zwiększać poziom prolaktyny, należy zachować ostrożność podczas stosowania u psów z ciążą urojoną.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Produkt może powodować działania neurologiczne po przypadkowym spożyciu, zwłaszcza przez dzieci.
Dzieci nie powinny mieć styczności z produktem leczniczym weterynaryjnym. Niezużyte części tabletki należy umieścić z powrotem w blistrze i pudełku oraz przechowywać ostrożnie poza zasięgiem dzieci i zawsze zużywać podczas następnego podania.
Po przypadkowym połknięciu należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Senności i biegunki występowały bardzo rzadko.
U psów występowanie działań neurologicznych (pobudzenie, ataksja, nienaturalne pozycje i (lub) ruchy, prostracja, drżenia i agresja, wokalizacja) zgłaszano bardzo rzadko. Obserwowane działania są przemijające i ustępują po przerwaniu leczenia.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Ciąża i laktacja:
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego w czasie ciąży i laktacji nie zostało określone. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
W przypadkach zapalenia żołądka należy unikać jednoczesnego podawania leków antycholinergicznych (atropiny), ponieważ mogą znosić działanie metoklopramidu na perystaltykę przewodu pokarmowego.
W przypadkach jednoczesnej biegunki nie ma przeciwwskazań do stosowania leków antycholinergicznych.
Jednoczesne stosowanie metoklopramidu z neuroleptykami pochodnymi fenotiazyny (acepromazyna)
i butyferonu zwiększa ryzyko działania neurologicznego (patrz punkt 4.6).
Metoklopramid może nasilać działanie produktów wpływających depresyjnie na ośrodkowy układ nerwowy. W przypadku jednoczesnego stosowania zaleca się użycie najmniejszej dawki metoklopramidu, aby uniknąć nadmiernej sedacji.
Podanie doustne.
Zalecana dawka to 0,22 mg metoklopramidu (co odpowiada 0,25 mg metoklopramidu chlorowodorku) na kg masy ciała, 4 razy na dzień.
Poniższa tabela jest przeznaczona jako wskazówka przy podawaniu produktu:
Masa ciała kg | Dawka mg/zwierzę* | Vomend vet 5 g | Vomend vet 10 g | |
5-7,5 | 1,25 |
|
>7,5-12,5 | 2,5 |
| LUB |
|
>12,5-17,5 | 3,75 |
| ||
>17,5-22,5 | 5 |
| LUB |
|
>22,5-27,5 | 6,25 |
| ||
>27,5-32,5 | 7,5 | LUB |
| |
>32,5-37,5 | 8,75 | |||
>37,5-45 | 10 |
| LUB |
|
>45-55 | 12,5 |
| LUB |
|
>55-65 | 15 |
| LUB | |
>65-75 | 17,5 |
| LUB | |
>75-85 | 20 |
| LUB |
|












= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
* dawka w mg metoklopramidu chlorowodorku na zwierzę na podanie.
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni ze stroną z linią podziału skierowaną do góry i stroną wypukłą (zaokrągloną) skierowaną do powierzchni.
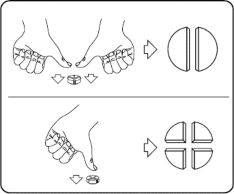
2 równe części: nacisnąć kciukami po obu stronach tabletki.
4 równe części: nacisnąć kciukiem w połowie tabletki.
W przypadku przedawkowania nie są znane inne działania niepożądane niż te opisane w punkcie 4.6.
Nie dotyczy.
Grupa farmakoterapeutyczna: leki stosowane w czynnościowych zaburzeniach układu pokarmowego, prokinetyki
Kod ATCvet: QA03FA01
Działanie przeciwwymiotne metoklopramidu wynika głównie z jego aktywności antagonistycznej w receptorach D2 w ośrodkowym układzie nerwowym, zapobiegając nudnościom i wymiotom wywołanym przez większość bodźców.
Działanie prokinetyczne na pasaż przez żołądek i dwunastnicę (zwiększenie nasilenia i rytmu skurczów żołądka i otwarcie odźwiernika) jest pośredniczone przez aktywność muskarynową, aktywność antagonistyczną w receptorach D2 i aktywność agonistyczną w receptorach 5-HT4 na poziomie przewodu pokarmowego.
Metoklopramid jest szybko i całkowicie wchłaniany po podaniu doustnym.
Metoklopramid jest szybko rozprowadzany do większości tkanek i płynów, przekracza barierę krew- mózg.
Metoklopramid jest metabolizowany przez wątrobę. Usuwanie metoklopramidu odbywa się głównie
z moczem.
Laktoza bezwodna Kroskarmeloza sodowa Magnezu stearynian Aromat drobiowy Drożdże (suszone)
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 30 miesięcy. Okres ważności podzielonych tabletek po pierwszym otwarciu opakowania bezpośredniego: 3 dni.
Każdą niewykorzystaną część tabletki należy umieścić z powrotem w otwartym blistrze i tekturowym pudełku.
Blistry OPA/ALU/PVC//ALU zawierające 10 tabletek.
Pudełko tekturowe zawierające 10 lub 100 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny
z obowiązującymi przepisami.
Dechra Regulatory B.V. Handelsweg 25
5531 AE Bladel Holandia
OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: {DD/MM/RRRR}





























