Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Fatroseal 2,6 g, zawiesina dowymieniowa dla krów w okresie zasuszenia
FATROSEAL 2.6 g intramammary suspension for dry cows(AT, BE, CZ, DE, DK, EE, EL, ES, IE, LU, NL, HU, PT, SK, NI).
FATROSEAL intramammary suspension for dry cows (FR).
Każda tubostrzykawka dowymieniowa 4 g zawiera:
Substancja czynna:
Bizmutu azotan zasadowy ciężki 2,6 g (co odpowiada 1,858 g bizmutowi ciężkiemu)
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Zawiesina dowymieniowa.
Jednorodna zawiesina o barwie od białej do szarawej.
Bydło (krowy mleczne w okresie zasuszenia).
Zapobieganie nowym zakażeniom wewnątrzwymieniowym w okresie zasuszenia.
U krów uznanych za wolne od podklinicznej postaci zapalenia wymienia, produkt może być stosowany niezależnie w okresie zasuszenia i w celu zapobiegania zapaleniu wymienia.
Nie stosować u krów w okresie laktacji. Patrz punkt 4.7.
Nie stosować jako jedyny produkt leczniczy weterynaryjny u krów z podkliniczną postacią zapalenia wymienia w okresie zasuszenia.
Nie stosować u krów z kliniczną postacią zapalenia wymienia w okresie zasuszenia.
Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Decyzja o zastosowaniu produktu powinna zostać podjęta po przeprowadzeniu przez lekarza weterynarii oceny stanu klinicznego poszczególnych krów. W kryteriach oceny należy uwzględnić historię zapaleń wymienia i odnotowywane liczby komórek somatycznych u poszczególnych krów lub
wyniki badań na obecność zapaleń podklinicznych, wykonanych za pomocą odpowiednich, uznanych testów, bądź też badań bakteriologicznych pobranych próbek.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Dobrą praktyką jest regularna obserwacja krów w okresie zasuszenia pod kątem objawów klinicznej postaci zapalenia wymienia. Jeśli w uszczelnionej ćwiartce wystąpi kliniczne zapalenie wymienia, zainfekowaną ćwiartkę należy zdoić ręcznie, a następnie zastosować odpowiednie leczenie.
W celu zmniejszenia ryzyka zanieczyszczenia, tubostrzykawki nie należy zanurzać w wodzie. Tubostrzykawki należy używać wyłącznie jednokrotnie.
Ponieważ produkt nie wykazuje działania przeciwbakteryjnego, aby obniżyć ryzyko ostrego zapalenia wymienia związanego z nieprawidłową techniką podania i/lub brakiem higieny (patrz punkt 4.6), istotne jest, aby podczas podawania produktu przestrzegać zasad aseptyki, opisanych w punkcie 4.9. Po zastosowaniu produktu nie należy podawać żadnych innych produktów dowymieniowych. U krów, u których może występować podkliniczna postać zapalenia wymienia, produkt może zostać podany po zastosowaniu w zakażonej ćwiartce antybiotykoterapii odpowiedniej dla okresu zasuszenia.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Sole bizmutu mogą wywoływać reakcje nadwrażliwości.
Osoby o znanej nadwrażliwości (alergii) na sole bizmutu powinny unikać kontaktu z produktem leczniczym weterynaryjnym.
Produkt może powodować podrażnienia skóry i oczu. Należy unikać kontaktu ze skórą lub oczami. W przypadku kontaktu ze skórą lub oczami, przemyć zanieczyszczone miejsce dużą ilością wody. Jeśli podrażnienie utrzymuje się, należy zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną.
Chusteczki dezynfekujące, jeżeli są dołączone do produktu, mogą powodować podrażnienia skóry i oczu ze względu na zawartość alkoholu izopropylowego i diglukonianiu chlorheksydyny.
Należy unikać kontaktu ze skórą lub oczami. Po użyciu należy umyć ręce.
Po zastosowaniu produktu bardzo rzadko obserwowano ostre zapalenie wymienia, występujące głównie w związku z nieprawidłową techniką podawania oraz brakiem higieny. Patrz punkt 4.5 oraz
4.9 dotyczący
znaczenia zachowania zasad aseptyki.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
4.7. Stosowanie w ciąży, laktacji lub w okresie nieśności
Ciąża:
Ponieważ produkt nie ulega wchłanianiu po podaniu dowymieniowym, może być stosowany u zwierząt w okresie ciąży. Po wycieleniu, pozostałe w strzyku uszczelnienie może zostać spożyte przez cielę. Spożycie produktu przez cielę jest bezpieczne i nie powoduje działań niepożądanych.
Laktacja:
Produktu leczniczego weterynaryjnego nie należy podawać w okresie laktacji. Po przypadkowym podaniu u krowy w okresie laktacji można zaobserwować niewielki (do 2-krotnego), przejściowy wzrost liczby komórek somatycznych. W takim przypadku należy zdoić wymię ręcznie, aby usunąć uszczelnienie. Nie są konieczne dodatkowe środki ostrożności.
W badaniach klinicznych wykazano zgodność porównywalnego produktu uszczelniającego wymię, zawierającego bizmutu azotan zasadowy, jedynie z produktami do stosowania w okresie zasuszenia zawierającymi kloksacylinę.
Patrz także punkt 4.5 „Specjalne środki ostrożności dotyczące stosowania u zwierząt”.
Wyłącznie do podawania dowymieniowego.
Produkt posiada dyszę z podwójną końcówką. Zatyczka tubostrzykawki może zostać częściowo lub całkowicie usunięta. Zaleca się, aby chwycić strzyk u jego podstawy, co ułatwi umieszczenie zawiesiny w zatoce strzykowej, by zamknąć kanał strzykowy od góry.
Opcja z krótką końcówką: krótka końcówka umożliwia częściowe wprowadzenie, dzięki czemu tubostrzykawka zostaje wprowadzona jedynie do początkowej części kanału strzykowego.
Opcja z długą końcówką: długa końcówka może ułatwić podawanie i pomaga uniknąć wysunięcia końcówki w przypadku leczenia nerwowych, ruchliwych krów.
Krok 1: Usunięcie odłamywanej części zatyczki
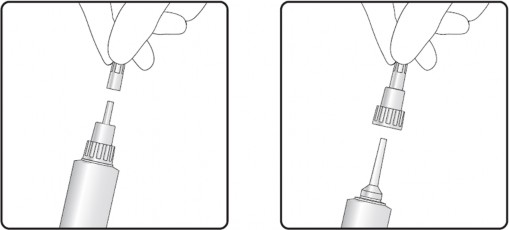
Krok 2: Wprowadzenie krótkiej lub długiej końcówki
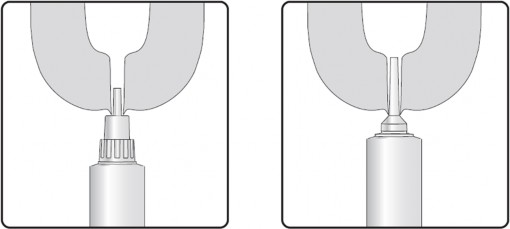
Zawartość jednej tubostrzykawki wprowadzić do każdej ćwiartki wymienia bezpośrednio po ostatnim udoju w laktacji (przy zasuszeniu). Po podaniu nie rozmasowywać strzyku ani wymienia, ponieważ ważne jest, aby produkt pozostał w strzyku i nie dostał się do wymienia.
Należy zachować ostrożność, aby nie wprowadzić patogenów do strzyku, co pozwoli ograniczyć ryzyko zapalenia wymienia po podaniu produktu.
Istotnym jest dokładne oczyszczenie i dezynfekcja strzyków przy pomocy spirytusu chirurgicznego lub nasączonych alkoholem chusteczek. Strzyki należy wycierać do momentu, gdy na chusteczce przestanie być widoczne zabrudzenie. Przed zastosowaniem produktu pozostawić strzyki do wyschnięcia. Produkt podawać przy zachowaniu zasad aseptyki, zapobiegając zanieczyszczeniu dyszy tubostrzykawki. Po podaniu zalecane jest użycie odpowiedniego płynu do kąpieli strzyków lub aerozolu.
W przypadku niskich temperatur produkt może zostać ogrzany do temperatury pokojowej, aby ułatwić jego podanie.
Po podaniu krowom w dawce 2-krotnie przekraczającej dawkę zalecaną nie obserwowano klinicznych działań niepożądanych.
Tkanki jadalne: Zero dni. Mleko: Zero godzin.
Grupa farmakoterapeutyczna: produkty do strzyków i wymion. Kod ATC vet: QG52X
Zastosowanie produktu w każdej ćwiartce wymienia tworzy fizyczną barierę przed wnikaniem bakterii, ograniczając częstość występowania nowych zakażeń wymienia w okresie zasuszenia.
Zasadowy azotan bizmutu nie ulega wchłanianiu z gruczołu mlekowego, ale pozostaje w strzyku w postaci uszczelnienia do momentu mechanicznego usunięcia (co zostało wykazane u krów z okresem zasuszenia trwającym do 100 dni).
Glinu stearynian
Krzemionka koloidalna bezwodna Parafina ciekła
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata.
Brak specjalnych środków ostrożności dotyczących przechowywania.
Jednodawkowa tubostrzykawka dowymieniowa z LDPE z zatyczką z LDPE, zawierająca 4 g zawiesiny.
Wielkości opakowań:
Pudełko tekturowe zawierające 24 tubostrzykawki. Pudełko tekturowe zawierające 60 tubostrzykawek. Pudełko tekturowe zawierające 120 tubostrzykawek.
Pudełko tekturowe zawierające 24 tubostrzykawki + 24 chusteczki do higieny strzyków. Pudełko tekturowe zawierające 60 tubostrzykawek + 60 chusteczek do higieny strzyków. Pudełko tekturowe zawierające 120 tubostrzykawek + 120 chusteczek do higieny strzyków.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
FATRO S.p.A. - Via Emilia, 285 - Ozzano dell’Emilia (Bolonia), Włochy
3186/22
/DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 31/05/2022











