Spis treści:
- NAZWA WETERYNARYJNEGO PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- DANE KLINICZNE
- DANE FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- KLASYFIKACJA WETERYNARYJNYCH PRODUKTÓW LECZNICZYCH
ANEKS I
CHARAKTERYSTYKA WETERYNARYJNEGO PRODUKTU LECZNICZEGO
NAZWA WETERYNARYJNEGO PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla każdego z docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia
Specjalne środki ostrożności dotyczące stosowania
Zdarzenia niepożądane
Stosowanie w ciąży, podczas laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Droga podania i dawkowanie
Objawy przedawkowania (oraz sposób postępowania przy udzielaniu natychmiastowej pomocy i odtrutki, w stosownych przypadkach)
Szczególne ograniczenia dotyczące stosowania i specjalne warunki stosowania, w tym ograniczenia dotyczące stosowania przeciwdrobnoustrojowych i przeciwpasożytniczych weterynaryjnych produktów leczniczych w celu ograniczenia ryzyka rozwoju oporności
Okresy karencji
DANE FARMAKOLOGICZNE
Kod ATCvet:
Dane farmakodynamiczne
Dane farmakokinetyczne
DANE FARMACEUTYCZNE
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności przy przechowywaniu
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytych weterynaryjnych produktów leczniczych lub pochodzących z nich odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
KLASYFIKACJA WETERYNARYJNYCH PRODUKTÓW LECZNICZYCH
Clavusan 250 mg + 62,5 mg tabletki dla psów i kotów
Każda tabletka zawiera:
Substancje czynne:
Amoksycylina (jako amoksycylina trójwodna) 250 mg
Kwas klawulanowy (jako potasu klawulanian, rozcierka)
62,5 mg
Substancje pomocnicze:
Skład jakościowy substancji pomocniczych i pozostałych składników |
Krospowidon |
Powidon |
Karboksymetyloskrobia sodowa (typ A) |
Celuloza mikrokrystaliczna |
Krzemionka koloidalna uwodniona |
Magnezu stearynian |
Sacharyna sodowa |
Aromat waniliowy |
Biała do jasno żółtej, okrągła i wypukła tabletka z linią podziału w kształcie krzyża po jednej stronie. Tabletki mogą być dzielone na 2 lub 4 równe części.
Psy i koty.
Leczenie zakażeń wywołanych przez bakterie wrażliwe na amoksycylinę w połączeniu z kwasem klawulanowym, w tym: zapalenia skóry (powierzchowne i głębokie ropne zapalenie skóry), zakażenia tkanek miękkich (ropnie i zapalenia zatok okołoodbytowych), zakażenia stomatologiczne (np. zapalenie dziąseł); zakażenia dróg moczowych; zakażenia dróg oddechowych (górnych i dolnych); zapalenie jelit.
Nie stosować u królików, kawii domowych, chomików, myszoskoczków i szynszyli.
Nie stosować w przypadkach stwierdzonej nadwrażliwości na substancje czynne, inne antybiotyki z grupy antybiotyków beta-laktamowych lub na dowolną substancję pomocniczą.
Nie stosować u zwierząt z poważnym zaburzeniem czynności nerek, z towarzyszącym bezmoczem i skąpomoczem.
Nie stosować u przeżuwaczy i koni.
Brak.
Specjalne środki ostrożności dotyczące bezpiecznego stosowania u docelowych gatunków zwierząt Stosowanie produktu powinno być oparte na identyfikacji i badaniu lekowrażliwości docelowego patogenu (docelowych patogenów). Jeżeli nie jest to możliwe, terapia powinna opierać się na informacjach epidemiologicznych i znajomości lekowrażliwości docelowych patogenów na poziomie lokalnym/regionalnym. Stosowanie produktu powinno być zgodne z oficjalną, krajową i regionalną polityką stosowania leków przeciwdrobnoustrojowych.
Antybiotyk o niższym ryzyku selekcji oporności na leki przeciwdrobnoustrojowe (niższa kategoria AMEG) powinien być stosowany w leczeniu pierwszego rzutu, gdy badanie lekowrażliwości sugeruje prawdopodobną skuteczność takiego podejścia.
Stosowanie amoksycyliny w połączeniu z kwasem klawulanowym należy ograniczyć do leczenia stanów klinicznych, w których reakcja na leczenie innymi lekami przeciwbakteryjnymi lub penicylinami o wąskim spektrum działania jest niedostateczna.
Wykazano oporność krzyżową pomiędzy amoksycyliną/kwasem klawulanowym a antybiotykami beta-laktamowymi. Należy starannie rozważyć stosowanie produktu, gdy w badaniu lekowrażliwości wykazano oporność na antybiotyki beta-laktamowe, ponieważ skuteczność produktu może być zmniejszona.
Stosowanie produktu niezgodne z ChWPL może zwiększać częstość występowania bakterii opornych na amoksycylinę/kwas klawulanowy i może obniżać skuteczność leczenia antybiotykami beta- laktamowymi, w związku z możliwością wystąpienia oporności krzyżowej.
Należy zachować ostrożność podczas stosowania produktu u małych zwierząt roślinożernych innych niż wymienione w przeciwwskazaniach w punkcie 3.3.
U zwierząt z niewydolnością wątroby lub nerek należy dokładnie rozważyć schemat dawkowania.
Specjalne środki ostrożności dla osób podających weterynaryjny produkt leczniczy zwierzętom Penicyliny i cefalosporyny mogą powodować reakcje nadwrażliwości (alergię) po wstrzyknięciu, wdychaniu, połknięciu lub kontakcie ze skórą. Nadwrażliwość na penicyliny może prowadzić do reakcji krzyżowej na cefalosporyny i odwrotnie. Czasami reakcje uczuleniowe na te substancje mogą być ciężkie.
Osoby o znanej nadwrażliwości, lub którym zalecono unikanie kontaktu z tego typu produktami, nie powinny mieć kontaktu z tym weterynaryjnym produktem leczniczym.
Podczas kontaktu z tym weterynaryjnym produktem leczniczym należy zachować szczególną ostrożność i stosować wszystkie zalecane środki ostrożności, aby uniknąć narażenia.
W razie pojawienia się objawów po narażeniu na produkt, takich jak wysypka skórna, należy zwrócić się do lekarza i pokazać mu niniejsze ostrzeżenie. Poważniejsze objawy obejmują obrzęk twarzy, ust i oczu lub trudności z oddychaniem i wymagają natychmiastowej pomocy lekarskiej.
Po użyciu należy umyć ręce.
W celu uniknięcia przypadkowego połknięcia, szczególnie przez dziecko, niewykorzystane części tabletki należy umieścić z powrotem w gnieździe blistra, włożyć z powrotem do zewnętrznego opakowania i przechowywać w bezpiecznym miejscu, w miejscu niewidocznym i niedostępnym dla dzieci.
Psy i koty:
Bardzo rzadko (< 1 zwierzę/10 000 leczonych zwierząt, włączając pojedyncze raporty): | Zaburzenia żołądkowo-jelitowe (wymioty, biegunka, anoreksja). |
Częstość nieznana (nie może być określona na podstawie dostępnych danych) | Reakcje alergiczne (reakcje skórne, anafilaksja)*. |
* W takich przypadkach należy przerwać podawanie produktu i zastosować leczenie objawowe.
Zgłaszanie zdarzeń niepożądanych jest istotne, ponieważ umożliwia ciągłe monitorowanie bezpieczeństwa stosowania weterynaryjnego produktu leczniczego. Zgłoszenia najlepiej przesłać za pośrednictwem lekarza weterynarii do właściwych organów krajowych lub do podmiotu odpowiedzialnego lub jego lokalnego przedstawiciela za pośrednictwem krajowego systemu zgłaszania. Odpowiednie dane kontaktowe znajdują się również w rozdziale „Dane kontaktowe” ulotki dołączonej do opakowania.
Produkt może być stosowany w okresie ciąży i laktacji.
Chloramfenikol, makrolidy, sulfonamidy i tetracykliny mogą hamować działanie przeciwbakteryjne penicylin z powodu szybkiego wystąpienia działania bakteriostatycznego. Należy brać pod uwagę możliwość wystąpienia alergicznych reakcji krzyżowych z innymi penicylinami. Penicyliny mogą nasilać działanie aminoglikozydów.
Podanie doustne.
Zalecana dawka to 12,5 mg/kg masy ciała (10 mg amoksycyliny/2,5 mg kwasu klawulanowego na kg masy ciała), dwa razy dziennie.
Poniższa tabela zawiera wskazówki dotyczące podawania tabletek w zalecanej dawce.
Aby zapewnić prawidłowe dawkowanie, należy jak najdokładniej określić masę ciała zwierzęcia w celu uniknięcia podania zbyt małej dawki.
Liczba tabletek – dwa razy dziennie (dawka: 12,5 mg/kg m.c.) | |||
Masa ciała (kg) | Amoksycylina/kwas klawulanowy 50 mg + 12,5 mg | Amoksycylina/kwas klawulanowy 250 mg + 62,5 mg | Amoksycylina/kwas klawulanowy 500 mg + 125 mg |
1-1,25 | ¼ | - | - |
>1,25-2,5 | ½ | - | - |
>2,5-3,75 | ¾ | - | - |
>3,75-5 | 1 | - | - |
>5-6,25 | 1 ¼ | ¼ | - |
>6,25-12,5 | - | ½ | ¼ |
>12,5-18,75 | - | ¾ | - |
>18,75-25 | - | 1 | ½ |
>25-31,25 | - | 1 ¼ | - |
>31,25-37,5 | - | 1 ½ | - |
>37,5-50 | - | - | 1 |
>50-62,5 | - | - | 1 ¼ |
>62,5-75 | - | - | 1 ½ |
































= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
Tabletki można podzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania.
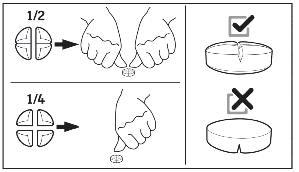
Minimalny czas trwania leczenia wynosi 5 dni, a w większości typowych przypadków odpowiedź następuje po 5 – 7 dniach leczenia.
W przewlekłych lub trudnych przypadkach może być wymagane dłuższe leczenie, np. przewlekła choroba skóry 10 – 20 dni, przewlekłe zapalenie pęcherza moczowego 10 – 28 dni, choroba dróg oddechowych 8 – 10 dni.
W takich przypadkach całkowita długość leczenia zależy od decyzji lekarza, jednak powinna być wystarczająco długa, aby zapewnić całkowite ustąpienie choroby bakteryjnej.
Do częściej obserwowanych objawów przedawkowania należą łagodne objawy żołądkowe-jelitowe (biegunka i wymioty).
Nie dotyczy.
Nie dotyczy.
QJ01CR02
Amoksycylina, podobnie jak inne antybiotyki beta-laktamowe, działa poprzez hamowanie syntezy ścian komórek bakteryjnych poprzez zakłócanie końcowego etapu syntezy peptydoglikanu. To działanie bakteriobójcze powoduje lizę jedynie komórek rosnących.
Kwas klawulanowy jest inhibitorem beta-laktamaz i zwiększa przeciwbakteryjne spektrum amoksycyliny.
Amoksycylina w połączeniu z kwasem klawulanowym ma szeroki zakres działania, który obejmuje szczepy produkujące beta-laktamazy, zarówno Gram-dodatnie, jak i Gram-ujemne bakterie tlenowe, względnie beztlenowe i bezwzględnie beztlenowe, w tym:
Gram-dodatnie:
Clostridium spp.
Corynebacterium spp.
Peptostreptococcus spp.
Staphylococcus spp. (w tym szczepy produkujące beta-laktamazy)
Streptococcus spp.
Grama-ujemne:
Bacteroides spp.
Escherichia coli (w tym większość szczepów produkujących beta-laktamazy)
Campylobacter spp. Fusobacterium necrophorum Pasteurella spp.
Proteus spp.
Oporność wykazano wśród Enterobacter spp., Pseudomonas aeruginosa i u opornego na metycylinę
Staphylococcus aureus. Zaobserwowano tendencje do zwiększania oporności E. coli.
Wrażliwość i wzorce oporności mogą się różnić w zależności od obszaru geograficznego, szczepu bakteryjnego i mogą ulec zmianie w miarę upływu czasu.
Wartości graniczne amoksycyliny/kwasu klawulanowego (CLSI VET 01S ED5:2020)
E. Coli (pies): wrażliwe MIC ≤ 8/4 µg/ml
Staphylococcus spp. (pies, kot): wrażliwe MIC ≤ 0,25/0,12 µg/ml, oporne: ≥ 1/0,5 µg/ml Streptococcus spp. (kot): wrażliwe MIC ≤ 0,25/0,12 µg/ml, oporne: ≥ 1/0,5 µg/ml Pasteurella multocida (kot): wrażliwe MIC ≤ 0,25/0,12 µg/ml, oporne: ≥ 1/0,5 µg/ml
Główne mechanizmy oporności na amoksycylinę/kwas klawulanowy to:
Inaktywacja przez te bakteryjne beta-laktamaz, które same nie są hamowane przez kwas klawulanowy. Modyfikacja białek wiążących penicylinę (PBP – Penicillin-Binding Proteins), które zmniejszają powinowactwo czynnika antybakteryjnego do białek docelowych (oporny na metycylinę S. aureus, MRSA i S. pseudintermedius, MRSP). U bakterii, zwłaszcza Gram-ujemnych, występują następujące mechanizmy przyczyniające się do wystąpienia oporności lub ją wywołujące: zmniejszenie przepuszczalności ściany komórkowej lub aktywne wypompowywanie substancji z komórki.
Geny oporności mogą być zlokalizowane na chromosomach (mecA, MRSA) lub plazmidach (LAT, MIR, ACT, FOX, beta-laktamazach rodziny CMY), pojawiły się też różne mechanizmy oporności.
Psy:
‐ Amoksycylina
Po podaniu dawki amoksycyliny 10 mg/kg m.c. maksymalne stężenia w osoczu osiągane są w ciągu 1,0 do 2,0 godzin (tmax) przy średnim okresie półtrwania wynoszącym 1,0–1,5 godziny. Obserwowano wartość Cmax 8223 ng/ml i AUC0-last 22490 ng.h/ml.
‐ Kwas klawulanowy
Po podaniu dawki kwasu klawulanowego 2,5 mg/kg m.c. maksymalne stężenia w osoczu osiągane są w ciągu 0,5 do 1,75 godziny (tmax) przy średnim okresie półtrwania wynoszącym 0,5–0,6 godziny. Obserwowano wartość Cmax 3924 ng/ml i AUC0-last 5284 ng.h/ml.
Koty:
‐ Amoksycylina
Po podaniu dawki amoksycyliny 10 mg/kg m.c. maksymalne stężenia w osoczu osiągane jest w ciągu 1,3 do 3,0 godzin (tmax) przy średnim okresie półtrwania wynoszącym 1,0–1,3 godziny.
Obserwowano wartość Cmax 9843 ng/ml i AUC0-last 37283 ng.h/ml
‐ Kwas klawulanowy
Po podaniu dawki kwasu klawulanowego 2,5 mg/kg m.c. maksymalne stężenia w osoczu osiągane jest w ciągu 0,3 do 2,0 godzin (tmax) przy średnim okresie półtrwania wynoszącym 0,6–0,7 godziny. Obserwowano wartość Cmax 4945 ng/ml i AUC0-last 8266 ng.h/ml.
Amoksycylina jest dobrze wchłaniana po podaniu doustnym. Amoksycylina (pKa 2,8) ma stosunkowo małą pozorną objętość dystrybucji, słabo wiąże się z białkami osocza (34% u psów) i ma krótki końcowy okres półtrwania z powodu aktywnego wydalania kanalikowego przez nerki. Po wchłonięciu najwyższe stężenia stwierdza się w nerkach (w moczu) i żółci, a następnie w wątrobie, płucach, sercu i śledzionie. Dystrybucja amoksycyliny w płynie mózgowo-rdzeniowym jest ograniczona, chyba że ma miejsce zapalenie opon mózgowo-rdzeniowych.
Kwas klawulanowy (pKa 2,7) jest również dobrze wchłaniany po podaniu doustnym. Przenikanie kwasu klawulanowego do płynu mózgowo-rdzeniowego jest ograniczone. Wiązanie z białkami osocza wynosi około 25%, a okres półtrwania w fazie eliminacji jest krótki. Kwas klawulanowy jest wydalany głównie przez nerki (w niezmienionej postaci w moczu).
Nie dotyczy.
Okres ważności weterynaryjnego produktu leczniczego zapakowanego do sprzedaży: 30 miesięcy Niewykorzystaną część tabletki należy ponownie umieścić w blistrze i zużyć w ciągu 36 godzin
Nie przechowywać w temperaturze powyżej 30°C. Przechowywać w oryginalnym opakowaniu.
Zgrzewany na gorąco blister oPA/Alu/PVC – PVC/Alu, każdy zawierający 10 tabletek. Wielkość opakowań:
Pudełko tekturowe zawierające 10, 30, 50, 100 lub 250 tabletek. Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
Należy skorzystać z krajowego systemu odbioru odpadów w celu usunięcia niewykorzystanego weterynaryjnego produktu leczniczego lub materiałów odpadowych pochodzących z jego zastosowania w sposób zgodny z obowiązującymi przepisami oraz krajowymi systemami odbioru odpadów dotyczącymi danego weterynaryjnego produktu leczniczego.
Alfasan Nederland B.V.
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: {DD/MM/RRRR}
Wydawany na receptę weterynaryjną.
Szczegółowe informacje dotyczące powyższego weterynaryjnego produktu leczniczego są dostępne w unijnej bazie danych produktów (https://medicines.health.europa.eu/veterinary).











