Spis treści:
ULOTKA DLA PACJENTA
Ulotka dołączona do opakowania: informacja dla użytkownika
Optiray 300 roztwór do wstrzykiwań i infuzji, 636 mg/ml
(Ioversolum)
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
Należy zwrócić się do lekarza lub farmaceuty w razie jakichkolwiek dalszych wątpliwości.
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie możliwe objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie.
Spis treści ulotki
Co to jest lek Optiray i w jakim celu się go stosuje
Optiray jest stosowany w różnych badaniach radiologicznych, w tym:
obrazowaniu naczyń krwionośnych, zarówno tętnic, jak i żył (u dorosłych i dzieci)
nerek (u dorosłych i dzieci)
tomografii komputerowej (u dorosłych)
Optiray jest środkiem kontrastowym zawierającym jod. Jod blokuje promieniowanie rentgenowskie, co umożliwia uwidocznienie naczyń krwionośnych i narządów wewnętrznych, przez które przepływa krew.
Informacje ważne przed zastosowaniem leku Optiray Kiedy nie stosować leku Optiray:
jeśli pacjent ma uczulenie na środki kontrastowe zawierające jod lub którykolwiek z pozostałych składników tego leku (wymienione w punkcie 6).
jeśli u pacjenta występuje nadczynność tarczycy
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Optiray należy zwrócić się do lekarza, jeśli u pacjenta występuje:
astma lub reakcje alergiczne w przeszłości, takie jak nudności, wymioty, niskie ciśnienie krwi, objawy skórne
niewydolność serca, nadciśnienie, zaburzenia krążenia lub udar i jeśli pacjent jest w podeszłym wieku
cukrzyca
choroba nerek lub wątroby
zaburzenia mózgowe
schorzenia szpiku kostnego, takie jak pewne nowotwory krwi, nazywane paraproteinemia, szpiczak mnogi
pewne nieprawidłowości krwinek czerwonych, nazywane niedokrwistością sierpowatokrwinkową
guz nadnerczy, który wpływa na ciśnienie krwi, nazywany guzem chromochłonnym
zwiększone stężenie aminokwasu - homocysteiny, spowodowane nieprawidłową przemianą materii
niedawne badanie pęcherzyka żółciowego z zastosowaniem środka kontrastowego
planowane badanie tarczycy z użyciem substancji zawierającej jod
Należy je przełożyć, ponieważ lek Optiray może wpływać na jego wyniki przez okres do 16 dni.
U pacjentów, którym podano Optiray, zgłaszano ciężkie skórne reakcje niepożądane, takie jak eozynofilia i objawy układowe (DRESS), zespół Stevensa-Johnsona (SJS), toksyczna nekroliza naskórka (zespół Lyella lub TEN) oraz ostra uogólniona osutka krostkowa (AGEP), które mogą zagrażać życiu.
Podczas lub krótko po procedurze obrazowania może wystąpić krótkotrwałe zaburzenie pracy mózgu zwane encefalopatią. Należy niezwłocznie poinformować lekarza w przypadku
zauważenia któregokolwiek z objawów związanych z tym stanem opisanych w punkcie 4.
Zgłaszano ciężkie skórne reakcje niepożądane u pacjentów, którym podano Optiray, takie jak eozynofilia i objawy układowe (ang. drug reaction with eosinophilia and systemic symptoms,
DRESS), zespół Stevensa-Johnsona (ang. Stevens-Johnson syndrome, SJS), toksyczna nekroliza naskórka (zespół Lyella lub TEN, ang. toxic epidermal necrolysis) oraz ostra uogólniona osutka krostkowa (ang. acute exanthematous pustulosis, AGEP), które mogą zagrażać życiu.
Podczas procedury lub krótko po procedurze obrazowania może wystąpić krótkotrwałe zaburzenie pracy mózgu zwane encefalopatią. Należy niezwłocznie poinformować lekarza w przypadku
zauważenia któregokolwiek z objawów związanych z tym stanem opisanych w punkcie 4.
Dzieci i młodzież w wieku poniżej 18 lat
Dzieci w wieku poniżej 18 lat
Optiray 300 jest stosowany do obrazowania naczyń krwionośnych lub nerek w tej grupie wiekowej. Jednak nie jest zalecany do stosowania u dzieci poddawanych badaniu tomografii komputerowej. W przypadku noworodków, a zwłaszcza wcześniaków, zalecana jest kontrola poziomu hormonów tarczycy, nazywanych TSH i T4. Kontrola taka odbywa się 7-10 dni i 1 miesiąc po podaniu leku Optiray.
U dzieci poniżej 3 lat, w tym u noworodków, których matki otrzymały w czasie ciąży jodowany środek kontrastowy, zaleca się kontrolę hormonów tarczycy nazywanych TSH i T4. Kontrole te odbywają się 7-10 dni i 1 miesiąc po podaniu leku Optiray.
Optiray a inne leki
Należy powiedzieć lekarzowi lub specjaliście radiologowi o wszystkich lekach stosowanych obecnie lub ostatnio, a także o lekach, które pacjent planuje stosować.
Następujące leki mogą wpływać na lek Optiray lub lek Optiray może na nie wpływać:
metformina: lek stosowany w leczeniu cukrzycy
Lekarz zbada czynność nerek przed zastosowaniem i po zastosowaniu leku Optiray. W zależności od poziomu czynności nerek lekarz może rozważyć przerwanie stosowania
metforminy w okresie między 48 godzin przed badaniem a badaniem. Nie należy ponownie rozpoczynać jej stosowania przez co najmniej 48 godziny od badania i może to nastąpić tylko wtedy, jeśli czynność nerek wróciła do poprzedniego poziomu.
interleukiny: leki stosowane w leczeniu pewnych guzów
niektóre leki podwyższające ciśnienie krwi z powodu zwężania naczyń krwionośnych
W celu zapobiegania ryzyku wystąpień zaburzeń układu nerwowego leku Optiray nie należy nigdy stosować podczas stosowania tych leków.
leki do znieczulenia ogólnego
Zgłaszano większą częstość występowania działań niepożądanych.
diuretyki: leki, które zwiększają wytwarzanie moczu i obniżają ciśnienie krwi
W przypadku odwodnienia spowodowanego stosowaniem diuretyków, zastosowanie
jodowanych środków kontrastowych może zwiększyć ryzyko wystąpienia ostrej niewydolności nerek.
Optiray z jedzeniem i piciem
Należy poradzić się lekarza. U pacjentów z istniejącą chorobą nerek nie należy ograniczać picia wody, ponieważ może to dalej pogarszać czynność nerek.
Ciąża i karmienie piersią
Ciąża
Należy powiedzieć lekarzowi, jeśli pacjentka jest w ciąży lub podejrzewa, że jest w ciąży. Lekarz poda lek Optiray pacjentce w ciąży tylko wtedy, gdy jest to bezwzględnie konieczne, ponieważ lek mógłby zaszkodzić nienarodzonemu dziecku.
Karmienie piersią
Należy przerwać karmienie piersią przez jeden dzień po wstrzyknięciu, ponieważ niedostępne są wystarczające dane dotyczące bezpieczeństwa stosowania. Należy skonsultować się z lekarzem lub specjalistą radiologiem.
Prowadzenie pojazdów i obsługiwanie maszyn
Prowadzenie pojazdów lub obsługiwanie maszyn jest niewskazane przez 1 godzinę po
wstrzyknięciu.
Poza tym obserwowane były takie objawy jak zawroty głowy, senność, osłabienie i zaburzenia widzenia. Jeśli objawy takie występują u pacjenta, nie należy podejmować próby wykonywania żadnych czynności, które wymagają koncentracji i zdolności do właściwej reakcji.
Lek Optiray zawiera sód.
Lek zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy lek uznaje się za "wolny od sodu".
Jak stosować lek Optiray
Badania z zastosowaniem leku Optiray będą wykonywane wyłącznie przez lekarza lub specjalistę radiologa, którzy podejmą również decyzję o dawce.
Lek Optiray jest wstrzykiwany do naczynia krwionośnego i jest dystrybuowany w organizmie przez krwiobieg. Przed użyciem lek jest ogrzewany do temperatury ciała, następnie wstrzykiwany raz lub kilka razy podczas badania radiologicznego.
Dawka jest uzależniona od rodzaju badania oraz innych czynników, takich jak stan pacjenta i wiek. Stosowana jest najmniejsza dawka, która umożliwi uzyskanie obrazów odpowiedniej jakości.
Zastosowanie większej niż zalecana dawki leku Optiray
Przedawkowanie jest potencjalnie niebezpieczne i może mieć wpływ na oddychanie, serce i układ krążenia. Należy niezwłocznie powiadomić lekarza lub specjalistę radiologa, jeśli pacjent zauważy jakikolwiek z takich objawów po otrzymaniu leku Optiray.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się do lekarza lub specjalisty radiologa.
Możliwe działania niepożądane
zatrzymanie akcji serca lub oddychania
skurcze naczyń krwionośnych serca lub zakrzepy krwi
udar, zasinienie ust, omdlenie
utrata pamięci
zaburzenia mowy
nagłe ruchy
chwilowa ślepota
ostra niewydolność nerek
wysypka skórna, zaczerwienienie lub pęcherze, które mogą przekształcić się w zagrażające
życiu reakcje skórne, w tym rozległe złuszczanie się skóry (toksyczna nekroliza naskórka) lub reakcja polekowa, która powoduje wysypkę, gorączkę, zapalenie narządów wewnętrznych, nieprawidłowości hematologiczne i chorobę ogólnoustrojową (DRESS)
objawy reakcji uczuleniowych, takie jak
wstrząs alergiczny
obkurczone drogi oddechowe
obrzęk krtani, gardła, języka
trudności z oddychaniem
kaszel, kichanie
zaczerwienienie i (lub) obrzęk twarzy i oczu
swędzenie, wysypka i pokrzywka
Działania niepożądane mogą wystąpić z następującą częstością: bardzo częste, występują u więcej niż 1 z 10 użytkowników
uczucie gorąca
częste, występują u 1 do 10 na 100 użytkowników
ból
nudności
niezbyt częste, występują u 1 do 10 na 1000 użytkowników
pokrzywka
zaczerwienienie skóry, swędzenie,
zawroty głowy
ból głowy
zaburzenie smaku
zaburzenia czucia, takie jak kłucie, mrowienie
wymioty
kichanie
wysokie ciśnienie krwi
rzadkie, występują u 1 do 10 na 10 000 użytkowników
omdlenie
zawroty głowy
nieostre widzenie
pulsujące tętno
niskie ciśnienie krwi
nagłe zaczerwienienie twarzy
skurcze krtani
obrzęk i zwężenie dróg oddechowych, w tym ucisk gardła, świszczący oddech
trudności z oddychaniem
zapalenie wewnątrz nosa, które powoduje kichanie i zatkany nos
kaszel, podrażnienie gardła
suchość w jamie ustnej
wysypka
parcie na mocz
obrzęk twarzy, w tym oczu
dreszcze,
niekontrolowane drżenie
uczucie zimna
bardzo rzadkie, występują u mniej niż 1 na 10 000 użytkowników
ciężka reakcja uczuleniowa
dezorientacja, niepokój, nerwowość
utrata przytomności, drętwienie
paraliż
senność
osłupienie
zaburzenia głosu
zaburzenia mowy
zmniejszona wrażliwość dotyku lub odczuwania
alergiczne zapalenie oczu powodujące zaczerwienienie, łzawienie i świąd oczu
dzwonienie lub brzęczenie w uszach
nieregularne bicie serca, powolne tętno
ból w klatce piersiowej
zmiany aktywności serca mierzone za pomocą EKG
choroba zakłócająca przepływ krwi przez mózg
wysokie ciśnienie krwi
zapalenie żył, rozszerzenie naczyń krwionośnych
nagromadzenie płynu w płucach
ból gardła
niska zawartość tlenu we krwi
bóle brzucha
zapalenie ślinianek, obrzęk języka
trudności w połykaniu, zwiększone wydzielanie śliny
najczęściej bolesny, silny obrzęk głębokich warstw skóry, głównie w obrębie twarzy
zwiększona potliwosć
kurcze mięśni
ostra niewydolność nerek lub nieprawidłowa czynność nerek
nietrzymanie moczu, krew w moczu, osłabione oddawanie moczu
obrzęk tkanek spowodowany nadmiarem płynu
reakcje w miejscu wstrzyknięcia, w tym ból, zaczerwienienie, krwawienie lub zwyrodnienie komórek
złe lub nietypowe samopoczucie, zmęczenie, ospałość
nieznane: częstość nie może być określona na podstawie dostępnych danych
ciężka reakcja alergiczna ze wstrząsem
przejściowo niedoczynna tarczyca
napady drgawek
krótkotrwałe zaburzenia pracy mózgu (encefalopatia), które mogą powodować dezorientację, omamy, zaburzenia widzenia, ślepotę, drgawki, utratę koordynacji, utratę ruchu po jednej stronie ciała, problemy z mową i utratę przytomności.
zaburzenie ruchu
utrata pamięci
chwilowa ślepota
zatrzymanie akcji serca, zagrażające życiu nieregularne bicie serca
dodatkowe uderzenia serca
skurcze tętnic serca, silne bicie serca
niebieskie zabarwienie skóry (sinica) spowodowane niską zawartością tlenu we krwi
wstrząs
zakrzep krwi lub skurcz w naczyniu krwionośnym
bladość
zatrzymanie oddechu, astma, obkurczone drogi oddechowe
zmniejszona zdolność do wydawania głosu za pomocą narządów głosowych
biegunka
ciężka reakcja obejmująca skórę, krew i narządy wewnętrzne (reakcja polekowa z eozynofilią i objawami ogólnoustrojowymi znana również jako DRESS lub zespół nadwrażliwości na leki)
czerwona, łuszcząca się, rozległa wysypka z guzkami pod skórą i pęcherzami, której towarzyszy gorączka na początku leczenia (ostra uogólniona osutka krostkowa)
czerwone krostki (plamki lub grudki)
zagrażająca życiu reakcja z objawami grypopodobnymi i bolesną wysypką / pęcherzami na skórze, ustach, oczach i genitaliach (zespół Stevena-Johnsona / toksyczna nekroliza naskórka)
brak lub bolesne albo trudne oddawanie moczu
niedoczynność tarczycy u noworodków
gorączka
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak przechowywać lek Optiray
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie. Termin ważności oznacza ostatni dzień podanego miesiąca.
Przechowywać pojemniki w opakowaniu zewnętrznym w celu ochrony przed światłem. Chronić przed promieniowaniem rentgenowskim.
Nie przechowywać w temperaturze powyżej 30°C.
Optiray 300 może być przechowywany przez jeden miesiąc w temperaturze 37ºC w cieplarce przeznaczonej do przechowywania środków kontrastowych, z zapewnionym przepływem powietrza.
Nie stosować tego leku, jeśli zauważy się przebarwienie lub cząstki stałe.
Zawartość opakowania i inne informacje Co zawiera lek Optiray:
Substancją czynną jest jowersol.
Jeden mililitr Optiray 300 zawiera 636 mg jowersolu, co odpowiada 300 mg jodu związanego organicznie.
Pozostałe składniki to: wersenian sodowo–wapniowy (stabilizator), trometamol i chlorowodorek trometamolu (bufor) i woda do wstrzykiwań.
Wodorotlenek sodu i (lub) kwas solny mogą być używane w ustalenia wartości pH na poziomie 6,0 do 7,4.
Jak wygląda lek Optiray i co zawiera opakowanie
Optiray 300 jest zapakowany w:
bezbarwne fiolki o pojemności 10 lub 20 ml, wyposażone w zamknięcia z gumy bromobutylowej i zabezpieczenia wieczek z aluminium. Pudełko zawiera 10 fiolek.
bezbarwne butelki o pojemności 50, 75, 100, 150 lub 200 ml, wyposażone w zamknięcia z gumy bromobutylowej i zabezpieczenia wieczek z aluminium. Pudełko zawiera następujące ilości butelek. Pojemność 50 ml - 10 lub 25 butelek. Pojemność 100 ml - 10 lub 12 butelek. Pojemność 75 ml, 150
ml lub 200 ml -10 butelek.
bezbarwne butelki o pojemności 500 ml, wyposażone w zamknięcia z gumy bromobutylowej i zabezpieczenia wieczek z aluminium. Pudełko zawiera 5 butelek, 6 butelek lub 10 butelek.
Optiray 300 jest również dostarczany w podręcznych ampułko-strzykawkach i strzykawkach ze wstrzykiwaczem ciśnieniowym, wykonanych z polipropylenu. Nasadka strzykawki i tłok są wykonane z kauczuku naturalnego.
Wstępnie napełnione strzykawki podręczne o pojemności 30 lub 50 ml. Pudełko zawiera 10 strzykawek. Wstępnie napełnione strzykawki podręczne o pojemności 50 ml. Pudełko zawiera 20 strzykawek.
Strzykawki ze wstrzykiwaczem ciśnieniowym o pojemności: pojemność 50 ml lub 100 ml. Pudełko zawiera 10 lub 20 strzykawek.Pojemność 125 ml. Pudełko zawiera 10 strzykawek.
Nie wszystkie wielkości opakowań i pudełek muszą znajdować się w obrocie we wszystkich krajach.
Podmiot odpowiedzialny i wytwórca:
Adres podmiotu odpowiedzialnego
Guerbet BP 57400
95943 Roissy CDG Cedex Francja
W celu uzyskania bardziej szczegółowych informacji na temat tego leku należy zwrócić się do przedstawiciela podmiotu odpowiedzialnego: Guerbet Poland Sp. z o.o., tel. (22) 6684110.
Wytwórca
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią. Działania niepożądane związane z lekiem Optiray są generalnie niezależne od podanej dawki. W większości przypadków są one łagodne lub umiarkowane i bardzo rzadko poważne lub zagrażające życiu.
Należy natychmiast skontaktować się z lekarzem, jeśli wystąpi którykolwiek z poniższych
objawów ciężkich działań niepożądanych:
Guerbet Ireland ULC, Damastown, Mulhuddart, Dublin 15,
Irlandia
lub
Guerbet BP 57400
95943 Roissy CDG Cedex Francja
miejsce wytwarzania: 16-24 rue Jean Chaptal, 93600 Aulnay sous Bois, Francja
Data ostatniej aktualizacji ulotki:
Instrukcja obsługi strzykawek podręcznych
Wstępnie napełniona strzykawka
Montaż i kontrola
Uwaga: Zewnętrzna powierzchnia strzykawki nie jest jałowa.
Zawartość strzykawki oraz powierzchnia pod niebieską nasadką i żebra usztywniające tłoczka są jałowe i dlatego podczas montażu należy zachować ostrożność.
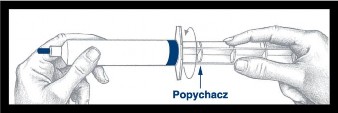
| Wyjąć strzykawkę z podstawki i sprawdzić, czy nie ma wycieków wokół niebieskiej nasadki i na zewnątrz tłoczka. Nie używać strzykawki w razie zauważenia wycieku. |
| Po wkręceniu popychacza w tłoczek strzykawki, ważne jest przekręcenie popychacza dodatkowo o ½ obrotu, tak aby niebieski tłoczek obracał się swobodnie. |
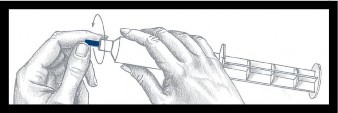
| Przed użyciem strzykawki niebieską nasadkę należy odkręcić i wyrzucić. Powierzchnia pod nasadką jest jałowa, należy uważać, żeby jej nie dotykać podczas wykonywania dalszych czynności. Strzykawka jest teraz gotowa do nałożenia igły lub rurki infuzyjnej. |
Po użyciu wyrzucić strzykawkę i niewykorzystaną porcję leku.
Instrukcja obsługi strzykawek ze wstrzykiwaczem ciśnieniowym
Wstępnie napełniona strzykawka
Montaż i kontrola
Uwaga: Zewnętrzna strona strzykawki nie jest jałowa.
Zawartość strzykawki oraz powierzchnia pod niebieską nasadką i żebra usztywniające tłoczka są jałowe i dlatego podczas montażu należy zachować ostrożność.
| Wyjąć strzykawkę z podstawki i sprawdzić, czy nie ma wycieków wokół niebieskiej nasadki i na zewnątrz tłoczka. Nie używać strzykawki w razie zauważenia wycieku. Umieścić strzykawkę w osłonie ciśnieniowej. |
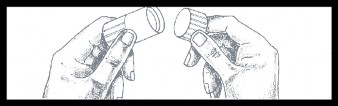
| W celu zdjęcia niebieskiej nasadki, należy ją wcisnąć i przekręcić, a po zdjęciu wyrzucić. Powierzchnia pod nasadką jest jałowa. Podczas dalszych czynności należy zachować ostrożność. |
| Następnie usunąć kapturek z zabezpieczającej osłonki przeciwpyłowej łącznika typu Luer, obracając go w celu zerwania widocznego zabezpieczenia. Kapturek wyrzucić. |
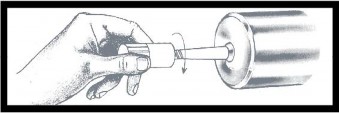
| Przykręcić łącznik typu Luer do strzykawki, trzymając za osłonę przeciwpyłową i dokręcając go do oporu. Zdjąć i wyrzucić osłonę przeciwpyłową bezpośrednio przed podłączeniem jałowej rurki łącznika. |
Po użyciu wyrzucić strzykawkę i niewykorzystaną porcję leku.