Spis treści:
- Co to jest lek Fulvestrant Glenmark i w jakim celu się go stosuje
- Informacje ważne przed zastosowaniem leku Fulvestrant Glenmark Kiedy nie stosować leku Fulvestrant Glenmark:
- Jak stosować lek Fulvestrant Glenmark
- Możliwe działania niepożądane
- Jak przechowywać lek Fulvestrant Glenmark
- Zawartość opakowania i inne informacje Co zawiera lek Fulvestrant Glenmark
Ulotka dołączona do opakowania: informacja dla użytkownika
Fulvestrant Glenmark, 250 mg/5 ml, roztwór do wstrzykiwań w ampułko-strzykawce
Fulvestrantum
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy
niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
Co to jest lek Fulvestrant Glenmark i w jakim celu się go stosuje
jako jedyny lek, w leczeniu kobiet po menopauzie z pewnym rodzajem raka piersi zwanym rakiem piersi z obecnością receptorów estrogenowych, który jest miejscowo zaawansowany lub rozprzestrzenił się do innych części ciała (przerzuty) lub
w skojarzeniu z palbocyklibem w leczeniu kobiet z pewnym rodzajem raka piersi zwanego rakiem piersi z obecnością receptorów hormonalnych, bez ekspresji receptora ludzkiego naskórkowego czynnika wzrostu 2, który jest miejscowo zaawansowany lub rozprzestrzenił się do innych części ciała (przerzuty). Kobiety, które nie osiągnęły jeszcze menopauzy będą również otrzymywać lek zwany agonistą hormonu uwalniającego hormon luteinizujący (LHRH).
Gdy lek Fulvestrant Glenmark jest podawany w skojarzeniu z palbocyklibem, ważne jest, by także przeczytać ulotkę dołączoną do opakowania z palbocyklibem. W razie jakichkolwiek pytań
dotyczących palbocyklibu należy zwrócić się do lekarza prowadzącego.
Lek Fulvestrant Glenmark zawiera substancję czynną fulwestrant, która należy do leków blokujących działanie receptorów estrogenowych. Estrogeny, żeńskie hormony płciowe, mogą czasami mieć wpływ na rozwój raka piersi.
Lek Fulvestrant Glenmark jest stosowany albo:
Informacje ważne przed zastosowaniem leku Fulvestrant Glenmark Kiedy nie stosować leku Fulvestrant Glenmark:
jeśli pacjentka ma uczulenie na fulwestrant lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
jeśli pacjentka jest w ciąży lub karmi piersią.
jeśli u pacjentki występują ciężkie zaburzenia czynności wątroby.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Fulvestrant Glenmark należy omówić to z lekarzem lub farmaceutą lub pielęgniarką, jeśli którakolwiek z sytuacji dotyczy pacjenta:
choroby nerek lub wątroby
zmniejszona liczba płytek krwi (które umożliwiają krzepnięcie krwi) lub skaza krwotoczna
choroba zakrzepowa w przeszłości
zmniejszenie wysycenia mineralnego kości (osteoporoza)
uzależnienie od alkoholu
Dzieci i młodzież
Leku Fulvestrant Glenmark nie stosuje się u dzieci i młodzieży w wieku poniżej 18 lat.
Lek Fulvestrant Glenmark a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach stosowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje stosować.
W szczególności należy poinformować lekarza, jeśli pacjentka przyjmuje leki przeciwzakrzepowe (leki zapobiegające powstawaniu zakrzepów krwi).
Ciąża i karmienie piersią
Leku Fulvestrant Glenmark nie wolno stosować w ciąży. Jeśli pacjentka może zajść w ciążę powinna stosować skuteczną antykoncepcję podczas leczenia lekiem Fulvestrant Glenmark i przez 2 lata po przyjęciu ostatniej dawki.
Podczas leczenia lekiem Fulvestrant Glenmark nie wolno karmić piersią.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie należy spodziewać się, aby lek Fulvestrant Glenmark wpływał na zdolność prowadzenia pojazdów lub obsługiwanie maszyn. Jeśli po zastosowaniu leku Fulvestrant Glenmark wystąpi uczucie
zmęczenia nie wolno prowadzić pojazdów mechanicznych i obsługiwać maszyn.
Lek Fulvestrant Glenmark zawiera 500 mg alkoholu (etanolu) w każdym wstrzyknięciu, co jest równoważne 100 mg/ml (10% w/v). Ilość alkoholu w każdym wstrzyknięciu tego leku jest równoważna 13 ml piwa lub 5 ml wina.
Ilość alkoholu w tym leku prawdopodobnie nie będzie miała wpływu na dorosłych i młodzież. Alkohol w tym leku może zmieniać działanie innych leków. Jeśli pacjentka przyjmuje inne leki, powinna poradzić się lekarza lub farmaceuty.
Jeśli pacjentka jest w ciąży lub karmi piersią, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Jeśli pacjentka jest uzależniona od alkoholu, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Lek Fulvestrant Glenmark zawiera alkohol benzylowy
Lek zawiera 500 mg alkoholu benzylowego w każdej ampułko-strzykawce, co odpowiada 100 mg/ml. Alkohol benzylowy może powodować reakcje alergiczne.
Jeśli pacjentka jest w ciąży lub karmi piersią, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Kobiety w ciąży lub karmiące piersią, pacjentki z chorobami wątroby lub nerek powinny
skontaktować się z lekarzem przed zastosowaniem leku, gdyż duża ilość alkoholu benzylowego może gromadzić się w ich organizmie i powodować działania niepożądane (tzw. kwasicę metaboliczną).
Lek Fulvestrant Glenmark zawiera benzylu benzoesan
Lek Fulvestrant Glenmark zawiera 750 mg benzylu benzoesanu w każdej ampułko-strzykawce, co odpowiada 150 mg/ml.
Jak stosować lek Fulvestrant Glenmark
Możliwe działania niepożądane
reakcje uczuleniowe (nadwrażliwość), w tym obrzęki twarzy, warg, języka i (lub) gardła, które mogą być objawami reakcji anafilaktycznych
choroba zakrzepowo-zatorowa (zwiększone ryzyko tworzenia się skrzeplin żylnych)*
zapalenie wątroby
niewydolność wątroby
Jeśli u pacjenta wystąpi którekolwiek z następujących działań niepożądanych należy powiadomić lekarza, farmaceutę lub pielęgniarkę:
Bardzo częste działania niepożądane (mogą wystąpić u więcej niż 1 na 10 osób)
objawy w miejscu podania leku, takie jak ból i (lub) stan zapalny
zmiany aktywności enzymów wątrobowych (w badaniu krwi)*
nudności
uczucie osłabienia, zmęczenie*
ból stawów i bóle mięśniowo-szkieletowe
uderzenia gorąca
wysypka skórna
reakcje uczuleniowe (nadwrażliwość), w tym obrzęki twarzy, warg, języka i (lub) gardła
Wszystkie pozostałe działania niepożądane:
Częste działania niepożądane (mogą wystąpić u najwyżej 1 na 10 osób)
bóle głowy
wymioty, biegunka lub utrata apetytu*
infekcje układu moczowego
bóle pleców*
zwiększone stężenie bilirubiny (barwnik wytwarzany przez wątrobę)
choroba zakrzepowo-zatorowa (zwiększone ryzyko tworzenia się skrzeplin żylnych)*
zmniejszona liczba płytek krwi (małopłytkowość)
krwawienia z pochwy
ból w dolnej części pleców promieniujący do nogi z jednej strony ciała (rwa kulszowa)
nagłe osłabienie, drętwienie, mrowienie lub utrata ruchomości w nodze, szczególnie z jednej strony ciała, nagłe trudności z chodzeniem lub utrzymaniem równowagi (neuropatia obwodowa)
Działania niepożądane występujące niezbyt często (mogą wystąpić u najwyżej 1 na 100 osób)
gęste, białawe upławy z pochwy i kandydoza pochwy (zakażenie)
zasinienie i krwawienie w miejscu wstrzyknięcia
wzrost aktywności gamma-glutamylotransferazy, enzymu wątrobowego oznaczanego w badaniach krwi
zapalenie wątroby (hepatitis)
niewydolność wątroby
drętwienie, mrowienie i ból
reakcje anafilaktyczne
* Obejmuje działania niepożądane, w przypadku których wpływ produktu Fulvestrant Glenmark nie może zostać oceniony z powodu istnienia choroby podstawowej.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, 02-222 Warszawa; tel.: + 48 22 49 21 301; faks: + 48 22 49 21 309 Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak przechowywać lek Fulvestrant Glenmark
Zawartość opakowania i inne informacje Co zawiera lek Fulvestrant Glenmark
Substancją czynną leku jest fulwestrant. Każda ampułko-strzykawka (5 ml) zawiera 250 mg fulwestrantu.
Pozostałe składniki to: etanol (96%), alkohol benzylowy, benzylu benzoesan i olej rycynowy oczyszczony.
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza lub farmaceuty. W razie wątpliwości należy zwrócić się do lekarza lub farmaceuty.
Zalecana dawka to 500 mg fulwestrantu (dwa wstrzyknięcia 250 mg/5 ml), podawane raz na miesiąc oraz dodatkowa dawka 500 mg podana po 2 tygodniach od pierwszej dawki.
Lek Fulvestrant Glenmark zostanie powoli wstrzyknięty domięśniowo przez lekarza lub pielęgniarkę, każde wstrzyknięcie w inny pośladek.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku, należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Jeśli u pacjenta wystąpią którekolwiek z następujących działań niepożądanych należy niezwłocznie skontaktować się z lekarzem:
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pudełku tekturowy po: Termin ważności (EXP) lub na etykiecie po skrócie: EXP. Termin ważności oznacza ostatni dzień podanego miesiąca.
Przechowywać i przewozić w stanie schłodzonym (2°C - 8°C).
Należy ograniczyć przechowywanie produktu w temperaturze innej niż 2°C - 8°C. Należy unikać przechowywania w temperaturze wyższej niż 30°C i nie przekraczać okresu 28 dni ze średnią
temperaturą przechowywania poniżej 25°C (ale powyżej zakresu 2°C - 8°C). Jeśli zakres temperatur zostanie przekroczony, należy natychmiast zastosować zalecane warunki przechowywania
(przechowywać i przewozić w stanie schłodzonym 2°C - 8°C). Przekroczenie właściwego zakresu temperatury przechowywania może mieć skumulowany wpływ na jakość produktu, a 28-dniowy okres nie może być przekroczony w ciągu 2 lat terminu ważności produktu Fulvestrant Glenmark.
Ekspozycja na temperaturę poniżej 2°C nie powoduje uszkodzenia produktu, jeśli nie jest on przechowywany w temperaturze poniżej -20°C.
Przechowywać ampułko-strzykawkę w oryginalnym opakowaniu w celu ochrony przed światłem.
Personel medyczny jest odpowiedzialny za właściwe przechowywanie, sposób użycia i zniszczenie opakowania leku Fulvestrant Glenmark po jego zużyciu.
Ten lek może stanowić zagrożenie dla środowiska wodnego. Leków nie należy wyrzucać do
kanalizacji ani domowych pojemników na odpadki. Należy zapytać farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
Jak wygląda lek Fulvestrant Glenmark i co zawiera opakowanie
Lek Fulvestrant Glenmark to przezroczysty, bezbarwny do żółtego, lepki roztwór w ampułko-
strzykawce, zawierającej 5 ml roztworu do wstrzykiwań. W celu podania zalecanej miesięcznej dawki 500 mg należy wstrzyknąć zawartość dwóch ampułko-strzykawek.
Lek Fulvestrant Glenmark posiada 2 rodzaje opakowań: opakowanie zawierające 1 szklaną ampułko- strzykawkę lub opakowanie zawierające 2 szklane ampułko-strzykawki.
Opakowania zawierają także igły do podawania, z systemem zabezpieczającym (BD Safety Glide).
Podmiot odpowiedzialny i wytwórca
Glenmark Pharmaceuticals s.r.o. Hvězdova 1716/2b
140 78 Praga 4 Republika Czeska
Wytwórca
Laboratorios Farmalán, S.A. Calle La Vallina s/n, Edificio 2 Polígono Industrial Navatejera 24193 Villaquilambre, León Hiszpania
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do miejscowego przedstawiciela podmiotu odpowiedzialnego:
Glenmark Pharmaceuticals Sp. z o. o. ul. Osmańska 14
02-823 Warszawa
Ten produkt leczniczy jest dopuszczony do obrotu w państwach członkowskich pod następującymi nazwami:
Państwo | Nazwa produktu leczniczego |
Dania | Fulvestrant Glenmark |
Hiszpania | FULVESTRANT VISO FARMACÉUTICA 250 MG SOLUCION INYECTABLE EFG |
Holandia | Fulvestrant Glenmark 250 mg oplossing voor injectie |
Niemcy | Fulvestrant Glenmark 250 mg Injektionslösung |
Norwegia | Fulvestrant Glenmark |
Polska | Fulvestrant Glenmark |
Słowacja | Fulvestrant Glenmark 250 mg injekčný roztok |
Szwecja | Fulvestrant Glenmark |
Wielka Brytania | Fulvestrant 250 mg solution for injection |
Data ostatniej aktualizacji ulotki:
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Lek Fulvestrant Glenmark, 500 mg (2 x 250 mg/5 ml roztwór do wstrzykiwań) powinien być podawany przy użyciu dwóch ampułko-strzykawek, patrz punkt 3.
Instrukcja podawania
Uwaga – nie należy umieszczać w autoklawie igły z systemem zabezpieczającym (BD SafetyGlide Safety Hypodermic Needle) przed jej zastosowaniem. Podczas stosowania leku i usuwania
pozostałości należy unikać kontaktu rąk z igłą.
Dotyczy obu strzykawek:
Wyjąć szklaną ampułkę z pojemnika i sprawdzić, czy nie jest uszkodzona.
Otworzyć opakowanie zewnętrzne igły z systemem zabezpieczającym (SafetyGlide).
Roztwory do podania pozajelitowego należy przed podaniem ocenić wizualnie, czy nie zawierają cząstek stałych i, czy nie zmieniły barwy.
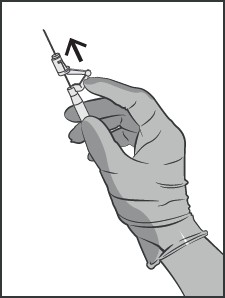
Trzymać strzykawkę pionowo w części prążkowanej (C). Drugą ręką chwycić nasadkę (A) i ostrożnie przekręcić plastikową, sztywną końcówkę nasadki w kierunku przeciwnym do ruchu wskazówek zegarka (patrz rysunek nr 1).
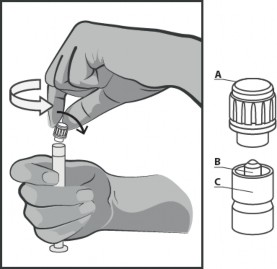
Rysunek nr 1
Usunąć sztywną końcówkę nasadki (A) w kierunku pionowym ku górze. W celu zachowania sterylności nie dotykać końcówki strzykawki (B) (patrz rysunek nr 2).
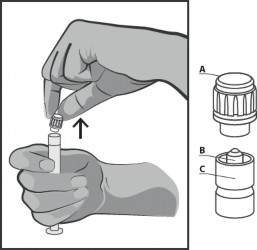
Rysunek nr 2
Dołączyć igłę z systemem zabezpieczającym do końcówki Luer-Lock i mocno dokręcić do oporu (patrz rysunek nr 3).
Sprawdzić czy igła jest połączona z końcówką Luer przed przejściem do pozycji pionowej.
Pociągnąć osłonkę igły zdecydowanym ruchem, aby nie uszkodzić jej ostrego końca.
Napełnioną igłę zbliżyć do miejsca podania.
Usunąć osłonkę igły.
Usunąć nadmiar powietrza ze strzykawki.
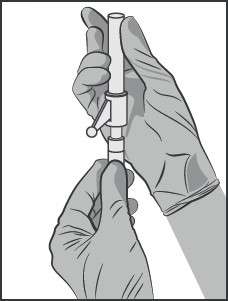
Rysunek nr 3
Lek podawać domięśniowo, powoli (1-2 minuty/wstrzyknięcie), w mięsień pośladkowy (miejsce na pośladku). Dla wygody osoby podającej, ścięcie igły znajduje się na tej samej powierzchni igły co dźwignia systemu zabezpieczającego igłę (patrz rysunek nr 4).
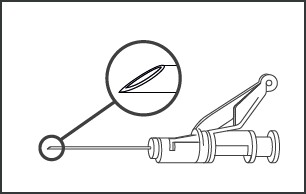
Rysunek nr 4
Natychmiast po podaniu leku należy uruchomić palcem system zabezpieczający igłę przez popchnięcie do przodu jego dźwigni (patrz rysunek nr 5).
UWAGA: System należy aktywować z dala od siebie i innych. Końcówka igły jest całkowicie ukryta w momencie usłyszenia kliknięcia, należy to potwierdzić wizualnie.
Rysunek nr 5 Usuwanie pozostałości
Ampułko-strzykawki są przeznaczone tylko do jednorazowego użycia.
Ten lek może stanowić zagrożenie dla środowiska wodnego. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.











