Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Szybkiej kontroli objawów ciężkiego, ostrego pobudzenia psychoruchowego w przebiegu zaburzeń psychotycznych lub w epizodach manii w chorobie afektywnej dwubiegunowej, gdy nie można
zastosować leczenia doustnego.
Doraźnym leczeniu majaczenia, po niepowodzeniu leczenia niefarmakologicznego.
Leczeniu pląsawicy o nasileniu łagodnym i umiarkowanym w chorobie Huntingtona, gdy inne produkty lecznicze nie są skuteczne lub nie są tolerowane, a leczenia doustnego nie można
zastosować.
Zapobieganiu wymiotom i nudnościom pooperacyjnym, jako jedyny lek lub w skojarzeniu, u
pacjentów z umiarkowanym lub wysokim ich ryzykiem, gdy inne produkty lecznicze nie są skuteczne lub nie są tolerowane.
Skojarzonym leczeniu nudności i wymiotów pooperacyjnych, gdy inne produkty lecznicze nie są skuteczne lub nie są tolerowane.
Dawkowanie i sposób podawania
5 mg domięśniowo
Dawkę można powtarzać co godzinę, aż do osiągnięcia odpowiedniej kontroli objawów.
U większości pacjentów wystarczą dawki do 15 mg/dobę. Dawka maksymalna wynosi 20 mg/dobę.
Na wczesnym etapie leczenia należy ocenić zasadność dalszego stosowania produktu Haloperidol WZF (patrz punkt 4.4). Należy odstawić produkt Haloperidol WZF roztwór do wstrzykiwań tak szybko, jak umożliwią to wskazania kliniczne, jeżeli natomiast konieczne jest dalsze leczenie, należy rozpocząć stosowanie haloperydolu w postaci doustnej, stosując przeliczenie dawki 1:1, a następnie dostosować dawkę do odpowiedzi klinicznej.
1 do 10 mg domięśniowo.
Leczenie rozpoczynać od najniższej możliwej dawki, a następnie jeśli pobudzenie się utrzymuje, dawkę dostosować w odstępach co 2-4 godziny, aż do dawki maksymalnej wynoszącej 10 mg/dobę.
2 do 5 mg domięśniowo.
Dawkę można powtarzać co godzinę, aż do osiągnięcia odpowiedniej kontroli objawów lub do osiągnięcia dawki maksymalnej wynoszącej 10 mg/dobę.
1 do 2 mg domięśniowo, w momencie wprowadzenia do znieczulenia lub na 30 minut przed wybudzeniem.
1 do 2 mg domięśniowo.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Leki przeciwarytmiczne klasy IA (np.: dyzopiramid, chinidyna).
Leki przeciwarytmiczne klasy III (np.: amiodaron, dofetylid, dronedaron, ibutylid, sotalol).
Niektóre leki przeciwdepresyjne (np.: cytalopram, escytalopram).
Niektóre antybiotyki (np.: azytromycyna, klarytromycyna, erytromycyna, lewofloksacyna, moksyfloksacyna, telitromycyna).
Inne leki przeciwpsychotyczne (np.: pochodne fenotiazyny, sertyndol, pimozyd, zyprazydon).
Niektóre leki przeciwgrzybicze (np. pentamidyna).
Niektóre leki przeciwmalaryczne (np. halofantryna).
Niektóre leki stosowane w zaburzeniach żołądkowo-jelitowych (np. dolasetron).
Niektóre produkty lecznicze stosowane w onkologii (np. toremifen, wandetanib).
Inne produkty lecznicze (np. beprydyl, metadon). Powyższa lista nie jest wyczerpująca.
Należy zachować ostrożność stosując produktu Haloperidol WZF w skojarzeniu z produktami leczniczymi, które wpływają na równowagę elektrolitową (patrz punkt 4.4).
Produkty lecznicze mogące zwiększać stężenie haloperydolu w osoczu
Metabolizm haloperydolu przebiega kilkoma szlakami (patrz punkt 5.2). Główne szlaki metaboliczne obejmują glukuronidację i redukcję grupy ketonowej. Uczestniczy w tym również układ
enzymatyczny cytochromu P450, szczególnie CYP3A4 oraz, w mniejszym stopniu, CYP2D6. Hamowanie tych szlaków metabolizmu przez inne produkty lecznicze lub poprzez zmniejszenie aktywności enzymów CYP2D6 może spowodować wzrost stężenia haloperydolu. Hamowanie
CYP3A4 oraz zmniejszenie aktywności CYP2D6 może dawać efekt addytywny (patrz punkt 5.2). Na podstawie ograniczonych i niekiedy sprzecznych informacji, stężenie haloperydolu w osoczu,
w przypadku jednoczesnego podawania z inhibitorem CYP3A4 i (lub) CYP2D6, może się zwiększyć o 20 do 40%, chociaż w niektórych przypadkach zgłaszano wzrost stężenia nawet o 100%.
Przykładowe produkty lecznicze, które mogą zwiększać stężenie haloperydolu w osoczu (na podstawie doświadczenia klinicznego lub mechanizmu interakcji z lekami), to:
inhibitory CYP3A4 – alprazolam, fluwoksamina, indynawir, itrakonazol, ketokonazol, nefazodon, pozakonazol, sakwinawir, werapamil, worykonazol.
inhibitory CYP2D6 – bupropion, chloropromazyna, duloksetyna, paroksetyna, prometazyna, sertralina, wenlafaksyna.
inhibitory jednocześnie CYP3A4 i CYP2D6: fluoksetyna, rytonawir.
bez potwierdzonego mechanizmu – buspiron. Powyższa lista nie jest wyczerpująca.
Podwyższone stężenie haloperydolu w osoczu może prowadzić do zwiększenia ryzyka zdarzeń niepożądanych, włącznie z wydłużeniem odstępu QTc (patrz punkt 4.4). Wydłużenie odstępu QTc obserwowano podczas jednoczesnego podawania z inhibitorami metabolicznymi - ketokonazolem (400 mg/dobę) i paroksetyną (20 mg/dobę).
Zaleca się, aby pacjentów, przyjmujących haloperydol jednocześnie z tego typu produktami leczniczymi, monitorować pod kątem wystąpienia objawów przedmiotowych i podmiotowych
nasilonego lub wydłużonego działania farmakologicznego haloperydolu, a w razie potrzeby zaleca się zmniejszenie dawki produktu Haloperidol WZF.
Produkty lecznicze mogące zmniejszać stężenie haloperydolu w osoczu
Jednoczesne stosowanie haloperydolu z lekami silnie indukującymi CYP3A4 może stopniowo
zmniejszać stężenie haloperydolu w osoczu do tego stopnia, że jego skuteczność zostanie obniżona. Przykładowe substancje to:
karbamazepina, fenobarbital, fenytoina, ryfampicyna, ziele dziurawca zwyczajnego (Hypericum perforatum).
Powyższa lista nie jest wyczerpująca.
Po kilku dniach leczenia można zaobserwować indukcję enzymów. Najsilniejszą indukcję enzymów stwierdza się zwykle po około 2 tygodniach i może następnie utrzymywać się przez taki sam okres po przerwaniu stosowania produktu leczniczego. Zaleca się, aby w trakcie skojarzonego leczenia z induktorami CYP3A4, monitorować stan pacjentów, a w razie potrzeby zwiększyć dawkę produktu Haloperidol WZF. Po odstawieniu leku indukującego CYP3A4, stężenie haloperydolu może stopniowo wzrastać i dlatego może być konieczne zmniejszenie dawki produktu Haloperidol WZF.
Wiadomo, że walproinian sodu hamuje glukuronidację, ale nie wpływa na stężenie haloperydolu w osoczu.
Wpływ haloperydolu na inne produkty lecznicze
Haloperydol może nasilać depresję ośrodkowego układu nerwowego (OUN), jaką wywołuje alkohol lub produkty lecznicze hamujące OUN, w tym leki nasenne, uspokajające lub silne leki
przeciwbólowe. Donoszono również o nasilonym wpływie na OUN podczas jednoczesnego stosowania z metyldopą.
Haloperydol może działać przeciwstawnie do adrenaliny i innych produktów
sympatykomimetycznych (np. substancji pobudzających, takich jak pochodne amfetaminy) oraz odwracać działanie hipotensyjne produktów leczniczych blokujących receptory adrenergiczne, takich jak guanetydyna.
Haloperydol może zmniejszać działanie lewodopy i innych agonistów dopaminy.
Haloperydol jest inhibitorem CYP2D6. Hamuje metabolizm trójpierścieniowych leków
przeciwdepresyjnych (np. imipraminy, dezypraminy), zwiększając tym samym ich stężenie w osoczu.
Inne rodzaje interakcji
W rzadkich przypadkach, po jednoczesnym zastosowaniu litu i haloperydolu zgłaszano wystąpienie następujących objawów: encefalopatia, zespół objawów pozapiramidowych, dyskinezy późne, złośliwy zespół neuroleptyczny, ostry zespół mózgowy oraz śpiączka. Większość z tych objawów miała charakter przemijający. Dotychczas pozostaje niejasne, czy stanowią one osobną jednostkę kliniczną.
Niemniej, zaleca się, aby u pacjentów otrzymujących jednocześnie lit i produkt Haloperidol WZF, natychmiast przerwać leczenie w razie wystąpienia tego typu objawów.
Odnotowano działanie antagonistyczne haloperydolu wobec leku przeciwzakrzepowego, fenindionu.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Zgłaszane w badaniach klinicznych haloperydolu.
Zgłaszane w badaniach klinicznych haloperydolu dekanonianu i dotyczących substancji czynnej.
Zgłaszane po wprowadzeniu do obrotu haloperydolu oraz haloperydolu dekanonianu.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
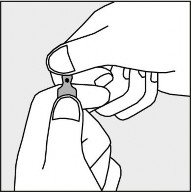
Aby otworzyć ampułkę należy trzymać ją pionowo, w obu dłoniach, kolorową kropką do siebie - patrz rysunek 2. Górną część ampułki należy uchwycić w taki sposób, aby kciuk znajdował się powyżej kolorowej kropki.
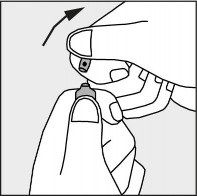
Nacisnąć zgodnie ze strzałką umieszczoną na rysunku 3.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
HALOPERIDOL WZF, 5 mg/ml, roztwór do wstrzykiwań
Każdy ml roztworu do wstrzykiwań zawiera 5 mg haloperydolu (Haloperidolum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań
Przezroczysty i bezbarwny płyn.
Produkt leczniczy Haloperidol WZF roztwór do wstrzykiwań wskazany jest u dorosłych w:
Dawkowanie
Dorośli
Zalecana jest mała dawka początkowa, którą należy dostosowywać w zależności od odpowiedzi na leczenie, ustalając najmniejszą, skuteczną dawkę (patrz punkt 5.2).
Zalecane dawki produktu Haloperidol WZF roztwór do wstrzykiwań przedstawiono w tabeli 1.
Tabela 1.: Zalecenia dotyczące dawkowania haloperydolu u dorosłych w wieku 18 lat i starszych
Szybka kontrola objawów ciężkiego, ostrego pobudzenia psychoruchowego w przebiegu zaburzeń psychotycznych lub w epizodach manii w chorobie afektywnej dwubiegunowej, gdy nie można zastosować leczenia doustnego.
Doraźne leczenie majaczenia, po niepowodzeniu leczenia niefarmakologicznego |
Leczenie pląsawicy o nasileniu łagodnym i umiarkowanym w chorobie Huntingtona, gdy inne produkty lecznicze nie są skuteczne lub nie są tolerowane, a leczenia doustnego nie można zastosować |
Zapobieganiu wymiotom i nudnościom pooperacyjnym, jako jedyny lek lub w skojarzeniu, u pacjentów z umiarkowanym lub wysokim ich ryzykiem, gdy inne produkty lecznicze nie są skuteczne lub nie są tolerowane. |
Skojarzone leczenie nudności i wymiotów pooperacyjnych, gdy inne produkty lecznicze nie są skuteczne lub nie są tolerowane |
Zakończenie leczenia
Zaleca się stopniowe odstawianie haloperydolu (patrz punkt 4.4).
Szczególne grupy pacjentów
Osoby w podeszłym wieku
Zalecana dawka początkowa haloperydolu u pacjentów w podeszłym wieku to połowa najmniejszej dawki dla dorosłych.
Kolejne dawki można podawać i dostosowywać, stosownie do odpowiedzi na leczenie. Zaleca się ostrożne i stopniowe zwiększanie dawki u pacjentów w podeszłym wieku.
Dawka maksymalna wynosi 5 mg/dobę.
Zastosowanie dawek powyżej 5 mg/dobę można rozważyć tylko u pacjentów, którzy tolerowali większe dawki i po powtórnej ocenie indywidualnego profilu korzyści – ryzyko u danego pacjenta.
Zaburzenia czynności nerek
Nie oceniano wpływu zaburzeń czynności nerek na parametry farmakokinetyczne haloperydolu. Nie ma potrzeby zmiany dawki podczas stosowania leku u pacjentów z zaburzeniami czynności nerek, należy jednak zachować ostrożność. Pacjenci z ciężkimi zaburzeniami czynności nerek mogą wymagać zastosowania mniejszej dawki początkowej, niż pacjenci z prawidłową czynnością nerek, a kolejne dawki należy dostosować do odpowiedzi na leczenie (patrz punkt 5.2).
Zaburzenia czynności wątroby
Nie oceniano wpływu zaburzeń czynności wątroby na parametry farmakokinetyczne haloperydolu. Ponieważ haloperydol jest intensywnie metabolizowany w wątrobie, zaleca się stosowanie połowy
dawki początkowej. Kolejne dawki należy dostosować do odpowiedzi na leczenie (patrz punkty 4.4 i 5.2).
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Haloperidol WZF roztwór do wstrzykiwań u dzieci i młodzieży w wieku poniżej 18 lat. Brak dostępnych danych.
Sposób podawania
Haloperidol WZF roztwór do wstrzykiwań zalecany jest wyłącznie do podania domięśniowego (patrz punkt 4.4). Instrukcje dotyczące przygotowania produktu Haloperidol WZF roztwór do wstrzykiwań, patrz punkt 6.6.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Stan śpiączki.
Depresja ośrodkowego układu nerwowego (OUN). Choroba Parkinsona.
Otępienie z ciałami Lewy'ego. Postępujące porażenie nadjądrowe.
Stwierdzone wydłużenie odstępu QTc lub wrodzony zespół wydłużonego QT. Niedawno przebyty ostry zawał mięśnia sercowego.
Niewyrównana niewydolność serca.
Zaburzenia rytmu komorowego lub torsade de pointes w wywiadzie. Niewyrównana hipokaliemia.
Stosowanie produktów leczniczych wydłużających odstęp QT (patrz punkt 4.5).
Zwiększona śmiertelność wśród osób w podeszłym wieku z otępieniem
Odnotowano rzadkie przypadki nagłych zgonów pacjentów z zaburzeniami psychicznymi, którzy otrzymywali leki przeciwpsychotyczne, w tym haloperydol (patrz punkt 4.8).
Pacjenci w podeszłym wieku z psychozą związaną z otępieniem, otrzymujący leki
przeciwpsychotyczne są narażeni na zwiększone ryzyko zgonu. Analizy siedemnastu badań z kontrolą placebo (średni czas trwania 10 tygodni), głównie z udziałem pacjentów przyjmujących atypowe leki przeciwpsychotyczne, wykazały, że ryzyko zgonu u pacjentów otrzymujących lek było 1,6 do 1,7 razy większe, niż ryzyko zgonu u pacjentów otrzymujących placebo. Podczas typowego 10 tygodniowego badania z grupą kontrolną odsetek zgonów u pacjentów otrzymujących leki przeciwpsychotyczne wynosił 4,5%, w porównaniu do około 2,6% w grupie placebo. Chociaż przyczyny zgonu były różne, większość wiązała się albo z zaburzeniami sercowo-naczyniowymi (np. niewydolność serca, nagły
zgon) albo z zakażeniami (np. zapalenie płuc). Badania obserwacyjne wskazują, że leczeniu haloperydolem pacjentów w podeszłym wieku towarzyszy zwiększona umieralność. Ten związek
może być silniejszy dla haloperydolu, niż dla atypowych leków przeciwpsychotycznych, jest bardziej zauważalny w pierwszych 30 dniach od rozpoczęcia leczenia i utrzymuje się przez co najmniej
6 miesięcy. Nie ustalono jeszcze, w jakim zakresie zwiększenie umieralności w badaniach obserwacyjnych można przypisać lekowi przeciwpsychotycznemu, a w jakim niektórym indywidualnym cechom pacjenta.
Haloperidol WZF roztwór do wstrzykiwań nie jest wskazany w leczeniu zaburzeń behawioralnych w przebiegu otępienia.
Wpływ na układ sercowo-naczyniowy
Donoszono o przypadkach wydłużenia odstępu QTc i (lub) komorowych zaburzeń rytmu,
towarzyszących rzadkim przypadkom nagłych zgonów, po zastosowaniu haloperydolu (patrz punkty
4.3 i 4.8). Ryzyko takich zdarzeń zwiększa się po zastosowaniu dużych dawek, przy dużym stężeniu w osoczu oraz u predysponowanych pacjentów lub po podaniu pozajelitowym, a zwłaszcza dożylnym.
Haloperidol WZF roztwór do wstrzykiwań zalecany jest wyłącznie do stosowania domięśniowego. Jeśli jednak jest podawany dożylnie, należy prowadzić monitorujące badanie EKG, w celu wykrycia wydłużenia odstępu QTc lub komorowych zaburzeń rytmu.
Należy zachować ostrożność u pacjentów z rzadkoskurczem, chorobą serca, wydłużeniem odstępu QTc w wywiadzie rodzinnym lub nadużywających kiedykolwiek w przeszłości lub aktualnie alkoholu. Należy również zachować ostrożność u pacjentów, u których stężenia haloperydolu w osoczu mogą osiągać wysokie wartości (patrz punkt 4.4 Osoby wolno metabolizujące przy udziale CYP2D6).
Przed podaniem leku domięśniowo zaleca się przeprowadzenie badania EKG. W trakcie leczenia u każdego pacjenta należy rozważyć potrzebę przeprowadzenia badań EKG, w celu wykrycia wydłużenia odstępu QTc lub komorowych zaburzeń rytmu, jednak w przypadku podania dawek
wielokrotnych domięśniowo zaleca się prowadzenie ciągłego monitorowania EKG. Monitorowanie
EKG zaleca się prowadzić do 6 godzin po podaniu produktu leczniczego Haloperidol WZF roztwór do wstrzykiwań pacjentom w profilaktyce lub leczeniu nudności i wymiotów pooperacyjnych.
Jeżeli w trakcie leczenia odstęp QT ulegnie wydłużeniu, zaleca się zmniejszenie dawki, jeżeli jednak odstęp QTc jest dłuższy niż 500 ms, haloperydol należy odstawić.
Zaburzenia elektrolitowe, takie jak hipokaliemia i hipomagnezemia, zwiększają ryzyko komorowych zaburzeń rytmu i należy je skorygować przed rozpoczęciem leczenia haloperydolem. Dlatego zaleca się wykonanie badania stężenia elektrolitów przed rozpoczęciem leczenia i okresowe monitorowanie w trakcie leczenia.
Zgłaszano również przypadki częstoskurczu i niedociśnienia (w tym niedociśnienia ortostatycznego) (patrz punkt 4.8). Zaleca się zachowanie ostrożności w przypadku podawania haloperydolu pacjentom z objawami niedociśnienia lub niedociśnienia ortostatycznego.
Zdarzenia naczyniowo-mózgowe
W randomizowanych badaniach klinicznych z kontrolą placebo, przeprowadzonych wśród pacjentów z otępieniem, odnotowano około 3-krotny wzrost ryzyka naczyniowo-mózgowych zdarzeń
niepożądanych podczas stosowania niektórych atypowych leków przeciwpsychotycznych. Badania obserwacyjne porównujące odsetek udarów u pacjentów w podeszłym wieku otrzymujących
jakiekolwiek leki przeciwpsychotyczne wobec odsetka udarów u pacjentów, którzy nie otrzymywali tego typu produktów leczniczych, wykazały podwyższony odsetek udarów wśród pacjentów otrzymujących leczenie. Wzrost ten może być większy w przypadku stosowania każdej z pochodnych butyrofenonu, w tym haloperydolu. Mechanizm prowadzący do tego wzrostu częstości udarów nie został poznany. Nie można wykluczyć zwiększonego ryzyka w innych grupach pacjentów. Należy
zachować ostrożność stosując produkt Haloperidol WZF u pacjentów z czynnikami ryzyka udaru.
Złośliwy zespół neuroleptyczny
Stosowanie haloperydolu wiązało się z występowaniem złośliwego zespołu neuroleptycznego, rzadko występującą reakcją osobniczą, charakteryzującą się wysoką gorączką, uogólnionym wzmożonym napięciem mięśniowym, dysfunkcją układu autonomicznego, zaburzeniami świadomości oraz podwyższoną aktywnością fosfokinazy kreatyninowej w osoczu. Hipertermia jest często wczesnym objawem tego zespołu. Należy niezwłocznie przerwać podawanie leku przeciwpsychotycznego i wdrożyć odpowiednie leczenie objawowe oraz uważnie obserwować pacjenta.
Dyskinezy późne
U niektórych pacjentów po długotrwałym leczeniu lub po zakończeniu stosowania produktu leczniczego mogą wystąpić dyskinezy późne. Charakteryzują je przede wszystkim rytmiczne,
mimowolne ruchy języka, twarzy, ust lub żuchwy. U niektórych pacjentów objawy te mogą utrzymywać się stale. Objawy te mogą być zamaskowane podczas wznawiania leczenia, zwiększania dawki lub zamiany na inny lek przeciwpsychotyczny. Jeśli wystąpią objawy przedmiotowe lub podmiotowe dyskinez późnych, należy rozważyć przerwanie stosowania każdego z leków przeciwpsychotycznych, w tym produktu Haloperidol WZF.
Objawy zespołu pozapiramidowego
Mogą wystąpić objawy zespołu pozapiramidowego (np. drżenie, wzmożone napięcie mięśni, nadmierne wydzielanie śliny, spowolnienie ruchów, akatyzja, ostra dystonia). Stosowanie haloperydolu wiązało się z wystąpieniem akatyzji, charakteryzującej się subiektywnym uczuciem nieprzyjemnego niepokoju i rozdrażnienia oraz potrzebą poruszania się, czemu często towarzyszy niemożność pozostania nieruchomo w pozycji siedzącej lub stojącej. Z większym
prawdopodobieństwem objawy te mogą wystąpić w kilku pierwszych tygodniach leczenia. U pacjentów z tego typu objawami zwiększanie dawki może prowadzić do ich nasilenia.
Ostra dystonia może wystąpić w pierwszych dniach leczenia produktem Haloperidol WZF, lecz stwierdzano ją także później lub po zwiększeniu dawki. Do objawów dystonii należą, m.in.: kręcz szyi, grymasy twarzy, szczękościsk, protruzja języka oraz nietypowe ruchy gałek ocznych, w tym napadowe przymusowe patrzenie z rotacją gałek ocznych. Większe ryzyko tego typu reakcji występuje u mężczyzn oraz w grupach osób w młodszym wieku. Ostra dystonia może wymagać przerwania stosowania produktu leczniczego.
Leki stosowane w parkinsonizmie o działaniu cholinolitycznym mogą być stosowane, jeżeli wymaga tego opanowanie objawów zespołu pozapiramidowego, lecz nie zaleca się rutynowego ich
przepisywania, jako środka zapobiegawczego. Jeśli zachodzi konieczność jednoczesnego podawania leków przeciw parkinsonizmowi, można kontynuować ich stosowanie po odstawieniu produktu Haloperidol WZF, jeżeli ich wydalanie przebiega szybciej niż haloperydolu, aby uniknąć wystąpienia lub nasilenia objawów zespołu pozapiramidowego. Należy pamiętać o możliwości zwiększenia
ciśnienia wewnątrzgałkowego w razie jednoczesnego stosowania cholinolitycznych produktów
leczniczych, w tym leków stosowanych w parkinsonizmie, z produktem leczniczym Haloperidol WZF.
Napady drgawkowe/Drgawki
Odnotowano, że haloperydol może wywołać napady drgawkowe. Należy zachować ostrożność u pacjentów z padaczką oraz u osób predysponowanych do drgawek (np. pacjenci odstawiający alkohol i z uszkodzeniem mózgu).
Objawy ze strony wątroby i dróg żółciowych
Haloperydol metabolizowany jest w wątrobie, dlatego zaleca się stosowanie połowy zalecanej dawki początkowej, a także zachowanie ostrożności, stosując lek u pacjentów z zaburzeniami czynności wątroby (patrz punkty 4.2 i 5.2). Odnotowano pojedyncze przypadki zaburzenia czynności wątroby lub zapalenia wątroby, najczęściej z zastojem żółci (patrz punkt 4.8).
Objawy ze strony układu dokrewnego
Tyroksyna może nasilać działanie toksyczne haloperydolu. U osób z nadczynnością tarczycy leki
przeciwpsychotyczne można podawać tylko z zachowaniem ostrożności, jednocześnie zawsze stosując leczenie w celu utrzymania prawidłowej czynności tarczycy.
Wpływ leków przeciwpsychotycznych na gospodarkę hormonalną obejmuje hiperprolaktynemię, która może wywołać mlekotok, ginekomastię, skąpe miesiączkowanie lub brak miesiączki (patrz punkt 4.8). Badania z zastosowaniem ludzkich hodowli tkankowych wskazują, że prolaktyna może stymulować wzrost komórek nowotworów piersi. Chociaż w badaniach klinicznych oraz epidemiologicznych nie wykazano wyraźnego związku pomiędzy podawaniem leków przeciwpsychotycznych a nowotworami piersi u ludzi, należy zachować ostrożność u pacjentek z nowotworem piersi w wywiadzie. Należy zachować ostrożność stosując produkt Haloperidol WZF u pacjentów ze stwierdzoną
hiperprolaktynemią oraz u pacjentów z nowotworami prolaktyno-zależnymi (patrz punkt 5.3).
Odnotowano przypadki hipoglikemii oraz zespołu nieprawidłowego wydzielania hormonu antydiuretycznego, związane ze stosowaniem haloperydolu (patrz punkt 4.8).
Żylna choroba zakrzepowo-zatorowa
Odnotowano przypadki żylnej choroby zakrzepowo-zatorowej (VTE, ang.: Venous Thromboembolism) związane ze stosowaniem leków przeciwpsychotycznych. Z uwagi na to, że
u pacjentów otrzymujących leki przeciwpsychotyczne często występują nabyte czynniki ryzyka żylnej choroby zakrzepowo-zatorowej, przed rozpoczęciem oraz podczas leczenia produktem Haloperidol WZF należy rozpoznać wszystkie możliwe czynniki ryzyka VTE oraz podjąć odpowiednie działania prewencyjne.
Odpowiedź na leczenie oraz zakończenie leczenia
W schizofrenii odpowiedź terapeutyczna na stosowanie leków przeciwpsychotycznych może być opóźniona.
Po odstawieniu leków przeciwpsychotycznych, nawrót objawów choroby podstawowej może nie być widoczny przez kilka tygodni lub miesięcy.
Bardzo rzadko donoszono o przypadkach ostrych objawów odstawienia (w tym nudnościach,
wymiotach oraz bezsenności) po nagłym odstawieniu wysokich dawek leków przeciwpsychotycznych. Jako środek ostrożności zaleca się stopniowe odstawianie.
Pacjenci z depresją
Jeżeli depresja jest objawem dominującym, zaleca się, aby produkt Haloperidol WZF nie był stosowany w monoterapii. Haloperydol może być stosowany z lekami przeciwdepresyjnymi w stanach, gdy współistnieją depresja i psychozy (patrz punkt 4.5).
Zmiana fazy choroby z manii na depresję
W leczeniu epizodów maniakalnych w przebiegu choroby afektywnej dwubiegunowej istnieje ryzyko zmiany fazy z manii na depresję. Istotne jest obserwowanie pacjentów pod kątem zmiany fazy na depresyjną z towarzyszącym ryzykiem, takim jak zachowania samobójcze, by wdrożyć odpowiednie leczenie, gdy taka zmiana nastąpi.
Osoby z wolnym metabolizmem przy udziale cytochromu CYP2D6
Haloperidol WZF należy stosować z ostrożnością u pacjentów wolno metabolizujących przy udziale cytochromu P450 2D6 i którzy jednocześnie otrzymują inhibitor CYP3A4.
Badania dotyczące interakcji przeprowadzono jedynie u osób dorosłych. Wpływ na układ sercowo-naczyniowy
Jednoczesne stosowanie produktu Haloperidol WZF oraz produktów leczniczych wydłużających
odstęp QTc jest przeciwskazane (patrz punkt 4.3). Przykłady tego typu produktów leczniczych:
Ciąża
Umiarkowana ilość danych dotyczących stosowania u kobiet w ciąży (ponad 400 zakończonych ciąż) nie wykazuje wad rozwojowych ani toksycznego wpływu haloperydolu na płód/noworodka. Istnieją jednak pojedyncze zgłoszenia przypadków uszkodzenia płodu po zastosowaniu haloperydolu, głównie w skojarzeniu z innymi produktami leczniczymi. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Jako środek ostrożności, pożądane jest unikanie stosowania produktu Haloperidol WZF w okresie ciąży.
Noworodki narażone na działanie leków przeciwpsychotycznych (w tym haloperydolu) w trzecim trymestrze ciąży są zagrożone wystąpieniem działań niepożądanych, w tym objawów pozapiramidowych i (lub) objawów odstawienia, których nasilenie i czas trwania po urodzeniu może być różna. Zgłaszano przypadki pobudzenia, wzmożonego lub obniżonego napięcia mięśniowego, drżenia, senności, niewydolności oddechowej, a także zaburzeń dotyczących ssania. Dlatego zaleca się, aby uważnie monitorować stan noworodka.
Karmienie piersią
Haloperydol przenika do mleka ludzkiego. Niewielkie ilości haloperydolu wykryto w osoczu
i w moczu noworodków karmionych piersią przez kobiety, które przyjmowały haloperydol. Dane dotyczące wpływu haloperydolu na dzieci karmione piersią nie są wystarczające. Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać stosowanie produktu Haloperidol WZF, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki.
Płodność
Haloperydol zwiększa stężenie prolaktyny. Hiperprolaktynemia może hamować wydzielanie gonadoliberyny przez podwzgórze, czego skutkiem może być zmniejszone wydzielanie gonadotropin przez przysadkę. Może to spowodować zahamowanie aktywności reprodukcyjnej, poprzez
upośledzenie procesu steroidogenezy w gonadach, zarówno u kobiet, jak i u mężczyzn (patrz punkt 4.4).
Haloperidol WZF wywiera umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Może wystąpić pewnego stopnia senność lub zaburzenia koncentracji, szczególnie po zastosowaniu dużych dawek oraz na początku leczenia. Alkohol może nasilać te objawy. Pacjentom należy zalecić, aby nie prowadzili pojazdów i nie obsługiwali maszyn w trakcie leczenia, dopóki nie upewnią się, jak reagują na leczenie.
Bezpieczeństwo stosowania haloperydolu oceniano u 284 pacjentów biorących udział w 3 badaniach z placebo w grupie kontrolnej oraz u 1295 pacjentów otrzymujących haloperydol w 16 badaniach klinicznych, z podwójnie ślepą próbą, z lekiem porównawczym w grupie kontrolnej.
W oparciu o połączone dane dotyczące bezpieczeństwa, uzyskane w powyższych badaniach, najczęściej zgłaszanymi działaniami niepożądanymi były: zaburzenia pozapiramidowe (34%),
bezsenność (19%), pobudzenie (15%), hiperkinezja (13%), ból głowy (12%), zaburzenia psychotyczne
(9%), depresja (8%), zwiększenie masy ciała (8%), drżenie (8%), wzmożone napięcie mięśniowe
(7%), niedociśnienie ortostatyczne (7%), dystonia (6%) oraz nadmierna senność (5%).
Dodatkowo, bezpieczeństwo stosowania haloperydolu dekanonianu oceniano u 410 pacjentów uczestniczących w 3 badaniach porównawczych (jedno porównujące haloperydolu dekanonian
z flufenazyną i dwa porównujące haloperydolu dekanonian z haloperydolem w postaci doustnej), w 9 badaniach otwartych i 1 badaniu oceniającym zależność odpowiedzi od dawki.
W tabeli 2. uwzględniono następujące działania niepożądane:
Częstość występowania działań niepożądanych ustalono w oparciu (lub oszacowano na podstawie) badań klinicznych lub badan epidemiologicznych haloperydolu, i zdefiniowana została
z zastosowaniem następującej konwencji:
Bardzo często: ≥1/10 Często: ≥1/100 do <1/10
Niezbyt często: ≥1/1 000 do <1/100 Rzadko: ≥1/10 000 do <1/1 000 Bardzo rzadko: <1/10 000
Nieznana: częstość nie może być określona na podstawie dostępnych danych.
Działania niepożądane wymieniono zgodnie z klasyfikacją układów i narządów, w kolejności od najcięższych w obrębie danej kategorii częstości.
Tabela 2.: Działania niepożądane
Klasyfikacja układów i narządów | Działanie niepożądane | ||||
Częstość występowania | |||||
Bardzo często | Często | Niezbyt często | Rzadko | Nieznana | |
Zaburzenia krwi i układu | Leukopenia | Pancytopenia Agranulocytoza | |||
chłonnego | Trombocytopenia Neutropenia | ||||
Zaburzenia układu immunologi- cznego | Nadwrażli- wość | Reakcja anafilaktyczna | |||
Zaburzenia endokrynolo- giczne | Hiperprola- ktynemia | Zespół nieprawidłowego wydzielania hormonu antydiuretycznego | |||
Zaburzenia metabolizmu i odżywiania | Hipoglikemia | ||||
Zaburzenia psychiczne | Pobudzenie Bezsenność | Zaburzenia psychotyczne Depresja | Stan splątania Utrata libido Obniżone libido Niepokój | ||
Zaburzenia układu nerwowego | Objawy zespołu pozapira- midowego Hiperkine- zja Ból głowy | Dyskinezy późne Akatyzja Bradykinezja Dyskinezy Dystonia Hipokinezja Wzmożone napięcie mięśniowe Zawroty głowy Senność Drżenie Mięśni | Drgawki Parkinsonizm Sedacja Mimowolne skurcze mięśni | Złośliwy zespół neurolepty- czny Zaburzenia motoryczne Oczopląs | Bezruch Skokowa sztywność mięśni Twarz maskowata |
Zaburzenia oka | Napadowe przymusowe patrzenie Zaburzenia widzenia | Niewyraźne widzenie | |||
Zaburzenia serca | Częstoskurcz | Migotanie komór Torsade de pointes Częstoskurcz komorowy Skurcze |
dodatkowe | |||||
Zaburzenia naczyniowe | Niedociśnie- nie tętnicze Niedociśnie- nie tętnicze ortostatyczne | ||||
Zaburzenia układu oddechowe- go, klatki piersiowej i śródpiersia | Duszności | Skurcz oskrzeli | Obrzęk krtani Skurcz krtani | ||
Zaburzenia żołądka i jelit | Wymioty Nudności Zaparcia Suchość w jamie ustnej Nadmierne wydzielanie śliny | ||||
Zaburzenia wątroby | Nieprawidło- we wyniki testów czynno- ściowych wątroby | Zapalenie wątroby Żółtaczka | Ostra niewydolność wątroby Cholestaza | ||
Zaburzenia skóry i tkanki podskórnej | Wysypka | Nadwrażli- wość na światło Pokrzywka Świąd Nadmierne pocenie się | Obrzęk naczynioruchowy Złuszczające się zapalenie skóry Leukocytoklasty- czne zapalenie naczyń | ||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Kręcz szyi Sztywność mięśni Skurcze mięśni Zesztywnienie mięśniowo- szkieletowe | Szczękościsk Drżenie pęczkowe mięśni | Rabdomioliza | ||
Zaburzenia nerek i dróg | Zatrzymanie moczu |
moczowych | |||||
Ciąża, połóg i okres okołoporodo- wy | Zespół objawów odstawienia u noworodka (patrz punkt 4.6) | ||||
Zaburzenia układu rozrodczego i piersi | Zaburzenia erekcji | Brak miesiączki Mlekotok Bóle menstrua- cyjne Ból piersi Tkliwość piersi | Obfite Miesiączko- wanie Zaburzenia miesiączko- wania Zaburzenia seksualne | Priapizm Ginekomastia | |
Zaburzenia ogólne i stany w miejscu podania | Wysoka gorączka Obrzęk Zaburzenia chodu | Nagły zgon Obrzęk twarzy Hipotermia | |||
Badania diagnostycz- ne | Zwiększenie masy ciała Zmniejszeni e masy ciała | Wydłużenie odstępu QT w EKG |
W trakcie stosowania haloperydolu zgłaszano przypadki wydłużenia odstępu QT w EKG, komorowych zaburzeń rytmu (migotanie komór, częstoskurcz komorowy), torsade de pointes oraz nagłego zgonu.
Wpływ leków przeciwpsychotycznych jako klasy terapeutycznej
Odnotowano przypadki zatrzymania akcji serca w trakcie stosowania leków przeciwpsychotycznych.
W trakcie stosowania leków przeciwpsychotycznych odnotowano przypadki żylnej choroby zakrzepowo-zatorowej, w tym przypadki zatoru tętnicy płucnej oraz zakrzepicy żył głębokich. Częstość występowania nie jest znana.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy przedmiotowe i podmiotowe
Przedawkowanie haloperydolu objawia się nasileniem znanego działania farmakologicznego oraz
działań niepożądanych. Najważniejsze objawy to ciężkie objawy pozapiramidowe, niedociśnienie oraz sedacja. Objawami reakcji pozapiramidowej są wzmożone napięcie mięśni oraz uogólnione lub
miejscowe drżenie mięśni. Bardziej prawdopodobne jest wystąpienie nadciśnienia niż niedociśnienia tętniczego.
W skrajnych przypadkach, pacjent może zapaść w stan śpiączki z depresją oddechową
i niedociśnieniem, które mogą być na tyle poważne, że mogą prowadzić do stanu podobnego do wstrząsu. Należy uwzględnić ryzyko komorowych zaburzeń rytmu, związane prawdopodobnie z wydłużeniem odstępu QTc.
Leczenie
Brak swoistego antidotum. Stosuje się leczenie podtrzymujące. Nie określono skuteczności
zastosowania węgla aktywowanego (w przypadku doustnego przedawkowania). Nie zaleca się poddawania pacjenta dializie w ramach leczenia przedawkowania, ponieważ usuwa ona jedynie bardzo niewielką ilość haloperydolu (patrz punkt 5.2).
U pacjentów w stanie śpiączki należy zapewnić drożność dróg oddechowych za pomocą rurki ustno- gardłowej lub dotchawicznej rurki intubacyjnej. W razie depresji oddechowej może być konieczne zastosowanie mechanicznej wentylacji.
Zaleca się monitorowanie czynności serca za pomocą elektrokardiografu (EKG) oraz parametrów życiowych, prowadzone do czasu normalizacji EKG. Zaleca się stosować odpowiednie środki przeciwarytmiczne w leczeniu ciężkich zaburzeń rytmu.
Niedociśnieniu tętniczemu oraz zapaści naczyniowo-sercowej można przeciwdziałać, podając dożylnie płyny, osocze lub koncentrat albuminowy oraz leki wazopresyjne, takie jak dopamina lub noradrenalina. Adrenaliny nie wolno podawać, ponieważ w połączeniu z haloperydolem może wywołać gwałtowny spadek ciśnienia.
W przypadku ciężkich objawów pozapiramidowych, zaleca się pozajelitowe podanie produktu leczniczego stosowanego w parkinsonizmie.
Grupa farmakoterapeutyczna: leki psycholeptyczne, leki przeciwpsychotyczne, pochodne butyrofenonu, kod ATC: N05AD01
Mechanizm działania
Haloperydol to lek przeciwpsychotyczny należący do grupy pochodnych butyrofenonu. Haloperydol jest ośrodkowo działającym, silnym antagonistą receptora dopaminowego typu 2, który w zalecanych dawkach wykazuje niskie powinowactwo do receptorów adrenergicznych α1, oraz nie wykazuje
aktywności przeciwhistaminowej ani przeciwcholinergicznej.
Działanie farmakodynamiczne
Haloperydol zmniejsza nasilenie omamów i urojeń, co stanowi bezpośrednią konsekwencję blokowania sygnałów dopaminergicznych w mezolimbicznym szlaku dopaminergicznym. Efekt ośrodkowego blokowania dopaminy występuje w jądrach podstawnych (szlaku nigrostriatalnym).
Haloperydol wywołuje skuteczną sedację psychomotoryczną, co wyjaśnia jego korzystne działanie w manii oraz zespołach przebiegających z pobudzeniem.
Oddziaływanie na jądra podstawne prawdopodobnie leży u podstawy niepożądanego wpływu na motorykę pozapiramidową (dystonia, akatyzja, parkinsonizm).
Działanie przeciwdopaminergiczne haloperydolu na laktotrofy w przedniej części przysadki wyjaśnia hiperprolaktynemię wywołaną przez osłabienie dopamino-zależnego mechanizmu stałej inhibicji wydzielania prolaktyny. Ponadto, powinowactwo do receptorów dopaminergicznych w strefie
chemoreceptorowej pola najdalszego, wyjaśnia aktywność przeciw nudnościom i wymiotom.
Wchłanianie
Po podaniu domięśniowym, haloperydol jest w całości wchłaniany. Maksymalne stężenie haloperydolu w osoczu osiągane jest w ciągu 20 do 40 minut.
Dystrybucja
U dorosłych średnio około 88 do 92% haloperydolu wiąże się z białkami osocza. Wiązanie z białkami osocza podlega dużej zmienności osobniczej. Haloperydol jest szybko dystrybuowany do różnych
tkanek i narządów, na co wskazuje duża objętość dystrybucji (średnia wartość 8 do 21 l/kg po podaniu dożylnym). Haloperydol z łatwością przenika barierę krew-mózg. Przenika również przez łożysko i do mleka ludzkiego.
Metabolizm
Haloperydol jest intensywnie metabolizowany w wątrobie. Do głównych szlaków metabolicznych haloperydolu u człowieka należą glukuronidacja, redukcja grupy ketonowej, oksydacyjna
N-dealkilacja i tworzenie metabolitów pirydynowych. Wydaje się, że metabolity haloperydolu nie przyczyniają się w istotny sposób do jego aktywności, jednak szlak redukcyjny odpowiada za około 23% biotransformacji, i nie można wykluczyć wstecznej konwersji zredukowanych metabolitów haloperydolu do haloperydolu. W metabolizmie haloperydolu uczestniczą enzymy CYP3A4
i CYP2D6. Hamowanie lub indukcja CYP3A4 lub CYP2D6 może wpływać na metabolizm haloperydolu. Hamowanie aktywności enzymów CYP2D6 może spowodować wzrost stężenia haloperydolu.
Eliminacja
Okres półtrwania haloperydolu w fazie eliminacji po podaniu domięśniowym wynosi około 21 godzin (zakres od 13 do 36 godzin). Pozorny klirens haloperydolu po podaniu pozanaczyniowym waha się od 0,9 do 1,5 l/h/kg, a u osób wolno metabolizujących przy udziale CYP2D6 jego wartość jest niższa.
Obniżona aktywność enzymów CYP2D6 może spowodować wzrost stężenia haloperydolu. Zmienność osobnicza (współczynnik zmiany, %) w zakresie klirensu haloperydolu oszacowano na 44%, na podstawie analizy populacyjnej parametrów farmakokinetycznych u pacjentów ze schizofrenią. Po podaniu dożylnym haloperydolu, 21% dawki zostało wydalone z kałem, a 33% w moczu. Mniej niż 3% dawki wydalane jest z moczem w postaci niezmienionej.
Liniowość/nieliniowość
Zależność pomiędzy wielkością dawki a stężeniem haloperydolu w osoczu u dorosłych jest liniowa. Szczególne grupy pacjentów
Osoby w podeszłym wieku
Stężenie haloperydolu w osoczu u pacjentów w podeszłym wieku było wyższe niż u młodszych osób dorosłych, które otrzymały taką samą dawkę. Wyniki niewielkich badań klinicznych wskazują na niższy klirens i dłuższy okres półtrwania w fazie eliminacji haloperydolu u osób w podeszłym wieku. Wyniki mieszczą się w zakresie obserwowanej zmienności parametrów farmakokinetycznych haloperydolu. U pacjentów w podeszłym wieku zaleca się odpowiednie dostosowanie dawki (patrz punkt 4.2)
Zaburzenia czynności nerek
Nie oceniano wpływu zaburzeń czynności nerek na parametry farmakokinetyczne haloperydolu. Około jednej trzeciej dawki haloperydolu wydalane jest z moczem, głównie w postaci metabolitów. Mniej niż 3% podanej dawki haloperydolu wydalane jest z moczem w postaci niezmienionej. Wydaje się, że metabolity haloperydolu nie przyczyniają się w istotny sposób do jego aktywności, jednak nie można wykluczyć wstecznej konwersji zredukowanego metabolitu haloperydolu do haloperydolu.
Chociaż nie wydaje się, aby zaburzenia czynności nerek wpływały na eliminację haloperydolu
w klinicznie istotnym zakresie, należy zachować ostrożność u pacjentów z zaburzeniami czynności nerek, a w szczególności u pacjentów z ciężkimi zaburzeniami czynności nerek z powodu długiego okresu półtrwania haloperydolu i jego zredukowanego metabolitu i możliwości kumulacji (patrz punkt 4.2).
Ze względu na dużą objętość dystrybucji haloperydolu oraz wiązanie w dużym stopniu z białkami osocza, tylko bardzo niewielka ilość usuwana jest za pomocą dializy.
Zaburzenia czynności wątroby
Nie oceniano wpływu zaburzeń czynności wątroby na parametry farmakokinetyczne haloperydolu. Ponieważ jednak haloperydol jest intensywnie metabolizowany w wątrobie, zaburzenia czynności wątroby mogą znacząco wpływać na jego farmakokinetykę. Dlatego zaleca się stosowanie połowy dawki początkowej oraz zachowanie ostrożności u pacjentów z zaburzeniami czynności wątroby (patrz punkty 4.2 i 4.4).
Zależności farmakokinetyczno-farmakodynamiczne
Stężenie terapeutyczne
Jak wynika z opublikowanych danych z wielu badań klinicznych, odpowiedź terapeutyczną u większości pacjentów z ostrą lub przewlekłą schizofrenią, uzyskuje się przy stężeniu w osoczu
wynoszącym od 1 do 10 ng/ml. Część pacjentów może wymagać większych stężeń, jako wynik dużej zmienności osobniczej parametrów farmakokinetycznych haloperydolu.
U pacjentów z pierwszym epizodem schizofrenii, odpowiedź terapeutyczną można uzyskać już przy stężeniu od 0,6 do 3,2 ng/ml, jak oszacowano na podstawie pomiarów wysycenia receptorów D2 oraz zakładając, że wysycenie receptorów D2 rzędu 60 - 80% jest najbardziej właściwe do uzyskania odpowiedzi terapeutycznej i zahamowania objawów pozapiramidowych. Przeciętnie, stężenie w tym zakresie osiągane jest po zastosowaniu dawek dobowych wynoszących od 1 do 4 mg.
Ze względu na dużą zmienność osobniczą parametrów farmakokinetycznych haloperydolu oraz mając na uwadze korelację pomiędzy stężeniem a uzyskanym efektem, zaleca się, aby dostosować indywidualną dawkę haloperydolu na podstawie uzyskanej odpowiedzi na leczenie, biorąc pod uwagę dane, które wskazują na 5-dniowe opóźnienie do uzyskania połowy maksymalnej odpowiedzi na
leczenie. W indywidualnych przypadkach można rozważyć zbadanie stężeń haloperydolu we krwi.
Wpływ na układ sercowo-naczyniowy
Ryzyko wydłużenia odstępu QTc wzrasta wraz z dawką haloperydolu oraz jego stężeniem w osoczu.
Objawy zespołu pozapiramidowego
Objawy zespołu pozapiramidowego mogą wystąpić w zakresie dawek terapeutycznych, chociaż ich częstość jest większa przy dawkowaniu, którego skutkiem jest stężenie wyższe niż terapeutyczne.
Dane niekliniczne wynikające z konwencjonalnych badań toksyczności po podaniu wielokrotnym oraz genotoksyczności, nie ujawniają szczególnego zagrożenia dla człowieka. Podawanie haloperydolu
u gryzoni powodowało obniżenie płodności, teratogenność w ograniczonym stopniu, jak również działanie embriotoksyczne.
W badaniach działania rakotwórczego haloperydolu, u samic myszy obserwowano zależny od dawki wzrost częstości występowania gruczolaków przysadki mózgowej oraz nowotworów gruczołów sutkowych. Nowotwory te mogą być spowodowane długotrwałym blokowaniem receptorów
dopaminowych D2 i hiperprolaktynemią. Znaczenie tych obserwacji dotyczących nowotworów u gryzoni, w kontekście ryzyka dla człowieka, nie jest znane.
W kilku badaniach in vitro obserwowano blokowanie przez haloperydol kanału potasowego hERG w sercu. W wielu badaniach in vivo, dożylne podanie haloperydolu w niektórych modelach
zwierzęcych powodowało znaczne wydłużenie odstępu QTc przy dawkowaniu na poziomie
0,3 mg/kg, i maksymalnym stężeniu w osoczu Cmax co najmniej 7 do 14 razy wyższym niż stężenia
terapeutyczne wynoszące od 1 do 10 ng/ml, które były skuteczne u większości pacjentów w badaniach klinicznych. Te dawki podawane dożylnie, powodujące wydłużenie odstępu QTc, nie powodowały
zaburzeń rytmu serca. W niektórych badaniach przeprowadzanych na zwierzętach, większe dawki podawanego dożylnie haloperydolu wynoszące 1 mg/kg lub więcej, powodowały wydłużenie odstępu QTc i (lub) komorowe zaburzenia rytmu przy wartości Cmax co najmniej 38 do 137 razy większej niż stężenia w osoczu po zastosowaniu dawek terapeutycznych, które były skuteczne u większości
pacjentów w badaniach klinicznych.
Kwas mlekowy
Woda do wstrzykiwań
Nie dotyczy.
3 lata
Przechowywać w temperaturze poniżej 25C. Nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
10 ampułek o pojemności 1 ml ze szkła bezbarwnego w tekturowym pudełku.
Instrukcja otwierania ampułki
Przed otwarciem ampułki należy upewnić się, że cały roztwór znajduje się w dolnej części ampułki. Można delikatnie potrząsnąć ampułką lub postukać w nią palcem, aby ułatwić spłynięcie roztworu.
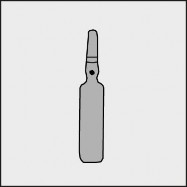
Na każdej ampułce umieszczono kolorową kropkę (patrz rysunek 1.) jako oznaczenie znajdującego się poniżej niej punktu nacięcia.
Ampułki są przeznaczone wyłącznie do jednorazowego użytku, należy je otwierać bezpośrednio przed użyciem. Pozostałą zawartość niezużytego produktu należy zniszczyć zgodnie z obowiązującymi przepisami.
Rysunek 1.
Rysunek 2.
Rysunek 3.
Warszawskie Zakłady Farmaceutyczne Polfa S.A. ul. Karolkowa 22/24; 01-207 Warszawa
Pozwolenie nr R/3029
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 23.04.1976 r. Data ostatniego przedłużenia pozwolenia: 11.12.2012 r.











