Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE
- NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE
NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
HYPNOMIDATE, 2 mg/ml, roztwór do wstrzykiwań
1 ml roztworu do wstrzykiwań zawiera 2 mg etomidatu (Etomidatum).
Każda ampułka zawiera 20 mg etomidatu.
Każda ampułka zawiera 3,5 ml glikolu propylenowego.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań.
Jałowy, przezroczysty, bezbarwny, wodny roztwór.
Etomidat jest środkiem do wprowadzenia do znieczulenia ogólnego. Stosuje się go również, jako
znieczulenie dodatkowe w znieczuleniu miejscowym.
Równoczesne stosowanie znieczulenia drogą wziewną nie jest konieczne; jeśli natomiast jest stosowane, lek
wziewny może być podany w bardzo niewielkiej dawce (ogólne znieczulenie dożylne).
Produkt Hypnomidate wskazany jest do krótkich zabiegów diagnostycznych lub zabiegów przeprowadzanych w warunkach ambulatoryjnych, w których konieczne jest szybkie wybudzenie pacjenta. Wpływ etomidatu w zalecanych dawkach na wskaźniki hemodynamiczne jest bardzo niewielki (patrz punkt
4.4 i 4.8), a zatem jest on szczególnie wskazany w kardiochirurgii i u pacjentów z chorobami serca.
Dorośli
Ampułki produktu Hypnomidate zawierają po 10 ml (20 mg etomidatu) roztworu gotowego do użycia (2 mg etomidatu w 1 ml roztworu). Skuteczna dawka wywołująca sen wynosi 0,3 mg/kg masy ciała.
Dlatego u pacjentów dorosłych jedna ampułka zwykle wystarcza do wywołania snu trwającego 4-5 minut.
Dawka ta może być dostosowana do masy ciała.
Ten produkt musi być podawany wyłącznie przez lekarzy przeszkolonych w zakresie wykonywania intubacji dotchawiczej. Musi być dostępny sprzęt do sztucznego oddychania.
Sen może być wydłużany przez podawanie dodatkowych dawek produktu Hypnomidate. Nie wolno stosować więcej niż 3 ampułki (30 ml).
Produkt Hypnomidate nie ma właściwości przeciwbólowych, dlatego zaleca się podawanie razem
z odpowiednim opioidem, np. 1-2 ml fentanylu dożylnie na 1-2 minuty przed wstrzyknięciem produktu
Hypnomidate.
Dawka powinna być dostosowana indywidualnie, w zależności od reakcji pacjenta i działania klinicznego.
Szczególne grupy pacjentów
Dzieci
U dzieci poniżej 15 roku życia może być konieczne zwiększenie dawki w celu uzyskania takiej samej głębokości i czasu snu jak u dorosłych. Niekiedy niezbędna jest dawka uzupełniająca, wynosząca około 30% zwykłej dawki dla dorosłych (patrz punkt 5.2).
Pacjenci w podeszłym wieku
Pacjentom w podeszłym wieku należy podać dawkę pojedynczą 0,15-0,2 mg/kg masy ciała, którą następnie należy dostosować w zależności od indywidualnej reakcji pacjenta (patrz punkt 4.4 i 5.2).
Sposób podawania
Podanie dożylne.
Produkt Hypnomidate należy podawać powoli drogą dożylną.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą.
Produkt Hypnomidate należy podawać wyłącznie dożylnie.
Wprowadzeniu do znieczulenia produktem Hypnomidate może towarzyszyć niewielkie, przemijające obniżenie ciśnienia krwi, związane ze zmniejszeniem obwodowego oporu naczyniowego. U pacjentów osłabionych, u których hipotensja może być niebezpieczna, należy zastosować następujące środki zaradcze:
Leki neuroleptyczne, opioidy, leki o działaniu sedatywnym oraz alkohol mogą zwiększać działanie nasenne
etomidatu.
Indukcji etomidatem może towarzyszyć lekkie i przemijające zmniejszenie oporu obwodowego, co może nasilać działanie innych leków zmniejszających ciśnienie tętnicze krwi.
Wpływ innych leków na etomidat
Jednoczesne podanie etomidatu z alfentanylem zmniejsza końcowy okres półtrwania etomidatu do 29 minut. Należy zachować ostrożność stosując etomidat i alfentanyl jednocześnie gdyż stężenie etomidatu może spaść poniżej progu nasennego.
Całkowity klirens osoczowy i objętość dystrybucji etomidatu zmniejsza się 2 do 3 razy bez wpływu na okres półtrwania, gdy podawany jest z fentanylem podanym dożylnie. Może zaistnieć konieczność zmniejszenia dawki, gdy etomidat jest podawany jednocześnie z fentanylem podanym dożylnie.
Wpływ etomidatu na inne leki
Jednoczesne podawanie etomidatu i ketaminy nie wywiera istotnego wpływu na stężenie w osoczu lub parametry farmakokinetyczne ketaminy lub jej głównego metabolitu, norketaminy.
Ciąża
Badania na zwierzętach nie wykazały pośredniego działania embriotoksycznego i teratogennego etomidatu. Produkt Hypnomidate może być stosowany w okresie ciąży tylko wtedy, jeśli potencjalne korzyści przewyższają ryzyko dla płodu.
W czasie znieczulenia kobiet w ciąży etomidat przenika przez łożysko. Ocena noworodków, których matki
otrzymywały produkt Hypnomidate, w skali Apgar była porównywalna z oceną noworodków, których matki otrzymywały inne leki nasenne. U noworodka, którego matka otrzymywała produkt Hypnomidate wystąpiło przemijające, trwające około 6 godzin zmniejszenie stężenia kortyzolu. Zmniejszone wartości pozostawały w granicach wartości prawidłowych.
Karmienie piersią
Etomidat przenika do mleka ludzkiego. Wpływ etomidatu na organizm noworodków jest nieznany. Podczas leczenia oraz w ciągu 24 godzin od stosowania produktu Hypnomidate nie należy karmić piersią.
Płodność
Badania rozrodczości u zwierząt nie wykazały, że produkt Hypnomidate stosowany w zalecanych dawkach
wpływa na płodność.
Etomidat wywiera znaczny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Nie zaleca się obsługiwania potencjalnie niebezpiecznych maszyn i prowadzenia pojazdów przez pierwsze 24 godziny po podaniu produktu. Czas powrotu do normalnej sprawności może być różny w zależności od czasu trwania zabiegu, całkowitej przyjętej dawki i innych zastosowanych leków. Dlatego też, decyzję zezwalającą pacjentowi na prowadzenie pojazdów i obsługiwanie maszyn musi podjąć lekarz anestezjolog.
Bezpieczeństwo produktu Hypnomidate oceniano u 812 badanych, którzy wzięli udział w 4 otwartych badaniach klinicznych z produktem Hypnomidate stosowanym do indukowania znieczulenia ogólnego. Wskazani pacjenci przyjęli co najmniej jedną dawkę produktu Hypnomidate i dostarczyli dane dotyczące bezpieczeństwa. Na podstawie zbiorczych danych z tych badań klinicznych najczęściej zgłaszanymi działaniami niepożądanymi (o częstości 5%) były dyskinezy (u 10,3 %) i ból żył (u 7,6%).
W poniższej tabeli przedstawiono działania niepożądane (w tym powyżej wymienione) stwierdzone podczas stosowania produktu Hypnomidate w trakcie badań klinicznych lub po wprowadzeniu produktu do obrotu.
Kategorie częstości występowania podano zgodnie z następującą konwencją: Bardzo często (1/10)
Często (1/100 do < 1/10)
Niezbyt często (1/1 000 do < 1/100)
Rzadko (1/10 000 do < 1/1 000)
Bardzo rzadko (< 1/10 000)
Nieznana (częstość nie może być określona na podstawie dostępnych danych)
Klasyfikacja układów i narządów | Działania niepożądane | |||
Kategoria częstości | ||||
Bardzo często (1/10) | Często (1/100 do <1/10) | Niezbyt często (1/1 000 do <1/100) | Nieznana | |
Zaburzenia układu immunologicznego | Reakcje nadwrażliwości (włączając wstrząs anafilaktyczny, reakcje anafilaktyczne i anafilaktoidalne) | |||
Zaburzenia endokrynologiczne | Zmniejszenie stężenia kortyzolu | Niewydolność nadnerczy | ||
Zaburzenia układu nerwowego | Dyskinezy | Drgawki miokloniczne mięśni | Hipertonia, mimowolne skurcze mięśni, oczopląs | Drgawki (włącznie z napadami typu grand mal) |
Zaburzenia serca | Bradykardia, skurcze dodatkowe, dodatkowe skurcze komorowe | Zatrzymanie serca, całkowity blok przedsionkowo komorowy | ||
Zaburzenia naczyniowe | Ból żył, obniżenie ciśnienia tętniczego | Zapalenie żył, nadciśnienie | Wstrząs, zakrzepowe zapalenie żył (głębokich i powierzchownych) | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Bezdech, hiperwentylacja, świst krtaniowy | Hipowentylacja, czkawka, kaszel | Depresja oddechowa, skurcz oskrzeli (włącznie ze zgonem) | |
Zaburzenia żołądka i jelit | Wymioty, nudności | Nadmierne wydzielanie śliny | ||
Zaburzenia skóry i tkanki podskórnej | Wysypka | Rumień | Zespół Stevensa-Johnsona, pokrzywka | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Sztywność mięśni | Szczękościsk | ||
Zaburzenia ogólne i stany w miejscu podania | Ból w miejscu wstrzyknięcia | |||
Urazy, zatrucia i powikłania po zabiegach | Powikłania anestezji, opóźnione odzyskanie przytomności po anestezji, niewystarczająca analgezja, nudności w trakcie zabiegów | |||
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, Tel.: + 48 22 49 21 301, Faks: + 48 22
49 21 309, e-mail: ndl@urpl.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy
W przypadku przedawkowania etomidatu podanego w postaci bolusa, sen staje się głębszy oraz może wystąpić niedociśnienie, zahamowanie czynności wydzielniczej kory nadnerczy, depresja oddechowa lub nawet zatrzymanie oddychania. W razie zatrzymania oddechu należy koniecznie przedsięwziąć odpowiednie środki wspomagające oddychanie. Może również wystąpić dezorientacja i przedłużone wybudzanie.
Leczenie
Poza środkami wspomagającymi (np. oddychanie), niezbędne może okazać się podanie 50 mg-100 mg hydrokortyzonu (a nie hormonu adrenokortykotropowego [ACTH]).
Grupa farmakoterapeutyczna: Inne leki do znieczulenia ogólnego, etomidat, kod ATC: N01A X07.
Etomidat jest lekiem o krótkotrwałym działaniu nasennym do stosowania dożylnego w znieczuleniu ogólnym. U dorosłych dawka 0,2 – 0,3 mg/kg masy ciała (w przybliżeniu 1 ampułka zawierająca 10 ml produktu Hypnomidate) wywołuje w ciągu 10 sekund sen trwający przez około 5 minut (lub dłużej,
u pacjentów premedykowanych lekami o działaniu uspokajającym).
Przy odpowiednim stężeniu w mózgu etomidat działa przeciwdrgawkowo i chroni tkankę mózgową przed uszkodzeniem komórek, wywołanym niedotlenieniem. Etomidat nie działa przeciwbólowo, co wyklucza stosowanie jego jako jedynego środka znieczulającego. Etomidat jest szybko hydrolizowany, głównie
w wątrobie. Wybudzenie następuje szybko i rzadko towarzyszy mu uczucie senności czy zawroty głowy. Wpływ etomidatu na układ naczyniowo – sercowy jest minimalny. Środek ten nie powoduje uwalniania histaminy, ani nie wpływa na czynność wątroby.
Zahamowanie czynności nadnerczy
Etomidat stosowany do wprowadzenia do znieczulenia zmniejsza stężenie kortyzolu i aldosteronu w osoczu.
Pozostają one niższe przez 6-8 godzin. Zwykle ich stężenia wracają do wartości wyjściowych w ciągu
24 godzin. Etomidat jest specyficznym i odwracalnym inhibitorem 11-beta-hydroksylacji syntezy steroidów w nadnerczach.
Stężenie w osoczu
Po podaniu dożylnym zmiany stężenia etomidatu w osoczu mogą być opisane jako model trójkompartmentowy odzwierciedlający procesy dystrybucji, metabolizmu i eliminacji.
Dystrybucja
Około 76,5% etomidatu wiąże się z białkami osocza. Etomidat szybko ulega dystrybucji do mózgu i innych tkanek. Objętość dystrybucji wynosi około 4,5 l/kg.
Metabolizm i eliminacja
Etomidat metabolizowany jest w wątrobie. Po 24 godzinach 75% podanej dawki wydalane jest z moczem, głównie w postaci metabolitów. Tylko 2% etomidatu wydala się z moczem w postaci niezmienionej.
Końcowy okres półtrwania wynoszący od 3 do 5 godzin odzwierciedla powolną dystrybucję etomidatu
z głębokiego kompartmentu obwodowego.
Zależność stężenie-efekt
Minimalne stężenie etomidatu w osoczu wywołujące działania nasenne wynosi około 0,3 μg/ml.
Populacje specjalne
Dzieci: W badaniu przeprowadzonym u 12 dzieci (wiek 7-13 lat, masa ciała 22-48 kg) początkowa objętość dystrybucji skorygowana o masę ciała była 2,4- krotnie większa niż u dorosłych (0,66 wobec 0,27 l/kg),
a klirens u dzieci był o około 58% większy niż u dorosłych. Wyniki te wskazują na konieczność stosowania u dzieci większych dawek leku niż u dorosłych.
Niewydolność wątroby: Opisywano wydłużenie okresu półtrwania u pacjentów z marskością wątroby otrzymujących etomidat w skojarzeniu z fentanylem. W tej grupie pacjentów należy rozważyć zmniejszenie szybkości wlewu.
Osoby w podeszłym wieku: Klirens etomidatu u osób w podeszłym wieku (> 65 lat) w porównaniu z osobami
młodszymi jest zmniejszony. Początkowe stężenia w osoczu są większe u osób w podeszłym wieku
w wyniku mniejszej początkowej objętości dystrybucji. Z tego względu w tej grupie pacjentów konieczne może być zmniejszenie dawki leku.
Wyniki standardowych badań na zwierzętach wskazują na działania szkodliwe wynikające z aktywności farmakologicznej etomidatu, przy narażeniu wielokrotnie przekraczającym maksymalną ekspozycję człowieka. Dlatego wyniki te mają niewielkie znaczenie w praktyce klinicznej.
Toksyczne dawki dla matek szczurów zmniejszały przeżywalność potomstwa.
Glikol propylenowy Woda do wstrzykiwań
Nie mieszać produktu leczniczego z innymi produktami leczniczymi.
3 lata
Przechowywać w temperaturze poniżej 25˚C.
Produkt leczniczy Hypnomidate (2 mg/ml) dostępny jest w ampułkach o pojemności 10 ml w tekturowym
pudełku. Jedno opakowanie zawiera 5 ampułek po 10 ml.
stosowania
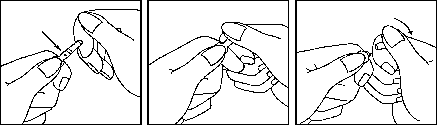
Przed otwarciem ampułki należy założyć rękawiczki ochronne.
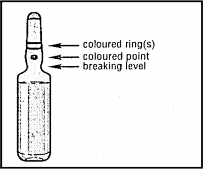
Ampułki
1. Chwycić ampułkę między kciuk i palec wskazujący pozostawiając wolny koniec ampułki. | kolorowy pierścień kolorowy punkt miejsce złamania |
2. Drugą ręką chwycić koniec ampułki przykładając palec wskazujący do końca ampułki a kciuk ustawiając na kolorowym punkcie równolegle do kolorowego pierścienia na końcu ampułki. | |
3. Trzymając kciuk na tym punkcie energicznie złamać koniec ampułki, utrzymując jednocześnie mocno pozostałą część ampułki drugą ręką. |
W razie przypadkowego narażenia skóry na działanie produktu miejsce obmyć wodą. Należy unikać stosowania mydła, alkoholu i innych środków myjących, które mogą wywołać chemiczne lub mechaniczne uszkodzenie skóry.
DO OBROTU
Piramal Critical Care B.V.
Rouboslaan 32, 2252 TR, Voorschoten, Holandia
R/1266
DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 23 marzec 1982
Data ostatniego przedłużenia pozwolenia: 30 czerwiec 2014
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
3 kwiecień 2019











