Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na prostaglandyny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Stosowanie u pacjentek, u których istnieją przeciwwskazania do stosowania produktów nasilających skurcze macicy, lub u których przeciwwskazane są przedłużające się skurcze macicy, np. w następujących przypadkach:
wielorództwo wysokiego stopnia (sześć lub więcej donoszonych ciąż),
opóźnione wstawianie się główki,
przebyte wcześniej operacje macicy, takie jak cięcie cesarskie lub histerektomia,
niewspółmierność porodowa (miednicowo-główkowa),
nagłe stany położnicze, w których wskaźnik korzyści do ryzyka dla płodu lub dla matki przemawia za wykonaniem operacji chirurgicznej,
położenie płodu inne niż główkowe,
podejrzenie kliniczne wczesnego zagrożenia płodu na podstawie jego czynności serca,
zakażenie dolnych dróg rodnych,
niezdiagnozowane upławy i (lub) nieprawidłowe krwawienia w czasie ciąży,
trudny i (lub) traumatyczny poród w wywiadzie,
część przodująca nad wchodem miednicy,
czynna choroba serca, płuc, nerek lub wątroby,
łożysko przodujące.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
zatrzymanie akcji serca
Zaburzenia układu immunologicznego:
reakcje nadwrażliwości (np. reakcja anafilaktyczna, wstrząs anafilaktyczny, reakcja rzekomoanafilaktyczna)
Zaburzenia układu oddechowego, klatki piersiowej śródpiersia:
astma, skurcz oskrzeli, kaszel, duszność, uczucie ucisku w klatce piersiowej, rzężenia grubobańkowe nad polami płucnymi
Zaburzenia żołądka i jelit:
biegunka, nudności, wymioty
Zaburzenia skóry i tkanki podskórnej:
wysypka
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej:
ból pleców
Zaburzenia naczyniowe:
nadciśnienie tętnicze
Ciąża, połóg i okres okołoporodowy:
nieprawidłowe skurcze macicy (występujące ze zwiększoną częstością, ze zwiększonym napięciem lub wydłużone w czasie) z lub bez zmiany częstości akcji serca płodu, pęknięcie macicy, odklejenie łożyska, zator tętnicy płucnej/zator płynem owodniowym, nagłe rozszerzenie szyjki macicy
Zaburzenia układu rozrodczego i piersi:
uczucie ciepła, ból, podrażnienie w obrębie pochwy
Zaburzenia ogólne i stany w miejscu podania:
gorączka, zwiększenie liczby białych krwinek
U pacjentek może dojść do zwiększenia temperatury ciała i liczby krwinek białych, ustępujących po zakończeniu leczenia.
U płodu/noworodka:
Badania diagnostyczne:
stan zagrożenia płodu/zaburzenia częstości akcji serca płodu w czasie lub następujące po leczeniu produktem Prepidil, ocena stanu noworodka po porodzie na mniej niż 7 punktów w skali Apgar, kwasica u płodu
Ciąża, połóg i okres okołoporodowy:
śmierć płodu, poród martwego płodu, śmierć noworodka*
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Prepidil, 500 μg/3 g, żel do szyjki macicy
3 g żelu zawiera 500 μg dinoprostonu (Dinoprostonum). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Żel do szyjki macicy
Prepidil stosuje się do wspomagania indukcji porodu o czasie, kiedy jest to konieczne z przyczyn położniczych lub internistycznych.
Ten produkt leczniczy może być podawany wyłącznie przez wykwalifikowany personel medyczny oraz w szpitalach i klinikach ze specjalistycznymi oddziałami położniczymi wyposażonymi
w urządzenia do ciągłego monitorowania.
Nie należy przekraczać zalecanej dawki ani skracać przerw między dawkami, ponieważ zwiększa to ryzyko hiperstymulacji macicy, pęknięcia macicy, krwotoku z macicy oraz śmierci płodu lub noworodka.
Podanie do szyjki macicy.
Aby produkt został prawidłowo podany, pacjentka powinna leżeć na wznak i mieć założony wziernik dopochwowy celem uwidocznienia szyjki macicy.
Cała zawartość strzykawki (500 μg dinoprostonu = 3 g produktu Prepidil) powinna zostać
wstrzyknięta delikatnie i w sposób jałowy do kanału szyjki przy pomocy załączonego do opakowania jałowego plastikowego cewnika. Następnie należy delikatnie usunąć plastikowy cewnik z kanału szyjki. Produktu Prepidil nie należy podawać powyżej ujścia wewnętrznego szyjki. Po podaniu żelu pacjentka powinna pozostać w pozycji leżącej przez co najmniej 15 minut, aby maksymalnie ograniczyć wypływanie żelu.
Zawartość strzykawki może być stosowana tylko u jednej pacjentki. Nie należy próbować podawać małej ilości żelu pozostałego w plastikowym cewniku.
Po użyciu strzykawkę, plastikowy cewnik i wszelkie niewykorzystane części opakowania należy wyrzucić.
INSTRUKCJA UŻYCIA STRZYKAWKI
Wyjąć jałowy plastikowy cewnik i jałową strzykawkę z opakowania zewnętrznego.
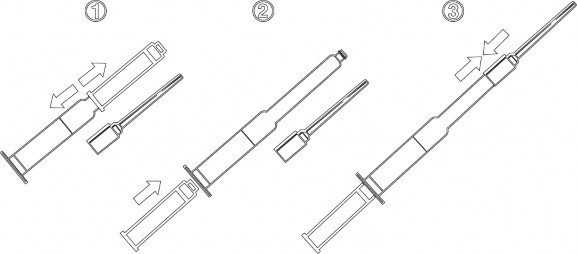
Produkt Prepidil powinien być stosowany wyłącznie w szpitalach i klinikach ze specjalistycznymi oddziałami położniczymi i tylko wtedy, kiedy zapewniona jest 24 godzinna opieka medyczna.
Podobnie jak w przypadku wszystkich leków oksytotycznych, należy wziąć pod uwagę ryzyko
pęknięcia macicy. Należy wziąć pod uwagę jednoczesne stosowanie innych produktów leczniczych oraz stan matki i płodu w celu zminimalizowania ryzyka hiperstymulacji macicy, pęknięcia macicy, krwotoku z macicy oraz śmierci płodu lub noworodka. Podczas stosowania dinoprostonu należy prowadzić ciągłe elektroniczne monitorowanie czynności skurczowej macicy i tętna płodu.
W przypadku pacjentek, u których wystąpiło wzmożone napięcie ściany macicy lub nadmierna kurczliwość macicy, albo u których zaobserwowano nieprawidłowości w zapisie częstości akcji serca
płodu, należy postępować w sposób uwzględniający dobro płodu i matki. W przypadku stwierdzonej w przeszłości hipertonii macicy lub nadmiernej jej kurczliwości lekarz powinien zalecić ciągłe monitorowanie skurczów oraz stanu matki i płodu.
Wymagana jest ostrożność przy podawaniu produktu Prepidil pacjentkom z zaburzeniami krążenia, wątroby lub nerek, czynną astmą lub astmą, jaskrą (lub zwiększonym ciśnieniem wewnątrzgałkowym), padaczką, nadciśnieniem tętniczym lub pęknięciem błon płodowych.
Dinoproston należy stosować z zachowaniem ostrożności u pacjentek w ciąży mnogiej. W przypadku utrzymujących się silnych skurczów, ryzyko pęknięcia macicy powinno być zawsze wzięte pod uwagę.
Przed zastosowaniem produktu Prepidil powinny zostać starannie ocenione proporcje miednicowo- główkowe.
Leczenie pacjentek z nadmiernym napięciem ściany macicy lub jej nadmierną kurczliwością, lub
u których czynność serca płodu budzi niepokój powinno mieć na celu zachowanie dobrego stanu ogólnego płodu i matki.
Tak jak w przypadku wszystkich substancji o działaniu takim jak oksytocyna, w przypadku nadmiernej aktywności lub nieprawidłowego bólu macicy, powinna być wzięta pod uwagę możliwość pęknięcia macicy. Następstwem pęknięcia macicy może być przedostanie się do krążenia kobiety ciężarnej zatorowego materiału tkankowego pochodzenia płodowego (między innymi płynu owodniowego). Ze względu na obecność antygenów pochodzących od płodu w tym materiale tkankowym, u kobiety może dojść do reakcji anafilaktoidalnej tzw. „ciążowy zespół anafilaktoidalny” (ang. Anaphylactoid Syndrom of pregnancy). Stosowanie egzogennych prostaglandyn może nasilić reakcję na oksytocynę.
W badaniach na zwierzętach, w których przez kilka tygodni stosowano duże dawki prostaglandyn
z grupy E i F, ujawniono, że mogą one powodować rozrost kości. Podobny efekt obserwowano także u noworodków, które przez długi czas leczone były prostaglandyną E1.
Nie wykazano tego typu wpływu na kości podczas krótkotrwałego stosowania produktu Prepidil. Żelu Prepidil nie należy nakładać powyżej ujścia wewnętrznego szyjki, ponieważ przy podaniu zewnątrzowodniowym obserwowano nadmierną stymulację macicy.
Pacjentki z ciężkimi chorobami nerek lub wątroby związanymi z zaburzeniami metabolicznymi należy poddać ściślejszej obserwacji.
U kobiet w wieku 35 lat i starszych, kobiet z powikłaniami w ciąży oraz u kobiet w ciąży trwającej dłużej niż 40 tygodni istnieje większe poporodowe ryzyko rozwoju rozsianego wykrzepiania wewnątrznaczyniowego. Dodatkowo, te czynniki mogą zwiększać ryzyko związane z indukcją porodu (patrz punkt 4.8). Z tego względu dinoproston należy stosować ostrożnie u tych kobiet. Bezpośrednio po porodzie należy zwracać szczególną uwagę na możliwość wystąpienia wczesnych oznak rozwijającego się rozsianego wykrzepiania wewnątrznaczyniowego (np. fibrynoliza).
Odpowiedź na oksytocynę może być silniejsza w przypadku jednoczesnego podawania egzogennej prostaglandyny. Nie zaleca się jednoczesnego stosowania z innymi lekami oksytotycznymi. Jeśli podanie oksytocyny po podaniu dinoprostonu jest konieczne, zalecana jest co najmniej 6-godzinna przerwa pomiędzy podaniami.
Produkt Prepidil może być stosowany jedynie w ciąży, w celu wspomagania indukcji porodu.
Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Częstość i nasilenie działań niepożądanych produktu Prepidil są zależne od dawki i w pewnym stopniu również od sposobu podania. Podczas stosowania produktu Prepidil obserwowano następujące działania niepożądane:
U matki:
Zaburzenia serca:
Tak jak w przypadku wszelkich innych produktów stosowanych domacicznie, należy pamiętać
o ryzyku zakażeń miejscowych w wyniku zewnątrzowodniowego podania żelu.
W przypadku wystąpienia zakażenia powinno zostać wdrożone odpowiednie leczenie.
*Po zastosowaniu dinoprostonu, a zwłaszcza po wystąpieniu ciężkich zdarzeń niepożądanych, takich jak pęknięcie macicy (patrz punkty 4.2, 4.3 i 4.4), zgłaszano przypadki śmierci płodu, porodu martwego płodu i śmierci noworodka.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego.
Produkt Prepidil jest dostępny tylko w opakowaniach jednostkowych, dlatego objawy przedawkowania mogą w zwykłych warunkach wystąpić jedynie u pacjentek z nadwrażliwością na lek. Objawami przedawkowania mogą być: nadmierne napięcie macicy lub nieprawidłowo intensywne lub częste skurcze macicy, które mogą doprowadzić do stanu zagrożenia płodu.
W razie przedawkowania należy zastosować leczenie objawowe. W przypadku utrzymującej się nadmiernej stymulacji macicy i (lub) zagrożenia płodu po zaprzestaniu podawania produktu Prepidil korzystne może być dożylne podanie beta-mimetyku. Jeżeli leczenie objawowe okaże się nieskuteczne, wskazane jest doprowadzenie do natychmiastowego porodu.
Grupa farmakoterapeutyczna: Leki pobudzające skurcze macicy. Prostaglandyny, kod ATC: G 02 AD 02
Dinoproston jest prostaglandyną E2 (PGE2), należy do grupy naturalnych nienasyconych kwasów tłuszczowych. Prostaglandyny mają bardzo zróżnicowane właściwości farmakologiczne, włącznie ze zdolnością do stymulowania narządów zawierających mięśnie gładkie oraz do modulowania odpowiedzi narządów na inne bodźce hormonalne. Dinoproston podany do szyjki macicy przyspiesza jej dojrzewanie u pacjentek w celu wspomagania indukcji porodu. Dokładny mechanizm działania produktu nie został dotychczas w pełni wyjaśniony, jednakże doświadczalnie wykazano, że po podaniu dinoprostonu objętość krwi krążącej w szyjce wzrasta, podobnie jak w początkowych etapach spontanicznego porodu. Dane potwierdzają fakt, że podanie do szyjki macicy dinoprostonu stymuluje hemodynamikę szyjki, a w związku z tym indukuje jej dojrzewanie.
Naturalne prostaglandyny są produktem przemiany odpowiednich wolnych wielonienasyconych kwasów tłuszczowych i ulegają przekształceniu w nieaktywne metabolity.
Po podaniu do szyjki macicy 500 μg dinoprostonu (w postaci żelu) maksymalne stężenie w osoczu obserwowano po upływie 30 do 40 minut. Następnie poziom ten szybko wracał do normy niezależnie od skurczów macicy.
Po podaniu dożylnym okres półtrwania dinoprostonu wynosi mniej niż jedną minutę, podczas gdy okres półtrwania każdego z jego podstawowych metabolitów wynosi około ośmiu minut.
Brak danych.
Krzemu dwutlenek koloidalny Glicerolu trójoctan
Nie dotyczy.
2 lata
Przechowywać w lodówce (2°C - 8°C).
3g żelu w plastikowej strzykawce umieszczonej w jałowym opakowaniu oraz plastikowy cewnik umieszczony w jałowym opakowaniu, w tekturowym pudełku.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Pfizer Europe MA EEIG, Boulevard de la Plaine 17, 1050 Bruxelles, Belgia
R/1550
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 13.03.1991 r. Data ostatniego przedłużenia pozwolenia: 01.07.2009 r.











