Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Leczenie stanów lękowych;
Leczenie bezsenności związanej ze stanami lękowymi. Benzodiazepiny wskazane są jedynie w przypadku ciężkich zaburzeń, uniemożliwiających prowadzenie normalnego trybu życia lub będących przyczyną skrajnego dyskomfortu dla chorego;
Kontrola skurczów mięśniowych, także związanych ze spastycznością pochodzenia ośrodkowego;
Jako środek do premedykacji przed mniejszymi zabiegami chirurgicznymi;
Leczenie objawów nagłego odstawienia alkoholu.
Dawkowanie i sposób podawania Zwykłe dawkowanie
stany lękowe i bezsenność
stany lękowe: zwykle stosuje się 2 mg trzy razy na dobę.
Maksymalna dawka stosowana w leczeniu stanów lękowych to 30 mg na dobę, w dawkach podzielonych. Dawkę należy ustalać indywidualnie.
bezsenność związana ze stanami lękowymi: 5 mg do 15 mg na dobę przed snem.
Należy stosować najmniejszą dawkę zapewniającą kontrolę objawów. Nie należy przedłużać leczenia pełną dawką ponad okres czterech tygodni. Długotrwałe, przewlekłe stosowanie
nie jest zalecane. Produkt leczniczy powinien być odstawiany stopniowo. Pacjenci przyjmujący benzodiazepiny przez dłuższy czas mogą wymagać dłuższego okresu zmniejszania dawki. Wskazana może być pomoc lekarza specjalisty.
stany związane ze skurczem mięśni
skurcz mięśni: 2 mg do 15 mg na dobę, w dawkach podzielonych;
kontrola spastyczności pochodzenia ośrodkowego w wybranych przypadkach: 2 mg do 60 mg na dobę, w dawkach podzielonych.
jako środek do premedykacji przed znieczuleniem ogólnym
5 mg do 20 mg.
leczenie objawów nagłego odstawienia alkoholu
10 mg, trzy do czterech razy w ciągu pierwszych 24 godzin, następnie dawkę można zmniejszyć do 5 mg, trzy do czterech razy na dobę.
Dzieci
stany lękowe i bezsenność
Diazepam tabletki nie jest zalecany do stosowania u dzieci w tym wskazaniu.
stany związane ze skurczem mięśni
w kontroli napięcia i drażliwości w spastyczności pochodzenia ośrodkowego w wybranych przypadkach: 5 mg do 40 mg na dobę w dawkach podzielonych.
dzieci w wieku od 6 do 12 lat: początkowa dawka to 5 mg dwa razy na dobę.
dzieci w wieku od 12 do 18 lat: początkowa dawka to 10 mg dwa razy na dobę; maksymalna dawka to 40 mg na dobę.
jako środek do premedykacji przed znieczuleniem ogólnym
dzieci w wieku od 6 do 18 lat: 2 mg do 10 mg.
Benzodiazepin nie należy podawać dzieciom bez dokładnej oceny wskazania. Leczenie powinno trwać jak najkrócej.
Dzieci w wieku poniżej 6 lat
Diazepam tabletki nie jest przeznaczony dla dzieci w wieku poniżej 6 lat.
Osoby w podeszłym wieku oraz pacjenci osłabieni
Dawka produktu leczniczego nie powinna przekraczać połowy dawki zwykle stosowanej. U takich pacjentów należy prowadzić regularne kontrole w początkowym okresie leczenia, aby
zminimalizować dawkę i (lub) częstość przyjmowania produktu leczniczego i zapobiec przedawkowaniu na skutek kumulacji.
Pacjenci z zaburzeniami czynności nerek i (lub) wątroby
U pacjentów z zaburzeniami czynności nerek i (lub) wątroby niezbędne jest zmniejszenie dawki (patrz punkt 4.4).
Przeciwwskazania
Nadwrażliwość na substancję czynną diazepam, inne benzodiazepiny, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1
Myasthenia gravis
Ciężka niewydolność oddechowa
Zespół bezdechu sennego
Ciężka niewydolność wątroby (ryzyko encefalopatii).
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Diazepam działa przeciwlękowo, uspokajająco, nasennie, przeciwdrgawkowo i powoduje
relaksację mięśni szkieletowych prawdopodobnie poprzez nasilenie hamowania neuroprzekaźnika
ośrodkowego układu nerwowego – kwasu -aminomasłowego (GABA). Może powodować łagodne uspokojenie aż do wywołania snu, a nawet śpiączki, gdyż w ośrodkowym układzie nerwowym działa na układy odpowiedzialne za regulację zachowań emocjonalnych, tj. układ limbiczny, podwzgórze
i wzgórze.
Przypuszcza się, że mechanizm ośrodkowego działania benzodiazepin polega na allosferycznej interakcji receptorów błonowych z receptorami GABA, co powoduje otwarcie kanałów chlorkowych i zwiększone przenikanie jonów chlorkowych do wnętrza neuronu. Wynikiem tego działania jest hiperpolaryzacja błon oraz zahamowanie czynności neuronów i uwalniania neuroprzekaźnika.
Prawdopodobnie, przeciwlękowe działanie diazepamu i być może paradoksalne działania stymulujące ośrodkowy układ nerwowy są wynikiem odhamowania odpowiedzi tłumiącej. Po kilku dniach przyjmowania diazepamu obserwowano nieznaczne skrócenie fazy REM snu, przemijające po przerwaniu podawania leku. Również fazy III i IV snu są znacząco krótsze w czasie stosowania diazepamu w zwykłych dawkach.
Relaksacyjne działanie diazepamu na mięśnie szkieletowe jest związane głównie z hamowaniem dośrodkowych dróg polisynaptycznych. Produkt leczniczy może hamować odbicia mono-
i polisynaptyczne, działając jak inhibitor przewodzenia nerwowego lub blokując synaptyczne
przewodzenie sygnału. Drugim prawdopodobnym mechanizmem działania diazepamu jest hamowanie czynności neuronów motorycznych.
Diazepam działa przeciwdrgawkowo poprzez zwiększanie hamowania presynaptycznego
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
RELANIUM, 5 mg, tabletki
Jedna tabletka zawiera 5 mg diazepamu (Diazepamum).
Substancje pomocnicze o znanym działaniu: laktoza jednowodna, żółcień chinolinowa (E104). Każda tabletka zawiera 41,35 mg laktozy jednowodnej i 0,01 mg żółcieni chinolinowej.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka
Tabletki barwy żółtej, okrągłe, obustronnie wypukłe, o gładkiej powierzchni.
W celu osiągnięcia optymalnego działania, dawkę leku należy dobierać starannie i indywidualnie. Leczenie należy rozpocząć od najmniejszej skutecznej dawki właściwej w danym przypadku.
Czas leczenia
Leczenie diazepamem powinno trwać, w zależności od wskazania, możliwie jak najkrócej (patrz punkt 4.4) i nie powinno być dłuższe niż 4 tygodnie w przypadku bezsenności lub 8-12 tygodni w przypadku stanów lękowych, wliczając w to czas stopniowego odstawiania produktu leczniczego. Nie należy wydłużać czasu leczenia ponad wskazane powyżej, bez ponownej oceny stanu pacjenta.
Na początku leczenia należy poinformować pacjenta, że czas trwania leczenia jest ograniczony i dokładnie wyjaśnić w jaki sposób dawka będzie stopniowo zmniejszana. Ponadto ważne jest,
aby pacjent był świadomy ryzyka zjawiska „z odbicia”, aby zmniejszyć lęk związany z pojawieniem się jego objawów podczas odstawiania produktu leczniczego.
Należy wziąć pod uwagę, że w przypadku stosowania benzodiazepin o krótkim czasie działania,
zespół odstawienia może się pojawić w przerwie między dawkami szczególnie, gdy stosowane są duże dawki.
W przypadku stosowania benzodiazepin o długim czasie działania należy ostrzec pacjenta przed
zmianą na benzodiazepiny o krótkim czasie działania, ze względu na możliwość wystąpienia objawów odstawienia.
Podanie doustne.
Dorośli
Jednoczesne przyjmowanie alkoholu/leków hamujących ośrodkowy układ nerwowy
Należy unikać jednoczesnego stosowania diazepamu z alkoholem i (lub) lekami hamującymi ośrodkowy układ nerwowy. Takie skojarzenie może zwiększyć efekt kliniczny diazepamu, w tym silne uspokojenie, klinicznie istotną depresję oddechową i (lub) sercowo-naczyniową (patrz punkty 4.5 i 4.8).
Ryzyko związane z równoczesnym stosowaniem opioidów
Jednoczesne stosowanie produktu leczniczego Relanium i opioidów może spowodować sedację, depresję oddechową, śpiączkę i zgon. Z tego względu jednoczesne przepisywanie leków uspokajających, takich jak benzodiazepiny lub podobnych leków, takich jak Relanium, z opioidami powinno ograniczać się tylko do pacjentów, u których alternatywne sposoby leczenia
są niewystarczające. Jeśli podjęto decyzję o przepisaniu produktu leczniczego Relanium jednocześnie z opioidami, należy stosować najmniejszą skuteczną dawkę przez możliwie najkrótszy czas (patrz
także punkt 4.2).
Należy uważnie obserwować pacjentów, czy nie występują u nich objawy przedmiotowe i podmiotowe depresji oddechowej i sedacji. W związku z tym zdecydowanie zaleca się poinformowanie pacjentów i ich opiekunów (jeśli dotyczy) o tych objawach (patrz punkt 4.5). Nadużywanie alkoholu lub leków w wywiadzie
Diazepam należy stosować ze szczególną ostrożnością u pacjentów nadużywających alkoholu lub leków w wywiadzie.
Należy unikać podawania diazepamu pacjentom uzależnionym od leków hamujących ośrodkowy układ nerwowy oraz alkoholu.
Wyjątek od powyższej sytuacji stanowi leczenie ostrych objawów odstawienia.
Pacjenci powinni być objęci regularną kontrolą w celu zminimalizowania dawki i (lub) częstości
przyjmowania produktu leczniczego oraz zapobiegnięciu jego przedawkowania na skutek kumulacji.
Tolerancja
Po wielokrotnym stosowaniu przez kilka tygodni może dojść do pewnej utraty skuteczności nasennego działania benzodiazepin.
Uzależnienie
Stosowanie benzodiazepin może prowadzić do uzależnienia psychicznego i fizycznego.
Ryzyko uzależnienia wzrasta z dawką i z czasem trwania leczenia, jest większe u pacjentów nadużywających alkoholu lub leków w wywiadzie lub u pacjentów ze stwierdzonymi zaburzeniami osobowości. Bardzo ważne jest regularne monitorowanie takich pacjentów, należy unikać rutynowego powtórnego przepisywania leków. Lek powinien być odstawiany stopniowo.
Objawy odstawienia
W przypadku rozwinięcia się uzależnienia fizycznego, nagłe odstawienie produktu leczniczego powoduje pojawienie się objawów odstawienia, takich jak: bóle głowy, bóle mięśniowe, skrajny lęk, napięcie, niepokój, splątanie, drażliwość. W cięższych przypadkach mogą pojawić się następujące objawy: utrata poczucia rzeczywistości, zaburzenia osobowości, nadwrażliwość na dźwięk, drętwienie i mrowienie kończyn, nadwrażliwość na światło, hałas i dotyk, omamy, napady padaczkowe.
Zjawisko „z odbicia”, bezsenność i lęk
Podczas odstawiania leczenia przemijająco może pojawić się zjawisko „z odbicia”- nasilenie
objawów, które były przyczyną zastosowania benzodiazepin; mogą temu towarzyszyć inne objawy, takie jak: zmiany nastroju, lęk, zaburzenia snu i niepokój. Ryzyko zespołu odstawienia i (lub)
zjawiska „z odbicia” jest większe po nagłym odstawieniu produktu leczniczego, dlatego zaleca się, aby dawki produktu zmniejszać stopniowo.
Czas trwania leczenia
Leczenie powinno trwać, w zależności od wskazania, możliwie jak najkrócej (patrz punkt 4.2)
i nie powinno być dłuższe niż 4 tygodnie w przypadku bezsenności lub 8 do 12 tygodni w przypadku stanów lękowych, wliczając w to czas stopniowego odstawiania produktu leczniczego. Nie należy wydłużać tych okresów bez ponownej oceny stanu pacjenta.
Na początku leczenia należy poinformować pacjenta, że czas trwania leczenia jest ograniczony i dokładnie wyjaśnić, w jaki sposób dawka będzie stopniowo zmniejszana. Ponadto, ważne aby pacjent był świadomy ryzyka wystąpienia zjawiska „z odbicia”, co pomoże zminimalizować lęk związany z pojawieniem się objawów podczas odstawiania produktu leczniczego.
Należy wziąć pod uwagę, że w przypadku stosowania benzodiazepin o krótkim czasie działania,
zespół odstawienia może się pojawić w przerwie między dawkami, szczególnie, gdy stosowane są duże dawki. W przypadku stosowania benzodiazepin o długim czasie działania, należy przestrzec pacjenta przed zmianą na benzodiazepiny o krótkim czasie działania, ze względu na możliwość wystąpienia objawów odstawienia (patrz punkt 4.8).
Niepamięć
Benzodiazepiny mogą powodować niepamięć następczą, która może pojawić się po zastosowaniu dawek terapeutycznych, a ryzyko jej pojawienia się jest większe, gdy stosowane są większe dawki. Objawom niepamięci może towarzyszyć zachowanie nieadekwatne do sytuacji. Niepamięć następcza występuje najczęściej po kilku godzinach po przyjęciu produktu leczniczego i dlatego, aby zmniejszyć ryzyko związane z jej wystąpieniem, pacjent powinien mieć zapewniony 7-8 godzinny nieprzerwany sen (patrz punkt 4.8).
Reakcje psychiczne i paradoksalne
Podczas stosowania benzodiazepin obserwowano reakcje, takie jak: niepokój, pobudzenie, drażliwość, agresja, urojenia, złość, wściekłość, koszmary senne, halucynacje, psychozy, zachowanie
nieadekwatne do sytuacji i inne niepożądane skutki dotyczące zachowania. Jeśli pojawi się którykolwiek z powyższych objawów, należy przerwać leczenie. Prawdopodobieństwo pojawienia się takich objawów jest większe u dzieci i osób w podeszłym wieku (patrz punkt 4.8).
Szczególne grupy pacjentów
U dzieci występuje zwiększona wrażliwość ośrodkowego układu nerwowego na działanie benzodiazepin. U takich pacjentów ze względu na niepełny rozwój szlaku metabolicznego proces powstawania nieaktywnych metabolitów może być zahamowany lub niekompletny.
Benzodiazepin nie należy stosować u dzieci bez starannej oceny konieczności zastosowania; czas trwania leczenia należy ograniczyć do minimum.
Pacjenci w podeszłym wieku i osłabieni powinni otrzymywać zmniejszoną dawkę (patrz punkt 4.2). Ze względu na działanie miorelaksacyjne diazepamu istnieje ryzyko upadków i w konsekwencji,
złamania stawu biodrowego u osób w podeszłym wieku.
Zmniejszenie dawki jest również wskazane u pacjentów z przewlekłą niewydolnością oddechową, ze względu na możliwość wystąpienia depresji oddechowej.
Należy zachować ostrożność podczas stosowania diazepamu u pacjentów z niewydolnością serca lub niewydolnością oddechową w wywiadzie.
Stosowanie benzodiazepin nie jest wskazane u pacjentów z ciężką niewydolnością wątroby, w związku z ryzykiem wystąpienia encefalopatii.
W przypadku zaburzeń czynności nerek i (lub) wątroby konieczne jest zmniejszenie dawki. Podczas długotrwałego leczenia zaleca się monitorowanie liczby krwinek i czynności wątroby.
Ze względu na ryzyko wystąpienia napadu padaczkowego w wyniku nagłego przerwania leczenia benzodiazepinami, należy zwrócić szczególną uwagę na stosowanie produktu leczniczego u pacjentów z padaczką.
Benzodiazepiny nie są zalecane w terapii podstawowej zaburzeń psychotycznych.
Nie powinny być stosowane w monoterapii depresji lub stanów lękowych związanych z depresją (może to zwiększać ryzyko samobójstwa u tych pacjentów).
Diazepam nie jest odpowiedni do leczenia przewlekłych psychoz lub stanów z fobią lub natręctwami.
W przypadku utraty bliskich lub żałoby benzodiazepiny mogą hamować dostosowanie psychologiczne.
Produkt leczniczy Relanium zawiera laktozę jednowodną.
Ten produkt leczniczy zawiera 41,35 mg laktozy jednowodnej w każdej tabletce. Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
Produkt leczniczy Relanium zawiera żółcień chinolinową (E104).
Ten produkt leczniczy zawiera 0,01 mg żółcieni chinolinowej w każdej tabletce. Z uwagi na zawartość żółcieni chinolinowej produkt leczniczy może powodować reakcje alergiczne.
Produkt leczniczy Relanium zawiera sód (obecny w żółcieni chinolinowej).
Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu w każdej tabletce, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
Interakcje farmakokinetyczne
Metabolizm utleniania diazepamu zachodzi przy udziale izoenzymów CYP3A oraz CYP2C19, dlatego leki wpływające na aktywność tych cytochromów mogą modyfikować działanie diazepamu. Leki takie jak atazanawir, cymetydyna, ketokonazol, fluwoksamina, fluoksetyna, omeprazol, disulfiram, izoniazyd, propranolol i ryfampicyna, które są inhibitorami CYP3A i CYP2C19 mogą prowadzić do
zwiększonego i przedłużonego działania uspokajającego. Istnieją także doniesienia, że diazepam wpływa na metaboliczną eliminację fenytoiny.
Cyzapryd może prowadzić do czasowego nasilenia działania uspokajającego doustnych benzodiazepin ze względu na szybsze ich wchłanianie.
Stężenie diazepamu w surowicy może być zwiększone, jeśli jest stosowany jednocześnie
z rytonawirem, co może powodować bardzo silne uspokojenie i depresję oddechową. Może być konieczne zmniejszenie dawki diazepamu.
Interakcje farmakodynamiczne
Nasilenie działania uspokajającego, wpływu na układ oddechowy oraz parametry hemodynamiczne obserwuje się przy jednoczesnym stosowaniu benzodiazepin z lekami działającymi depresyjnie
na ośrodkowy układ nerwowy, takimi jak: leki przeciwpsychotyczne, leki
przeciwlękowe/uspokajające, przeciwdepresyjne, nasenne, przeciwpadaczkowe, opioidowe leki
przeciwbólowe, znieczulające, przeciwhistaminowe o działaniu uspokajającym, a także z alkoholem. Pacjenci przyjmujący diazepam powinni unikać spożywania alkoholu (patrz punkt 4.4).
Opioidy
Jednoczesne stosowanie leków uspokajających, takich jak benzodiazepiny np. Relanium lub ich pokrewne, z opioidami zwiększa ryzyko sedacji, depresji oddechowej, śpiączki i zgonu z powodu nasilonego depresyjnego działania na ośrodkowy układ nerwowy. Dawka i czas jednoczesnego stosowania powinny być ograniczone (patrz punkt 4.4).
Jednoczesne przyjmowanie kwasu walproinowego zwiększa ryzyko wystąpienia psychozy. Jednoczesne stosowanie buprenorfiny z benzodiazepinami może spowodować śmierć w wyniku
zahamowania czynności ośrodka oddechowego. Dlatego dawka powinna być ograniczona i należy unikać tego skojarzenia w razie ryzyka niewłaściwego użycia.
Teofilina może zmniejszać działanie benzodiazepin.
Płodność
Brak dostępnych danych.
Ciąża
Nie należy stosować produktu leczniczego w czasie ciąży, szczególnie w I i III trymestrze,
chyba że jest to bezwzględnie konieczne. Leczenie należy wówczas prowadzić pod bardzo ścisłym nadzorem lekarza.
Badania na zwierzętach wykazały niewielki szkodliwy wpływ benzodiazepin na płód. W niektórych badaniach odnotowano późne zaburzenia w zachowaniu noworodków narażonych na diazepam
in utero.
Jeśli produkt leczniczy Relanium został przepisany kobiecie w okresie rozrodczym, należy ją poinformować o konieczności skontaktowania się z lekarzem w celu zaprzestania leczenia produktem, jeśli planuje zajść w ciążę lub podejrzewa, że jest w ciąży.
Jeśli z powodu istotnych wskazań kobieta przyjmuje Relanium w późnym okresie ciąży lub w trakcie porodu, u noworodka mogą wystąpić objawy działania farmakologicznego diazepamu (takie jak: obniżenie temperatury ciała, hipotonia, niemiarowa czynność serca, brak odruchu ssania,
umiarkowana depresja oddechowa). Należy pamiętać, że u noworodków zespół enzymów odpowiadających za metabolizm produktu leczniczego nie jest jeszcze w pełni rozwinięty (zwłaszcza u wcześniaków).
U dzieci matek, które przyjmowały długotrwale diazepam w późnym okresie ciąży, mogło rozwinąć się uzależnienie fizyczne oraz istnieje ryzyko pojawienia się objawów zespołu odstawienia w okresie po urodzeniu.
Karmienie piersią
Benzodiazepiny przenikają do mleka, dlatego nie należy stosować produktu leczniczego podczas karmienia piersią.
Należy poinformować pacjenta, że tak jak w przypadku innych leków uspokajających, diazepam może zmieniać zdolność do wykonywania zadań wymagających zręczności.
Uspokojenie, amnezja, zaburzenia koncentracji i działanie zaburzające czynność mięśni mogą niekorzystnie wpłynąć na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Prawdopodobieństwo wystąpienia zaburzeń uwagi zwiększa się, jeśli czas trwania snu pacjenta nie jest wystarczająco długi.
Ponadto należy poinformować pacjenta, że alkohol może nasilać wszelkie zaburzenia i w związku z tym należy unikać alkoholu podczas leczenia.
Działania niepożądane zostały przedstawione zgodnie z klasyfikacją układów i narządów oraz według częstości.
Częstość występowania działań niepożądanych określono następująco:
bardzo często (≥1/10); często (≥100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1000); bardzo rzadko (<1/10 000); częstość nieznana (nie może być określona na podstawie dostępnych danych).
Najczęściej występujące działania niepożądane to: zmęczenie, senność i osłabienie siły mięśniowej, zwykle zależne od dawki. Te działania występują szczególnie na początku leczenia i ustępują po
wielokrotnym podaniu.
Klasyfikacja układów i narządów | Działanie niepożądane | Częstość występowania |
Zaburzenia krwi i układu chłonnego | Dyskrazja krwi i agranulocytoza (zgłaszano pojedyncze przypadki) | Nieznana |
Zaburzenia psychiczne* | Splątanie Spłycenie emocjonalne Zmniejszenie czujności Depresja Zmniejszenie lub zwiększenie libido Reakcje paradoksalne*, uzależnienie psychiczne* | Nieznana Nieznana Nieznana Nieznana Nieznana |
Zaburzenia układu nerwowego | Niezborność ruchów Upośledzenie wymowy, niewyraźna mowa Bóle głowy Drżenia Zawroty głowy Niepamięć następcza** | Nieznana Nieznana Nieznana Nieznana Nieznana Nieznana |
Zaburzenia oka | Podwójne widzenie Nieostre widzenie | Nieznana Nieznana |
Zaburzenia ucha i błędnika | Zawroty głowy | Nieznana |
Zaburzenia serca | Niewydolność serca, w tym zatrzymanie akcji serca Nieregularny rytm serca | Nieznana Nieznana |
Zaburzenia naczyniowe | Niedociśnienie Depresja krążeniowa | Nieznana Nieznana |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Depresja oddechowa, w tym niewydolność oddechowa | Nieznana |
Zaburzenia żołądka i jelit | Nudności Suchość błon śluzowych jamy ustnej Nadmierne wydzielanie śliny Zaparcia Zaburzenia żołądkowo-jelitowe | Nieznana Nieznana Nieznana Nieznana Nieznana |
Zaburzenia wątroby i dróg żółciowych | Żółtaczka | Nieznana |
Zaburzenia skóry i tkanki podskórnej | Reakcje skórne | Nieznana |
Zaburzenia nerek i dróg moczowych | Nietrzymanie moczu Zatrzymanie moczu | Nieznana Nieznana |
Badania diagnostyczne | Zwiększenie aktywności fosfatazy zasadowej we krwi Zwiększenie aktywności aminotransferaz | Nieznana Nieznana |
Urazy, zatrucia i powikłania po zabiegach | Upadki i złamania kości*** | Nieznana |
*Reakcje paradoksalne, takie jak: niepokój, pobudzenie, drażliwość, agresja, urojenia, złość, wściekłość, koszmary senne, halucynacje, psychozy, zachowanie nieadekwatne do sytuacji i inne niepożądane skutki dotyczące zachowania są znane w przypadku stosowania benzodiazepin. Jeśli pojawi się którykolwiek z powyższych objawów, należy przerwać leczenie. Prawdopodobieństwo pojawienia się takich objawów jest większe u dzieci i osób w podeszłym wieku.
Długotrwałe stosowanie (nawet dawek leczniczych) może prowadzić do uzależnienia fizycznego; nagłe
odstawienie produktu leczniczego może powodować wystąpienie efektu odstawienia lub zjawiska „z odbicia” (patrz punkt 4.4). Może wystąpić uzależnienie psychiczne. Zgłaszano przypadki nadużywania benzodiazepin;
** Niepamięć następcza może występować po dawkach terapeutycznych, a ryzyko jej pojawienia się jest większe dla większych dawek. Objawom niepamięci mogą towarzyszyć zachowania nieadekwatne do sytuacji (patrz punkt 4.4);
*** W przypadku osób w podeszłym wieku oraz pacjentów jednocześnie przyjmujących środki uspokajające lub spożywających alkohol, istnieje zwiększone ryzyko upadków i złamań.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego.
Objawy
Benzodiazepiny zazwyczaj powodują senność, niezborność ruchów, zaburzenie mowy i oczopląs. Przedawkowanie diazepamu rzadko zagraża życiu jeśli produkt leczniczy był przyjmowany jako jedyny, ale może prowadzić do całkowitego zniesienia odruchów, bezdechu, obniżenia ciśnienia, depresji krążeniowej i oddechowej oraz śpiączki. Jeśli wystąpi śpiączka, zwykle trwa kilka godzin, zdarza się jednak, że trwa dłużej i powtarza się, zwłaszcza u osób w podeszłym wieku.
Działanie depresyjne na układ oddechowy jest bardziej nasilone u pacjentów z chorobami układu oddechowego.
Benzodiazepiny nasilają działanie innych leków hamujących ośrodkowy układ nerwowy oraz alkoholu.
Postępowanie
Należy monitorować parametry życiowe pacjenta i wdrożyć działania, których wymaga stan kliniczny pacjenta. W szczególności leczenia objawowego mogą wymagać pacjenci, u których wystąpiły
zaburzenia czynności układu sercowo-oddechowego lub ośrodkowego układu nerwowego.
Należy zapobiec dalszemu wchłanianiu się produktu leczniczego przez podanie w ciągu 1-2 godzin węgla aktywowanego. Sennym pacjentom, którym podano węgiel, należy koniecznie zapewnić drożność dróg oddechowych. W przypadku ciężkiej depresji ośrodkowego układu nerwowego, należy rozważyć podanie antagonisty benzodiazepin - flumazenilu, ale tylko w ściśle monitorowanych warunkach. Flumazenil ma krótki okres półtrwania (około 1 godziny) i dlatego pacjenci, którym podano flumazenil wymagają monitorowania po zakończeniu jego działania. Flumazenil należy stosować z wyjątkową ostrożnością w przypadku jednoczesnego podawania leków obniżających próg drgawkowy (np. trójpierścieniowych leków przeciwdepresyjnych). W celu zapoznania się z dalszymi zaleceniami dotyczącymi prawidłowego stosowania flumazenilu, należy przeczytać druki informacyjne tego leku. W razie pojawienia się pobudzenia, nie należy podawać barbituranów.
Dalsze postępowanie zależy od stanu klinicznego i powinno być zgodne z zaleceniami Krajowego Centrum Informacji Toksykologicznej, jeśli są dostępne.
Grupa farmakoterapeutyczna: leki psycholeptyczne, pochodne benzodiazepiny; kod ATC: N05BA01
i zmniejsza rozprzestrzenianie aktywności drgawkowej, ale nie działa na wyładowania przebiegające prawidłowo. W zwykle stosowanych dawkach wywiera nieznaczny wpływ na autonomiczny układ nerwowy, oddechowy i sercowo-naczyniowy.
Wchłanianie
Diazepam jest szybko i prawie całkowicie absorbowany z przewodu pokarmowego i osiąga stężenie maksymalne po 30 - 90 minutach od przyjęcia dawki doustnej. Stężenia we krwi diazepamu
i jego metabolitów wykazujących aktywność farmakologiczną, są wprost proporcjonalne do dawki
i wykazują znaczne różnice osobnicze. Już po pierwszej dawce diazepamu obserwuje się wystąpienie efektów: przeciwlękowego, relaksacyjnego, a także przeciwpadaczkowego. Po dłuższym leczeniu
i osiągnięciu stanu stacjonarnego efekty te ulegają wzmocnieniu. Stężenia terapeutyczne diazepamu w osoczu są trudne do określenia, przyjmuje się, że stężenia >300 ng/ml, łącznie ze stężeniami metabolitów, są skuteczne.
Dystrybucja
Diazepam jest w znacznym stopniu (98 - 99%) wiązany z białkami osocza. Ulega rozległej dystrybucji w tkankach organizmu. Objętość dystrybucji wynosi około 1,1 l/kg. Dystrybucja jest szybka, o czym świadczy gwałtowne zmniejszanie się stężeń we krwi po dożylnym podaniu produktu leczniczego.
Produkt leczniczy i jego metabolity przenikają przez barierę krew - mózg i przez łożysko. Stężenie diazepamu we krwi płodu może być równe lub nawet większe niż we krwi matki. Diazepam szybko przenika do płynu mózgowo-rdzeniowego i do mózgu, a następnie jego działanie zmniejsza się
z powodu redystrybucji do tkanki tłuszczowej i do innych tkanek. Lek i jego metabolity również przenikają do mleka.
Metabolizm, Eliminacja
Eliminacja diazepamu jest dwufazowa. Początkowo występuje szybka faza dystrybucji,
a następnie druga, dłuższa faza eliminacji o t0,5 wahającym się od 20 do 50 h. Diazepam jest metabolizowany w wątrobie i powstają trzy aktywne metabolity: oksazepam, temazepam
i demetylodiazepam. Tworzenie metabolitów powoduje przedłużenie działania diazepamu do 2 - 5 dni, gdyż mają one dłuższe t0,5, a ich ilość w ustroju zwiększa się w czasie krótkotrwałego przyjmowania produktu leczniczego. W przypadku tworzenia metabolitów o dłuższym t0,5, ich stężenie w osoczu będzie większe niż stężenie leku macierzystego.
Diazepam jest w nieznacznym stopniu wydalany z moczem w postaci niezmienionej, po połączeniu
z kwasem glukuronowym, ale głównie w postaci metabolitów. Oksazepam i hydroksylowe metabolity są sprzęgane z kwasem glukuronowym i siarkowym i są wydalane z moczem.
Biologiczne okresy półtrwania (t0,5) diazepamu i jego metabolitów u zdrowych ochotników wahają się:
diazepam 20 – 50 h, a metabolity: demetylodiazepam 30 – 200 h, 3-hydroksydiazepam 5 – 20 h, oksazepam 6 – 20 h. Różnice obserwowane u pacjentów są jeszcze większe.
Stan stacjonarny jest osiągany w ciągu 2 tygodni od rozpoczęcia leczenia.
Zdolność organizmu do metabolizowania zależy od wielu czynników, takich jak: wiek, płeć, stan odżywienia, wydolność metaboliczna wątroby, czynność nerek, stan hormonów, palenie tytoniu, choroby, równoczesna terapia innymi lekami. Oprócz tego występują różnice indywidualne wynikające z różnic genetycznych.
Szczególne grupy pacjentów
Okres półtrwania w fazie eliminacji może być wydłużony u niemowląt, osób w podeszłym wieku i pacjentów z chorobami wątroby. W zaburzeniach czynności nerek okres półtrwania diazepamu pozostaje niezmieniony.
Badania kliniczne
Brak danych dla tego produktu.
Rakotwórczość
Potencjalne działanie rakotwórcze diazepamu przyjmowanego doustnie badano u kilku gatunków gryzoni. U samców myszy obserwowano zwiększoną częstość występowania guzów wątrobowo- komórkowych. Nie zaobserwowano zwiększonej częstości występowania guzów u samic myszy, szczurów, chomików i myszoskoczków.
Mutagenność
W szeregu badań uzyskano słabe dowody na działanie mutagenne w wysokich stężeniach, znacznie przekraczających dawki terapeutyczne stosowane u ludzi.
Zaburzenia płodności
Badania nad rozrodczością szczurów wykazały zmniejszenie liczby ciąż i przeżywalności potomstwa po podaniu doustnym dawek 100 mg/kg mc./dobę przed i po okresie godowym, a także w czasie ciąży i karmienia.
Działanie teratogenne
Wykazano, że diazepam ma działanie teratogenne u myszy w dawce 45-50 mg/kg mc., 100 mg/kg mc. i 140 mg/kg mc. jak również u chomików w dawce 280 mg/kg mc. Natomiast nie wykazano działania teratogennego u szczurów w dawce 80 mg/kg mc. i 300 mg/kg mc. oraz u królików w dawce 20 mg/kg mc. i 50 mg/kg mc.
Laktoza jednowodna Skrobia ziemniaczana Talk
Krzemionka koloidalna bezwodna Magnezu stearynian
Żółcień chinolinowa (E104)
Nie dotyczy.
5 lat
Przechowywać w temperaturze poniżej 25°C. Chronić od światła i wilgoci. Przechowywać w oryginalnym opakowaniu.
Tabletki pakowane są w blistry z folii polichlorowinylowej bezbarwnej i aluminiowej (PVC-Al) lub blistry z zabezpieczeniem przed dostępem dzieci z folii polichlorowinylowej białej i aluminiowej pokrytej warstwą papieru (PVC-Al/PET/PAP), w tekturowym pudełku.
Wielkość opakowania: 20 tabletek.
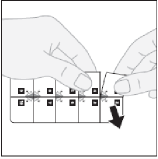
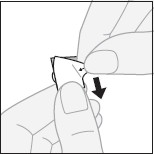
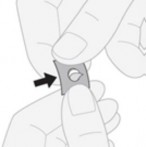
Specjalne środki ostrożności dotyczące przygotowania produktu leczniczego do stosowania Wyjmowanie tabletki z blistra z zabezpieczeniem przed dostępem dzieci
Oddzielenie jednej tabletki: aby oddzielić fragment blistra z jedną tabletką, należy rozerwać blister wzdłuż perforowanych linii.
Zerwanie warstwy zewnętrznej: zaczynając od rogu podważyć i zerwać warstwę zewnętrzną z oderwanego fragmentu blistra.
Wyjęcie tabletki: delikatnie wypchnąć tabletkę przez warstwę folii.
Te tabletki są dostarczane w specjalnym opakowaniu z zabezpieczeniem przed dostępem dzieci.
Na każdym fragmencie blistra z jedną tabletką jest umieszczony numer. Tabletki należy przyjmować po kolei, zgodnie z numeracją, zaczynając od numeru 1.
Bez szczególnych wymagań dotyczących usuwania.
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
GSK PSC Poland sp. z o.o. ul. Grunwaldzka 189
60-322 Poznań
R/1496
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 15-07-1969 Data ostatniego przedłużenia pozwolenia: 10-06-2009











