Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Bacteroides spp.
Gardnerella vaginalis
Mobiluncus spp.
Mycoplasma hominis
Peptostreptococcus spp.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
DALACIN, 20 mg/g (2%), krem dopochwowy
5 g kremu (zawartość aplikatora) zawiera 100 mg klindamycyny (Clindamycinum) w postaci klindamycyny fosforanu.
Substancje pomocnicze o znanym działaniu
5 g kremu zawiera 250 mg glikolu propylenowego, co odpowiada 50 mg/g.
5 g kremu zawiera 160,5 mg alkoholu cetostearylowego, co odpowiada 32,1 mg/g. 5 g kremu zawiera 50 mg alkoholu benzylowego, co odpowiada 10 mg/g.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Krem dopochwowy.
Krem jest biały, o półstałej konsystencji.
Krem dopochwowy Dalacin stosuje się w leczeniu bakteryjnego zapalenia pochwy, wywołanego przez wrażliwe drobnoustroje.
Podawać dopochwowo 5 g kremu (100 mg klindamycyny), co odpowiada pojemności jednego aplikatora, raz na dobę, najlepiej przed udaniem się na spoczynek nocny, przez 7 kolejnych dni. W zależności od objawów, można zalecić krótszy, 3-dniowy okres leczenia.
Sposób podawania
Zawsze przed zastosowaniem kremu należy umyć ręce.
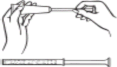
Zdjąć nakrętkę z tuby.
W miejscu usuniętej nakrętki przykręcić do tuby jeden z aplikatorów jednorazowego użycia. Trzymając tubę u dołu, delikatnie wcisnąć zawartość kremu do aplikatora.
Gdy tłok przestanie się przesuwać, oznacza to, że aplikator został napełniony. Odkręcić aplikator z tuby i ponownie nakręcić na nią nakrętkę.
Leżąc na plecach, mocno chwycić aplikator i wprowadzić go do pochwy tak głęboko, jak to możliwe bez uczucia dyskomfortu.
Trzymając aplikator, powoli nacisnąć tłok do momentu, aż się zatrzyma i cała zawartość kremu zostanie podana.

szyjka macicy
pochwa
odbyt
Delikatnie wyjąć aplikator, owinąć go w papier i wyrzucić do pojemnika na śmieci. Nie należy wyrzucać aplikatora do toalety.
Po zastosowaniu kremu należy dokładnie umyć ręce.
Nadwrażliwość na klindamycynę, linkomycynę lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Klindamycyna jest przeciwwskazana u pacjentek, u których po zastosowaniu antybiotyków występowało zapalenie okrężnicy.
Stosowanie kremu dopochwowego Dalacin może być przyczyną namnażania w pochwie drobnoustrojów niewrażliwych na klindamycynę, zwłaszcza drożdżaków.
Objawy wskazujące na rzekomobłoniaste zapalenie jelit mogą wystąpić podczas lub po zakończeniu leczenia antybiotykiem. Rzekomobłoniaste zapalenie jelit notowano po zastosowaniu prawie każdego z leków przeciwbakteryjnych, w tym klindamycyny, mimo że wchłania się ona z kremu tylko
w minimalnym stopniu. Powikłanie to może mieć przebieg łagodny do zagrażającego życiu. Dlatego ważne jest, aby wziąć je pod uwagę, jeśli u pacjentki wystąpi biegunka związana z zastosowaniem antybiotyku. Jeśli ma ona umiarkowane nasilenie, wystarczy przerwać stosowanie produktu. Jeśli natomiast wystąpi rzekomobłoniaste zapalenie jelit, należy ponadto wdrożyć odpowiednie leczenie przeciwbakteryjne. Przeciwwskazane jest podawanie leków hamujących perystaltykę.
Zaleca się, aby podczas stosowania kremu dopochwowego Dalacin pacjentka nie współżyła płciowo ani nie stosowała tamponów dopochwowych lub irygacji pochwy.
Krem dopochwowy Dalacin zawiera składniki, które mogą uszkadzać produkty wytworzone z gumy
i lateksu, takie jak krążki dopochwowe czy prezerwatywy, osłabiając ich skuteczność w zapobieganiu ciąży lub ochronie przed chorobami przenoszonymi drogą płciową, w tym AIDS. Dlatego nie zaleca się używania prezerwatyw ani krążków dopochwowych w trakcie stosowania produktu.
Informacje dotyczące substancji pomocniczych
Krem dopochwowy Dalacin zawiera glikol propylenowy, alkohol cetostearylowy oraz alkohol benzylowy (patrz punkt 2).
Alkohol cetostearylowy może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry). Alkohol benzylowy może powodować reakcje alergiczne i łagodne miejscowe podrażnienie.
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności kremu dopochwowego Dalacin u dzieci.
Ze względu na właściwości hamowania przekaźnictwa nerwowo-mięśniowego, klindamycyna może wzmacniać działanie środków zwiotczających (np. eteru, tubokuraryny, halogenków pankuronium). Może to prowadzić do nieoczekiwanych, zagrażających życiu powikłań śródoperacyjnych.
Obserwowano oporność krzyżową pomiędzy klindamycyną a linkomycyną. In vitro stwierdzono antagonistyczne działanie klindamycyny i erytromycyny.
Ze względu na brak danych zaleca się, aby nie stosować kremu dopochwowego Dalacin jednocześnie z innymi produktami podawanymi dopochwowo.
Badania dotyczące szkodliwego wpływu na reprodukcję przeprowadzone na szczurach i królikach otrzymujących klindamycynę per os i podskórnie nie wykazały zaburzeń płodności ani uszkodzenia płodu w wyniku stosowania klindamycyny, z wyjątkiem dawek działających toksycznie na organizm matki.
Na podstawie badań nad wpływem na reprodukcję u zwierząt nie zawsze można przewidzieć reakcję u ludzi.
Ciąża
W badaniach rozrodczości myszy i szczurów po podskórnym i doustnym podaniu klindamycyny w dawce od 20 mg/kg mc. do 600 mg/kg mc. na dobę nie wykazano zaburzeń płodności ani szkodliwego działania klindamycyny na płód. U jednego szczepu myszy obserwowano rozszczepienie podniebienia; powyższe zjawisko nie występowało u innych szczepów myszy ani innych gatunków, w związku z tym zostało uznane za specyficzne dla danego szczepu.
W badaniach klinicznych z użyciem klindamycyny w postaci kremu dopochwowego, prowadzonych u kobiet w drugim i trzecim trymestrze ciąży systematycznie otrzymujących klindamycynę w postaci
kremu dopochwowego, nie zaobserwowano zwiększonej częstości występowania nieprawidłowości. Krem dopochwowy Dalacin można stosować w pierwszym trymestrze ciąży tylko w przypadku wyraźnej konieczności.
Brak wystarczających danych z badań klinicznych dotyczących stosowania klindamycyny u kobiet
w pierwszym trymestrze ciąży. Przed zastosowaniem kremu dopochwowego Dalacin u kobiet w ciąży należy rozważyć stosunek ryzyka do ewentualnych korzyści wynikających z użycia produktu przez pacjentkę.
Karmienie piersią
Brak danych dotyczących przenikania klindamycyny do mleka ludzkiego podczas stosowania kremu dopochwowego. Klindamycyna po zastosowaniu ogólnoustrojowym pojawia się w mleku ludzkim w stężeniu od < 0,5 do 3,8 µg/ml.
Klindamycyna może mieć szkodliwy wpływ na mikroflorę przewodu pokarmowego niemowlęcia karmionego piersią, czego skutkiem może być biegunka lub obecność krwi w stolcu, a ponadto może ona wywoływać wysypkę.
Przy podejmowaniu decyzji o zastosowaniu klindamycyny u karmiącej piersią pacjentki należy wziąć pod uwagę korzyści dla rozwoju i zdrowia dziecka wynikające z karmienia piersią oraz kliniczne uzasadnienie podania matce klindamycyny, jak również wszelkie potencjalne działania niepożądane klindamycyny, jakie mogą wystąpić u karmionego piersią dziecka, oraz szkodliwy wpływ choroby matki na karmione piersią przez nią dziecko.
Płodność
Badania dotyczące płodności u szczurów, którym podawano klindamycynę w postaci doustnej, nie wykazały wpływu na płodność oraz zdolność rozrodczą. Nie przeprowadzono badań u zwierząt
z zastosowaniem klindamycyny w postaci kremu dopochwowego.
Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Bezpieczeństwo stosowania klindamycyny w postaci kremu dopochwowego oceniono w badaniach klinicznych prowadzonych u kobiet niebędących w ciąży i u kobiet ciężarnych w drugim i trzecim trymestrze ciąży.
Częstość występowania działań niepożądanych pogrupowano według następującej klasyfikacji: bardzo często (≥1/10),często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do
<1/1 000), bardzo rzadko (<1/10 000) i częstość nieznana (nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów (wg. MedDRA) | Bardzo często ≥1/10 | Często ≥1/100 do <1/10 | Niezbyt często ≥1/1 000 do <1/100 | Rzadko ≥1/10 000 do <1/1 000 | Bardzo rzadko <1/10 000 | Częstość nieznana |
Zakażenia i zarażenia pasożytnicze | Zakażenia grzybicze, zakażenie drożdżakami | Zakażenia bakteryjne | Kandydoza skóry | |||
Zaburzenia układu immunologicznego | Reakcje alergiczne | |||||
Zaburzenia endokrynologiczne | Nadczynność tarczycy | |||||
Zaburzenia układu nerwowego | Ból głowy, zawroty głowy, zaburzenia smaku | |||||
Zaburzenia ucha i błędnika | Zawroty głowy pochodzenia błędnikowego |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Zakażenia górnych dróg oddechowych | Krwawienie z nosa | ||||
Zaburzenia żołądka i jelit | Ból brzucha, zaparcia, biegunka, nudności, wymioty | Miejscowy ból brzucha, wzdęcia z oddawaniem gazów, nieprzyjemny zapach z ust | Rzekomobłoniaste zapalenie jelit*, zaburzenia żołądka i jelit, niestrawność | |||
Zaburzenia skóry i tkanki podskórnej | Świąd (w miejscach innych niż miejsce podania), wysypka | Pokrzywka, rumień | Wysypka grudkowo- plamkowa | |||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Ból pleców | |||||
Zaburzenia nerek i dróg moczowych | Zakażenia dróg moczowych, cukromocz, białkomocz | Bolesne lub utrudnione oddawanie moczu | ||||
Ciąża, połóg i okres okołoporodowy | Nieprawidłowy poród | |||||
Zaburzenia układu rozrodczego i piersi | Kandydoza pochwy i sromu | Zapalenie pochwy i sromu, zaburzenia pochwy i sromu, zaburzenia miesiączkowania, ból pochwy i sromu, krwotok z macicy, upławy | Rzęsistkowe zapalenie pochwy i sromu, zapalenie pochwy, ból w okolicy miednicy | Endometrioza | ||
Zaburzenia ogólne i stany w miejscu podania | Obrzęk zapalny, ból | |||||
Badania diagnostyczne | Nieprawidłowe wyniki badań mikrobiologicznych |
* Działania niepożądane zgłoszone po wprowadzeniu produktu do obrotu.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego.
Klindamycyna w postaci fosforanu, stosowana dopochwowo, może wchłaniać się w ilościach powodujących ogólne działania niepożądane klindamycyny (patrz punkty 4.4 i 4.8). W razie przedawkowania zaleca się zastosowanie leczenia objawowego i podtrzymującego czynności życiowe.
Grupa farmakoterapeutyczna: leki odkażające i przeciwzakaźne stosowane w ginekologii; antybiotyki, kod ATC: G 01 AA 10.
Klindamycyna jest antybiotykiem z grupy linkozamidów, który hamuje syntezę białek bakteryjnych na poziomie rybosomów bakteryjnych. Antybiotyk wiąże się preferencyjnie do podjednostki 50S rybosomu oraz wpływa na proces translacji. Mimo że fosforan klindamycyny jest nieczynny in vitro, szybka hydroliza in vivo przekształca ten związek w klindamycynę o działaniu przeciwbakteryjnym.
Podobnie jak większość inhibitorów syntezy białek, klindamycyna wykazuje głównie działanie bakteriostatyczne, a jej skuteczność zależy od długości czasu, w którym stężenie substancji czynnej pozostaje powyżej wartości MIC dla zakażającego drobnoustroju.
Oporność na klindamycynę jest najczęściej spowodowana modyfikacją miejsca docelowego na rybosomie, zazwyczaj poprzez chemiczną modyfikację zasad RNA lub poprzez mutacje punktowe
w RNA bądź sporadycznie w białkach. Dla niektórych drobnoustrojów wykazano oporność krzyżową in vitro między linkozamidami, makrolidami i streptograminami B. Wykazano występowanie oporności krzyżowej pomiędzy klindamycyną a linkomycyną.
Klindamycyna działa in vitro na większość szczepów poniższych drobnoustrojów, związanych z występowaniem bakteryjnego zakażenia pochwy:
W diagnostyce i w trakcie bakteryjnego leczenia zapalenia pochwy nie wykonuje się rutynowo posiewów ani badania wrażliwości. Nie ustalono standardowej metodologii badania wrażliwości bakterii mogących wywoływać tę chorobę: Gardnerella vaginalis i Mobiluncus spp. Metody określania wrażliwości szczepów Bacteroides spp. oraz beztlenowych ziarenkowców Gram-dodatnich, jak również szczepów Mycoplasma spp., zostały ustalone przez Instytut Norm Klinicznych i Laboratoryjnych (CLSI, ang.
Clinical and Laboratory Standards Institute), a progi wrażliwości na klindamycynę dla beztlenowców Gram-ujemnych i Gram-dodatnich zostały opublikowane zarówno przez Europejski Komitet ds.
Oznaczania Lekowrażliwości Drobnoustrojów (EUCAST, ang. European Committee on Antimicrobial Susceptibility Testing), jak i CLSI. Izolaty kliniczne, które wykazują wrażliwość na klindamycynę
i oporność na erytromycynę, należy badać pod kątem indukowanej oporności na klindamycynę metodą
dwóch krążków (ang. D-test). Należy jednak pamiętać, że progi wrażliwości stosowane są głównie przy wyborze antybiotykoterapii ogólnej, a nie miejscowej.
Po dopochwowym podaniu dawki 100 mg fosforanu klindamycyny w postaci 2% kremu dopochwowego raz na dobę przez 7 dni 6 zdrowym ochotniczkom, około 4% (zakres 0,6% do 11%) podawanej dawki wchłaniało się do krążenia ogólnego. Maksymalne stężenie klindamycyny w surowicy obserwowane pierwszego dnia wynosiło średnio 18 ng/ml (zakres 4 do 47 ng/ml), a 7. dnia średnie stężenie wynosiło 25 ng/ml (zakres 6 do 61 ng/ml). Powyższe maksymalne stężenia wystąpiły w ciągu około 10 godzin po podaniu leku (zakres 4 do 24 godzin).
Po dopochwowym podaniu dawki 100 mg fosforanu klindamycyny w postaci 2% kremu dopochwowego raz na dobę przez 7 kolejnych dni 5 kobietom z bakteryjnym zakażeniem pochwy, wchłanianie było wolniejsze i mniej zróżnicowane niż u zdrowych ochotniczek. Około 4% (zakres 2% do 8%) dawki wchłaniało się do krążenia ogólnego. Maksymalne stężenie klindamycyny obserwowane pierwszego dnia wynosiło średnio 13 ng/ml (zakres 6 do 34 ng/ml), a 7. dnia stężenie wynosiło średnio 16 ng/ml (zakres
7 do 26 ng/ml). Powyższe maksymalne stężenia wystąpiły w ciągu około 14 godzin po podaniu leku (zakres 4 do 24 godzin).
Po wielokrotnym podaniu dopochwowym fosforanu klindamycyny w postaci 2% kremu dopochwowego obserwowano niewielką kumulację klindamycyny w organizmie lub nie było kumulacji. Okres półtrwania w organizmie wynosił 1,5 do 2,6 godzin.
Stosowanie u pacjentek w podeszłym wieku
Badania kliniczne fosforanu klindamycyny w postaci 2% kremu dopochwowego nie objęły wystarczającej liczby pacjentek w wieku 65 lat i powyżej, umożliwiającej określenie przyczyn innej odpowiedzi na lek niż obserwowana u młodszych pacjentek.
Rakotwórczość
Nie przeprowadzono na zwierzętach badań klinicznych dotyczących kancerogennego działania produktu.
Mutagenność
Badania genotoksyczności obejmowały test mikrojądrowy u szczurów oraz test Amesa. Obydwa testy były negatywne.
Rozrodczość
Badania dotyczące zdolności do rozrodu, przeprowadzone na szczurach, którym podawano dawkę do 300 mg/kg mc. na dobę (31-krotnie większą od podawanej pacjentom w przeliczeniu na mg/m² pc.) nie wykazały wpływu na płodność lub zdolności reprodukcyjne.
Badania dotyczące rozwoju zarodka i płodu przeprowadzone na szczurach otrzymujących klindamycynę per os oraz na szczurach i królikach otrzymujących klindamycynę podskórnie nie wykazały szkodliwego wpływu klindamycyny na rozwój z wyjątkiem dawek powodujących toksyczny wpływ na organizm matki.
Sorbitanu monostearynian Polisorbat 60
Glikol propylenowy (E1520) Kwas stearynowy
Alkohol cetostearylowy
Cetylu palmitynian (Cutina CPV) Olej mineralny
Alkohol benzylowy (E1519) Woda oczyszczona
Nie dotyczy.
6.2 Okres ważności
2 lata
Przechowywać w temperaturze poniżej 25°C.
Tuba laminowana (LMDPE) zabezpieczona zakrętką, zawierająca 40 g kremu, umieszczona w tekturowym pudełku wraz z 7 aplikatorami.
Każdy aplikator po napełnieniu (jedna dawka) zawiera około 5 g kremu (100 mg klindamycyny).
Bez specjalnych wymagań dotyczących usuwania.
DO OBROTU
Pfizer Europe MA EEIG Boulevard de la Plaine 17 1050 Bruxelles
Belgia
R/7131
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 08.05.1997 r. Data ostatniego przedłużenia pozwolenia: 30.01.2014 r.
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
21.05.2021











