Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Dawkowanie
Leczniczo
Profilaktycznie
Sposób podawania
Odłączając niemowlę od respiratora
Należy odłączyć niemowlę na chwilę od respiratora i podać 1,25 do 2,5 ml/kg (100 do 200 mg/kg) zawiesiny w pojedynczym szybkim wstrzyknięciu przez rurkę intubacyjną bezpośrednio do dolnego odcinka tchawicy. Przez około 1 minutę należy prowadzić ręczną wentylację za pomocą worka samorozprężalnego, a następnie należy ponownie podłączyć dziecko do respiratora, którego parametry ustawione są tak samo jak przed podaniem zawiesiny. W razie konieczności, kolejne dawki (1,25 ml/kg mc.) należy podać w taki sam sposób.
Bez konieczności odłączania niemowlęcia od respiratora
Należy podać 1,25 do 2,5 ml/kg (100 do 200 mg/kg) zawiesiny w pojedynczym szybkim wstrzyknięciu bezpośrednio do dolnego odcinka tchawicy, wprowadzając cewnik, przez port ssania do rurki intubacyjnej. W razie konieczności, kolejne dawki (1,25 ml/kg mc.) należy podać w taki sam sposób.
Po podaniu produktu leczniczego Curosurf, podatność płuc (rozszerzenie klatki piersiowej), może ulec gwałtownej poprawie, co wymaga szybkiego dostosowania ustawień parametrów respiratora.
Poprawa wymiany gazowej w pęcherzykach płucnych może doprowadzić do gwałtownego wzrostu stężenia tlenu we krwi tętniczej: dlatego, aby zapobiec hiperoksji, należy szybko dostosować stężenie wdychanego tlenu. W celu utrzymania odpowiedniej wartości utlenowania krwi, oprócz regularnych badań gazometrycznych zaleca się także stałe monitorowanie przezskórnie ciśnienia parcjalnego tlenu (PaO2) lub nasycenia krwi tętniczej tlenem.
Istnieje trzeci sposób podawania zawiesiny przez rurkę dotchawiczą w sali porodowej zanim rozpocznie się mechaniczną wentylację:
W tym przypadku stosuje się wentylację manualną za pomocą worka samorozprężalnego, a jej przerwanie i zastosowanie aparatu CPAP (ang. Continuous Positive Airway Pressure) jest możliwe na sali porodowej jak i później, po przeniesieniu na oddział neonatologiczny (ang.: INtubation SURfactant Extubation – INSURE).
Mniej Inwazyjne Podanie Surfaktantu przez cienki cewnik (LISA – ang. Less Invasive Surfactant Administration)
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Szczególne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
odnaleźć nacięcie znajdujące się na kolorowym, plastikowym kapslu,
unieść kapsel w miejscu nacięcia i pociągnąć go do góry,
pociągnąć w dół plastikową część kapsla razem z jego częścią aluminiową,
i 5) usunąć cały kapsel ściągając aluminiowy pierścień,
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CUROSURF, 80 mg/ml, zawiesina do stosowania dotchawiczego i dooskrzelowego
1 ml zawiesiny zawiera:
Poractant alfa (frakcja fosfolipidów z płuc świni) 80 mg,
co odpowiada około 74 mg całej zawartości fosfolipidów i 0,9 mg niskocząsteczkowych hydrofobowych protein.
Jedna fiolka zawiera:
1,5 ml zawiesiny, w której znajduje się 120 mg frakcji fosfolipidów z płuc świni lub
3 ml zawiesiny, w której znajduje się 240 mg frakcji fosfolipidów z płuc świni.
Curosurf jest to naturalny surfaktant (czynnik powierzchniowo czynny) otrzymywany ze świńskich pęcherzyków płucnych. Zawiera głównie fosfolipidy, przede wszystkim fosfatydylocholinę (w przybliżeniu 70% całej zawartości fosfolipidów) i około 1%
specyficznych, hydrofobowych, niskocząsteczkowych protein powierzchniowych SP-B i SP-C. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zawiesina do stosowania dotchawiczego i dooskrzelowego.
Jałowa zawiesina o barwie białej do żółtej w fiolkach jednodawkowych, do stosowania dotchawiczego i dooskrzelowego.
Leczenie zespołu zaburzeń oddychania (RDS) u wcześniaków.
Podanie profilaktyczne u wcześniaków z grupy ryzyka wystąpienia RDS.
Zaleca się podanie jednej dawki 100 do 200 mg/kg masy ciała (1,25 do 2,5 ml/kg mc.) najszybciej jak to możliwe po rozpoznaniu RDS.
U dzieci, u których RDS jest uważany za przyczynę utrzymującego się lub pogorszającego się stanu dróg oddechowych, może być konieczne dodatkowe podanie dawek po 100 mg/kg mc. każda (1,25 ml/kg) w odstępach co najmniej 12-godzinnych (maksymalna dawka całkowita wynosi od 300 do 400 mg/kg mc.).
Pojedynczą dawkę 100 - 200 mg/kg mc. należy podać jak najwcześniej po urodzeniu (najlepiej w ciągu 15 minut). Kolejne dawki 100 mg/kg mc. można podać 6 do 12 godzin po podaniu pierwszej dawki, a następnie w odstępach 12-godzinnych w przypadku wystąpienia RDS wymagającego zastosowania mechanicznej wentylacji (maksymalna dawka całkowita: 300 - 400 mg/kg mc.).
Curosurf powinien być stosowany wyłącznie przez odpowiednio przeszkolony personel medyczny, mający doświadczenie w opiece, reanimacji i utrzymywaniu stabilnego stanu wcześniaków.
Curosurf jest podawany dotchawiczo i dooskrzelowo u noworodków, u których stale monitorowana jest praca serca oraz stężenie tlenu lub nasycenie tlenem krwi tętniczej, jak to ma miejsce na oddziałach neonatologicznych.
Curosurf jest dostępny w gotowych do użycia fiolkach, które należy przechowywać w lodówce, w temperaturze od 2° do 8°C. Przed podaniem leku, fiolki należy ogrzać do temperatury pokojowej, na przykład przez trzymanie w dłoniach przez kilka minut, i delikatnie obrócić kilkakrotnie dnem do góry, nie wstrząsając, w celu otrzymania jednorodnej zawiesiny.
Zawiesinę należy pobrać z fiolki sterylną igłą do strzykawki postępując zgodnie z instrukcją opisaną w punkcie 6.6. W celu wprowadzenia zawiesiny do płuc należy zastosować odpowiedni cewnik lub rurkę.
Curosurf można podawać zarówno:
Alternatywnie, u spontanicznie oddychających wcześniaków, Curosurf może być również podany mniej inwazyjną metodą (metoda LISA), przez cienki cewnik. Dawki są takie same, jak dla metod podania produktu opisanych w punktach a), b) i c). U dziecka oddychającego spontanicznie i pozostającego na CPAP-ie, wizualizuje się w laryngoskopii bezpośredniej struny głosowe i wprowadza do tchawicy cewnik o małej średnicy. Curosurf jest podawany w pojedynczym bolusie w ciągu 0,5 - 3 minut. Po podaniu produktu Curosurf, cewnik jest natychmiast usuwany. W trakcie całej procedury należy nieprzerwanie stosować CPAP.
Do podania surfaktantu należy używać cienkich cewników oznakowanych znakiem CE. Populacje specjalne
Niewydolność nerek lub wątroby
Bezpieczeństwo i skuteczność produktu Curosurf u pacjentów z niewydolnością nerek lub wątroby nie zostały ocenione.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Żadne szczególne przeciwwskazania nie są dotychczas znane.
Przed podaniem produktu Curosurf, stan ogólny noworodka powinien być stabilny. Wymagane jest wyrównanie parametrów biochemicznych w przypadku kwasicy, niedociśnienia tętniczego krwi, niedokrwistości, hipoglikemii i hipotermii.
W przypadku refluksu, należy przerwać podawanie preparatu Curosurf, i jeśli to konieczne zwiększyć ciśnienie szczytowe wdechowe, do całkowitego oczyszczenia rurki intubacyjnej.
U noworodków, u których wentylacja ulega znacznemu pogorszeniu w trakcie podawania lub bezpośrednio po podaniu leku, może dojść do zatkania rurki intubacyjnej śluzem, szczególnie, jeżeli przed podaniem leku obserwowano znaczną ilość wydzieliny w płucach. Odessanie wydzieliny przed podaniem leku może zmniejszyć prawdopodobieństwo zatkania rurki intubacyjnej śluzem. Jeżeli istnieje podejrzenie zatkania rurki intubacyjnej, a odessanie wydzieliny nie przynosi rezultatów, rurkę intubacyjną należy natychmiast wymienić.
Niemniej jednak, nie zaleca się aspiracji wydzieliny tchawicy przez co najmniej 6 godzin od podania leku, z wyjątkiem sytuacji zagrażających życiu.
W przypadku wystąpienia epizodów bradykardii, niedociśnienia tętniczego lub zmniejszenia saturacji tlenem (patrz punkt 4.8), należy przerwać podawanie produktu Curosurf i zastosować odpowiednie postępowanie celem normalizacji pracy serca. Po uzyskaniu stabilizacji noworodek może być poddany ponownie leczeniu, przy jednoczesnym odpowiednim monitorowaniu jego funkcji życiowych.
Po podaniu produktu leczniczego Curosurf, podatność płuc (rozszerzenie klatki piersiowej) i utlenowanie, może ulec gwałtownej poprawie, co wymaga szybkiego dostosowania ustawień parametrów respiratora.
Poprawa wymiany gazowej w pęcherzykach płucnych może doprowadzić do gwałtownego wzrostu stężenia tlenu we krwi tętniczej: dlatego, aby zapobiec hiperoksji, należy szybko dostosować stężenie wdychanego tlenu. W celu utrzymania odpowiedniej wartości utlenowania krwi, oprócz regularnych badań gazometrycznych, zaleca się także stałe monitorowanie przezskórnie ciśnienia parcjalnego tlenu (PaO2) lub nasycenia krwi tętniczej tlenem.
Kontynuując leczenie można zastosować nCPAP (nasal continuous positive airway pressure), ale jedynie na oddziałach odpowiednio do tego wyposażonych.
Noworodki poddane leczeniu surfaktantem należy ściśle kontrolować w kierunku objawów infekcji. Przy pierwszych objawach infekcji należy natychmiast zastosować odpowiednią terapię antybiotykową.
W przypadkach, gdy stosowanie produktu Curosurf nie przynosi poprawy, lub w przypadku nagłego nawrotu, przed podaniem kolejnej dawki należy rozważyć możliwość innych powikłań przedwczesnego urodzenia, takich jak przetrwały przewód tętniczy lub inna choroba płuc, np. zapalenie płuc.
U noworodków urodzonych w długim czasie po pęknięciu błon płodowych (dłuższym niż 3 tygodnie) może występować niedorozwój płuc i mogą one nie reagować optymalnie na podanie surfaktantu.
Podanie surfaktantu ma na celu zmniejszenie stopnia ciężkości RDS, ale nie należy oczekiwać całkowitego wyeliminowania śmiertelności i zachorowalności związanej z przedwczesnym urodzeniem, gdyż ze względu na swoją niedojrzałość wcześniaki mogą być narażone również na inne powikłania. Obserwowano chwilowe zahamowanie czynności elektrycznej mózgu po padaniu produktu Curosurf, trwające od 2 do 10 minut. Objawy takie zaobserwowano w jednym tylko badaniu klinicznym i nie ma zgodności co do ich znaczenia klinicznego.
Podczas podawania produktu Curosurf z użyciem metody LISA odnotowano zwiększoną częstość występowania: bradykardii, bezdechów i zmniejszonego wysycenia krwi tlenem. Zdarzenia te na ogół mają krótki czas trwania, nie mają następstw w trakcie podawania produktu oraz są łatwe do opanowania. Jeśli te zdarzenia stają się poważne, należy przerwać leczenie surfaktantem i wdrożyć leczenie powikłań.
Brak jest dostępnych danych dotyczących skutków zastosowania dawek początkowych innych niż 100 lub 200 mg/kg mc., podawania dawek częściej niż co 12 godzin lub rozpoczęcia podawania produktu Curosurf po upływie więcej niż 15 godzin od rozpoznania RDS.
Nie przeprowadzono badań dotyczących stosowania leku Curosurf u wcześniaków z ciężkim niedociśnieniem tętniczym.
Nie przeprowadzono badań dotyczących interakcji.
Nie dotyczy.
Nie dotyczy.
W tabeli poniżej wymieniono działania niepożądane obserwowane w trakcie badań klinicznych oraz po wprowadzeniu leku do obrotu. Działania niepożądane wymienione zostały zgodnie z klasyfikacją układów i narządów MedDRA (Preferred terms), z następująco zdefiniowaną częstością występowania: bardzo często (≥1/10); często (≥1/100 i <1/10); niezbyt często (≥1/1000 i <1/100); rzadko (≥1/10 000 i <1/1000), bardzo rzadko (<1/10 000); nieznana (częstość nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Działanie niepożądane | Częstość |
Zakażenia i zarażenia pasożytnicze | Sepsa | Niezbyt często |
Zaburzenia układu nerwowego | Krwotok wewnątrzczaszkowy | Niezbyt często |
Zaburzenia serca | Bradykardia | Rzadko |
Zaburzenia naczyniowe | Niedociśnienie tętnicze | Rzadko |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Dysplazja oskrzelowo-płucna | Rzadko |
Odma opłucnowa | Niezbyt często | |
Krwotok płucny | Rzadko |
Hiperoksja | Nieznana | |
Sinica noworodka | Nieznana | |
Bezdech | Nieznana | |
Badania diagnostyczne | Zmniejszona saturacja krwi tętniczej tlenem | Rzadko |
Nietypowe EEG | Nieznana | |
Urazy, zatrucia i powikłania po zabiegach | Powikłania intubacji dotchawiczej | Nieznana |
Bezdech lub sepsa mogą być wynikiem niedojrzałości noworodka.
Krwotokom wewnątrzczaszkowym występującym po podaniu produktu Curosurf towarzyszył spadek średniego ciśnienia tętniczego krwi oraz szybki wzrost do maksymalnego ciśnienia parcjalnego tlenu (PaO2). Aby uniknąć wysokich wartości maksymalnych ciśnienia parcjalnego tlenu zaleca się dostosowanie parametrów wentylacji natychmiast po podaniu leku (patrz punkt 4.2).
W przeprowadzonych dotychczas badaniach klinicznych zaobserwowano niewielki wzrost częstości występowania przetrwałego przewodu tętniczego u noworodków leczonych produktem Curosurf. Zjawisko to również zaobserwowano w przypadku stosowania innych egzogennych surfaktantów i jest ono związane ze zmianami hemodynamicznymi wywołanymi przez gwałtowne rozprężenie płuc po podaniu surfaktantu.
Zaobserwowano powstawanie przeciwciał przeciwko białkom wchodzącym w skład produktu Curosurf, ale jak dotąd bez żadnych dowodów mających znaczenie kliniczne.
Pomimo zastosowania intensywnej opieki medycznej, u wcześniaków relatywnie często dochodzi do wylewu krwi do mózgu i niedokrwienia mózgu, rozpoznawanego jako okołokomorowe rozmiękanie istoty białej lub zaburzeń hemodynamicznych, takich jak przetrwały przewód tętniczy i utrzymujące się krążenie płodowe. U dzieci tych wstępuje również wysokie ryzyko infekcji, takich jak zapalenie płuc i bakteriemia (lub posocznica). Napady drgawek mogą wystąpić również w okresie okołoporodowym. U wcześniaków również często występują zaburzenia obrazu krwi i równowagi elektrolitowej, które mogą nasilać się pod wpływem ciężkich chorób i wentylacji mechanicznej. Aby dopełnić obrazu możliwych powikłań związanych z wcześniactwem, poniżej wymieniono zaburzenia, bezpośrednio związane ze stopniem nasilenia choroby i z zastosowaniem wentylacji mechanicznej, koniecznej do ponownego utlenowania krwi: odma opłucnowa, rozedma śródmiąższowa płuc i krwotok płucny. Ponadto, długotrwałe stosowanie dużych stężeń tlenu i wentylacja mechaniczna mogą być związane z wystąpieniem dysplazji oskrzelowo-płucnej i retinopatii wcześniaków.
Metoda LISA
W badaniach klinicznych, częstość występowania niektórych łagodnych i przemijających zdarzeń niepożądanych, bez następstw w trakcie podawania produktów, była częstsza w grupach w których stosowana była metoda LISA niż w grupach kontrolnych gdzie stosowana była standardowa metoda; w szczególności: desaturacja (57,4% w grupie z użyciem metody LISA vs 26,6% w grupie kontrolnej), bezdech (21,8% vs 12,8%), bradykardia (11,9% vs 2,8%), piana na
ustach (21,8 vs 2,8%), kaszel (7,9% vs 0,9%), dławienie się (6,9% vs 1,8%) oraz kichanie (5% vs 0). Różnice w częstości występowania zdarzeń niepożądanych pomiędzy tymi dwiema grupami mogą być wytłumaczone przez mniej częste stosowanie sedacji w grupach gdzie użyta była metoda LISA, w porównaniu do grup gdzie zostało zastosowanie standardowe leczenie.
Większość z tych zdarzeń była łatwa do opanowania.
W spontanicznym porównawczym badaniu klinicznym (NINSAPP – ang. Nonintubated Surfactant Application) zgłaszano przypadki martwiczego zapalenia jelit wymagające operacji (8,4% w grupie z użyciem metody LISA i 3,8% w grupie z użyciem standardowej metody podania – intubacja z wentylacją mechaniczną) i ogniskowe perforacje jelita wymagające operacji (11,2.% w grupie z użyciem metody LISA i 10,6% w grupie z użyciem standardowej metody podania), bez statystycznie istotnych różnic pomiędzy grupami. Zdarzenia te mogą być zarówno powikłaniem wcześniactwa lub konsekwencjami innych zabiegów stosowanych u tych wcześniaków.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, e-mail: ndl@urpl.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dotychczas nie było doniesień o przedawkowaniu produktu Curosurf.
Niemniej jednak, w razie przypadkowego przedawkowania leku, należy odessać jak największą ilość zawiesiny, a następnie stosować leczenie wspomagające ze szczególnym uwzględnieniem gospodarki wodno-elektrolitowej.
Grupa farmakoterapeutyczna: Inne preparaty stosowane w chorobach układu oddechowego. Surfaktanty płucne.
Kod ATC: R07 AA 02
Mechanizm działania
Płucny surfaktant (czynnik powierzchniowo czynny) jest mieszaniną substancji, głównie fosfolipidów i swoistych protein, pokrywających wewnętrzną powierzchnię pęcherzyków płucnych.
Ich zasadnicze działanie polega na zmniejszeniu napięcia powierzchniowego w pęcherzykach płucnych, co stabilizuje pęcherzyki płucne, zapobiega ich zapadaniu się po wydechu i umożliwia prawidłową wymianę gazową w czasie cyklu oddechowego.
Działanie farmakodynamiczne
Niedobór surfaktantu płucnego, niezależnie od przyczyny, prowadzi do zespołu ostrej niewydolności oddechowej, który u przedwcześnie urodzonych niemowląt jest znany jako zespół zaburzeń oddychania RDS (Respiratory Distress Syndrome) lub zespół błon szklistych (Hyaline Membrane Disease). RDS jest główną przyczyną śmiertelności i zachorowalności wcześniaków
oraz jest odpowiedzialny za późniejsze powikłania ze strony układu oddechowego oraz ośrodkowego układu nerwowego.
Curosurf jest produktem służącym do substytucyjnego leczenia niedoboru endogennego surfaktantu, podawanym bezpośrednio do dróg oddechowych.
Zdolność do zmniejszania napięcia powierzchniowego, jaką wykazuje preparat Curosurf, sprzyja łatwiejszej dystrybucji leku w płucach oraz rozprzestrzenianiu się na powierzchni kontaktu powietrze-płyn w pęcherzykach płucnych. Działanie produktu Curosurf, zarówno fizjologiczne jak i terapeutyczne, zostało dokładnie udokumentowane na różnych modelach zwierzęcych.
U niedojrzałych płodów króliczych, wydobytych poprzez histerektomię a następnie natychmiast uśmierconych, podanie leku powodowało istotną poprawę w rozprężaniu płuc.
U wcześniaków króliczych wentylowanych 100% tlenem, po podaniu preparatu Curosurf przez zgłębnik dotchawiczy, stwierdzono znaczne zwiększenie objętości oddechowej i podatności płuc w porównaniu ze zwierzętami z grupy kontrolnej.
Podanie produktu Curosurf wcześniakom króliczym (o standaryzowanej pojemności oddechowej około 10 ml/kg masy ciała), zwiększyło podatność płuc do poziomu zbliżonego do występującego u dojrzałych noworodków zwierząt.
Skuteczność kliniczna i bezpieczeństwo stosowania
W spontanicznym badaniu klinicznym (NINSAPP) porównano podawanie leku Curosurf z użyciem metody LISA i standardowej metody podania (intubacja, podanie surfaktantu, wentylacja mechaniczna) w dwóch grupach wcześniaków z RDS i w wieku ciążowym pomiędzy 23 i 27 tygodniem (grupa z użyciem metody LISA: N=108, grupa kontrolna: N=105). Metoda LISA była nie gorsza od metody standardowej w pierwszorzędowym punkcie końcowym (przeżycie bez dysplazji oskrzelowo-płucnej w 36 tygodniu wieku ciążowego) . LISA była lepsza w odniesieniu do drugorzędowych punktów końcowych – zwiększała częstość przeżycia bez poważnych powikłań oraz zmniejszała częstość współchorobowości typowej dla wcześniactwa. Metoda LISA istotnie redukowała konieczność wentylacji mechanicznej.
Po podaniu dotchawiczym, Cursurf w większości pozostaje w płucach. U noworodków króliczych okres półtrwania dipalmitylofosfatydylocholiny znakowanej C14 wynosi
67 godzin. 48 godzin po podaniu, stwierdza się wyłącznie śladowe ilości fosfolipidów surfaktantu w surowicy i narządach innych niż płuca.
W badaniach ostrej toksyczności, przeprowadzonych u różnych gatunków zwierząt, którym podawano lek dootrzewnowo i dooskrzelowo, nie stwierdzono objawów toksyczności w płucach ani toksyczności układowej, a także nie stwierdzono przypadków śmiertelnych.
Badania podostrej toksyczności w obrębie tchawicy, jakie przeprowadzono w czasie 14 dni u psów, królików i szczurów, nie wykazały, aby preparat Curosurf wywoływał
jakiekolwiek działanie kliniczne, czy też zmiany hematologiczne lub zmiany makroskopowe związane ze schematem leczenia. Ponadto, podawanie szczurom dootrzewnowo preparatu Curosurf przez 4 tygodnie, nie dostarczyło żadnego dowodu na bezpośrednią toksyczność.
Curosurf podawany pozajelitowo świnkom morskim nie wywoływał żadnych reakcji anafilaktycznych, ani też nie pobudzał syntezy przeciwciał, które byłyby wykrywalne za pomocą biernej skórnej reakcji anafilaktycznej. Również nie zaobserwowano wystąpienia żadnej reakcji anafilaktycznej po podaniu leku dotchawiczo. Ponadto, nie istnieją dowody na zdolność do wywoływania nadwrażliwości skórnej (test Magnussona i Kligmana).
Curosurf nie wykazywał żadnego działania mutagennego lub klastogennego.
Sodu chlorek, woda do wstrzykiwań Wodorowęglan sodu (do regulacji pH)
Nie dotyczy.
18 miesięcy dla produktu przechowywanego w opakowaniu zamkniętym. Do jednorazowego użytku. Niewykorzystaną zawiesinę należy wyrzucić.
Przechowywać w lodówce w temperaturze od 2°C do 8°C.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Nieotwarte i nieużyte fiolki produktu Curosurf, które zostały ogrzane do temperatury pokojowej, w ciągu 24 godzin można umieścić z powrotem w lodówce w celu późniejszego ich użycia.
Fiolki nie należy ogrzewać do temperatury pokojowej i umieszczać w lodówce więcej niż jeden raz.
Szklana fiolka zabezpieczona korkiem gumowym i kapslem z aluminium i plastiku w tekturowym pudełku.
2 fiolki po 1,5 ml zawiesiny 80 mg/ml lub 1 fiolka po 3 ml zawiesiny 80 mg/ml w tekturowym pudełku.
Przed podaniem leku, fiolkę należy ogrzać do temperatury pokojowej a następnie kilkakrotnie delikatnie obrócić dnem do góry, nie wstrząsając, w celu otrzymania jednorodnej zawiesiny.
Zawiesinę należy pobrać z fioki przy pomocy sterylnej igły i strzykawki.
W celu pobrania zawiesiny należy postępować ściśle według poniższych wskazówek:
6) i 7) zdjąć gumowy korek przed pobraniem zawartości fiolki.
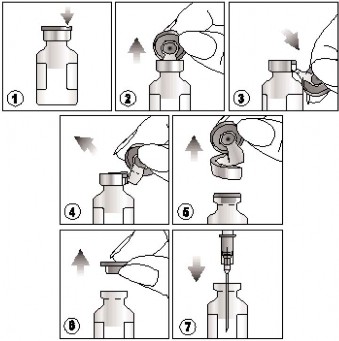
Do jednorazowego użytku. Niewykorzystaną zawiesinę, jaka pozostała w fiolce, należy wyrzucić. Nie przechowywać niewykorzystanej zawiesiny do ponownego stosowania.
Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z przepisami.
Chiesi Farmaceutici S.p.A. Via Palermo, 26/A
43122 Parma, Włochy
Świad. Rej. Nr: 7647 dla Curosurf 240 mg/3 ml
Świad. Rej. Nr: 7648 dla Curosurf 120 mg/1,5 ml
Pozwolenie MZ Nr: 7647,7648 dla Curosurf 80 mg/ml
23.04.1998 r.
22.07.2003 r.
17.07.2008 r.
11.10.2016











