Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
w przypadku strzykawki z zamocowanym na jej końcu korkiem:
mocno wcisnąć korek w szyjkę butelki przy pomocy strzykawki,
aby napełnić strzykawkę, butelkę należy energicznie wstrząsnąć, odwrócić do góry dnem, a następnie ostrożnie przesuwać tłok strzykawki do dołu, wciągając zawiesinę w pożądanej ilości określonej na podziałce,
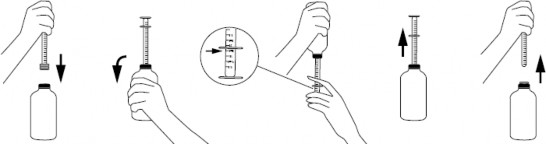
butelkę odwrócić do pozycji początkowej i ostrożnie wyjąć strzykawkę z korka (rys. 1), Rysunek 1
końcówkę strzykawki należy umieścić w ustach dziecka, a następnie wolno wciskając tłok, ostrożnie opróżnić zawartość strzykawki,
po zastosowaniu butelkę zamknąć, pozostawiając korek w szyjce butelki, a strzykawkę umyć i wysuszyć.
w przypadku strzykawki z korkiem umieszczonym w szyjce butelki:
po odkręceniu zakrętki nałożyć strzykawkę na korek umieszczony w szyjce butelki,
aby napełnić strzykawkę, butelkę należy energicznie wstrząsnąć, odwrócić do góry dnem, a następnie ostrożnie przesuwać tłok strzykawki do dołu, wciągając zawiesinę w pożądanej ilości określonej na podziałce,
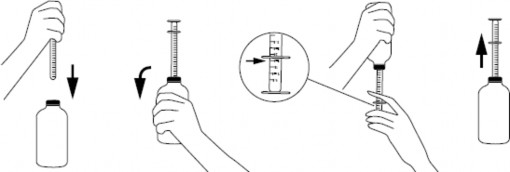
butelkę odwrócić do pozycji początkowej i ostrożnie wyjąć strzykawkę z korka (rys. 2), Rysunek 2
końcówkę strzykawki należy umieścić w ustach dziecka, a następnie wolno wciskając tłok, ostrożnie opróżnić zawartość strzykawki,
po zastosowaniu butelkę zamknąć, a strzykawkę umyć i wysuszyć.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Paracetamol Hasco, 120 mg/5 ml, zawiesina doustna
5 ml zawiesiny zawiera 120 mg paracetamolu (Paracetamolum). Substancje pomocnicze o znanym działaniu: sacharoza.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
zawiesina doustna
Gorączka i bóle różnego pochodzenia (np. po zabiegach chirurgicznych, bóle związane
z wyrzynaniem się zębów, bóle głowy o łagodnym lub umiarkowanym nasileniu), dolegliwości towarzyszące reakcji organizmu na szczepionkę (ból, gorączka, odczyn miejscowy).
U niemowląt od 0 do 3 miesiąca życia (o masie ciała do 4 kg): leczenie objawowe gorączki trwającej nie dłużej niż 3 dni oraz bólu o nasileniu łagodnym do umiarkowanego.
Produkt leczniczy stosuje się doustnie.
Przed użyciem energicznie wstrząsnąć w celu uzyskania jednolitej zawiesiny. Produkt leczniczy przeznaczony dla dzieci.
Jeśli lekarz nie zaleci inaczej, przeciętna jednorazowa dawka paracetamolu wynosi 10 do 15 mg na kilogram masy ciała.
W razie konieczności dawkę można powtarzać, nie częściej niż co 4-6 godzin ani nie więcej niż 4 razy w ciągu doby, czyli maksymalnie 60 mg/kg mc./dobę.
W tabeli poniżej podano przykładowy schemat obliczania dawki leku:
Wiek (masa ciała dziecka) | Zalecana DAWKA JEDNORAZOWA | Maksymalna DAWKA DOBOWA |
od 0 do 3 miesiąca życia (do 4 kg) | 2,5 ml (60 mg) | 10 ml (240 mg) |
od 4 do 8 miesiąca życia (do 7 kg) | 4 ml (96 mg) | 16 ml (384 mg) |
od 9 do 11 miesiąca życia (do 8 kg) | 5 ml (120 mg) | 20 ml (480 mg) |
od 1 do 2 lat (do 10,5 kg) | 6,5 ml (156 mg) | 26 ml (624 mg) |
od 2 do 3 lat (do 13 kg) | 8 ml (192 mg) | 32 ml (768 mg) |
od 4 do 5 lat (do18,5 kg) | 12 ml (288 mg) | 48 ml (1152 mg) |
od 6 do 8 lat (do 24 kg) | 15 ml (360 mg) | 60 ml (1440 mg) |
od 9 do 10 lat (do 32 kg) | 20 ml (480 mg) | 80 ml (1920 mg) |
d 11 do 12 lat (do 45,6 kg) | 28,5 ml (684 mg) | 114 ml (2736 mg) |
o
Bez konsultacji z lekarzem nie stosować dłużej niż 3 dni.
Stosowanie u dzieci poniżej 2 roku życia powinno być zlecone przez lekarza.
Do opakowania dołączona jest łyżka miarowa lub miarka (kieliszek) lub korek i strzykawka doustna lub strzykawka doustna (korek umieszczony w szyjce butelki).
Instrukcja dawkowania przy pomocy strzykawki doustnej:
Brak specjalnych zaleceń dotyczących stosowania z posiłkiem.
Nadwrażliwość na którykolwiek ze składników produktu leczniczego, ciężka niewydolność wątroby lub wirusowe zapalenie wątroby, ciężka niewydolność nerek, choroba alkoholowa.
Produkt leczniczy zawiera paracetamol. Nie stosować z innymi lekami zawierającymi paracetamol z powodu ryzyka przedawkowania.
Nie należy stosować dawek większych niż zalecane.
W razie przedawkowania natychmiast skonsultować się z lekarzem, nawet jeśli pacjent czuje się dobrze.
Bez zalecenia lekarza nie stosować dłużej niż 3 dni.
W czasie stosowania paracetamolu nie należy spożywać napojów alkoholowych, nie stosować produktu leczniczego u osób uzależnionych od alkoholu. Stosować ostrożnie u osób z niewydolnością wątroby lub nerek.
Szczególne ryzyko uszkodzenia wątroby występuje u osób głodzonych.
U osób z astmą, uczulonych na kwas salicylowy może wystąpić uczulenie na paracetamol.
Dostępne wyniki badań wskazują, że podawanie paracetamolu może stanowić czynnik ryzyka rozwoju astmy i chorób alergicznych u dzieci.
Z uwagi na zawartość sacharozy, pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem sacharazy- izomaltazy nie powinni przyjmować produktu leczniczego.
Sodu pirosiarczyn zawarty w produkcie może rzadko powodować ciężkie reakcje nadwrażliwości i skurcz oskrzeli.
Produktu leczniczego nie należy przyjmować wraz z ośrodkowo działającymi środkami przeciwbólowymi ani z alkoholem, ponieważ nasila ich działanie. W przypadku jednoczesnego stosowania: barbituranów, leków przeciwpadaczkowych (m.in. glutetimid, fenobarbital, fenytoina, karbamazepina), ryfampicyny nasila się szkodliwe działanie paracetamolu na wątrobę. Paracetamol zwiększa toksyczność chloramfenikolu.
Długotrwałe stosowanie paracetamolu w dużych dawkach nasila działanie doustnych leków przeciwzakrzepowych z grupy pochodnych kumaryny.
Jednoczesne stosowanie paracetamolu z niesteroidowymi lekami przeciwzapalnymi zwiększa ryzyko wystąpienia zaburzeń czynności nerek.
Paracetamol przenika przez łożysko i do mleka kobiecego. W okresie ciąży i karmienia piersią stosować tylko w razie konieczności, gdy w opinii lekarza korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu.
Produkt leczniczy Paracetamol Hasco nie ma wpływu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu.
Działania niepożądane są wymienione poniżej w zależności od układów narządowych i częstości występowania. Częstość występowania jest określona jako: rzadko (1/10 000, <1/1 000) lub bardzo rzadko (< 1/10 000, w tym pojedyncze przypadki). W obrębie każdej grupy objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem częstości występowania.
Zaburzenia krwi i układu chłonnego
Bardzo rzadko (<1/10 000): zmniejszenie liczby płytek krwi (trombocytopenia), leukocytów (leukopenia, agranulocytoza).
Zaburzenia żołądka i jelit
Bardzo rzadko (<1/10 000): nudności, wymioty, biegunka.
Zaburzenia układu immunologicznego
Rzadko (1/10 000, <1/1 000): skórne reakcje uczuleniowe: pokrzywka, rumień, zapalenie skóry.
Produkt leczniczy stosowany przez dłuższy czas lub przedawkowany może spowodować uszkodzenie wątroby i nerek oraz methemoglobinemię z objawami sinicy (szaroniebieskie zabarwienie skóry).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Objawy przedawkowania:
Ciężkie zatrucie może wystąpić u dzieci po zażyciu 200 mg paracetamolu/kg mc.
Przypadkowe lub zamierzone przedawkowanie paracetamolu może spowodować w ciągu kilku, kilkunastu godzin takie objawy, jak: nudności, wymioty, nadmierne pocenie się, senność i ogólne osłabienie. Objawy te mogą ustąpić następnego dnia, pomimo rozwijającego się powoli ciężkiego uszkodzenia wątroby, objawiającego się uczuciem rozpierania w nadbrzuszu, nudnościami i żółtaczką. Leczenie przedawkowania:
Leczenie zatrucia paracetamolem musi odbywać się w szpitalu, w warunkach intensywnej opieki medycznej. Jeśli od momentu przyjęcia paracetamolu nie minęła godzina, należy sprowokować wymioty i podać węgiel aktywowany. Ocenę ciężkości zatrucia przeprowadza się na podstawie oznaczenia poziomu paracetamolu we krwi, lecz u dzieci może on być zaniżony lub nieistotny. Leczenie zatrucia do 24 godzin po przedawkowaniu polega na podawaniu N-acetylocysteiny dożylnie we wlewie kroplowym w 5% roztworze glukozy.
5.1 Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: Inne leki przeciwbólowe i przeciwgorączkowe, anilidy; kod ATC: N 02 BE 01.
Paracetamol, substancja czynna produktu leczniczego Paracetamol Hasco, zawiesina doustna, jest lekiem przeciwgorączkowym i przeciwbólowym przeznaczonym do stosowania u niemowląt i dzieci. Stosowany w zalecanych dawkach jest dobrze tolerowany.
Paracetamol jest pochodną aniliny wykazującą działanie przeciwgorączkowe i przeciwbólowe bez działania przeciwzapalnego. Paracetamol hamuje syntezę prostaglandyn w ośrodkowym układzie nerwowym poprzez hamowanie aktywności cyklooksygenazy kwasu arachidonowego. Dzięki temu zmniejsza wrażliwość receptorów bólowych na działanie kinin i serotniny, powodując podwyższenie progu bólowego. Działanie przeciwgorączkowe paracetamolu związane jest ze zmniejszeniem stężenia prostaglandyn w podwzgórzu. Paracetamol pozbawiony jest praktycznie działania przeciwzapalnego, ponieważ nie hamuje syntezy prostaglandyn w tkankach obwodowych. Nie hamuje agregacji płytek
i nie wpływa na czas krzepnięcia krwi.
Wchłanianie
Paracetamol po podaniu doustnym wchłania się dobrze i prawie całkowicie poprzez bierną dyfuzję z jelita cienkiego. Maksymalne stężenie w osoczu osiąga po ok. 30-60 minutach od podania.
Dystrybucja
Paracetamol jest rozprowadzany do większości tkanek organizmu (z wyjątkiem tkanki tłuszczowej), przenika przez łożysko, a także do mleka kobiecego. Wiąże się w niewielkim stopniu z białkami krwi. Stopień wiązania z białkami krwi zwiększa się ze wzrostem stężenia paracetamolu w osoczu. Okres półtrwania paracetamolu w surowicy (T½) wynosi u dorosłych 2-3 godziny, a u dzieci 1,5-2 godziny.
Metabolizm paracetamolu odbywa się głównie w wątrobie na drodze 3 szlaków: sprzęgania z kwasem glukuronowym, sprzęgania z siarczanami i oksydacji. Głównymi produktami metabolizmu są glukuronidy (60%) i siarczany (ok. 35%). Związki będące produktami sprzęgania są nieczynne
i nietoksyczne. Powstający w niewielkiej ilości hepatotoksyczny metabolit pośredni N-acetylo-p- benzochinoimina łączy się szybko ze zredukowanym glutationem, jest sprzęgana z cysteiną i kwasem merkapturowym i wydalana z moczem.
W przypadku przyjęcia dużych dawek paracetamolu zasoby wątrobowego glutationu mogą ulec wyczerpaniu, co powoduje znaczne nagromadzenie toksycznego metabolitu w wątrobie i może doprowadzić do uszkodzenia hepatocytów, ich martwicy oraz ostrej niewydolności wątroby.
Produkty sprzęgania paracetamolu są wydalane głównie z moczem. W ciągu 24 godzin wydalane jest 85-100% przyjętej dawki, w tym ok. 5% w postaci nie zmienionej.
Dostępne w piśmiennictwie niekliniczne dane o bezpieczeństwie stosowania paracetamolu nie zawierają wyników, które mają znaczenie dla zalecanego dawkowania oraz stosowania produktu leczniczego.
Sacharoza
Guma ksantan (E 415)
Kwas cytrynowy jednowodny (E 330) Sacharyna sodowa (E 954)
Sodu benzoesan (E 211) Sodu pirosiarczyn (E 223) Aromat truskawkowy Woda oczyszczona
Ponieważ nie wykonano badań dotyczących zgodności, produktu leczniczego nie wolno mieszać z innymi lekami.
3 lata
Przechowywać w zamkniętym, oryginalnym opakowaniu w temperaturze poniżej 25°C. Nie zamrażać.
Butelka o pojemności 60 ml, zawierająca 50 g produktu, wykonana ze szkła barwnego sodowo- wapniowo-krzemianowego zamykana zakrętką polietylenową, w pudełku tekturowym. Do opakowania dołączona jest miarka (kieliszek) lub łyżka miarowa lub korek i strzykawka doustna 5 ml.
albo
Butelka o pojemności 100 ml, zawierająca 115 g produktu, wykonana ze szkła barwnego sodowo- wapniowo-krzemianowego zamykana zakrętką aluminiową, w pudełku tekturowym. Do opakowania dołączona jest miarka (kieliszek) lub łyżka miarowa.
albo
Butelka o pojemności 125 ml, zawierająca 150g produktu, wykonana ze szkła barwnego sodowo- wapniowo-krzemianowego, zamykana zakrętką aluminiową lub zakrętką polietylenową z korkiem, w pudełku tekturowym. Do opakowania dołączona jest łyżka miarowa lub korek i strzykawka doustna 5 ml.
Brak szczególnych wymagań.
„PRZEDSIĘBIORSTWO PRODUKCJI FARMACEUTYCZNEJ HASCO-LEK” S.A.
51-131 Wrocław, ul. Żmigrodzka 242 E
Pozwolenie nr 8299
25.09.2000 r. / 03.12.2008 r.











