Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY SUBSTANCJI CZYNNEJ
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
w kardiochirurgii (m.in. operacje pomostowania tętnic wieńcowych, chirurgiczne leczenie wad zastawkowych serca, itp.);
w ortopedii (endoprotezoplastyka stawów biodrowych, leczenie złamań otwartych);
w chirurgii wątroby i dróg żółciowych (m.in. cholecystektomia, operacje na drogach żółciowych);
w chirurgii głowy i szyi (chirurgia twarzowo-szczękowa, laryngologia);
w operacjach ginekologicznych i położniczych (cesarskie cięcie, histerektomia i in.).
Dawkowanie i sposób podawania
Zakażenia o umiarkowanym i ciężkim przebiegu - 500 mg do 1 g co 6 lub 8 godzin.
Zakażenia o średnio ciężkim przebiegu wywołane przez ziarenkowce Gram-dodatnie - 250 mg do 500 mg co 8 godzin.
Ciężkie niepowikłane zakażenia dróg moczowych - 1 g co 12 godzin.
Pneumokokowe zapalenie płuc - 500 mg co 12 godzin.
Ciężkie zagrażające życiu zakażenia (np. zapalenie wsierdzia, posocznica) - 1 g do 1,5 g co 6 godzin - najczęściej w skojarzeniu z antybiotykami aminoglikozydowymi.
Profilaktyka chirurgiczna: 1 g do 2 g dożylnie 30 minut do 1 godziny przed operacją, a następnie po operacji 1 g do 2 g co 6 do 8 godzin przez 24 godziny. W przedłużających się operacjach (powyżej 2 godzin) zaleca się podanie 500 mg lub 1 g podczas zabiegu.
U pacjentów, u których powikłania bakteryjne pola operacyjnego mogą stanowić szczególne
zagrożenie (np. operacja pomostowania aortalno-wieńcowego) zaleca się podawanie antybiotyku przez 3 do 5 dni.
Maksymalna dawka dobowa cefazoliny wynosi 12 g.
Dzieci
25 mg do 50 mg/kg mc. na dobę, w dawkach podzielonych, co 6 lub 8 godzin; w ciężkich zakażeniach dawkę można zwiększyć do 100 mg/kg mc. na dobę.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
z niewydolnością nerek (w dawkowaniu należy uwzględnić klirens kreatyniny);
z chorobami przewodu pokarmowego w wywiadzie, zwłaszcza z zapaleniem jelita grubego.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
TARFAZOLIN, 1 g, proszek do sporządzania roztworu do wstrzykiwań i infuzji
Jedna fiolka zawiera 1 g cefazoliny (Cefazolinum) w postaci cefazoliny sodowej.
Proszek do sporządzania roztworu do wstrzykiwań i infuzji Krystaliczny, biały lub prawie biały proszek.

Tarfazolin jest wskazany w leczeniu ciężkich zakażeń wywołanych przez drobnoustroje wrażliwe na cefazolinę.
Zakażenia dróg oddechowych Zakażenia dróg moczowych
Zakażenia skóry i tkanek miękkich Zakażenia kości i stawów
Zakażenia dróg żółciowych Posocznica
Zapalenie wsierdzia
W profilaktyce chirurgicznej:
Należy brać pod uwagę oficjalne wytyczne, dotyczące odpowiedniego stosowania leków przeciwbakteryjnych.
Wielkość dawki zależy od stopnia ciężkości zakażenia, wrażliwości drobnoustroju wywołującego zakażenie, stanu pacjenta, wieku i masy ciała.
Dorośli
Nie określono bezpieczeństwa stosowania cefazoliny u wcześniaków i noworodków (poniżej 1 miesiąca), dlatego nie zaleca się podawania antybiotyku w tej grupie wiekowej.
Dawkowanie w niewydolności nerek
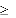
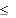
Wymagane zmiany dawkowania, uwzględniające klirens kreatyniny, należy zastosować po podaniu pierwszej, inicjującej dawki dostosowanej do ciężkości zakażenia i masy ciała.
Dorośli | ||
klirens kreatyniny ml/min | dawka | przerwa między dawkami |
55 | zmiana dawkowania nie jest konieczna | |
35 - 54 | zalecana dawka | co 8 godzin |
11 - 34 | 1/2 zalecanej dawki | co 12 godzin |
10 | 1/2 zalecanej dawki | co 18 - 24 godziny |
Dzieci klirens kreatyniny | dawka | przerwa między dawkami |
ml/min 70 - 40 | 60% zalecanej dawki | co 12 godzin |
40 - 20 | 25% zalecanej dawki | co 12 godzin |
20 - 5 | 10% zalecanej dawki | co 24 godziny |
Czas leczenia
Czas leczenia zależy od ciężkości i rodzaju zakażenia.
Cefazolinę należy podawać jeszcze przez co najmniej 2 do 3 dni po ustąpieniu objawów.
Sposób podawania
Tarfazolin można podawać domięśniowo lub dożylnie w postaci wstrzyknięć lub infuzji dożylnej.
Podanie domięśniowe
Roztwór cefazoliny należy podawać głęboko w mięsień pośladkowy lub boczną okolicę uda. Przed wstrzyknięciem leku należy dokonać aspiracji, w celu upewnienia się, czy igła nie znajduje się w naczyniu krwionośnym.
W celu zmniejszenia bólu lek należy wstrzykiwać w duże partie mięśniowe.
Podanie dożylne
W ciężkich zakażeniach, posocznicy oraz w zakażeniach zagrażających życiu cefazolinę zaleca się podawać dożylnie.
Lek należy wstrzykiwać do żyły powoli przez około 3 do 5 minut lub podawać we wlewie ciągłym. Sposób przygotowania roztworu podano w punkcie 6.6.
Nadwrażliwość na cefazolinę lub inne antybiotyki cefalosporynowe.
Pacjenci uczuleni na penicyliny mogą być również uczuleni na cefalosporyny (częściowa alergia krzyżowa).
Przed podaniem pacjentowi cefazoliny należy przeprowadzić dokładny wywiad dotyczący skłonności do reakcji nadwrażliwości na penicyliny, cefalosporyny lub inne alergeny.
Bardzo rzadko w czasie leczenia cefazoliną mogą wystąpić ciężkie objawy nadwrażliwości w postaci reakcji anafilaktycznej. Większe prawdopodobieństwo takiej reakcji występuje po podaniu
antybiotyku drogą parenteralną, u pacjentów ze skłonnością do reakcji alergicznych na wiele różnych substancji oraz u pacjentów, u których w przeszłości występowały objawy nadwrażliwości, zwłaszcza na inne leki.
W przypadku wystąpienia ostrych postaci reakcji alergicznych po podaniu cefazoliny, antybiotyk
należy natychmiast odstawić i podawać leki przeciwhistaminowe, kortykosteroidy oraz - w przypadku wstrząsu anafilaktycznego i obrzęku naczynioruchowego o ciężkim przebiegu - epinefrynę. Należy również monitorować podstawowe czynności życiowe (oddech, tętno, ciśnienie tętnicze krwi).
W przypadku pojawienia się wysypki u pacjentów leczonych cefazoliną, należy zmienić antybiotyk.
Cefazolina u niektórych pacjentów może wydłużać czas protrombinowy. U pacjentów z upośledzoną syntezą witaminy K lub jej niedoborem (np. przewlekłe choroby wątroby, niewydolność nerek,
niedożywienie) konieczne jest kontrolowanie czasu protrombinowego. W przypadku wydłużania się czasu protrombinowego należy podawać witaminę K.
Lek należy ostrożnie podawać pacjentom:
Jeśli wystąpi ciężka, uporczywa biegunka, należy wziąć pod uwagę możliwość rzekomobłoniastego zapalenia okrężnicy (w większości przypadków wywołanego przez Clostridium difficile). W takim przypadku należy przerwać stosowanie cefazoliny i rozpocząć odpowiednie leczenie. Podawanie środków hamujących perystaltykę jest przeciwwskazane.
Długotrwałe podawanie antybiotyków może być przyczyną nadmiernego rozwoju niewrażliwych bakterii lub grzybów. W przypadku pojawienia się nowych zakażeń grzybiczych lub bakteryjnych podczas leczenia cefazoliną, lek należy natychmiast odstawić i wdrożyć odpowiednie leczenie.
Probenecyd podany jednocześnie z cefazoliną zmniejsza wydalanie leku przez kanaliki nerkowe co prowadzi do dłuższego utrzymywania się podwyższonego stężenia leku w surowicy krwi.
Łączne podawanie cefalosporyn z antybiotykami aminoglikozydowymi niekiedy może być przyczyną wystąpienia objawów nefrotoksyczności.
U pacjentów leczonych cefazoliną mogą wystąpić fałszywie dodatnie wyniki testów redukcyjnych wykrywających cukry w moczu, dlatego w przypadku konieczności wykonania takiego oznaczenia zaleca się wykonywanie testów enzymatycznych.
U pacjentów leczonych cefazoliną, jak również u noworodków, których matki otrzymywały cefazolinę przed porodem, wyniki bezpośrednich jak i pośrednich testów antyglobulinowych (testy Coombs’a) mogą dawać fałszywie dodatnie wyniki.
Ciąża
Z uwagi na brak odpowiednio liczebnych, dobrze kontrolowanych badań u kobiet w ciąży, lek może być stosowany u tych pacjentek jedynie w przypadku zdecydowanej konieczności.
Karmienie piersią
Podczas podawania cefazoliny kobietom w okresie karmienia piersią należy zachować ostrożność.
Płodność
Badania przeprowadzone na szczurach, myszach i królikach nie wykazały teratogennego działania cefazoliny. Antybiotyk nie wpływał na płodność, ani nie powodował uszkodzenia płodu.
Brak danych dotyczących wpływu cefazoliny na zdolność prowadzenia pojazdów i obsługiwania urządzeń mechanicznych.
Częstość działań niepożądanych pojawiających się po zastosowaniu produktu leczniczego określana jest następująco:
bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100),
rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych)
Zakażenia i zarażenia pasożytnicze:
rzadko: grzybica jamy ustnej
częstość nieznana: grzybica narządów płciowych
Zaburzenia krwi i układu chłonnego:
częstość nieznana: neutropenia, leukopenia, małopłytkowość, trombocytoza
Reakcje nadwrażliwości
Zaburzenia układu immunologicznego:
częstość nieznana: wstrząs anafilaktyczny, eozynofilia, gorączka polekowa
Zaburzenia skóry i tkanki podskórnej:
częstość nieznana: wysypki, swędzenie, zespół Stevensa-Johnsona
Zaburzenia żołądka i jelit
rzadko: biegunka, nudności, wymioty, anoreksja, skurcze żołądka
bardzo rzadko: rzekomobłoniaste zapalenie jelita grubego - może pojawić się podczas trwania lub po zakończeniu terapii
Zaburzenia wątroby i dróg żółciowych
bardzo rzadko: zapalenie wątroby
częstość nieznana: niewielkie, przemijające zwiększenie aktywności aminotransferazy asparaginianowej, alaninowej, fosfatazy alkalicznej
Zaburzenia nerek i dróg moczowych
bardzo rzadko: przejściowy wzrost stężenia azotu mocznikowego, kreatyniny w surowicy
Zaburzenia ogólne i stany w miejscu podania
niezbyt często: zaczerwienienie, ból w miejscu domięśniowego wstrzyknięcia leku
rzadko: zakrzepowe zapalenie żyły w miejscu wstrzyknięcia
Przedawkowanie cefazoliny może doprowadzić do nasilenia działań niepożądanych łącznie z podrażnieniem ośrodkowego układu nerwowego i wystąpienia drgawek, zwłaszcza u pacjentów z niewydolnością nerek.
W przypadku przedawkowania należy przerwać podawanie leku, zastosować leczenie objawowe i w razie konieczności monitorować podstawowe czynności życiowe (oddech, tętno, ciśnienie tętnicze krwi).
Grupa farmakoterapeutyczna: leki przeciwbakteryjne do stosowania ogólnego, cefalosporyna pierwszej generacji.
Kod ATC: J01DB04
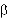
Cefazolina jest półsyntetyczną cefalosporyną I generacji. Antybiotyk ten charakteryzuje się opornością na wiele -laktamaz wytwarzanych przez szczepy oporne na penicyliny.
Mechanizm działania bakteriobójczego cefazoliny polega na blokowaniu końcowego etapu
biosyntezy ściany komórkowej bakterii. Miejscem docelowego działania antybiotyku są białka wiążące penicyliny (PBP), zlokalizowane w błonie protoplazmatycznej. Białka te pełnią funkcje
enzymatyczne (transpeptydazy, karboksydazy) w syntezie ściany komórkowej bakterii. Związanie się cefazoliny z PBP o aktywności transpeptydazy hamuje tworzenie wiązań pomiędzy pentapeptydami mukopolisacharydu ściany komórkowej bakterii. W dalszym etapie, na skutek aktywacji enzymów
autolitycznych (hydrolaz) dochodzi do osmolizy komórki bakteryjnej.
Cefazolina in vitro i in vivo działa bakteriobójczo na:
Bakterie Gram-dodatnie: Staphylococcus aureus (w tym szczepy wytwarzające penicylinazę), Staphylococcus epidermidis - gronkowce oporne na metycylinę są z reguły oporne na cefazolinę. Paciorkowce z wyjątkiem szczepów Enterococcus, Streptococcus pneumoniae.
Bakterie Gram-ujemne: Escherichia coli, Proteus mirabilis, Klebsiella spp., Enterobacter aerogenes, Haemophilus influenzae.
Wchłanianie
Cefazolina podawana jest pozajelitowo.
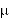
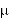
Po domięśniowym podaniu leku w dawce 500 mg lub 1 g maksymalne stężenie cefazoliny w
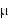
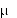
surowicy krwi występuje po 1 godzinie i wynosi odpowiednio 37 g/ml lub 64 g/ml, zaś stężenie po 8 godzinach - 3 g/ml lub 7 g/ml.
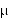
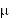
Po dożylnym podaniu w dawce 1 g cefazolina osiąga maksymalne stężenie w surowicy krwi - 185
g/ml - po mniej-więcej 5 minutach, a po 8 godzinach stężenie antybiotyku wynosi około 4 g/ml. Maksymalne stężenie cefazoliny w moczu po dożylnym podaniu dawki 500 mg lub 1 g wynosi odpowiednio 2,4 mg/ml lub 4 mg/ml.
Dystrybucja
Cefazolina wiąże się z białkami surowicy w około 75-86%.
Cefazolina dobrze penetruje do jamy opłucnowej, jamy otrzewnowej, płynu stawowego, żółci, kości i moczu. Antybiotyk przenika przez łożysko, jednak stężenie we krwi płodu jest niewielkie. Do mleka kobiecego cefazolina przenika w niewielkich ilościach.
Cefazolina nie przenika do płynu mózgowo-rdzeniowego, podobnie jak wszystkie cefalosporyny I generacji.
Eliminacja
Okres półtrwania cefazoliny po dożylnym podaniu wynosi około 1,8 godziny, a po domięśniowym – około 2 godzin.
Antybiotyk wydalany jest w około 90% w postaci aktywnej z moczem, głównie w procesie
przesączania kłębuszkowego i w mniejszym stopniu poprzez wydzielanie kanalikowe. Około 60% podanej dawki leku zostaje wydalone w pierwszych sześciu godzinach.
Długookresowe badania na zwierzętach dotyczące rakotwórczych i mutagennych właściwości cefazoliny nie zostały przeprowadzone.
Brak
Cefazoliny nie należy mieszać w jednej strzykawce z innymi lekami.
2 lata
Po otwarciu fiolki i przygotowaniu roztworu
Roztwory przygotowane do wstrzyknięć domięśniowych należy zużyć bezpośrednio po przygotowaniu.
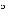
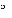
Roztwory przygotowane do wstrzykiwań i infuzji dożylnych zachowują trwałość przez 24 godziny w temperaturze 2 C do 8 C (lodówka).
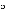
Przechowywać w temperaturze poniżej 25 C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Warunki przechowywania produktu leczniczego po przygotowaniu roztworu, patrz punkt 6.3.
Fiolki szklane z gumowym korkiem i aluminiowym kapslem, w tekturowym pudełku 1 fiolka
Wszelkie resztki niewykorzystanego produktu lub jego odpady należy usunąć w sposób zgodny z lokalnymi przepisami.
Przygotowanie roztworów
Wstrzyknięcia domięśniowe
Zawartość fiolki 1 g rozpuścić w około 3 ml wody do wstrzykiwań. Przed użyciem delikatnie wstrząsnąć.
Wstrzykiwać głęboko, w duże partie mięśniowe.
Roztwory przygotowane do wstrzyknięć domięśniowych należy zużyć bezpośrednio po przygotowaniu.
Wstrzyknięcia dożylne
Zawartość fiolki 1 g rozpuścić w co najmniej 10 ml wody do wstrzykiwań. Przed użyciem delikatnie wstrząsnąć.
Wstrzykiwać powoli, przez około 3 do 5 minut.
Infuzje dożylne
Roztwór przygotowany tak jak do wstrzykiwań dożylnych rozcieńczyć w 50 do 100 ml roztworu glukozy 5% lub 10%, płynu Ringera lub roztworu chlorku sodu 0,9% i przetaczać do dużych naczyń żylnych.
Roztwory przygotowane do wstrzykiwań i wlewów dożylnych zachowują trwałość przez 24 godziny w temperaturze 2 C do 8 C (lodówka).
Zmiana zabarwienia roztworu do żółtego (słomkowego) nie ma wpływu na aktywność ani na właściwości preparatu.
Tarchomińskie Zakłady Farmaceutyczne „Polfa” Spółka Akcyjna ul. A. Fleminga 2
03-176 Warszawa
Pozwolenie nr 8414
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 17.11.2000 r. Data ostatniego przedłużenia pozwolenia: 20.03.2008 r.











