Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDLUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi lekami i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDLUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Iberogast, płyn doustny
100 ml płynu zawiera: | ||
Iberis amara herbae extractum | (1: 1,5-2,5) | 15,0 ml |
ekstrahent–etanol 50% (v/v) | ||
Angelicae radicis extractum | (1: 2.5 - 3,5) | 10,0 ml |
ekstrahent - etanol 30% (v/v) | ||
Matricariae flos extractum | (1: 2 - 4) | 20,0 ml |
ekstrahent–etanol 30% (v/v) | ||
Carvi fructus extractum | (1: 2,5 - 3,5) | 10,0 ml |
ekstrahent - etanol 30% (v/v) | ||
Silybi mariani fructus extractum | (1: 2,5 - 3,5) | 10,0 ml |
ekstrahent - etano1 30% (v/v) | ||
Melissae folii extractum | (1 :2,5 - 3,5) | 10,0 ml |
ekstrahent - etanol 30% (v/v) | ||
Menthae piperitae folii extractum | (1: 2,5 - 3,5) | 5,0 ml |
ekstrahent - etanol 30% (v/v) | ||
Chelidonii herbae extractum | (1 :2,5 - 3,5) | 10,0 ml |
ekstrahent - etanol 30% (v/v) | ||
Liquiritiae radicis extractum | (1 :2,5 - 3,5) | 10,0 ml |
ekstrahent - etanol 30% (v/v) | ||
Lek Iberogast zawiera 29,5-32,6% (v/v) etanolu.
Płyn doustny
Leczenie zaburzeń czynnościowych związanych z motoryką przewodu pokarmowego, takich jak dyspepsja czynnościowa czy zespół jelita nadwrażliwego. Zaburzenia te objawiają się głównie
dolegliwościami skurczowymi jamy brzusznej i jelit, bólem brzucha, uczuciem pełności, wzdęciami, nudnościami i zgagą.
Dawkowanie
Jeśli lekarz nie zaleci inaczej, Iberogast przyjmuje się 3 razy na dobę w niewielkiej ilości płynu przed lub w czasie posiłków.
Dorośli i młodzież w wieku powyżej 12 lat: 20 kropli. Dzieci w wieku od 6 do 12 lat: 15 kropli.
Dzieci w wieku poniżej 6 lat: nie zaleca się stosowania.
Sposób podawania
Podanie doustne.
Wstrząsnąć przed użyciem.
Obecność osadu czy zmętnienia nie wpływa na skuteczność płynu Iberogast. Instrukcja pierwszego użycia kroplomierza
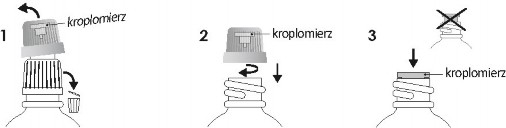
Odkręcić biało- zieloną zakrętkę i wyrzuć białą jej część. | Zakręcić zieloną zakrętkę do oporu, aby umieścić kroplomierz w butelce. | Upewnić się, że kroplomierz jest dobrze włożony. |
Podczas dozowania trzymać butelkę z kroplomierzem pod kątem 45°. Po użyciu szczelnie zamknąć zieloną zakrętką.
Czas stosowania
Nie ma ograniczeń dotyczących czasu stosowania.
W przypadku nie ustępowania dolegliwości po 7 dniach stosowania leku, należy zasięgnąć porady lekarza na temat ich przyczyny.
Nie należy stosować w przypadku nadwrażliwości na którykolwiek ze składników produktu leczniczego Iberogast.
Nie stosować produktu leczniczego, jeśli u pacjenta występuje lub występowała w przeszłości choroba wątroby lub jeśli pacjent jednocześnie przyjmuje inne produkty lecznicze, które mogą powodować uszkodzenie wątroby.
Podczas stosowania produktu leczniczego Iberogast notowano przypadki polekowego uszkodzenia wątroby (patrz również punkt 4.8).
W razie wystąpienia objawów uszkodzenia wątroby (takich jak zażółcenie skóry lub oczu, ciemny mocz, odbarwiony stolec, ból w nadbrzuszu) należy natychmiast przerwać leczenie i skontaktować się z lekarzem.
Dzieci:
Nie zaleca się podawania dzieciom w wieku poniżej 6 lat. U dzieci w wieku poniżej 6 lat każdy ból brzucha powinien być konsultowany z lekarzem.
Pacjentom należy również zalecić konsultację lekarską, jeśli objawy utrzymują się lub jeśli w ciągu 7 dni leczenia nie nastąpi oczekiwana poprawa.
Produkt leczniczy Iberogast zawiera etanol w stężeniu objętościowym wynoszącym ok. 31%. Dawka jednorazowa dla dorosłych (20 kropli) zawiera do 240 mg etanolu, co odpowiada 6,2 ml piwa lub 2,6 ml wina na dawkę.
Ze względu na zawartość alkoholu Iberogast nie jest przeznaczony i nie powinien być stosowany przez pacjentów z chorobą alkoholową.
Kobiety w ciąży lub karmiące piersią, dzieci oraz osoby z grup wysokiego ryzyka, do których zalicza się np. pacjentów z chorobami wątroby lub padaczką powinni skonsultować się z lekarzem przed rozpoczęciem stosowania produktu leczniczego Iberogast.
Dotychczas nie są znane. Badania interakcji produktu Iberogast nie były prowadzone.
Brak danych lub istnieją tylko ograniczone dane (mniej niż 300 kobiet w ciąży) dotyczące stosowania produktu leczniczego Iberogast u kobiet w okresie ciąży.
Badania na zwierzętach nie wykazały bezpośredniego lub pośredniego szkodliwego wpływu na reprodukcję (patrz punkt 5.3).
W celu zachowania ostrożności zaleca się unikanie stosowania produktu Iberogast w okresie ciąży. Brak wystarczających danych dotyczących przenikania produktu leczniczego Iberogast/metabolitów do mleka ludzkiego.
Nie można wykluczyć zagrożenia dla dzieci karmionych piersią.
Należy podjąć decyzję czy przerwać karmienie piersią czy przerwać podawanie produktu Iberogast biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla matki.
Pojedyncza dawka dla dorosłych zawiera do 240 mg alkoholu (etanolu). Patrz punkt 4.4. Iberogast nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane są przedstawione poniżej zgodnie z klasyfikacją układów i narządów MedDRA i następującą konwencją dotyczącą częstości: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Częstość | Działanie niepożądane |
Zaburzenia układu immunologicznego | Bardzo rzadko | Reakcje nadwrażliwości, takie jak np. reakcje skórne, świąd, duszność, mogą pojawić się u predysponowanych pacjentów. |
Zaburzenia wątroby i dróg żółciowych | Nieznana | Polekowe uszkodzenie wątroby*. |
* Podczas stosowania produktu leczniczego Iberogast notowano przypadki polekowego uszkodzenia wątroby (zwiększenie aktywności enzymów wątrobowych i stężenia bilirubiny, aż do wystąpienia żółtaczki polekowej, oraz przypadki niewydolności wątroby).
W sytuacji wystąpienia tych działań niepożądanych należy przerwać leczenie produktem Iberogast.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel: + 48 22 49 21 301
Fax: + 48 22 49 21 309
strona internetowa: https://smz.ezdrowie.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dotychczas nie stwierdzono objawów przedawkowania w badaniach toksyczności po podaniu jednorazowym lub po podawaniu wielokrotnym u różnych gatunków zwierząt ani też nie
zaobserwowano ich u ludzi w ciągu wielu lat dotychczasowego stosowania.
Grupa farmakoterapeutyczna: Iberogast jest lekiem roślinnym do stosowania w zaburzeniach żołądkowo-jelitowych.
Kod ATC: A 03
Produkt złożony Iberogast wykazuje dwukierunkowe działanie zarówno w testach in vitro jak i w badaniach prowadzonych na różnych odcinkach przewodu pokarmowego (żołądek i jelita) u zwierząt. Iberogast zwiększa napięcie podstawowe, szczególnie z powodu zawartości składnika Iberis amara, w odcinkach niepobudzonych lub słabo pobudzonych i wówczas ulegają złagodzeniu objawy uczucia pełności i wzdęcia.
Składniki o właściwościach rozkurczających z innych wyciągów roślinnych zawartych w leku Iberogast wywierają działanie w zbyt silnie pobudzonych częściach żołądka i jelit, co prowadzi do osłabienia skurczu.
Ponadto, Iberogast zmniejsza in vivo wrażliwość aferentną jelita na bodźce indukowane przez rozciągnięcie jelit i serotoninę.
Działanie takie może być tłumaczone wiązaniem różnych składników produktu leczniczego Iberogast z receptorami serotoninowymi i częściowo muskarynowymi i opioidowymi.
Iberogast zwiększa również stężenie chroniących błonę śluzową prostaglandyn i mucyny, obniża stężenie niszczących błonę śluzową leukotrienów i hamuje wydzielanie soku żołądkowego przez komórki okładzinowe żołądka.
Ponadto Iberogast posiada właściwości przeciwzapalne przypisywane hamowaniu enzymu 5-lipoksygenazy, a także działanie wiatropędne, przeciwutleniające i przeciwbakteryjne.
Ze względu na różnorodne i wzajemnie uzupełniające się mechanizmy działania wyciągów roślinnych wchodzących w skład produktu, Iberogast spełnia kryteria leku o aktywności wielokierunkowej.
Dla kilku składników wykazano szybkie wchłanianie w obrębie żołądka i jelit. Z badań toksykologicznych po wielokrotnym podaniu przez okres do 6 miesięcy można wywnioskować, że składniki czynne produktu leczniczego Iberogast nie kumulują się.
Przeprowadzono szerokie badania toksyczności ostrej, podostrej i przewlekłej (3 i 6 miesięcy) na dwóch gatunkach zwierząt. Badano również wpływ na reprodukcję, rozwój embrionalny,
przedurodzeniowy i pourodzeniowy, a także właściwości mutagenne w dawkach przekraczających zalecane do 1200 razy. Wyniki badań nie wskazują na występowanie żadnego z wymienionych
potencjałów ryzyka u ludzi.
Brak
Nie dotyczy
2 lata
Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 8 tygodni. Obecność osadu czy zmętnienia nie wpływa na skuteczność płynu Iberogast.
Nie stosować tego leku, po upływie terminu ważności zamieszczonego na butelce i opakowaniu zewnętrznym.
Nie przechowywać w temperaturze powyżej 25°C.
Butelka z brunatnego szkła z biało-zieloną zakrętką polietylenową, z zabezpieczeniem gwarancyjnym, aluminiową wkładką i kroplomierzem, w tekturowym pudełku.
Opakowanie zawiera 20 ml, 50 ml lub 100 ml płynu Iberogast.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Bayer Sp. z o.o.
Al. Jerozolimskie 158
02-326 Warszawa
10487
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 27 kwietnia 2004 Data ostatniego przedłużenia pozwolenia: 27 luty 2015











