Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/ DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
bóle głowy;
bóle zębów;
bóle związane z ząbkowaniem;
bóle po zabiegach stomatologicznych i chirurgicznych;
bóle mięśniowe, bóle kostno-stawowe.
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Ciężka niewydolność wątroby lub nerek
Wirusowe zapalenie wątroby
Choroba alkoholowa
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/ DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Paracetamol Aflofarm, 120 mg/5 ml, zawiesina doustna
5 ml zawiesiny doustnej zawiera 120 mg paracetamolu (Paracetamolum). Substancje pomocnicze o znanym działaniu: czerwień koszenilowa, sacharoza. Pełny wykaz substancji pomocniczych, patrz pkt. 6.1.
Zawiesina doustna
Płynna zawiesina o barwie różowo-czerwonej, o truskawkowym smaku i zapachu.
Gorączka, np. w przebiegu przeziębienia i grypy.
Bóle różnego pochodzenia o małym i umiarkowanym nasileniu:
Podanie doustne.
Do dawkowania leku należy używać miarki dołączonej do opakowania. Umożliwia to odmierzanie dokładnej dawki.
Dawkę ustala się wg masy ciała dziecka (przeciętnie jednorazowo 10 do 15 mg/kg mc.) lub wg poniższego schematu.
Dzieci w wieku od 3 m. ż. do 12 m. ż.: 2,5 do 5 ml (60 do 120 mg paracetamolu) w wieku od 1 do 6 lat: 5 do 10 ml (120 do 240 mg paracetamolu)
w wieku od 6 do 12 lat: 10 do 20 ml (240 do 480 mg paracetamolu).
Nie należy podawać produktu leczniczego częściej niż co 4 godziny, maksymalnie do 4 dawek na dobę. Nie przekraczać dawki 60 mg paracetamolu/kg mc. /24 godz..
Stosowanie u dzieci poniżej 2 lat powinno być zalecone przez lekarza. Nie podawać dzieciom dłużej niż 3 dni bez porozumienia z lekarzem.
Produkt leczniczy nie powinien być stosowany bez porozumienia z lekarzem dłużej niż 10 dni w przypadku dolegliwości bólowych, 3 dni w przypadku utrzymującej się gorączki i 2 dni
w przypadku objawów przeziębienia.
Produkt leczniczy zawiera paracetamol. Ze względu na ryzyko przedawkowania przed zastosowaniem należy sprawdzić czy inne przyjmowane leki nie zawierają paracetamolu.
W trakcie stosowania produktu leczniczego nie należy pić alkoholu z powodu ryzyka wystąpienia toksycznego uszkodzenia wątroby. Szczególne ryzyko uszkodzenia wątroby istnieje u osób głodzonych i regularnie spożywających alkohol.
Paracetamol należy stosować ostrożnie u pacjentów uczulonych na kwas acetylosalicylowy (mniej niż 5% pacjentów uczulonych na kwas acetylosalicylowy wykazuje również objawy nadwrażliwości na paracetamol), u pacjentów z niewydolnością nerek lub wątroby. Paracetamol może powodować hemolizę u osób z niedoborem dehydrogenazy glukozo-6-fosforanowej.
Paracetamol może wpływać na wyniki niektórych badań laboratoryjnych, tj. oznaczenie glukozy
w surowicy krwi metodą oksydaza/peroksydaza, oznaczanie kwasu 5-hydroksyindoilooctowego (5- HIAA) z odczynnikiem nitrozonaftolowym, wyniki testu z benitromidem oraz oznaczanie stężenia kwasu moczowego w surowicy – reakcja z kwasem fosforowolframowym.
Specjalne ostrzeżenia dotyczące substancji pomocniczych
Produkt leczniczy zawiera sacharozę. Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy, zespołem złego wchłaniania glukozy-galaktozy lub niedoborem sacharazy– izomaltazy, nie powinni przyjmować produktu leczniczego.
Produkt leczniczy zawiera czerwień koszenilową, która może powodować reakcje alergiczne.
Metoklopramid przyspiesza wchłanianie paracetamolu z przewodu pokarmowego.
Leki opóźniające opróżnianie żołądka (np. propantelina) mogą opóźniać wchłanianie paracetamolu. Równoczesne stosowanie paracetamolu i leków zwiększających metabolizm wątrobowy, tj. niektóre leki nasenne lub leki przeciwpadaczkowe np. fenobarbital, fenytoina, karbamazepina, jak również ryfampicyna może prowadzić do uszkodzenia wątroby, nawet podczas stosowania zalecanych dawek paracetamolu.
Paracetamol może nasilać toksyczne działanie zydowudyny (AZT) na szpik kostny.
Paracetamol nasila działanie leków przeciwzakrzepowych z grupy kumaryny i indandionu. Długotrwałe stosowanie paracetamolu jednocześnie z niesteroidowymi lekami przeciwzapalnymi zwiększa ryzyko uszkodzenia nerek, raka nerki lub pęcherza moczowego.
Stosowanie paracetamolu jednocześnie z inhibitorami MAO oraz w okresie 2 tygodni po zakończeniu leczenia tymi lekami, może wywołać stan pobudzenia i wysoką gorączkę.
Picie alkoholu podczas leczenia paracetamolem prowadzi do powstania toksycznego metabolitu, wywołującego martwicę komórek wątrobowych, co w następstwie może doprowadzić do
niewydolności wątroby.
Kofeina nasila przeciwbólowe działanie paracetamolu.
Ciąża
Paracetamol przenika przez łożysko. W przeprowadzonych dotychczas badaniach u kobiet ciężarnych nie stwierdzono niekorzystnego wpływu paracetamolu na płód, stosowanego w zalecanych dawkach.
Karmienie piersią
Paracetamol przenika do mleka w małych ilościach.
Z dostępnych danych wynika, że karmienie piersią nie jest przeciwwskazaniem do zastosowania paracetamolu.
Paracetamol może być stosowany w okresie ciąży i karmienia piersią w razie zdecydowanej konieczności.
Produkt leczniczy nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane uszeregowano zgodnie z częstością występowania określoną następująco Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥ 1/1 000 do <1/100), rzadko
(≥ 1/10 000 do <1/1 000), bardzo rzadko (<1/10 000).
Zaburzenia skóry i tkanki podskórnej
Rzadko: świąd, pokrzywka, wysypka i rumień, obrzęk naczynioruchowy, duszność, pocenie się.
Zaburzenia naczyniowe
Rzadko: obniżenie ciśnienia tętniczego krwi, aż do objawów wstrząsu.
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia Rzadko: napad astmy oskrzelowej.
Zaburzenia krwi i układu chłonnego
Bardzo rzadko: granulocytopenia, agranulocytoza, małopłytkowość, methemoglobinemia.
Zaburzenia żołądka i jelit Rzadko: nudności, wymioty.
Zaburzenia wątroby i dróg żółciowych Rzadko: objawy uszkodzenia wątroby.
Zaburzenia nerek i dróg moczowych
Bardzo rzadko: kolka nerkowa, martwica brodawek nerkowych, ostra niewydolność nerek.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
{aktualny adres, nr telefonu i faksu ww. Departamentu} e-mail: adr@urpl.gov.pl.
Przypadkowe lub zamierzone przedawkowanie paracetamolu może spowodować w ciągu kilku, kilkunastu godzin objawy takie jak: nudności, wymioty, nadmierne pocenie się, senność i ogólne osłabienie. Objawy te mogą ustąpić następnego dnia, pomimo że zaczyna się rozwijać uszkodzenie wątroby, które daje o sobie znać rozpieraniem w nadbrzuszu, powrotem nudności i żółtaczką.
W każdym przypadku przyjęcia jednorazowo paracetamolu w dawce 5 g lub większej należy sprowokować wymioty, jeśli od zażycia nie upłynęła więcej niż godzina. Należy podać doustnie 60 do 100 g węgla aktywowanego, najlepiej rozmieszanego z wodą. Wiarygodnej oceny ciężkości zatrucia dostarcza oznaczenie stężenia paracetamolu we krwi. Wartość tego stężenia w stosunku do czasu, jaki
upłynął od zażycia paracetamolu jest wartościową wskazówką, czy i jak intensywne leczenie odtrutkami będzie konieczne. Jeżeli oznaczenie stężenia paracetamolu we krwi nie jest możliwe, a prawdopodobna przyjęta dawka paracetamolu była duża, należy wdrożyć bardziej intensywne leczenie odtrutkami: należy podać 2,5 g metioniny i kontynuować leczenie acetylocysteiną lub
(i) mietioniną, które są bardzo skuteczne w pierwszych 10-12 godzinach od zatrucia, ale
prawdopodobnie są także skuteczne po 24 godzinach. Leczenie zatrucia paracetamolem powinno odbywać się w szpitalu, w warunkach oddziału intensywnej terapii.
Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe; anilidy. Kod ATC: N 02 BE 01
Paracetamol wykazuje działanie przeciwbólowe i przeciwgorączkowe oraz niewielką aktywność przeciwzapalną. Jest aktywnym metabolitem fenacetyny o znacznie mniejszej toksyczności.
Paracetamol poprzez hamowanie cyklooksygenazy kwasu arachidonowego, hamuje syntezę prostaglandyn w ośrodkowym układzie nerwowym. Skutkiem tego działania jest zmniejszenie
wrażliwości na działanie takich mediatorów jak kininy i serotonina, co powoduje podwyższenie progu bólowego.
Zmniejszenie stężenia prostaglandyn w podwzgórzu odpowiedzialne jest za działanie przeciwgorączkowe paracetamolu. Paracetamol nie wpływa na agregację płytek krwi.
Wchłanianie
Paracetamol szybko i prawie w całości wchłania się z przewodu pokarmowego. Wchłanianie może być zmniejszone, gdy jest przyjmowany po posiłku zawierającym duże ilości węglowodanów.
Stężenie maksymalne w surowicy paracetamol osiąga w ciągu 0,5-2 godzin od podania.
Dystrybucja
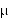
Paracetamol wiąże się z białkami krwi w 25-50%. Przenika przez łożysko, a także do mleka gdzie osiąga stężenie 10-15 g/ml w czasie 1 do 2 godzin po jednorazowym podaniu w dawce 650 mg. Okres półtrwania w mleku wynosi 1,35 do 3,5 godziny.
Objętość dystrybucji paracetamolu wynosi 0,83-1,36 l/kg.
Metabolizm
Paracetamol jest metabolizowany głównie w wątrobie. Tylko niewielka jego część (2-4%) wydalana jest w postaci niezmienionej przez nerki. Głównym metabolitem paracetamolu (ok. 90%) u dorosłych jest połączenie z kwasem glukuronowym, a u dzieci także z siarkowym (oba metabolity są
nieaktywne). Powstający w niewielkiej ilości (ok. 5%) hepatotoksyczny metabolit pośredni:
N-acetylo-p-benzochinoimina, jest sprzęgany z wątrobowym glutationem, a następnie w połączeniu z cysteiną i kwasem merkapturowym wydalany jest z moczem.
Eliminacja
Okres półtrwania paracetamolu wynosi 2–4 godzin. Wydalany jest z moczem. Około 5% podanej dawki leku wydalone zostaje w postaci niezmienionej. W niewydolności wątroby okres półtrwania paracetamolu może wydłużyć się nawet do 17 godzin. Istnieją doniesienia, że w podeszłym wieku także dochodzi do wydłużenia okresu półtrwania paracetamolu.
Paracetamol w dawkach od 4 do 20-krotnie większych niż maksymalna dopuszczalna dawka dobowa nie wywoływał działania teratogennego u myszy ani u szczurów, obserwowano natomiast zanik jąder i zaburzenia spermatogenezy u szczurów.
Polisorbat 80 Sacharoza Guma ksantan
Sacharyna sodowa Sodu benzoesan
Kwas cytrynowy bezwodny Czerwień koszenilowa (E 124)
Substancja poprawiająca smak i zapach truskawkowa (AR 0012/F) Woda oczyszczona
Nie dotyczy.
3 lata
Przechowywać w temperaturze poniżej 25 °C. Nie zamrażać. Przechowywać w oryginalnym opakowaniu.
Butelka ze szkła brunatnego, z zakrętką aluminiową białą z miarką w tekturowym pudełku. 1 butelka po 100 ml
Bez specjalnych wymagań.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Aflofarm Farmacja Polska Sp. z o.o. ul. Partyzancka 133/151
95-200 Pabianice
Tel.: (42) 22-53-100
Pozwolenie nr 10761
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 30.04.2004 r. Data ostatniego przedłużenia pozwolenia: 11.12.2008 r.











