Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
gorączka ≥ 40,0ºC w ciągu 48 godzin po podaniu szczepionki, niewywołana przez jakikolwiek, możliwy do zidentyfikowania czynnik;
zapaść lub stan podobny do wstrząsu (epizod hipotensyjno – hiporeaktywny) w ciągu 48 godzin
po szczepieniu;
długotrwały, nieustanny płacz trwający ≥ 3 godzin, pojawiający się w ciągu 48 godzin po
szczepieniu;
drgawki przebiegające z gorączką lub bez gorączki, występujące w ciągu 3 dni po szczepieniu.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Infanrix-IPV, zawiesina do wstrzykiwań w ampułkostrzykawce
Szczepionka przeciw błonicy, tężcowi, krztuścowi (bezkomórkowa, złożona) i poliomyelitis (inaktywowana), adsorbowana
1 dawka (0,5 ml) zawiera:
Toksoid błoniczy1 nie mniej niż 30 j.m.
Toksoid tężcowy1 nie mniej niż 40 j.m.
Antygeny Bordetella pertussis
Toksoid krztuścowy1 25 mikrogramów
Hemaglutynina włókienkowa1 25 mikrogramów
Pertaktyna1 8 mikrogramów
Poliowirus (inaktywowany)2
typ 1 (szczep Mahoney) 40 jednostek antygenu D
typ 2 (szczep MEF-1) 8 jednostek antygenu D
typ 3 (szczep Saukett) 32 jednostki antygenu D
1 adsorbowane na wodorotlenku glinu, uwodnionym 0,5 miligrama Al3+ 2 namnażane w hodowli komórkowej VERO
Szczepionka może zawierać śladowe ilości formaldehydu, neomycyny i polimyksyny, które są używane w procesie wytwarzania (patrz punkt 4.3).
Substancje pomocnicze o znanym działaniu
Szczepionka zawiera < 0,07 nanograma kwasu para-aminobenzoesowego w każdej dawce i 0,036 mikrograma fenyloalaniny w każdej dawce (patrz punkt 4.4).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zawiesina do wstrzykiwań w ampułkostrzykawce.
Infanrix-IPV jest mętną, białą zawiesiną.
Szczepionka jest wskazana do szczepienia uzupełniającego i przypominającego przeciwko błonicy, tężcowi, krztuścowi i poliomyelitis u dzieci w wieku od 16 miesięcy do 13 lat włącznie, które otrzymały uprzednio szczepienie pierwotne przeciw tym chorobom.
Stosowanie szczepionki Infanrix-IPV powinno być zgodne z oficjalnie obowiązującymi zaleceniami.
Dawkowanie
Należy podać pojedynczą dawkę (0,5 ml) szczepionki.
Infanrix-IPV może być stosowany u dzieci, które wcześniej otrzymały szczepionki zawierające pełnokomórkową lub acelularną składową krztuśca oraz szczepionki przeciwko poliomyelitis doustne zawierające żywe, atenuowane wirusy lub w postaci wstrzyknięć zawierające inaktywowane wirusy (patrz również punkty 4.8 i 5.1).
Sposób podawania
Infanrix-IPV powinien być podawany domięśniowo w mięsień naramienny, ale u bardzo małych dzieci szczepionkę można podawać w przednio-boczną część uda.
Nie podawać donaczyniowo.
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w
punkcie 6.1, lub na neomycynę, polimyksynę i formaldehyd.
Nadwrażliwość po uprzednim podaniu szczepionek przeciw błonicy, tężcowi, krztuścowi lub polio.
Stosowanie szczepionki Infanrix-IPV jest przeciwwskazane u dzieci ze stwierdzoną encefalopatią o nieznanej etiologii, która wystąpiła w ciągu 7 dni po podaniu szczepionki zawierającej antygeny krztuśca. W takim przypadku należy zrezygnować ze szczepienia przeciw krztuścowi i stosować szczepionki przeciw błonicy i tężcowi oraz polio.
Tak jak w przypadku innych szczepionek, podanie szczepionki Infanrix-IPV powinno być odroczone u osób w okresie ostrych i ciężkich chorób przebiegających z gorączką. Łagodna infekcja nie jest przeciwwskazaniem do szczepienia.
Tak jak w przypadku innych szczepionek podawanych we wstrzyknięciach, pacjentom należy zapewnić możliwość odpowiedniego natychmiastowego leczenia w przypadku wystąpienia reakcji anafilaktycznej po szczepieniu.
Szczepienie powinno być poprzedzone przeprowadzeniem dokładnego wywiadu lekarskiego (ze szczególnym uwzględnieniem poprzednich szczepień i występujących działań niepożądanych). Zgłaszane w wywiadzie rodzinnym drgawki lub zespół nagłej śmierci niemowląt (Sudden Infant Death Syndrome – SIDS) nie stanowią przeciwwskazania.
Jeśli którykolwiek z niżej wymienionych objawów pojawił się w związku czasowym ze szczepieniem szczepionką zawierającą składnik krztuścowy, należy dokładnie rozważyć decyzję o podaniu następnej dawki szczepionki, zawierającej składnik krztuścowy:
W pewnych okolicznościach, takich jak wysokie narażenie na zachorowanie na krztusiec, potencjalne korzyści mogą przeważyć ryzyko.
Tak jak w przypadku każdego szczepienia, należy dokładnie rozważyć potencjalne ryzyko i korzyść z podania szczepionki Infanrix-IPV lub odroczenia tego szczepienia u niemowląt i dzieci z obecnie rozpoznanym lub postępującym ciężkim zaburzeniem neurologicznym.
Szczepionkę Infanrix-IPV należy ostrożnie stosować u dzieci z trombocytopenią lub zaburzeniami krzepnięcia, ponieważ po podaniu domięśniowym szczepionki może u nich wystąpić krwawienie.
Zakażenie wirusem HIV nie stanowi przeciwwskazania. Jednakże u pacjentów z zaburzeniami odporności może nie pojawić się prawidłowa odpowiedź immunologiczna.
U dzieci otrzymujących leki immunosupresyjne (kortykosteroidy, chemioterapię, itp.) zaleca się odłożenie szczepienia do czasu zakończenia leczenia.
Szczepionki Infanrix-IPV w żadnym przypadku nie wolno podawać donaczyniowo.
Utrata przytomności (omdlenie) może wystąpić po podaniu lub nawet przed podaniem szczepionki, szczególnie u nastolatków, jako reakcja psychogenna na ukłucie igłą. Mogą temu towarzyszyć objawy neurologiczne, takie jak przemijające zaburzenia widzenia, parestezje oraz toniczno-kloniczne ruchy kończyn podczas odzyskiwania przytomności. Ważne jest zachowanie odpowiednich procedur, aby uniknąć urazów podczas omdleń.
Substancje pomocnicze o znanym działaniu
Infanrix-IPV zawiera kwas para-aminobenzoesowy. Może powodować reakcje alergiczne (możliwe reakcje typu późnego) i wyjątkowo skurcz oskrzeli.
Szczepionka zawiera 0,036 mikrograma fenyloalaniny w każdej dawce. Fenyloalanina może być szkodliwa dla pacjentów z fenyloketonurią (PKU), rzadką chorobą genetyczną, w której fenyloalanina gromadzi się w organizmie, ponieważ organizm nie usuwa jej w odpowiedni sposób.
Ta szczepionka zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy szczepionkę uznaje się za
„wolną od sodu”.
Ta szczepionka zawiera potas, mniej niż 1 mmol (39 mg) potasu na dawkę, to znaczy szczepionkę uznaje się za „wolną od potasu”.
Identyfikowalność
W celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę i numer serii podawanego produktu.
W badaniach klinicznych szczepionka Infanrix-IPV była podawana równocześnie ze skojarzoną szczepionką przeciw odrze, śwince i różyczce, szczepionką przeciw ospie wietrznej oraz szczepionką przeciwko zakażeniom wywoływanym przez Haemophilus influenzae typ b. Dostępne dane nie wskazują na występowanie klinicznie istotnej interferencji w wytwarzaniu przeciwciał na każdy z poszczególnych antygenów.
Nie badano interakcji z innymi szczepionkami, produktami biologicznymi lub innymi produktami leczniczymi. Jednakże, zgodnie z powszechnie przyjętymi wytycznymi dotyczącymi szczepień, teoretycznie nie ma powodów, aby Infanrix-IPV, jako szczepionka inaktywowana, nie mógł być podany jednocześnie z innymi szczepionkami lub immunoglobulinami, ale w różne miejsca ciała.
Tak jak w przypadku innych szczepionek, u pacjentów z zaburzeniami odporności lub otrzymujących leki immunosupresyjne może nie pojawić się prawidłowa odpowiedź immunologiczna na jeden lub więcej antygenów zawartych w szczepionce.
Przewiduje się, że stosowanie szczepionki Infanrix-IPV jedynie w rzadkich przypadkach będzie dotyczyło osób w wieku rozrodczym.
Nie są dostępne odpowiednie dane kliniczne na temat stosowania szczepionki u kobiet w okresie ciąży i karmienia piersią ani nie przeprowadzono odpowiednich badań na zwierzętach dotyczących toksycznego wpływu na czynności rozrodcze. Z tego powodu nie zaleca się stosowania szczepionki w czasie ciąży. Należy unikać podawania szczepionki w okresie karmienia piersią.
Przewiduje się, że stosowanie szczepionki Infanrix-IPV jedynie w rzadkich przypadkach będzie dotyczyło osób prowadzących pojazdy lub obsługujących maszyny. Jednakże senność, objaw często zgłaszany po szczepieniach, może czasowo wpłynąć na zdolność prowadzenia pojazdów lub obsługi maszyn.
Podsumowanie profilu bezpieczeństwa
Poniżej opisany profil bezpieczeństwa oparty jest na danych pochodzących od ponad 2 200 pacjentów.
Tak jak dla innych szczepionek DTPa i zawierających składową DTPa, zaobserwowano wzrost częstości występowania reakcji w miejscu podania i gorączki po szczepieniu uzupełniającym szczepionką Infanrix-IPV w stosunku do szczepienia pierwotnego.
Lista działań niepożądanych
Częstość występowania na dawkę określano jako:
Bardzo często: (1/10) Często: (1/100 do <1/10)
Niezbyt często: (1/1 000 do <1/100) Rzadko: (1/10 000 do <1/1 000) Bardzo rzadko: (<1/10 000)
Kolejność działań niepożądanych w każdej grupie częstości uwzględnia zmniejszający się stopień ciężkości działań niepożądanych.
Dane pochodzące z badań klinicznych
Zaburzenia krwi i układu chłonnego
Rzadko: powiększenie węzłów chłonnych
Zaburzenia układu nerwowego
Bardzo często: senność, ból głowy (w wieku 6-13 lat)
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Rzadko: zapalenie oskrzeli1, kaszel1
Zaburzenia żołądka i jelit
Często: biegunka, wymioty, nudności
Zaburzenia skóry i tkanki podskórnej
Niezbyt często: alergiczne zapalenie skóry, wysypka1 Rzadko: świąd, pokrzywka
Zaburzenia metabolizmu i odżywiania
Bardzo często: utrata apetytu
Zaburzenia ogólne i stany w miejscu podania
Bardzo często: gorączka ≥ 38°C, ból, zaczerwienienie i obrzęk w miejscu wstrzyknięcia* Często: gorączka ≥ 39,5°C, złe samopoczucie, reakcje w miejscu podania, w tym stwardnienie, osłabienie
Zaburzenia psychiczne
Bardzo często: nietypowy płacz, drażliwość, niepokój
* Informacje o rozległym obrzęku kończyny, w którą wykonano szczepienie szczepionką Infanrix-IPV (zdefiniowanym jako obrzęk o średnicy > 50 mm, widoczny rozlany obrzęk lub widoczne powiększenie obwodu kończyny) były uzyskane w dwóch badaniach klinicznych. Gdy Infanrix-IPV był podany jako czwarta lub piąta dawka DTPa dzieciom w wieku od 4. do 6. roku życia, rozległy obrzęk w miejscu wstrzyknięcia odnotowano odpowiednio u 13% i 25% pacjentów. Najczęściej był to duży, ograniczony obrzęk (o średnicy > 50 mm) występujący wokół miejsca wstrzyknięcia. U mniejszego odsetka dzieci (odpowiednio 3% i 6%) wystąpił rozlany obrzęk kończyny, w niektórych przypadkach obejmował sąsiadujący staw. Te reakcje pojawiały się w ciągu 48 godzin po szczepieniu i ustępowały samoistnie bez żadnych następstw średnio po 4 dniach.
Dane pochodzące z okresu po wprowadzeniu do obrotu
Zaburzenia krwi i układu chłonnego
Trombocytopenia2
Zaburzenia układu nerwowego
Zapaść lub stan podobny do wstrząsu (epizod hipotoniczno - hiporeaktywny), drgawki (z gorączką lub bez) w ciągu 2 do 3 dni od szczepienia
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Bezdech1
Zaburzenia skóry i tkanki podskórnej
Obrzęk naczynioruchowy1
Zaburzenia ogólne i stany w miejscu podania
Pęcherzyki w miejscu podania
Zaburzenia układu immunologicznego
Reakcje alergiczne, w tym reakcje anafilaktyczne1 i anafilaktoidalne
1 odnotowano po podaniu szczepionek GSK ze składnikiem DTPa
2 odnotowano po podaniu szczepionek ze składnikami D i T
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Zgłaszano przypadki podania większej dawki szczepionki niż zalecana podczas monitorowania działań niepożądanych po wprowadzeniu do obrotu. Zgłaszane działania niepożądane nie były specyficzne i były podobne do zgłaszanych po podaniu prawidłowej dawki szczepionki.
Grupa farmakoterapeutyczna: Skojarzona szczepionka bakteryjno-wirusowa, kod ATC: J07CA02.
Odpowiedź immunologiczna po szczepieniu uzupełniającym i przypominającym szczepionką Infanrix-IPV była oceniana u 917 zaszczepionych osób. Stwierdzono, że odpowiedź immunologiczna była niezależna od liczby dawek i rodzaju szczepionek podanych wcześniej (DTPw lub DTPa, OPV lub IPV). Dane przedstawiono w poniższych tabelach.
Odpowiedź immunologiczna po jednym miesiącu od szczepienia u dzieci w wieku od 15 do 26 miesięcy:
Antygen | Poprzednie szczepienie historia/schemat (N = liczba pacjentów) | 3 dawki DTPw + IPV 2-3-4 miesiąc życia (N = 37) | 3 dawki DTPa + IPV 2-3-4 / 2-4-6 / 3-4-5 lub 3-4,5-6 miesiąc życia (N=252) |
Błonica | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 0,1 j.m./ml w teście ELISA* | 100 | 99,6 |
Tężec | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 0,1 j.m./ml w teście ELISA* | 100 | 100 |
Krztusiec Toksoid krztuścowy Hemaglutynina włókienkowa Pertaktyna | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 5 j. ELISA/ml w teście ELISA | 100 100 100 | 100 100 100 |
Polio Typ 1 Typ 2 Typ 3 | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 8 w teście neutralizacji* | 100 100 100 | 100 100 100 |
*Miana te uznawane są za ochronne
Odpowiedź immunologiczna po jednym miesiącu od szczepienia u dzieci w wieku od 4 do 7 lat:
Antygen | Poprzednie szczepienie historia/schemat (N = liczba pacjentów) | 3 dawki DTPw + IPV 3-5-11 miesiąc życia (N = 128) | 3 dawki DTPa + IPV lub OPV 3-5-(11-12) miesiąc życia (N=208) | 4 dawki DTPw + IPV 2-3-4+(16-18) miesiąc życia (N=73) | 4 dawki DTPa + IPV lub OPV 2-4-6+18 miesiąc życia (N=166) |
Błonica | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 0,1 j.m./ml w teście ELISA* | 100 | 99,0 | 100 | 100 |
Tężec | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 0,1 j.m./ml w teście ELISA* | 100 | 100 | 100 | 100 |
Krztusiec: Toksoid krztuścowy Hemaglutynina włókienkowa Pertaktyna | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 5 j. ELISA/ml w teście ELISA | 98,3 100 100 | 100 100 100 | 95,5 100 100 | 99,4 100 100 |
Polio Typ 1 Typ 2 Typ 3 | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 8 w teście neutralizacji* | 100 100 100 | 100 100 99,5 | 100 100 100 | 100 100 100 |
*Miana te uznawane są za ochronne
Odpowiedź immunologiczna po jednym miesiącu od szczepienia u dzieci i młodzieży w wieku od 10
do 13 lat:
Antygen | Poprzednie szczepienie historia/schemat (N = liczba pacjentów) | 4 dawki DTPw + IPV w 2-3-4 + (16-18) miesiącu życia oraz 1 dawka DT-IPV w (5-6) roku życia (N = 53) |
Błonica | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 0,1 j.m./ml w teście ELISA* | 100 |
Tężec | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 0,1 j.m./ml w teście ELISA* | 100 |
Krztusiec: Toksoid krztuścowy Hemaglutynina włókienkowa Pertaktyna | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 5 j. ELISA/ml w teście ELISA | 100 100 100 |
Polio Typ 1 Typ 2 Typ 3 | Odsetek zaszczepionych, którzy osiągnęli miana ≥ 8 w teście neutralizacji* | 100 100 100 |
*Miana te uznawane są za ochronne
Po szczepieniu, u ≥ 99% wszystkich pacjentów stwierdzono ochronne miana przeciwciał przeciwko błonicy, krztuścowi, tężcowi i trzem typom poliowirusa.
Nie określono korelacji pomiędzy mianem przeciwciał, a właściwościami ochronnymi w przypadku krztuśca. Miana przeciwciał dla trzech antygenów krztuśca były we wszystkich przypadkach wyższe niż te obserwowane po szczepieniu podstawowym z zastosowaniem skojarzonej szczepionki zawierającej bezkomórkowy składnik krztuśca (DTPa, Infanrix), której skuteczność została wykazana w badaniu wykonanym wśród osób z kontaktów domowych. Na podstawie tego porównania można oczekiwać, że Infanrix-IPV będzie zapewniał ochronę przeciwko krztuścowi, jednak stopień i czas trwania ochrony wywołanej tą szczepionką nie zostały określone.
Ocena właściwości farmakokinetycznych nie jest wymagana dla szczepionek.
Dane niekliniczne uzyskane na podstawie konwencjonalnych badań dotyczących bezpieczeństwa stosowania, swoistej toksyczności oraz zgodności składników nie ujawniają żadnego szczególnego zagrożenia dla człowieka.
Sodu chlorek
Medium 199 (jako stabilizator, zawierające aminokwasy (w tym fenyloalaninę), sole mineralne (w tym sód i potas), witaminy (w tym kwas para-aminobenzoesowy) i inne substancje)
Woda do wstrzykiwań.
Adiuwanty, patrz punkt 2.
Z powodu braku badań zgodności szczepionki tej nie wolno mieszać w tej samej strzykawce z innymi
produktami leczniczymi.
3 lata.
Przechowywać w lodówce (2˚C – 8˚C). Nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
0,5 ml zawiesiny do wstrzykiwań w ampułkostrzykawce (ze szkła typu I) z zatyczką (butylową) - wielkość opakowania: 1 lub 10 sztuk z igłami lub bez igieł.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
W trakcie przechowywania może powstać biały osad i przezroczysty płyn powyżej. Jest to zjawisko
prawidłowe i nie zmniejsza działania szczepionki.
Ampułkostrzykawką należy wstrząsnąć w celu uzyskania jednorodnej mętnej, białej zawiesiny.
Przed podaniem zawiesinę należy obejrzeć, czy nie występują cząsteczki stałe i (lub) zmiany fizyczne. W przypadku jakichkolwiek zmian koloru i (lub) postaci szczepionki nie należy jej podawać.
Ampułkostrzykawka może być dostępna z końcówką luer pokrytą powłoką ceramiczną (ceramic
coated treatment - CCT) lub z adapterem PRTC (plastic rigid tip cap).
Instrukcja użycia dla ampułkostrzykawki z adapterem PRTC luer lock
Igła
Ampułkostrzykawka
Tłok Korpus
Osłonka na igłę

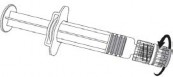
Nasadka 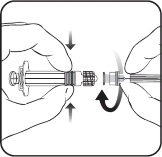
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
DOPUSZCZENIE DO OBROTU
GlaxoSmithKline Biologicals S.A. rue de l’Institut 89
1330 Rixensart, Belgia
11884
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 02.11.2005
Data ostatniego przedłużenia pozwolenia: 28.06.2007
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
03/2022
Szczegółowa informacja o tym leku jest dostępna na stronie internetowej Urzędu Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych











