Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
hipokaliemia;
zasadowica metaboliczna.
Przeciwwskazania związane ogólnie z hemofiltracją:
ostra niewydolność nerek ze znacznym hiperkatabolizmem, w przypadku gdy objawów mocznicy nie można dłużej opanować poprzez hemofiltrację;
niewystarczający przepływ krwi z dostępu żylnego;
wszelkie stany zwiększonego ryzyka krwotoku z powodu antykoagulacji systemowej.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wystąpienie interakcji między uzupełnianymi elektrolitami, odżywianiem pozajelitowym i innymi infuzjami zwykle stosowanymi w ramach intensywnej opieki medycznej, a składem surowicy i stanem płynów u pacjenta. Należy to uwzględnić, gdy zleca się leczenie hemofiltracją.
Toksyczne działanie naparstnicy może ulec zamaskowaniu przez hiperkaliemię, hipermagnezemię i hipokalcemię. Po korekcie tych elektrolitów drogą hemofiltracji mogą się pojawić objawy przedmiotowe i podmiotowe zatrucia naparstnicą, np. zaburzenia rytmu serca. Przy niskim stężeniu potasu lub wysokim stężeniu wapnia może wystąpić toksyczność naparstnicy przy dawkach suboptymalnych leczenia naparstnicą.
Witamina D i produkty lecznicze zawierające wapń, np. węglan wapnia jako substancja wiążąca fosforany, mogą zwiększać ryzyko hiperkalcemii.
Dodatkowe uzupełnienie wodorowęglanu sodu może zwiększać ryzyko wystąpienia zasadowicy metabolicznej.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Duosol nie zawierający potasu, roztwór do hemofiltracji
Mniejsza komora Roztwór elektrolitów | Większa komora Roztwór wodorowęglanu | |||
Substancje czynne: | 555 ml zawiera | na 1000 ml | 4445 ml zawiera | na 1000 ml |
sodu chlorek | 2,34 g | 4,21 g | 27,47 g | 6,18 g |
wapnia chlorek dwuwodny | 1,10 g | 1,98 g | — | — |
magnezu chlorek sześciowodny | 0,51 g | 0,91 g | — | — |
glukoza jednowodna co odpowiada glukozie bezwodnej | 5,49 g 5,0 g | 9,90 g 9,0 g | — | — |
sodu wodorowęglan | — | — | 15,96 g | 3,59 g |
Elektrolity: | [mmol/ komorę] | [mmol/l] | [mmol/ komorę] | [mmol/l] |
Na+ | 40,0 | 72 | 660 | 149 |
Ca2+ | 7,5 | 13,5 | — | — |
Mg2+ | 2,5 | 4,5 | — | — |
Cl- | 75,0 | 135 | 470 | 106 |
HCO3- | — | — | 190 | 42,8 |
teoretyczna osmolarność [mOsm/l] | 275 | 297 | ||
Skład gotowego do użycia roztworu do hemofiltracji po zmieszaniu:
1000 ml gotowego do użycia roztworu do hemofiltracji zawiera [mmol/l]: Na+ 140
Ca2+ 1,5
Mg2+ 0,5
Cl- 109
HCO3- 35,0
glukoza bezwodna 5,6 (co odp. 1,0 g) Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do hemofiltracji
Przezroczysty i bezbarwny roztwór, pozbawiony widocznych cząstek.
Teoretyczna osmolarność: 292 mOsm/l pH: 7,0-8,0
Gotowy do użycia roztwór wskazany jest do stosowania u pacjentów z ostrą niewydolnością nerek o różnej przyczynie, wymagających ciągłej hemofiltracji.
Zastosowanie roztworów do hemofiltracji u pacjentów z ostrą niewydolnością nerek powinno odbywać się pod nadzorem lekarza mającego doświadczenie w stosowaniu takiego leczenia.
Dawkowanie
Zalecona szybkość filtracji zależy od stanu klinicznego i masy ciała pacjenta. Jeżeli lekarz nie zaleci inaczej, zaleca się, w zależności od stanu metabolicznego pacjenta, szybkość filtracji 20-25 ml/kg masy ciała na godzinę, aby zapewnić eliminację zbędnych produktów przemiany materii, normalnie wydalanych w moczu.
Decyzję o wielkości dawki musi podjąć lekarz, ponieważ objętość roztworu substytucyjnego uzależniona jest od intensywności prowadzonego leczenia oraz ilości płynu, jaki ma zostać zastąpiony w celu utrzymania równowagi płynów ustrojowych.
Dzieci i młodzież
Wyżej wymienione zalecenia dotyczące dawkowania mają zastosowanie również dla dzieci i młodzieży.
Sposób podawania
Podanie dożylne.
Aby przygotować gotowy do użycia roztwór do hemofiltracji, należy otworzyć przegrodę pomiędzy komorami. Zawartość należy wymieszać poprzez pięciokrotne obrócenie worka. Dalsze instrukcje, patrz punkt 6.6.
Gotowy do użycia roztwór do hemofiltracji wprowadzany jest do obiegu pozaustrojowego przy pomocy pompy infuzyjnej.
Podczas hemofiltracji roztwór do hemofiltracji zastępuje ultrafiltrat usuwany z krwi z uwzględnieniem ogólnego bilansu płynów.
W ostrej niewydolności nerek, leczenie odbywa się w ograniczonym okresie czasu i zostaje przerwane, gdy czynność nerek jest w pełni przywrócona.
Przeciwwskazania związane z gotowym do użycia roztworem do hemofiltracji:
Przed i w trakcie hemofiltracji należy ściśle monitorować stan hemodynamiczny, równowagę płynów, równowagę elektrolitów i kwasowo-zasadową, stężenie glukozy we krwi oraz stężenie mocznika i kreatyniny w osoczu.
Przed i w trakcie hemofiltracji należy regularnie monitorować stężenie potasu w surowicy. Jeśli wystąpi zmniejszenie stężenia potasu w surowicy i rozwinie się hipokaliemia, może być konieczne uzupełnienie potasu i (lub) zmiana na roztwór uzupełniający z większym stężeniem potasu. W przypadkach zwiększonego stężenia potasu w surowicy, hiperkaliemii, może być wskazane zwiększenie szybkości filtracji, wraz z normalnymi działaniami z zakresu intensywnej opieki medycznej.
Konieczne jest również regularne oznaczanie stężenia fosforanów nieorganicznych w trakcie hemofiltracji. W przypadku stwierdzenia hipofosfatemii, należy uzupełnić ilość fosforanów nieorganicznych.
Plastikowe pojemniki mogą ulec uszkodzeniu w drodze od producenta do szpitala/oddziału dializ lub na terenie szpitala/oddziału dializ. Może to prowadzić do skażenia bakteryjnego lub rozwoju grzybów w roztworze do hemofiltracji. Dlatego też niezbędne jest uważne obejrzenie pojemnika i roztworu do hemofiltracji każdorazowo przed podłączeniem pojemnika oraz przed podaniem roztworu. Należy zwrócić szczególną uwagę nawet na najmniejsze uszkodzenia zamknięcia, zgrzewu, przegrody między komorami oraz narożników pojemnika, które mogą stanowić potencjalne źródła skażenia.
Roztwór do hemofiltracji wolno stosować tylko wtedy, gdy pojemnik (zewnętrzne opakowanie ochronne oraz worek dwukomorowy), przegroda pomiędzy komorami oraz złącza są nieuszkodzone i nienaruszone, a roztwór jest przezroczysty, bezbarwny oraz pozbawiony widocznych cząstek.
Roztwór należy stosować wyłącznie po otwarciu przegrody pomiędzy komorami i zmieszaniu obu roztworów. Dalsze instrukcje, patrz punkt 6.6.
W razie jakichkolwiek wątpliwości, decyzja dotycząca użycia roztworu powinna być podjęta przez lekarza odpowiedzialnego za leczenie.
Roztwór do hemofiltracji należy ogrzewać w przybliżeniu do temperatury ciała przy pomocy zintegrowanego lub zewnętrznego podgrzewacza. W żadnym wypadku nie wolno podawać roztworu, jeśli jest poniżej temperatury pokojowej.
Podczas stosowania tego produktu leczniczego zaobserwowano w rzadkich przypadkach wytrącanie białego osadu węglanu wapnia w przewodach, szczególnie w pobliżu pompy i urządzenia grzewczego. Dlatego podczas hemofiltracji należy ściśle kontrolować wizualnie roztwór w przewodach infuzyjnych co 30 minut w celu zapewnienia, że roztwór znajdujący się w przewodach jest przezroczysty i wolny od wytrąceń. Wytrącenia mogą wystąpić również ze znacznym opóźnieniem po rozpoczęciu leczenia. Jeśli zauważy się wytrącenia, należy natychmiast wymienić roztwór i przewody infuzyjne oraz dokładnie monitorować pacjenta.
Stężenie we krwi produktów leczniczych podatnych na filtrację np. produktów leczniczych w małym stopniu wiązanych z białkiem, może ulec obniżeniu. W razie konieczności należy zapewnić stosowne leczenie uzupełniające.
Interakcji z innymi produktami leczniczymi można uniknąć poprzez właściwe dawkowanie roztworu do hemofiltracji i ścisłą obserwację parametrów chemii klinicznej oraz czynności życiowych.
Istnieje jednak możliwość następujących interakcji:
Ciąża
Brak danych dotyczących stosowania produktu leczniczego Duosol u kobiet w okresie ciąży lub danych z badań na zwierzętach. Jednak ponieważ wszystkie składniki roztworu do hemofiltracji to substancje fizjologiczne, które służą do uzupełnienia istotnych składników osocza usuniętych drogą hemofiltracji, nie należy się spodziewać zagrożenia dla nienarodzonego dziecka. W razie potrzeby można rozważyć zastosowanie produktu leczniczego Duosol w okresie ciąży.
Karmienie piersią
Ponieważ wszystkie składniki roztworu do hemofiltracji to substancje fizjologiczne, które służą do uzupełnienia istotnych składników osocza usuniętych drogą hemofiltracji, nie należy się spodziewać zagrożenia dla dziecka. W razie potrzeby można rozważyć zastosowanie produktu leczniczego Duosol w okresie karmienia piersią.
Płodność
Ponieważ wszystkie składniki roztworu do hemofiltracji to substancje fizjologiczne, które służą do uzupełnienia istotnych składników osocza usuniętych drogą hemofiltracji, nie należy się spodziewać wpływu na płodność.
Nie dotyczy.
Nie odnotowano dotychczas żadnych działań niepożądanych, które mogłyby być związane ze stosowaniem roztworu do hemofiltracji buforowanego wodorowęglanem. Następujące działania niepożądane mogą być jednak wynikiem leczenia lub stosowanego roztworu. Częstość występowania tych działań niepożądanych jest nieznana (nie może być określona na podstawie dostępnych danych):
Zaburzenia metabolizmu i odżywiania
Przewodnienie lub odwodnienie, zaburzenia równowagi elektrolitów, hipofosfatemia, hiperglikemia, zasadowica metaboliczna
Zaburzenia naczyniowe
Nadciśnienie, niedociśnienie
Zaburzenia żołądka i jelit
Nudności, wymioty
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Skurcze mięśni
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych,
Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Podczas stosowania roztworu w zalecanych dawkach nie odnotowano dotychczas żadnych przypadków wymagających natychmiastowej pomocy, ponadto podawanie roztworu można w każdej chwili przerwać. W przypadku niedokładnego obliczenia i monitorowania równowagi płynów może dojść do przewodnienia lub odwodnienia organizmu, przejawiających się zmianami ciśnienia krwi, centralnego ciśnienia żylnego, szybkości tętna i płucnego ciśnienia tętniczego.
W przypadkach wystąpienia przewodnienia należy zwiększyć ultrafiltrację i zmniejszyć szybkość i objętość podawanego roztworu do hemofiltracji.
W przypadkach ciężkiego odwodnienia należy zmniejszyć lub przerwać ultrafiltrację i odpowiednio zwiększyć objętość podawanego roztworu do hemofiltracji.
Do przedawkowania wodorowęglanu może dojść po podaniu niewłaściwie dużej ilości roztworu do hemofiltracji, co może prowadzić do zasadowicy metabolicznej, spadku stężenia zjonizowanego wapnia lub wystąpienia tężyczki.
Przedawkowanie może powodować zastoinową niewydolność serca i (lub) zastój krwi w płucach oraz może prowadzić do zaburzeń stężenia elektrolitów i równowagi kwasowo-zasadowej.
Grupa farmakoterapeutyczna: roztwory do hemofiltracji, kod ATC: B05ZB Podstawowe zasady hemofiltracji
Woda i substancje w niej rozpuszczone, takie jak toksyny mocznicowe, elektrolity i wodorowęglan, są usuwane z krwi poprzez ultrafiltrację, w procesie ciągłej hemofiltracji. Ultrafiltrat jest zastępowany roztworem do hemofiltracji ze zbilansowaną zawartością elektrolitów i substancji buforującej.
Gotowy do użycia roztwór, składający się z roztworu wodorowęglanu i roztworu elektrolitów, to zmieszany roztwór do hemofiltracji buforowany wodorowęglanem, przeznaczony do stosowania w leczeniu ostrej niewydolności nerek poprzez hemofiltrację ciągłą.
Elektrolity Na+, K+, Mg2+, Ca2+, Cl- oraz wodorowęglan mają zasadnicze znaczenie dla utrzymania i korygowania homeostazy płynów i elektrolitów (objętość krwi, równowaga osmotyczna, równowaga kwasowo-zasadowa).
Skuteczność porównywalnych, podawanych dożylnie roztworów, w utrzymywaniu równowagi kwasowo-zasadowej w trakcie hemofiltracji jednoznacznie udowodniono w licznych badaniach oraz podczas wieloletniej praktyki klinicznej. Wykazano, że roztwory takie są bezpieczne i dobrze tolerowane. Właściwości farmakologiczne dożylnie podawanych elektrolitów i wodorowęglanu są dobrze znane.
Gotowy do użycia roztwór do hemofiltracji przeznaczony jest do podawania dożylnego. Dystrybucja elektrolitów i wodorowęglanu uzależniona jest od zapotrzebowania, stanu metabolicznego i stopnia funkcjonowania nerek.
Za wyjątkiem glukozy, składniki roztworu do hemofiltracji nie podlegają metabolizmowi. Wydalanie wody i elektrolitów uzależnione jest od zapotrzebowania komórkowego, stanu metabolicznego, stopnia funkcjonowania nerek oraz utraty płynów np. drogą jelitową, przez płuca i skórę.
Badania toksykologiczne nie zostały przeprowadzone, ponieważ wszystkie składniki roztworu do hemofiltracji to substancje fizjologiczne, których rolą jest substytucja podstawowych składników osocza usuwanych w procesie hemofiltracji.
Roztwór elektrolitów (mniejsza komora) Kwas solny 25% (do ustalania pH) Woda do wstrzykiwań
Roztwór wodorowęglanu (większa komora) Dwutlenek węgla (do ustalania pH)
Woda do wstrzykiwań
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności. Jeśli konieczne jest dodanie któregokolwiek produktu leczniczego do roztworu do hemofiltracji, powinno to być wykonane dopiero po przeprowadzeniu pełnej oceny jego zgodności z roztworem do hemofiltracji i tylko po dokładnym wymieszaniu obydwóch roztworów w worku dwukomorowym.
Okres ważności w nienaruszonym pojemniku 2 lata
Okres ważności po przygotowaniu gotowego do użycia roztworu
Zmieszany produkt powinien być wykorzystany natychmiast. Produkt po zmieszaniu zachowuje stabilność fizyczną i chemiczną przez 24 godziny w temperaturze 25°C.
Nie przechowywać w temperaturze powyżej 25°C. Nie przechowywać w lodówce ani nie zamrażać.
Worek dwukomorowy na bazie PP, umieszczony w zewnętrznym opakowaniu ochronnym na bazie PP, zawierający 4445 ml roztworu wodorowęglanu sodu oraz 555 ml roztworu elektrolitów (rozdzielone przegrodą), z dwoma przewodami z PP na większej komorze uszczelnionymi złączami Luer Lock z poliwęglanu. Przewód na małej komorze jest używany tylko w trakcie produkcji i nie jest przeznaczony do użycia.
2 worki po 5000 ml w tekturowym pudełku.
Instrukcja przygotowania gotowego do użycia roztworu do hemofiltracji
Przed użyciem należy poddać pojemnik i roztwór kontroli wzrokowej. Roztwór do hemofiltracji wolno stosować tylko wtedy, gdy pojemnik (zewnętrzne opakowanie ochronne oraz worek dwukomorowy), przegroda pomiędzy komorami oraz złącza są nieuszkodzone i nienaruszone, a roztwór jest przezroczysty, bezbarwny oraz pozbawiony widocznych cząstek.
Zewnętrzne opakowanie ochronne zdjąć bezpośrednio przed użyciem.
1.
Zdjąć zewnętrzne opakowanie ochronne.
2.
Rozprostować worek i położyć go na czystej, płaskiej powierzchni.
3.
Nacisnąć mniejszą komorę worka obiema dłońmi, w taki sposób, aby w pełni otworzyła się przegroda pomiędzy komorami na jej całej długości.
4.
Zapewnić dokładne wymieszanie zawartości, obracając worek pięciokrotnie w obie strony.
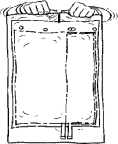
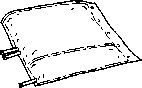

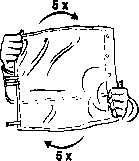
Do jednorazowego użytku. Niewykorzystaną zawartość roztworu i wszelkie uszkodzone pojemniki należy wyrzucić.
B. Braun Avitum AG Schwarzenberger Weg 73-79 34212 Melsungen
Niemcy
Pozwolenie nr 11998
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 29.12.2005 r. Data ostatniego przedłużenia pozwolenia: 02.03.2011 r.
20.06.2019











