Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
dawka (0,5 ml) szczepionki po rekonstytucji zawiera:
Żywy atenuowany wirus odry1 (szczep Schwarz)
3
nie mniej niż 103,0 CCID50
Żywy atenuowany wirus świnki1 (szczep RIT 4385, pochodzący od
szczepu Jeryl Lynn)
3
nie mniej niż 103,7 CCID50
Żywy atenuowany wirus różyczki2 (szczep Wistar RA 27/3)
3
nie mniej niż 103,0 CCID50
1 namnażany w hodowli komórek zarodków kurzych
2 namnażany w hodowli ludzkich komórek diploidalnych MRC-5
3 CCID50 – wyznaczona statystycznie ilość wirusa mogąca w wyniku zaszczepienia zakazić 50%
hodowli komórkowej
Ta szczepionka zawiera śladowe ilości neomycyny. Patrz punkt 4.3. Substancje pomocnicze o znanym działaniu
Szczepionka zawiera 9 mg sorbitolu.
Szczepionka zawiera 6,5 nanograma kwasu para-aminobenzoesowego w każdej dawce
i 334 mikrogramy fenyloalaniny w każdej dawce (patrz punkt 4.4). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa
Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań.
Liofilizowane komponenty odry, świnki i różyczki (MMR) mają postać proszku barwy białej do lekko
różowej.
Rozpuszczalnik jest przezroczystym i bezbarwnym roztworem.
PRIORIX jest przeznaczony do czynnego uodparniania przeciwko odrze, śwince i różyczce dzieci po ukończeniu 9. miesiąca życia, młodzieży oraz osób dorosłych.
W celu uzyskania informacji dotyczącej stosowania u dzieci w wieku od 9 do 12 miesięcy, patrz
punkty 4.2, 4.4 i 5.1.
Dawkowanie
Szczepionka PRIORIX powinna być stosowana zgodnie z oficjalnymi zaleceniami.
Osoby w wieku 12 miesięcy i starsze
Zaleca się podanie jednej dawki (0,5 ml) szczepionki. Druga dawka powinna zostać podana zgodnie z oficjalnymi zaleceniami.
Szczepionka PRIORIX może być stosowana u osób, które zostały uprzednio zaszczepione inną monowalentną lub skojarzoną szczepionką przeciw odrze, śwince i różyczce.
Niemowlęta w wieku od 9 do 12 miesięcy
Niemowlęta w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi na składniki szczepionki. W przypadku, gdy sytuacja epidemiologiczna wymaga szczepienia niemowląt w pierwszym roku ich życia (np. wybuch epidemii lub podróż w rejony endemiczne), druga dawka szczepionki PRIORIX powinna zostać podana w drugim roku życia, najlepiej w ciągu 3 miesięcy od podania pierwszej dawki. W żadnym przypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie (patrz punkty 4.4 i 5.1).
Niemowlęta w wieku poniżej 9 miesięcy
Nie określono bezpieczeństwa stosowania ani skuteczności szczepionki PRIORIX u niemowląt w wieku poniżej 9 miesięcy.
Sposób podawania
PRIORIX podaje się podskórnie, jakkolwiek można także podać domięśniowo, w obszar mięśnia
naramiennego lub w przednio-boczną część uda (patrz punkty 4.4 i 5.1).
Szczepionka powinna zostać podana podskórnie u pacjentów z trombocytopenią lub u których występują zaburzenia krzepnięcia (patrz punkt 4.4).
Instrukcja dotycząca rekonstytucji produktu leczniczego przed podaniem, patrz punkt 6.6.
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1, lub neomycynę. Stwierdzone w wywiadzie kontaktowe zapalenie skóry wywołane przez neomycynę nie jest przeciwwskazaniem do szczepienia. W celu uzyskania informacji dotyczących reakcji nadwrażliwości na białko jaja kurzego, patrz punkt 4.4.
Ciężki humoralny lub komórkowy (pierwotny lub nabyty) niedobór odporności, np. ciężki, złożony niedobór odporności, agammaglobulinemia lub AIDS lub objawowe zakażenie wirusem HIV, lub właściwy dla wieku odsetek limfocytów T CD4+ u dzieci w wieku poniżej 12 miesięcy z CD4+
<25%; w wieku między 12 a 35 miesięcy z CD4+ <20%; w wieku między 36 a 59 miesięcy z CD4+
<15% (patrz punkt 4.4).
Ciąża. Ponadto, należy unikać zajścia w ciążę przez 1 miesiąc po zaszczepieniu (patrz punkt 4.6).
Tak jak w przypadku innych szczepionek, u osób w okresie ostrych i ciężkich chorób przebiegających z gorączką podanie szczepionki powinno być odroczone. Łagodna infekcja, taka jak przeziębienie, nie jest przeciwwskazaniem do szczepienia.
Identyfikowalność
W celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę i numer serii podawanego produktu.
Podobnie jak w przypadku wszystkich szczepionek podawanych w iniekcji, istnieje możliwość wystąpienia rzadkiej reakcji anafilaktycznej, dlatego należy zapewnić możliwość fachowej opieki medycznej bezpośrednio po szczepieniu.
Alkohol, a także inne środki dezynfekujące powinny wyparować ze skóry przed podaniem szczepionki, ponieważ mogą unieczynnić atenuowane wirusy znajdujące się w szczepionce.
Niemowlęta szczepione w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi immunologicznej na składniki szczepionki, w związku z możliwą obecnością przeciwciał matczynych w ich organizmie (patrz punkty 4.2 i 5.1).
Szczególna ostrożność powinna zostać zachowana w przypadku podawania szczepionki PRIORIX osobom z zaburzeniami ośrodkowego układu nerwowego, u których istnieje ryzyko występowania drgawek gorączkowych lub u osób z drgawkami w wywiadzie rodzinnym. Osoby z przebytymi drgawkami gorączkowymi, powinny być ściśle monitorowane.
Zawarte w szczepionce wirusy odry i świnki są uzyskiwane z hodowli komórek zarodka kurzego i z tego powodu mogą zawierać śladowe ilości białka jaja. Osoby z reakcjami anafilaktycznymi, anafilaktoidalnymi lub innymi reakcjami typu natychmiastowego w wywiadzie (np. uogólniona pokrzywka, obrzęk jamy ustnej i gardła, trudności w oddychaniu, obniżenie ciśnienia tętniczego lub wstrząs) występującymi po spożyciu jaj mogą być bardziej narażone na wystąpienie reakcji typu natychmiastowego po szczepieniu, chociaż jak wykazano, reakcje te są bardzo rzadkie. Podczas szczepienia tych osób, należy zachować szczególną ostrożność oraz zapewnić dostępność odpowiednich środków leczniczych na wypadek wystąpienia reakcji nadwrażliwości.
Ograniczona ochrona przeciw odrze może zostać uzyskana przez zaszczepienie w ciągu 72 godzin od momentu narażenia na zarażenie naturalnie występującą odrą.
Utrata przytomności (omdlenie) może wystąpić po podaniu lub nawet przed podaniem szczepionki, szczególnie u młodzieży, jako reakcja psychogenna na ukłucie igłą. Mogą temu towarzyszyć objawy neurologiczne, takie jak przemijające zaburzenia widzenia, parestezje oraz toniczno-kloniczne ruchy kończyn podczas odzyskiwania przytomności. Ważne jest zachowanie odpowiednich procedur, aby uniknąć urazów podczas omdleń.
Tak jak w przypadku wszystkich szczepionek, nie wszystkie zaszczepione osoby mogą wytworzyć ochronny poziom przeciwciał.
PRIORIX W ŻADNYM PRZYPADKU NIE MOŻE BYĆ PODAWANY DONACZYNIOWO.
Trombocytopenia
Przypadki nasilenia lub nawrotu trombocytopenii u osób chorujących na tę chorobę były zgłaszane po podaniu pierwszej dawki żywych szczepionek przeciwko odrze, śwince, różyczce. Trombocytopenia związana ze szczepieniem szczepionką MMR jest rzadka i zasadniczo samoograniczająca. U pacjentów z istniejącą trombocytopenią lub historią trombocytopenii po szczepieniu przeciw odrze, śwince i różyczce należy dokładnie ocenić stosunek korzyści do ryzyka wynikający ze szczepienia szczepionką PRIORIX. Tych pacjentów należy szczepić z zachowaniem ostrożności i wykorzystując podskórną drogę podania.
Pacjenci z upośledzoną odpornością
Można rozważyć szczepienie pacjentów z wybranymi rodzajami niedoborów odporności w przypadku, gdy korzyści przewyższają ryzyko (np. pacjenci z bezobjawowym zakażeniem HIV, niedobór podklas
IgG, wrodzona neutropenia, przewlekła choroba ziarniakowa oraz choroby przebiegające z niedoborem dopełniacza).
Pacjenci z niedoborami odporności, u których nie stwierdza się przeciwwskazań do szczepienia (patrz punkt 4.3), mogą zareagować słabiej niż pacjenci z prawidłową czynnością układu immunologicznego; dlatego w przypadku kontaktu z patogenami niektóre z tych osób mogą zachorować na odrę, świnkę lub różyczkę pomimo prawidłowego podania szczepionki. Tych pacjentów należy starannie monitorować pod kątem występowania objawów odry, świnki i różyczki.
Przenoszenie
Przeniesienie wirusów odry i świnki ze szczepionki na osoby podatne na zachorowanie nie zostało nigdy udokumentowane. Wydalanie wirusów różyczki i odry do gardła występuje około 7 do 28 dni po szczepieniu, ze szczytową ilością wydalania około 11 dnia. Jednakże brak jest dowodów transmisji tych wydalonych wirusów na osoby podatne na zachorowanie. Przeniesienie wirusa różyczki na niemowlęta poprzez mleko matki oraz transmisja wirusa przez łożysko zostały udokumentowane, bez żadnego dowodu na wystąpienie klinicznych objawów choroby.
Substancje pomocnicze o znanym działaniu
Priorix zawiera kwas para-aminobenzoesowy. Może powodować reakcje alergiczne (możliwe reakcje typu późnego) i wyjątkowo skurcz oskrzeli.
Szczepionka zawiera 334 mikrogramy fenyloalaniny w każdej dawce. Fenyloalanina może być szkodliwa dla pacjentów z fenyloketonurią (PKU).
Ta szczepionka zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy szczepionkę uznaje się za
„wolną od sodu”.
Ta szczepionka zawiera potas, mniej niż 1 mmol (39 mg) potasu na dawkę, to znaczy szczepionkę uznaje się za „wolną od potasu”.
Badania kliniczne wykazały, że szczepionka PRIORIX może zostać podana jednocześnie z każdą z następujących monowalentnych lub skojarzonych szczepionek [w tym z sześciowalentnymi szczepionkami (DTPa-HBV-IPV/Hib)]: szczepionką przeciwko błonicy, tężcowi, krztuścowi (bezkomórkowa) (DTPa), szczepionką przeciwko błonicy, tężcowi, krztuścowi (bezkomórkowa) o zmniejszonej zawartości antygenów (dTpa), szczepionką przeciw Haemophilus influenzae typu b (Hib), inaktywowaną szczepionką przeciw polio (IPV), szczepionką przeciw wirusowemu zapaleniu wątroby typu B (HBV), szczepionką przeciw wirusowemu zapaleniu wątroby typu A (HAV), szczepionką przeciw meningokokom grupy B (MenB), szczepionką skoniugowaną przeciw meningokokom grupy C (MenC), szczepionką skoniugowaną przeciwko meningokokom grupy A, C, W135 i Y (MenACWY), szczepionką przeciw ospie wietrznej (VZV), doustną szczepionką przeciw polio (OPV) oraz skoniugowaną szczepionką przeciw pneumokokom, zgodnie z oficjalnymi zaleceniami.
Z uwagi na zwiększone ryzyko wystąpienia gorączki, tkliwości w miejscu wstrzyknięcia, zmiany nawyków żywieniowych i drażliwości w przypadku podawania szczepionki Bexsero równocześnie ze skojarzoną szczepionką przeciw odrze, śwince, różyczce i ospie wietrznej (MMR-V), należy rozważyć oddzielne podanie szczepionki PRIORIX o ile to możliwe.
Brak danych uzasadniających stosowanie PRIORIX z jakimikolwiek innymi szczepionkami.
W przypadku równoczesnego podawania szczepionki PRIORIX z innymi szczepionkami podawanymi w drodze iniekcji, szczepionki należy zawsze podawać w różne miejsca.
Jeżeli PRIORIX nie może być podany w tym samym czasie, co inne szczepionki zawierające żywe,
atenuowane wirusy, należy zachować odstęp co najmniej jednego miesiąca pomiędzy szczepieniami.
Jeżeli istnieje konieczność przeprowadzenia testów tuberkulinowych, należy je wykonać przed lub równocześnie z podaniem szczepionki, ponieważ istnieją doniesienia, że szczepionki przeciw odrze, śwince i różyczce mogą spowodować przejściowe obniżenie wrażliwości skórnej na tuberkulinę.
Anergia ta może utrzymywać się do 6 tygodni po szczepieniu i w tym okresie nie należy przeprowadzać prób tuberkulinowych, aby uniknąć fałszywie ujemnych wyników.
U pacjentów, którzy otrzymywali ludzką immunoglobulinę lub transfuzję krwi należy wstrzymać się z podawaniem szczepionki przez okres trzech miesięcy lub dłużej (aż do 11 miesięcy) w zależności od dawki ludzkiej immunoglobuliny jaka została podana, z powodu możliwości niewytworzenia u nich odporności na skutek obecności biernie nabytych przeciwciał przeciwko śwince, odrze lub różyczce.
Płodność
Szczepionka PRIORIX nie była oceniana w badaniach dotyczących płodności. Ciąża
Kobiety w okresie ciąży nie powinny być szczepione szczepionką Priorix.
Nie udokumentowano jednak przypadków uszkodzenia płodu po podaniu szczepionki przeciwko
odrze, śwince lub różyczce kobietom w okresie ciąży.
Chociaż teoretycznie nie można wykluczyć takiego ryzyka, nie zgłoszono żadnego przypadku zespołu różyczki wrodzonej u ponad 3500 nieświadomych wczesnej ciąży, podatnych na zakażenie kobiet, którym podano szczepionkę zawierającą komponentę różyczki. Z tego względu nieumyślne podanie szczepionki zawierającej komponentę odry, świnki i różyczki nieświadomej ciąży kobiecie nie powinno być powodem przerwania ciąży.
Należy unikać zajścia w ciążę przez okres 1 miesiąca od zaszczepienia. Kobiety, które planują ciążę powinny zostać pouczone o konieczności opóźnienia tej decyzji.
Karmienie piersią
Istnieją tylko ograniczone doniesienia dotyczące stosowania szczepionki PRIORIX w okresie karmienia piersią. Badania wykazały, ze kobiety karmiące piersią po porodzie, zaszczepione żywą, atenuowaną szczepionką przeciw różyczce mogą wydzielać wirusy wraz z mlekiem i przenosić je na dziecko karmione piersią, bez dowodu na wystąpienie klinicznych objawów choroby. Jedynie w przypadku, gdy zostanie potwierdzone lub gdy przypuszcza się, iż dziecko ma obniżoną odporność, należy przeprowadzić analizę korzyści i ryzyka wynikającego ze szczepienia matki (patrz punkt 4.3).
PRIORIX nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Przedstawiony profil bezpieczeństwa oparty jest na danych uzyskanych z badań klinicznych, w
których uczestniczyło około 12 000 osób zaszczepionych szczepionką PRIORIX.
Działania niepożądane, które mogą wystąpić po podaniu skojarzonej szczepionki przeciw odrze, śwince i różyczce są takie same, jak objawy obserwowane po podaniu szczepionek monowalentnych osobno lub w formie skojarzonej.
W kontrolowanych badaniach klinicznych aktywnie monitorowano objawy występujące po szczepieniu w czasie 42 dniowej obserwacji. Osoby zaszczepione były również proszone o odnotowywanie wszelkich zdarzeń klinicznych pojawiających się w trakcie trwania badania.
Najczęstszymi działaniami niepożądanymi występującymi po podaniu szczepionki PRIORIX były zaczerwienienie w miejscu podania oraz gorączka ≥ 38oC (mierzona w odbytnicy) lub ≥ 37,5oC (temperatura mierzona pod pachą lub w ustach).
Tabelaryczny wykaz działań niepożądanych
Działania niepożądane wymienione są zgodnie z częstością występowania: Bardzo często ≥ 1/10
Często ≥ 1/100 do <1/10
Niezbyt często ≥ 1/1000 do <1/100
Rzadko ≥ 1/10 000 do <1/1000
Dane pochodzące z badań klinicznych
Klasyfikacja układów i narządów | Częstość | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Często | zakażenie górnych dróg oddechowych |
Niezbyt często | zapalenia ucha środkowego | |
Zaburzenia krwi i układu chłonnego | Niezbyt często | uogólnione powiększenie węzłów chłonnych |
Zaburzenia układu immunologicznego | Rzadko | reakcje alergiczne |
Zaburzenia metabolizmu i odżywiania | Niezbyt często | jadłowstręt |
Zaburzenia psychiczne | Niezbyt często | nerwowość, nietypowy płacz, bezsenność |
Zaburzenia układu nerwowego | Rzadko | drgawki gorączkowe |
Zaburzenia oka | Niezbyt często | zapalenie spojówek |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Niezbyt często | zapalenie oskrzeli, kaszel |
Zaburzenia układu pokarmowego | Niezbyt często | obrzęk ślinianki przyusznej, biegunka, wymioty |
Zaburzenia skóry i tkanki podskórnej | Często | wysypka |
Zaburzenia ogólne i stany w | Bardzo często | zaczerwienienie w miejscu podania, |
miejscu podania | gorączka (mierzona w odbytnicy ≥ 38°C; mierzona pod pachą lub w ustach ≥ 37,5°C) | |
Często | ból i obrzęk w miejscu podania, gorączka (mierzona w odbytnicy > 39,5°C; mierzona pod pachą lub w ustach > 39°C) |
Ogólnie, kategorie częstości występowania działań niepożądanych były podobne po podaniu pierwszej i drugiej dawki szczepionki, z wyjątkiem bólu w miejscu wstrzyknięcia, który występował często po pierwszej dawce szczepionki i bardzo często po drugiej dawce szczepionki.
Dane pochodzące z okresu po wprowadzeniu do obrotu
Poniższe działania niepożądane odnotowywano sporadycznie w ramach monitorowania po wprowadzeniu do obrotu.
Ponieważ te działania niepożądane były zgłaszane dobrowolnie i dotyczyły populacji o nieokreślonej wielkości, nie jest możliwe określenie częstości ich występowania.
Klasyfikacja układów i narządów | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Zapalenie opon mózgowo-rdzeniowych, objawy przypominające odrę, objawy przypominające świnkę (w tym zapalenie jąder, zapalenie najądrzy i zapalenie przyusznic) |
Zaburzenia krwi i układu chłonnego | Małopłytkowość (trombocytopenia), plamica małopłytkowa |
Zaburzenia układu immunologicznego | Reakcje anafilaktyczne |
Zaburzenia układu nerwowego | Zapalenie mózgu*, zapalenie móżdżku i objawy przypominające zapalenie móżdżku (w tym przejściowe zaburzenia chodu i przejściowa ataksja), zespół Guillain-Barré, poprzeczne zapalenie rdzenia, zapalenie nerwów obwodowych |
Zaburzenia naczyniowe | Zapalenie naczyń |
Zaburzenia skóry i tkanki podskórnej | Rumień wielopostaciowy |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Ból stawów, zapalenie stawów |
*Zapalenie mózgu było zgłaszane z częstością mniejszą niż 1 na 10 milionów dawek. Ryzyko wystąpienia zapalenia mózgu w następstwie podania szczepionki jest znacznie niższe niż ryzyko wystąpienia zapalenia mózgu spowodowanego przez choroby, przeciw którym szczepionka uodparnia (odra: 1 na 1 000 do 2 000 przypadków; świnka: 2-4 na 1000 przypadków, różyczka około 1 na 6 000 przypadków).
Przypadkowe donaczyniowe podanie szczepionki może wywołać ciężką reakcję, a nawet wstrząs. Natychmiastowe działania lecznicze, które należy podjąć, zależą od ciężkości reakcji (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przypadki przedawkowania (podania dawki do dwukrotnie większej niż zalecana) były zgłaszane podczas monitorowania działań niepożądanych po wprowadzeniu szczepionki do obrotu. Nie były one powiązane z wystąpieniem żadnych działań niepożądanych.
Grupa farmakoterapeutyczna: szczepionka przeciwwirusowa, kod ATC: J07BD52
Odpowiedź immunologiczna u dzieci w wieku 12 miesięcy i starszych
W badaniach klinicznych z udziałem dzieci w wieku od 12 miesięcy do 2 lat wykazano, iż
szczepionka PRIORIX jest wysoce immunogenna.
Szczepienie pojedynczą dawką szczepionki PRIORIX indukowało wytwarzanie przeciwciał przeciw odrze u 98,1%, przeciwko śwince u 94,4% oraz przeciwko różyczce u 100% uprzednio seronegatywnych zaszczepionych.
Dwa lata po szczepieniu pierwotnym wskaźniki serokonwersji wynosiły 93,4% dla odry, 94,4% dla świnki oraz 100% dla różyczki.
Mimo iż brak danych dotyczących skuteczności ochronnej szczepionki PRIORIX, immunogenność jest akceptowana jako wskaźnik skuteczności ochronnej. Jednakże, niektóre z badań wskazują, iż efektywność ochrony przed świnką może być niższa niż obserwowane wskaźniki serokonwersji wobec świnki.
Odpowiedź immunologiczna u dzieci w wieku od 9 do 10 miesięcy
Do udziału w badaniu klinicznym zakwalifikowano 300 zdrowych dzieci w wieku od 9 do 10 miesięcy, w czasie otrzymywania pierwszej dawki szczepionki. 147 dzieci z tej grupy otrzymało równocześnie szczepionki PRIORIX i VARILRIX. Wskaźniki serokonwersji dla odry, świnki i różyczki wynosiły odpowiednio 92,6%, 91,5% oraz 100%. Wskaźniki serokonwersji po podaniu drugiej dawki, podanej 3 miesiące po pierwszej dawce wynosiły 100% dla odry, 99,2% dla świnki oraz 100% dla różyczki. W związku z tym, aby zapewnić optymalną odpowiedź immunologiczną, druga dawka szczepionki PRIORIX powinna zostać podana w ciągu 3 miesięcy.
Młodzież i osoby dorosłe
Bezpieczeństwo i immunogenność szczepionki PRIORIX u młodzieży i osób dorosłych nie były szczegółowo badane w badaniach klinicznych.
Domięśniowa droga podania
Ograniczona liczba pacjentów otrzymała w trakcie badań klinicznych szczepionkę PRIORIX domięśniowo. Wskaźniki serokonwersji wobec 3 składników były porównywalne do tych obserwowanych w przypadku podskórnej drogi podania.
Ocena właściwości farmakokinetycznych nie jest wymagana dla szczepionek.
Dane niekliniczne, opierające się na ogólnych badaniach bezpieczeństwa, nie wykazują żadnego
ryzyka dla ludzi.
Proszek:
Aminokwasy (w tym fenyloalanina) Laktoza (bezwodna)
Mannitol (E 421)
Sorbitol (E 420)
Medium 199 (w tym fenyloalanina, kwas para-aminobenzoesowy, sód i potas)
Rozpuszczalnik:
Woda do wstrzykiwań.
Po rekonstytucji szczepionkę należy zużyć natychmiast. Jeśli nie jest to możliwe, powinna być
przechowywana w temperaturze 2C - 8C i zużyta w ciągu 8 godzin od jej rekonstytucji.
Proszek w fiolce (szkło typu I) z gumowym korkiem.
0,5 ml roztworu w ampułce (szkło typu I) – opakowania po 1, 10, 20, 25, 40 lub 100 sztuk.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
leczniczego do stosowania
Rozpuszczalnik oraz szczepionkę po rekonstytucji należy ocenić wizualnie przed rekonstytucją oraz przed podaniem pod kątem obecności obcych cząstek i (lub) zmian fizycznych. W przypadku stwierdzenia nieprawidłowości w wyglądzie, nie należy używać rozpuszczalnika lub przygotowanej szczepionki.
Szczepionkę należy poddać rekonstytucji poprzez dodanie do fiolki z proszkiem całej objętości rozpuszczalnika z ampułki. Następnie należy energicznie wstrząsnąć, do momentu całkowitego rozpuszczenia proszku.
Zależnie od niewielkich wahań pH, szczepionka po rekonstytucji może przybierać barwę od brzoskwiniowej do różowej o odcieniu fuksji, co pozostaje bez wpływu na jej skuteczność.
Należy pobrać całą zawartość fiolki.
Do podania szczepionki należy użyć nowej igły.
Należy unikać kontaktu szczepionki ze środkami dezynfekującymi (patrz punkt 4.4).
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
DOPUSZCZENIE DO OBROTU
GlaxoSmithKline Biologicals S.A. rue de l’Institut 89
1330 Rixensart, Belgia
Tel.: +32(0)2 656 8111
Fax.: +32(0)2 656 8000
Pozwolenie nr 4830
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 27 marca 2000
Data ostatniego przedłużenia pozwolenia: 20 listopada 2013
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
04/2022
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
dawka (0,5 ml) szczepionki po rekonstytucji zawiera:
Żywy atenuowany wirus odry1 (szczep Schwarz)
3
nie mniej niż 103,0 CCID50
Żywy atenuowany wirus świnki1 (szczep RIT 4385, pochodzący od
szczepu Jeryl Lynn)
3
nie mniej niż 103,7 CCID50
Żywy atenuowany wirus różyczki2 (szczep Wistar RA 27/3)
3
nie mniej niż 103,0 CCID50
1 namnażany w hodowli komórek zarodków kurzych
2 namnażany w hodowli ludzkich komórek diploidalnych MRC-5
3 CCID50 – wyznaczona statystycznie ilość wirusa mogąca w wyniku zaszczepienia zakazić 50%
hodowli komórkowej
Ta szczepionka zawiera śladowe ilości neomycyny. Patrz punkt 4.3. Substancje pomocnicze o znanym działaniu
Szczepionka zawiera 9 mg sorbitolu.
Szczepionka zawiera 6,5 nanograma kwasu para-aminobenzoesowego w każdej dawce
i 334 mikrogramy fenyloalaniny w każdej dawce (patrz punkt 4.4). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Rodzaj i zawartość opakowania
z 1 osobną igłą: opakowania po 20 lub 40 sztuk
z 2 osobnymi igłami: opakowania po 1, 10, 25 lub 100 sztuk
bez igły: opakowania po 1, 10, 20, 25, 40 lub 100 sztuk
Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
PRIORIX, proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań Szczepionka przeciw odrze, śwince i różyczce, żywa
Proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań.
Liofilizowane komponenty odry, świnki i różyczki (MMR) mają postać proszku barwy białej do lekko
różowej.
Rozpuszczalnik jest przezroczystym i bezbarwnym roztworem.
PRIORIX jest przeznaczony do czynnego uodparniania przeciwko odrze, śwince i różyczce dzieci po ukończeniu 9. miesiąca życia, młodzieży oraz osób dorosłych.
W celu uzyskania informacji dotyczącej stosowania u dzieci w wieku od 9 do 12 miesięcy, patrz
punkty 4.2, 4.4 i 5.1.
Dawkowanie
Szczepionka PRIORIX powinna być stosowana zgodnie z oficjalnymi zaleceniami.
Osoby w wieku 12 miesięcy i starsze
Zaleca się podanie jednej dawki (0,5 ml) szczepionki. Druga dawka powinna zostać podana zgodnie z
oficjalnymi zaleceniami.
Szczepionka PRIORIX może być stosowana u osób, które zostały uprzednio zaszczepione inną monowalentną lub skojarzoną szczepionką przeciw odrze, śwince i różyczce.
Niemowlęta w wieku od 9 do 12 miesięcy
Niemowlęta w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi na składniki szczepionki. W przypadku, gdy sytuacja epidemiologiczna wymaga szczepienia niemowląt w pierwszym roku ich życia (np. wybuch epidemii lub podróż w rejony endemiczne), druga dawka szczepionki PRIORIX powinna zostać podana w drugim roku życia, najlepiej w ciągu 3 miesięcy od podania pierwszej dawki. W żadnym przypadku odstęp pomiędzy dawkami nie powinien być krótszy niż 4 tygodnie (patrz punkty 4.4 i 5.1).
Niemowlęta w wieku poniżej 9 miesięcy
Nie określono bezpieczeństwa stosowania ani skuteczności szczepionki PRIORIX u niemowląt w wieku poniżej 9 miesięcy.
Sposób podawania
PRIORIX podaje się podskórnie, jakkolwiek można także podać domięśniowo, w obszar mięśnia
naramiennego lub w przednio-boczną część uda (patrz punkty 4.4 i 5.1).
Szczepionka powinna zostać podana podskórnie u pacjentów z trombocytopenią lub u których występują zaburzenia krzepnięcia (patrz punkt 4.4).
Instrukcja dotycząca rekonstytucji produktu leczniczego przed podaniem, patrz punkt 6.6.
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1 lub neomycynę. Stwierdzone w wywiadzie kontaktowe zapalenie skóry wywołane przez neomycynę nie jest przeciwwskazaniem do szczepienia. W celu uzyskania informacji dotyczących reakcji nadwrażliwości na białko jaja kurzego, patrz punkt 4.4.
Ciężki humoralny lub komórkowy (pierwotny lub nabyty) niedobór odporności, np. ciężki, złożony niedobór odporności, agammaglobulinemia lub AIDS lub objawowe zakażenie wirusem HIV, lub właściwy dla wieku odsetek limfocytów T CD4+ u dzieci w wieku poniżej 12 miesięcy z CD4+
<25%; w wieku między 12 a 35 miesięcy z CD4+ <20%; w wieku między 36 a 59 miesięcy z CD4+
<15% (patrz punkt 4.4).
Ciąża. Ponadto, należy unikać zajścia w ciążę przez 1 miesiąc po zaszczepieniu (patrz punkt 4.6).
Tak jak w przypadku innych szczepionek, u osób w okresie ostrych i ciężkich chorób przebiegających z gorączką podanie szczepionki powinno być odroczone. Łagodna infekcja, taka jak przeziębienie, nie jest przeciwwskazaniem do szczepienia.
Identyfikowalność
W celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę i numer serii podawanego produktu.
Podobnie jak w przypadku wszystkich szczepionek podawanych w iniekcji, istnieje możliwość wystąpienia rzadkiej reakcji anafilaktycznej, dlatego należy zapewnić możliwość fachowej opieki medycznej bezpośrednio po szczepieniu.
Alkohol, a także inne środki dezynfekujące powinny wyparować ze skóry przed podaniem szczepionki, ponieważ mogą unieczynnić atenuowane wirusy znajdujące się w szczepionce.
Niemowlęta szczepione w pierwszym roku życia mogą nie wytworzyć wystarczającej odpowiedzi immunologicznej na składniki szczepionki, w związku z możliwą obecnością przeciwciał matczynych w ich organizmie (patrz punkty 4.2 i 5.1).
Szczególna ostrożność powinna zostać zachowana w przypadku podawania szczepionki PRIORIX osobom z zaburzeniami ośrodkowego układu nerwowego, u których istnieje ryzyko występowania drgawek gorączkowych lub u osób z drgawkami w wywiadzie rodzinnym. Osoby z przebytymi drgawkami gorączkowymi, powinny być ściśle monitorowane.
Zawarte w szczepionce wirusy odry i świnki są uzyskiwane z hodowli komórek zarodka kurzego i z tego powodu mogą zawierać śladowe ilości białka jaja. Osoby z reakcjami anafilaktycznymi, anafilaktoidalnymi lub innymi reakcjami typu natychmiastowego w wywiadzie (np. uogólniona pokrzywka, obrzęk jamy ustnej i gardła, trudności w oddychaniu, obniżenie ciśnienia tętniczego lub wstrząs) występującymi po spożyciu jaj mogą być bardziej narażone na wystąpienie reakcji typu natychmiastowego po szczepieniu, chociaż jak wykazano, reakcje te są bardzo rzadkie. Podczas szczepienia tych osób, należy zachować szczególną ostrożność oraz zapewnić dostępność odpowiednich środków leczniczych na wypadek wystąpienia reakcji nadwrażliwości.
Ograniczona ochrona przeciw odrze może zostać uzyskana przez zaszczepienie w ciągu 72 godzin od momentu narażenia na zarażenie naturalnie występującą odrą.
Utrata przytomności (omdlenie) może wystąpić po podaniu lub nawet przed podaniem szczepionki, szczególnie u młodzieży, jako reakcja psychogenna na ukłucie igłą. Mogą temu towarzyszyć objawy neurologiczne, takie jak przemijające zaburzenia widzenia, parestezje oraz toniczno-kloniczne ruchy kończyn podczas odzyskiwania przytomności. Ważne jest zachowanie odpowiednich procedur, aby uniknąć urazów podczas omdleń.
Tak jak w przypadku wszystkich szczepionek, nie wszystkie zaszczepione osoby mogą wytworzyć ochronny poziom przeciwciał.
PRIORIX W ŻADNYM PRZYPADKU NIE MOŻE BYĆ PODAWANY DONACZYNIOWO.
Trombocytopenia
Przypadki nasilenia lub nawrotu trombocytopenii u osób chorujących na tę chorobę były zgłaszane po podaniu pierwszej dawki żywych szczepionek przeciwko odrze, śwince, różyczce. Trombocytopenia związana ze szczepieniem szczepionką MMR jest rzadka i zasadniczo samoograniczająca. U pacjentów z istniejącą trombocytopenią lub historią trombocytopenii po szczepieniu przeciw odrze, śwince i różyczce należy dokładnie ocenić stosunek korzyści do ryzyka wynikający ze szczepienia szczepionką PRIORIX. Tych pacjentów należy szczepić z zachowaniem ostrożności i wykorzystując podskórną drogę podania.
Pacjenci z upośledzoną odpornością
Można rozważyć szczepienie pacjentów z wybranymi rodzajami niedoborów odporności w przypadku, gdy korzyści przewyższają ryzyko (np. pacjenci z bezobjawowym zakażeniem HIV, niedobór podklas IgG, wrodzona neutropenia, przewlekła choroba ziarniakowa oraz choroby przebiegające z niedoborem dopełniacza).
Pacjenci z niedoborami odporności, u których nie stwierdza się przeciwwskazań do szczepienia (patrz punkt 4.3), mogą zareagować słabiej niż pacjenci z prawidłową czynnością układu immunologicznego; dlatego w przypadku kontaktu z patogenami niektóre z tych osób mogą zachorować na odrę, świnkę lub różyczkę pomimo prawidłowego podania szczepionki. Tych pacjentów należy starannie monitorować pod kątem występowania objawów odry, świnki i różyczki.
Przenoszenie
Przeniesienie wirusów odry i świnki ze szczepionki na osoby podatne na zachorowanie nie zostało nigdy udokumentowane. Wydalanie wirusów różyczki i odry do gardła występuje około 7 do 28 dni po szczepieniu, ze szczytową ilością wydalania około 11 dnia. Jednakże brak jest dowodów transmisji tych wydalonych wirusów na osoby podatne na zachorowanie. Przeniesienie wirusa różyczki na niemowlęta poprzez mleko matki oraz transmisja wirusa przez łożysko zostały udokumentowane, bez żadnego dowodu na wystąpienie klinicznych objawów choroby.
Substancje pomocnicze o znanym działaniu
Priorix zawiera kwas para-aminobenzoesowy. Może powodować reakcje alergiczne (możliwe reakcje typu późnego) i wyjątkowo skurcz oskrzeli.
Szczepionka zawiera 334 mikrogramy fenyloalaniny w każdej dawce. Fenyloalanina może być szkodliwa dla pacjentów z fenyloketonurią (PKU).
Ta szczepionka zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy szczepionkę uznaje się za
„wolną od sodu”.
Ta szczepionka zawiera potas, mniej niż 1 mmol (39 mg) potasu na dawkę, to znaczy szczepionkę uznaje się za „wolną od potasu”.
Badania kliniczne wykazały, że szczepionka PRIORIX może zostać podana jednocześnie z każdą z następujących monowalentnych lub skojarzonych szczepionek [w tym sześciowalentnymi szczepionkami (DTPa-HBV-IPV/Hib)]: szczepionką przeciwko błonicy, tężcowi, krztuścowi (bezkomórkowa) (DTPa), szczepionką przeciwko błonicy, tężcowi, krztuścowi (bezkomórkowa) o zmniejszonej zawartości antygenów (dTpa), szczepionką przeciw Haemophilus influenzae typu B (Hib), inaktywowaną szczepionką przeciw polio (IPV), szczepionką przeciw wirusowemu zapaleniu wątroby typu B (HBV), szczepionką przeciw wirusowemu zapaleniu wątroby typu A (HAV), szczepionką przeciw meningokokom grupy B (MenB), szczepionką skoniugowaną przeciw meningokokom grupy C (MenC), szczepionką skoniugowaną przeciwko meningokokom grupy A, C, W135 i Y (MenACWY), szczepionką przeciw ospie wietrznej (VZV), doustną szczepionką przeciw polio (OPV) oraz skoniugowaną szczepionką przeciw pneumokokom, zgodnie z oficjalnymi zaleceniami.
Z uwagi na zwiększone ryzyko wystąpienia gorączki, tkliwości w miejscu wstrzyknięcia, zmiany nawyków żywieniowych i drażliwości w przypadku podawania szczepionki Bexsero równocześnie ze skojarzoną szczepionką przeciw odrze, śwince, różyczce i ospie wietrznej (MMR-V), należy rozważyć oddzielne podanie szczepionki PRIORIX o ile to możliwe.
Brak danych uzasadniających stosowanie PRIORIX z jakimikolwiek innymi szczepionkami.
W przypadku równoczesnego podawania szczepionki PRIORIX z innymi szczepionkami podawanymi
w drodze iniekcji, szczepionki należy zawsze podawać w różne miejsca.
Jeżeli PRIORIX nie może być podany w tym samym czasie, co inne szczepionki zawierające żywe, atenuowane wirusy, należy zachować odstęp co najmniej jednego miesiąca pomiędzy szczepieniami.
Jeżeli istnieje konieczność przeprowadzenia testów tuberkulinowych, należy je wykonać przed lub równocześnie z podaniem szczepionki, ponieważ istnieją doniesienia, że szczepionki przeciw odrze, śwince i różyczce mogą spowodować przejściowe obniżenie wrażliwości skórnej na tuberkulinę.
Anergia ta może utrzymywać się do 6 tygodni po szczepieniu i w tym okresie nie należy przeprowadzać prób tuberkulinowych, aby uniknąć fałszywie ujemnych wyników.
U pacjentów, którzy otrzymywali ludzką immunoglobulinę lub transfuzję krwi należy wstrzymać się z podawaniem szczepionki przez okres trzech miesięcy lub dłużej (aż do 11 miesięcy) w zależności od dawki ludzkiej immunoglobuliny jaka została podana, z powodu możliwości niewytworzenia u nich odporności na skutek obecności biernie nabytych przeciwciał przeciwko śwince, odrze lub różyczce.
Płodność
Szczepionka PRIORIX nie była oceniana w badaniach dotyczących płodności. Ciąża
Kobiety w okresie ciąży nie powinny być szczepione szczepionką Priorix.
Nie udokumentowano jednak przypadków uszkodzenia płodu po podaniu szczepionki przeciwko
odrze, śwince lub różyczce kobietom w okresie ciąży.
Chociaż teoretycznie nie można wykluczyć takiego ryzyka, nie zgłoszono żadnego przypadku zespołu różyczki wrodzonej u ponad 3500 nieświadomych wczesnej ciąży, podatnych na zakażenie kobiet, którym podano szczepionkę zawierającą komponentę różyczki. Z tego względu nieumyślne podanie szczepionki zawierającej komponentę odry, świnki i różyczki nieświadomej ciąży kobiecie nie powinno być powodem przerwania ciąży.
Należy unikać zajścia w ciążę przez okres 1 miesiąca od zaszczepienia. Kobiety, które planują ciążę powinny zostać pouczone o konieczności opóźnienia tej decyzji.
Karmienie piersią
Istnieją tylko ograniczone doniesienia dotyczące stosowania szczepionki PRIORIX w okresie karmienia piersią. Badania wykazały, ze kobiety karmiące piersią po porodzie, zaszczepione żywą, atenuowaną szczepionką przeciw różyczce mogą wydzielać wirusy wraz z mlekiem i przenosić je na dziecko karmione piersią, bez dowodu na wystąpienie klinicznych objawów choroby. Jedynie w przypadku, gdy zostanie potwierdzone lub gdy przypuszcza się, iż dziecko ma obniżoną odporność, należy przeprowadzić analizę korzyści i ryzyka wynikającego ze szczepienia matki (patrz punkt 4.3).
PRIORIX nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Przedstawiony profil bezpieczeństwa oparty jest na danych uzyskanych z badań klinicznych, w
których uczestniczyło około 12 000 osób zaszczepionych szczepionką PRIORIX.
Działania niepożądane, które mogą wystąpić po podaniu skojarzonej szczepionki przeciw odrze, śwince i różyczce są takie same, jak objawy obserwowane po podaniu szczepionek monowalentnych osobno lub w formie skojarzonej.
W kontrolowanych badaniach klinicznych aktywnie monitorowano objawy występujące po szczepieniu w czasie 42 dniowej obserwacji. Osoby zaszczepione były również proszone o odnotowywanie wszelkich zdarzeń klinicznych pojawiających się w trakcie trwania badania.
Najczęstszymi działaniami niepożądanymi występującymi po podaniu szczepionki PRIORIX były zaczerwienienie w miejscu podania oraz gorączka ≥ 38oC (mierzona w odbytnicy) lub ≥ 37,5oC (temperatura mierzona pod pachą lub w ustach).
Tabelaryczny wykaz działań niepożądanych
Działania niepożądane wymienione są zgodnie z częstością występowania: Bardzo często ≥ 1/10
Często ≥ 1/100 do <1/10
Niezbyt często ≥ 1/1000 do <1/100
Rzadko ≥ 1/10 000 do <1/1000
Dane pochodzące z badań klinicznych
Klasyfikacja układów i narządów | Częstość | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Często | zakażenie górnych dróg oddechowych |
Niezbyt często | zapalenia ucha środkowego | |
Zaburzenia krwi i układu chłonnego | Niezbyt często | uogólnione powiększenie węzłów chłonnych |
Zaburzenia układu immunologicznego | Rzadko | reakcje alergiczne |
Zaburzenia metabolizmu i odżywiania | Niezbyt często | jadłowstręt |
Zaburzenia psychiczne | Niezbyt często | nerwowość, nietypowy płacz, bezsenność |
Zaburzenia układu nerwowego | Rzadko | drgawki gorączkowe |
Zaburzenia oka | Niezbyt często | zapalenie spojówek |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Niezbyt często | zapalenie oskrzeli, kaszel |
Zaburzenia układu pokarmowego | Niezbyt często | obrzęk ślinianki przyusznej, biegunka, wymioty |
Zaburzenia skóry i tkanki podskórnej | Często | wysypka |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | zaczerwienienie w miejscu podania, gorączka (mierzona w odbytnicy ≥ 38°C; mierzona pod pachą lub w ustach ≥ 37,5°C) |
Często | ból i obrzęk w miejscu podania, gorączka (mierzona w odbytnicy > 39,5°C; |
mierzona pod pachą lub w ustach > 39°C) |
Ogólnie, kategorie częstości występowania działań niepożądanych były podobne po podaniu pierwszej i drugiej dawki szczepionki, z wyjątkiem bólu w miejscu wstrzyknięcia, który występował często po pierwszej dawce szczepionki i bardzo często po drugiej dawce szczepionki.
Dane pochodzące z okresu po wprowadzeniu do obrotu
Poniższe działania niepożądane odnotowywano sporadycznie w ramach monitorowania po wprowadzeniu do obrotu.
Ponieważ te działania niepożądane były zgłaszane dobrowolnie i dotyczyły populacji o nieokreślonej wielkości, nie jest możliwe określenie częstości ich występowania.
Klasyfikacja układów i narządów | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Zapalenie opon mózgowo-rdzeniowych, objawy przypominające odrę, objawy przypominające świnkę (w tym zapalenie jąder, zapalenie najądrzy i zapalenie przyusznic) |
Zaburzenia krwi i układu chłonnego | Małopłytkowość (trombocytopenia), plamica małopłytkowa |
Zaburzenia układu immunologicznego | Reakcje anafilaktyczne |
Zaburzenia układu nerwowego | Zapalenie mózgu*, zapalenie móżdżku i objawy przypominające zapalenie móżdżku (w tym przejściowe zaburzenia chodu i przejściowa ataksja), zespół Guillain-Barré, poprzeczne zapalenie rdzenia, zapalenie nerwów obwodowych |
Zaburzenia naczyniowe | Zapalenie naczyń |
Zaburzenia skóry i tkanki podskórnej | Rumień wielopostaciowy |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Ból stawów, zapalenie stawów |
*Zapalenie mózgu było zgłaszane z częstością mniejszą niż 1 na 10 milionów dawek. Ryzyko wystąpienia zapalenia mózgu w następstwie podania szczepionki jest znacznie niższe niż ryzyko wystąpienia zapalenia mózgu spowodowanego przez choroby, przeciw którym szczepionka uodparnia (odra: 1 na 1 000 do 2 000 przypadków; świnka: 2-4 na 1000 przypadków, różyczka około 1 na 6 000 przypadków).
Przypadkowe donaczyniowe podanie szczepionki może wywołać ciężką reakcję, a nawet wstrząs. Natychmiastowe działania lecznicze, które należy podjąć, zależą od ciężkości reakcji (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przypadki przedawkowania (podania dawki do dwukrotnie większej niż zalecana) były zgłaszane podczas monitorowania działań niepożądanych po wprowadzeniu szczepionki do obrotu. Nie były one powiązane z wystąpieniem żadnych działań niepożądanych.
Grupa farmakoterapeutyczna: szczepionka przeciwwirusowa, kod ATC: J07BD52
Odpowiedź immunologiczna u dzieci w wieku 12 miesięcy i starszych
W badaniach klinicznych z udziałem dzieci w wieku od 12 miesięcy do 2 lat wykazano, iż
szczepionka PRIORIX jest wysoce immunogenna.
Szczepienie pojedynczą dawką szczepionki PRIORIX indukowało wytwarzanie przeciwciał przeciw odrze u 98,1%, przeciwko śwince u 94,4% oraz przeciwko różyczce u 100% uprzednio seronegatywnych zaszczepionych.
Dwa lata po szczepieniu pierwotnym wskaźniki serokonwersji wynosiły 93,4% dla odry 94,4% dla świnki oraz 100% dla różyczki.
Mimo iż brak danych dotyczących skuteczności ochronnej szczepionki PRIORIX, immunogenność jest akceptowana jako wskaźnik skuteczności ochronnej. Jednakże, niektóre z badań wskazują, iż efektywność ochrony przed świnką może być niższa niż obserwowane wskaźniki serokonwersji wobec świnki.
Odpowiedź immunologiczna u dzieci w wieku od 9 do 10 miesięcy
Do udziału w badaniu klinicznym zakwalifikowano 300 zdrowych dzieci w wieku od 9 do 10 miesięcy, w czasie otrzymywania pierwszej dawki szczepionki. 147 dzieci z tej grupy otrzymało równocześnie szczepionki PRIORIX i VARILRIX. Wskaźniki serokonwersji dla odry, świnki i różyczki wynosiły odpowiednio 92,6%, 91,5% oraz 100%. Wskaźniki serokonwersji po podaniu drugiej dawki, podanej 3 miesiące po pierwszej dawce wynosiły 100% dla odry, 99,2% dla świnki i 100% dla różyczki. W związku z tym, aby zapewnić optymalną odpowiedź immunologiczną, druga dawka szczepionki PRIORIX powinna zostać podana w ciągu 3 miesięcy.
Młodzież i osoby dorosłe
Bezpieczeństwo i immunogenność szczepionki PRIORIX u młodzieży i osób dorosłych nie były szczegółowo badane w badaniach klinicznych.
Domięśniowa droga podania
Ograniczona liczba pacjentów otrzymała w trakcie badań klinicznych szczepionkę PRIORIX domięśniowo. Wskaźniki serokonwersji wobec 3 składników były porównywalne do tych obserwowanych w przypadku podskórnej drogi podania.
Ocena właściwości farmakokinetycznych nie jest wymagana dla szczepionek.
Dane niekliniczne, opierające się na ogólnych badaniach bezpieczeństwa, nie wykazują żadnego
ryzyka dla ludzi.
Proszek:
Aminokwasy (w tym fenyloalanina) Laktoza (bezwodna)
Mannitol (E 421)
Sorbitol (E 420)
Medium 199 (w tym fenyloalanina, kwas para-aminobenzoesowy, sód i potas)
Rozpuszczalnik:
Woda do wstrzykiwań.
Po rekonstytucji szczepionkę należy zużyć natychmiast. Jeśli nie jest to możliwe, powinna być
przechowywana w temperaturze 2C - 8C i zużyta w ciągu 8 godzin od jej rekonstytucji.
Proszek w fiolce (szkło typu I) z gumowym korkiem.
0,5 ml roztworu w ampułko-strzykawce (szkło typu I) z gumową zatyczką tłoka z lub bez igieł w następujących wielkościach opakowań:
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
leczniczego do stosowania
Rozpuszczalnik oraz szczepionkę po rekonstytucji należy ocenić wizualnie przed rekonstytucją oraz przed podaniem pod kątem obecności obcych cząstek i (lub) zmian fizycznych. W przypadku stwierdzenia nieprawidłowości w wyglądzie, nie należy używać rozpuszczalnika lub przygotowanej szczepionki.
Szczepionkę należy poddać rekonstytucji poprzez dodanie całego rozpuszczalnika z ampułko- strzykawki do fiolki z proszkiem.
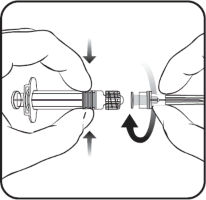
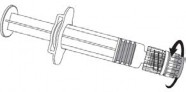
Aby dołączyć igłę do ampułko-strzykawki należy uważnie zapoznać się z instrukcją przedstawioną pod rysunkami 1 i 2. Ampułko-strzykawka dostarczana ze szczepionką PRIORIX może jednak różnić się nieznacznie od przedstawionej na rysunku (może nie mieć gwintu do wkręcania igły). W takim przypadku igła powinna być zamocowana bez wkręcania.
Nasadka igły
Osłonka igły

Igła
Adapter Luer Lock
Korpus strzykawki
Ampułko-strzykawka
Tłok ampułko-strzykawki
Nasadka na ampułko-strzykawkę
Rysunek 1. Rysunek 2.
Należy zawsze trzymać ampułko-strzykawkę za jej korpus, nie za tłok ani za adapter Luer Lock (ang. Luer Lock Adaptor, LLA), a igłę należy utrzymywać w osi ampułko-strzykawki (jak przedstawiono na rysunku 2.). Niezastosowanie się do tych zaleceń może spowodować przekrzywienie adaptera LLA i wyciek z ampułko-strzykawki.
Jeśli podczas przyłączania igły do ampułko-strzykawki dojdzie do odłączenia się adaptera LLA,
należy użyć nowej dawki szczepionki (nowej ampułko-strzykawki i fiolki).
DOPUSZCZENIE DO OBROTU
GlaxoSmithKline Biologicals S.A. rue de l’Institut 89
1330 Rixensart, Belgia
Tel.: +32(0)2 656 8111
Fax.: +32(0)2 656 8000
Pozwolenie nr 4830
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 27 marca 2000
Data ostatniego przedłużenia pozwolenia: 20 listopada 2013
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
04/2022











