Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
u pacjentów z suchym zapaleniem błony śluzowej nosa (rhinitis sicca),
po przezklinowym usunięciu przysadki mózgowej lub innych operacjach przebiegających z odsłonięciem opony twardej,
u dzieci w wieku poniżej 6 lat.
Produkt leczniczy nasic zawiera chlorek benzalkoniowy, dlatego nie powinien być stosowany przez osoby ze stwierdzoną nadwrażliwością na tę substancję konserwującą.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
pacjentów przyjmujących inhibitory monoaminooksydazy (inhibitory MAO) lub inne leki, które mogą powodować wzrost ciśnienia tętniczego krwi,
pacjentów ze zwiększonym ciśnieniem wewnątrzgałkowym, szczególnie z jaskrą z wąskim kątem przesączania,
pacjentów z ciężkimi chorobami układu sercowo-naczyniowego (np. choroba niedokrwienna serca, nadciśnienie),
pacjentów z guzem chromochłonnym,
pacjentów z chorobami metabolicznymi (np. nadczynność tarczycy, cukrzyca),
pacjentów z nadwrażliwością na substancje sympatykomimetyczne. Zastosowanie produktu u osób z taką nadwrażliwością może powodować bezsenność, zawroty głowy, drżenie,
zaburzenia rytmu serca i podwyższenie ciśnienia tętniczego,
pacjentów z porfirią,
pacjentów z rozrostem prostaty.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
nasic, (0,1 mg + 5,0 mg)/dawkę, aerozol do nosa, roztwór
Jedna dawka aerozolu do nosa (0,1 ml roztworu, co odpowiada 0,10 g) zawiera 0,1 mg ksylometazoliny chlorowodorku (Xylometazolini hydrochloridum) i 5,0 mg deksopantenolu (Dexpanthenolum).
Substancja pomocnicza o znanym działaniu:
Jedna uwolniona dawka 0,1 ml roztworu (odpowiadająca 0,10 g) zawiera 0,02 mg chlorku benzalkoniowego.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Aerozol do nosa, roztwór
Przezroczysty, bezbarwny roztwór.
Produkt leczniczy nasic jest wskazany w objawowym leczeniu niedrożności przewodów nosowych
w przebiegu przeziębienia oraz po przebytej operacji nosa - dla pobudzenia gojenia się błony śluzowej i poprawy drożności nosa.
Produkt leczniczy nasic jest wskazany do stosowania u dorosłych i dzieci w wieku powyżej 6 lat.
Dawkowanie
Dorośli oraz dzieci w wieku powyżej 6 lat:
po jednej dawce aerozolu do każdego otworu nosowego, w razie konieczności do trzech razy na dobę, trzymając butelkę pionowo jednocześnie delikatnie wciągając powietrze nosem.
Dawkowanie zależy od indywidualnej wrażliwości pacjenta i odpowiedzi klinicznej.
Produktu leczniczego nasic nie należy stosować dłużej niż 7 dni, chyba że na zalecenie lekarza. Należy zawsze zasięgnąć porady lekarza odnośnie okresu podawania leku u dzieci.
Powinna nastąpić kilkudniowa przerwa przed ponownym zastosowaniem. Nie należy stosować dawek większych niż zalecane.
Sposób podawania
Produkt leczniczy nasic jest przeznaczony wyłącznie do stosowania donosowego. Szczegółowa instrukcja stosowania produktu leczniczego nasic, patrz punkt 6.6.
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Nie należy stosować:
Ten produkt leczniczy powinien być stosowany tylko po uważnej ocenie korzyści i ryzyka w przypadku:
Pacjenci z zespołem długiego odstępu QT leczeni ksylometazoliną mogą być w większym stopniu narażeni na ciężkie arytmie komorowe.
Z powodu niebezpieczeństwa zaniku błony śluzowej nosa stosowanie produktu leczniczego
w przewlekłym zapaleniu śluzówki nosa powinno odbywać się jedynie pod nadzorem lekarza.
Ten produkt leczniczy zawiera 0,02 mg chlorku benzalkoniowego w każdej jednostce dawkowania 0,1 ml (odpowiadającej 0,1 g) roztworu. Chlorek benzalkoniowy może powodować podrażnienie lub obrzęk wewnątrz nosa, zwłaszcza przy długotrwałym stosowaniu.
Dodatkowe informacje:
Długotrwałe stosowanie i stosowanie w dawkach większych niż zalecane leków sympatykomimetycznych zmniejszających przekrwienie może prowadzić do reaktywnego przekrwienia błony śluzowej nosa.
Ten efekt „odbicia” prowadzi do zwężenia dróg oddechowych, co powoduje, że pacjent wielokrotnie stosuje produkt, aż jego stosowanie staje się trwałe. Konsekwencją tego jest przewlekły obrzęk (rhinitis medicamentosa), a nawet zanik błony śluzowej nosa (ozena).
W łagodniejszych przypadkach może być odpowiednie przerwanie stosowania leku sympatykomimetycznego najpierw w jednym z otworów nosowych, a po ustąpieniu objawów podanie w drugim otworze nosowym w celu utrzymania oddychania w części nosa.
Ze względu na ryzyko przeniesienia zakażenia, opakowanie leku powinno być stosowane tylko przez jednego pacjenta.
Chlorowodorek ksylometazoliny:
Podczas jednoczesnego stosowania z inhibitorami monoaminooksydazy typu tranylcyprominy lub trójpierścieniowymi lekami przeciwdepresyjnymi, jak i również produktami leczniczymi
zwiększającymi ciśnienie krwi, może nastąpić wzrost ciśnienia krwi będący wynikiem działania tych leków na układ sercowo-naczyniowy.
Deksopantenol:
Nieznane.
Badania dotyczące wpływu produktu na rozwój płodu są niewystarczające, dlatego produktu leczniczego nasic nie należy stosować u kobiet w ciąży.
Nie wiadomo, czy chlorowodorek ksylometazoliny przenika do mleka matki, dlatego produktu leczniczego nasic nie należy stosować u kobiet karmiących piersią.
Jeżeli produkt jest stosowany zgodnie z zaleceniami wówczas nie należy spodziewać się wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
W ocenie działań niepożądanych zastosowano następujące kryteria częstości: bardzo często (≥ 1/10);
często (≥ 1/100 do < 1/10);
niezbyt często (≥ 1/1 000 do < 1/100); rzadko (≥ 1/10 000 do < 1/1 000); bardzo rzadko (< 1/10 000);
częstość nieznana (nie może być określona na podstawie dostępnych danych).
Zaburzenia układu nerwowego
Bardzo rzadko: pobudzenie, bezsenność, zmęczenie (np. senność, sedacja), ból głowy, halucynacje (szczególnie u dzieci)
Zaburzenia serca
Rzadko: palpitacja, tachykardia Bardzo rzadko: arytmie serca
Zaburzenia naczyniowe
Rzadko: nadciśnienie
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Bardzo rzadko: zwiększony obrzęk błony śluzowej w wyniku osłabienia działania leku, krwawienie z nosa
Częstość nieznana: uczucie pieczenia i suchości błony śluzowej nosa, kichanie
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Bardzo rzadko: drgawki (szczególnie u dzieci)
Zaburzenia układu immunologicznego
Niezbyt często: reakcje nadwrażliwości (np. obrzęk naczynioruchowy, wysypka, świąd)
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych,
Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181 C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Chlorowodorek ksylometazoliny:
Obraz kliniczny zatrucia pochodnymi imidazolu może być mylący, ponieważ fazy pobudzenia mogą zmieniać się z fazami hamowania ośrodkowego układu nerwowego, serca i układu krążenia.
Szczególnie u dzieci często po zatruciu pojawiają się dominujące działania na ośrodkowy układ nerwowy ze skurczami i śpiączką, bradykardią, bezdechem, zarówno jak i wzmożonym napięciem mięśniowym, po którym nastąpić może niedociśnienie.
Objawy pobudzenia ośrodkowego układu nerwowego to niepokój, pobudzenie, halucynacje i drgawki. Objawy zahamowania czynności ośrodkowego układu nerwowego to obniżenie temperatury ciała,
zmęczenie, senność i śpiączka.
Ponadto mogą wystąpić następujące objawy: zwężenie źrenic, rozszerzenie źrenic, pocenie się, gorączka, bladość, sinica, nudności, tachykardia, bradykardia, zaburzenie rytmu serca, zatrzymanie akcji serca, nadciśnienie, podciśnienie podobne do wstrząsu, obrzęk płuc, zaburzenia oddychania
i bezdech.
Postępowanie w przypadku przedawkowania
W przypadku ciężkiego zatrucia wskazane jest intensywne leczenie szpitalne.
Z powodu szybkiego wchłaniania ksylometazoliny powinno się natychmiast zastosować węgiel (absorbent), siarczan sodu (środek przeczyszczający) lub płukanie żołądka (w przypadku dużych ilości). W celu obniżenia ciśnienia krwi można zastosować nieselektywny alfa bloker.
Środki wazopresyjne są przeciwwskazane. Jeśli konieczne, należy podać leki przeciwgorączkowe, przeciwdrgawkowe oraz tlen.
Deksopantenol:
Kwas pantotenowy i jego pochodne, włącznie z deksopantenolem, wykazują bardzo małą toksyczność. W razie przedawkowania nie jest konieczne specjalne postępowanie.
Grupa farmakoterapeutyczna: Leki udrożniające nos i inne produkty do stosowania miejscowego do nosa. Sympatykomimetyki w skojarzeniu z innymi lekami, z wyjątkiem kortykosteroidów.
kod ATC: R 01 AB 06
Chlorowodorek ksylometazoliny:
Chlorowodorek ksylometazoliny to pochodna imidazoliny o działaniu sympatykomimetycznym, głównie na receptory α-adrenergiczne. Jest lekiem obkurczającym naczynia krwionośne nosa,
w wyniku czego zmniejsza obrzęk i przekrwienie błony śluzowej. Zmniejszenie przekrwienia błony śluzowej nosa ułatwia oddychanie przez nos pacjentom, u których występują objawy niedrożności przewodów nosowych w przebiegu przeziębienia i po przebytej operacji nosa. Działanie rozpoczyna się w ciągu kilku minut (zwykle w ciągu 5-10 minut) po podaniu.
Deksopantenol:
Deksopantenol jest pochodną alkoholową kwasu pantotenowego, należącą do grupy witamin B. Po przemianie w organizmie w główny składnik koenzymu A, bierze udział w procesach metabolizmu węglowodanów, tłuszczów i białek. Jest niezbędny do prawidłowego wzrostu, czynności układu nerwowego, regeneracji skóry i nabłonków. Bierze udział w wydzielaniu acetylocholiny i hormonów kory nadnerczy. Wpływa również na wzrost włosów i paznokci oraz przyspiesza gojenie się ran.
Chlorowodorek ksylometazoliny:
W przypadku donosowego podawania chlorowodorku ksylometazoliny, wchłonięta ilość leku może być wystarczająca do wywołania działania ogólnoustrojowego, np. w obrębie ośrodkowego układu nerwowego i (lub) układu sercowo-naczyniowego.
Brak danych farmakokinetycznych z badań przeprowadzonych u ludzi.
Deksopantenol:
Deksopantenol jest wchłaniany przez skórę i utleniany enzymatycznie do kwasu pantotenowego w organizmie. W osoczu witamina jest transportowana w postaci związanej z białkami. Kwas
pantotenowy jest składnikiem koenzymu A, który bierze udział w wielu procesach biochemicznych. Brak szczegółowych badań dotyczących metabolizmu deksopantenolu w obrębie skóry i błony śluzowej. Od 60 do 70% dawki podanej doustnie jest wydalane w moczu, a 30 do 40% z kałem.
Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących
bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, toksycznego wpływu na reprodukcję, genotoksyczności, potencjalnego działania rakotwórczego nie ujawniają szczególnego zagrożenia dla człowieka.
Benzalkoniowego chlorku roztwór Potasu diwodorofosforan
Disodu fosforan dwunastowodny Woda oczyszczona
Nie dotyczy.
3 lata.
Okres ważności po pierwszym otwarciu opakowania: 12 tygodni.
Brak specjalnych zaleceń dotyczących przechowywania.
Butelka z oranżowego szkła typu III, z zamontowaną pompką rozpylającą z PE i zamknięciem z PE w tekturowym pudełku. Butelka zawiera 10 ml roztworu.
lub
Butelka z oranżowego szkła z zakrętką PP, z dołączoną oddzielnie pompką rozpylającą i nasadką ochronną PE, w tekturowym pudełku. Butelka zawiera 10 ml roztworu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Instrukcja stosowania produktu leczniczego nasic
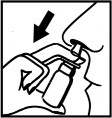
Szklana butelka z wmontowaną pompką rozpylającą
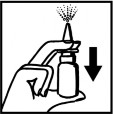
Zdjąć nasadkę ochronną z pompki. Przed pierwszym użyciem należy kilka razy nacisnąć pompkę aż do pojawienia się równomiernej mgły. Przy kolejnych aplikacjach preparat jest natychmiast gotowy do użytku. | |
| Końcówkę pompki wprowadzać możliwie pionowo do otworów nosowych i jeden raz przycisnąć pompkę. Ze względów higienicznych należy po użyciu wytrzeć końcówkę pompki i ponownie nałożyć na nią nasadkę ochronną. |
lub
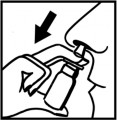
Szklana butelka z wkręcaną pompką rozpylającą
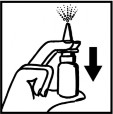
Zdjąć podłużną nasadkę ochronną z pompki rozpylającej. Odkręcić zakrętkę ze szklanej butelki i nakręcić końcówkę pompki rozpylającej. Następnie zdjąć nasadkę ochronną z końcówki dozownika. Przed pierwszym podaniem kilka razy nacisnąć pompkę aż do uzyskania jednolitej mgiełki. | |
| Wprowadzić końcówkę dozownika pionowo do otworu nosowego i nacisnąć pompkę w celu uwolnienia jednej dawki leku, jednocześnie delikatnie wciągnąć powietrze nosem. W ten sam sposób należy podać dawkę leku do drugiego otworu nosowego. Po użyciu oczyścić końcówkę dozownika i nałożyć na nią nasadkę ochronną. Przy następnych podaniach pompka dozująca będzie stale gotowa do dalszego użycia. |
M.C.M. Klosterfrau Healthcare Sp. z o.o. ul. Hrubieszowska 2
01-209 Warszawa
17443
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 01.12.2010 Data ostatniego przedłużenia pozwolenia: 18.05.2015