Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU /
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
- DOZYMETRIA
- INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
znakowania zestawów do sporządzania radiofarmaceutyków przeznaczonych do znakowania tym
roztworem;
w przypadku chorób tarczycy;
scyntygrafii gruczołów ślinowych: rozpoznanie przewlekłego zapalenia ślinianki (np.: zespół Sjögrena), jak również ocena funkcji wydzielniczej tkanki gruczołowej oraz drożności przewodów wyprowadzających; kontrolowanie odpowiedzi na działania lecznicze (w szczególności terapia radiojodem);
lokalizacji ektopowej błony śluzowej żołądka (uchyłek Meckela);
scyntygrafii kanalików łzowych: ocena drożności kanalików łzowych oraz kontrolowanie odpowiedzi na działania lecznicze.
Dawkowanie i sposób podawania
Scyntygrafia tarczycy: 20– 80 MBq
Scyntygrafia gruczołów ślinowych: do 150 MBq dla obrazów statycznych i do 370 MBq dla obrazów
dynamicznych
Scyntygrafia uchyłka Meckela: 300– 400 MBq
Scyntygrafia kanalików łzowych: 2-4 MBq na kroplę na jedno oko
Niewydolność nerek
Należy zachować szczególną ostrożność przy dawkowaniu aktywności pacjentom z niewydolnością nerek, gdyż stanowią oni grupę zwiększonego narażenia na promieniowanie.
Dzieci i młodzież
Dawkowanie należy szczególnie rozważyć u dzieci i młodzieży, biorąc pod uwagę wskazania kliniczne i ocenę stosunku korzyści do ryzyka w tej grupie pacjentów.
Aktywność do podania u dzieci i młodzieży określa się zgodnie z zaleceniami w karcie dawkowania pediatrycznego Europejskiego Towarzystwa Medycyny Nuklearnej (European Association of Nuclear Medicine, EANM). Aktywność do podania u dzieci i młodzieży określa się, mnożąc bazową aktywność (podaną na potrzeby obliczeń) przez podany w poniższej tabeli współczynnik zależności wagowej (patrz tabela 1).
A[MBq]Dawkowanie = aktywność bazowa x współczynnik
Scyntygrafia tarczycy: Podana aktywność [MBq] = 5,6 MBq x współczynnik (tabela 1). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka: Podana aktywność [MBq] = 10,5 MBq x współczynnik (tabela 1). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 20 MBq.
Tabela 1: Współczynniki zależności wagowej stosowane przy dawkowaniu u dzieci i młodzieży (w scyntygrafii tarczycy i identyfikacji/lokalizacji ektopowej błony śluzowej żołądka) zgodnie z wytycznymi EANM- 2014
Waga [kg]
Współczynnik
Waga [kg]
Współczynnik
Waga [kg]
Współczynnik
3
1
22
5,29
42
9,14
4
1,14
24
5,71
44
9,57
6
1,71
26
6,14
46
10,00
8
2,14
28
6,43
48
10,29
10
2,71
30
6,86
50
10,71
12
3,14
32
7,29
52–54
11,29
14
3,57
34
7,72
56–58
12,00
16
4,00
36
8,00
60–62
12,71
18
4,43
38
8,43
64–66
13,43
20
4,86
40
8,86
68
14,00
Scyntygrafia gruczołów ślinowych: Pediatryczna Grupa Robocza EANM (1990) zaleca wyliczenie dawki należnej na podstawie masy ciała dziecka zgodnie z tabelą podaną poniżej (patrz tabela 2). Minimalna aktywność wymagana dla uzyskania obrazu wystarczającej jakości wynosi 10 MBq.
Tabela 2: Współczynnik zależności wagowej stosowany przy dawkowaniu u dzieci i młodzieży (w scyntygrafii gruczołów ślinowych) zgodnie z zaleceniami EANM z roku 1990
Waga [kg]
Współczynnik
Waga [kg]
Współczynnik
Waga [kg]
Współczynnik
3
1
22
0,50
42
0,78
4
1,14
24
0,53
44
0,80
6
1,19
26
0,56
46
0,82
8
0,23
28
0,58
48
0,85
10
0,27
30
0,62
50
0,88
12
0,32
32
0,65
52–54
0,90
14
0,36
34
0,68
56–58
0,92
16
0,40
36
0,71
60–62
0,96
18
0,44
38
0,73
64–66
0,98
20
0,46
40
0,76
68
0,99
Scyntygrafia kanalików łzowych: Zalecane aktywności dla dzieci i młodzieży są takie same jak dla dorosłych.
Droga podania
Podanie dożylne lub do oka.
Do wielokrotnego użycia.
Instrukcje przygotowania produktu leczniczego przed podaniem, patrz punkt 12.
Sposób przygotowania pacjenta, patrz punkt 4.4.
We wskazaniach: scyntygrafia tarczycy, scyntygrafia gruczołów ślinowych i identyfikacja/lokalizacja ektopowej błony śluzowej żołądka sodu nadtechnecjan (99mTc) roztwór stosuje się dożylnie.
W scyntygrafii kanalików łzowych krople zakrapla się do worka spojówkowego (podanie do oka).
Obrazowanie
Scyntygrafia tarczycy: 20 minut po podaniu dożylnym.
Scyntygrafia gruczołów ślinowych: bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 15 minut.
Identyfikacja/lokalizacja ektopowej błony śluzowej żołądka (uchyłek Meckela): bezpośrednio po podaniu dożylnym w regularnych odstępach czasu w ciągu 30 minut.
Scyntygrafia kanalików łzowych: w czasie 2 minut od wprowadzenia kropli do worka spojówkowego wykonuje się obrazy dynamiczne, a następnie statyczne, w odpowiednich odstępach czasu przez 20 minut.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
przeciwtarczycowe produkty lecznicze (np.: karbimazol lub inne pochodne imidazolu, takie jak propylotiouracyl), salicylany, steroidy, sodu nitroprusydek, sodu sulfobromoftaleina, nadchlorany. Ich podawanie powinno być wstrzymane na 1 tydzień przed scyntygrafią tarczycy;
podawanie fenylobutazonu i środków wykrztuśnych powinno być wstrzymane na 2 tygodnie;
podawanie produktów zawierających naturalne lub syntetyczne hormony tarczycy (np. sodu tyroksynę, sodu liotyroninę, wyciąg z tarczycy) powinno zostać wstrzymane na 2–3 tygodnie przed badaniem;
podawanie amiodaronu, benzodiazepin, litu powinno być wstrzymane na 4 tygodnie przed badaniem;
dożylne środki kontrastowe nie powinny być podawane na 1–2 miesiące przed badaniem.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
1 osłona TechneVial Shield lub UltraVial Shield;
1 osłona jałowej fiolki, o ile nie została dostarczona z zabezpieczeniem Ultra-Technekow Safe.
Każdy generator Ultra-Technekow FM jest dostarczany z następującymi elementami:
7 fiolek TechneVials, jałowych, pustych fiolek o objętości 5 ml, 11 ml lub 25 ml;
1 jałowa fiolka jest dostarczana z zestawem do elucji;
1 fiolka eluentu, 100 ml jałowego roztworu soli fizjologicznej;
7 gazików do odkażania;
7 etykiet z symbolem radioaktywności.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU /
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
DOZYMETRIA
Wartości dawek, gdy pacjent nie otrzymał produktu blokującego:
Narząd
Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq]
Dorośli
15 lat
10 lat
5 lat
1 rok
Nadnercza
0,0037
0,0047
0,0072
0,011
0,019
Ściana pęcherza moczowego
0,018
0,023
0,030
0,033
0,060
Powierzchnia kości
0,0054
0,0066
0,0097
0,014
0,026
Mózg
0,0020
0,0025
0,0041
0,0066
0,012
Sutki
0,0018
0,0023
0,0034
0,0056
0,011
Pęcherzyk żółciowy
0,0074
0,0099
0,016
0,023
0,035
Przewód pokarmowy
- Ściana żołądka
0,026
0,034
0,048
0,078
0,16
- Jelito cienkie
0,016
0,020
0,031
0,047
0,082
- Okrężnica
0,042
0,054
0,088
0,14
0,27
- Ściana - okrężnicy wstępującej
0,057
0,073
0,12
0,20
0,38
- Ściana – okrężnicy zstępującej
0,021
0,028
0,045
0,072
0,13
Serce
0,0031
0,0040
0,0061
0,0092
0,017
Nerki
0,0050
0,0060
0,0087
0,013
0,021
Wątroba
0,0038
0,0048
0,0081
0,013
0,022
Płuca
0,0026
0,0034
0,0051
0,0079
0,014
Mięśnie
0,0032
0,0040
0,0060
0,0090
0,016
Przełyk
0,0024
0,0032
0,0047
0,0075
0,014
Jajniki
0,010
0,013
0,018
0,026
0,045
Trzustka
0,0056
0,0073
0,011
0,016
0,027
Szpik kostny
0,0036
0,0045
0,0066
0,0090
0,015
Ślinianki
0,0093
0,012
0,017
0,024
0,039
Skóra
0,0018
0,0022
0,0035
0,0056
0,010
Śledziona
0,0043
0,0054
0,0081
0,012
0,021
Jądra
0,0028
0,0037
0,0058
0,0087
0,016
Grasica
0,0024
0,0032
0,0047
0,0075
0,014
Tarczyca
0,022
0,036
0,055
0,12
0,22
Macica
0,0081
0,010
0,015
0,022
0,037
Pozostałe narządy
0,0035
0,0043
0,0064
0,0096
0,017
Dawka skuteczna (mSv/MBq)
0,013
0,017
0,026
0,042
0,079
Wartości dawek, gdy pacjent otrzymał produkt blokujący:
INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
Ultra-Technekow FM, 2,15–43,00 GBq, generator radionuklidu
Sodu nadtechnecjan (99mTc) do wstrzykiwań jest otrzymywany z generatora (99Mo/99mTc). Technet (99mTc) rozpada się, emitując promieniowanie gamma o średniej energii 140 keV i okresie półtrwania 6,01 h do technetu (99Tc), który ze względu na długi okres półtrwania wynoszący 2,13 x 105 lat uważany jest za quasi stabilny.
Generator radionuklidu zawierający izotop macierzysty 99Mo zaadsorbowany na kolumnie chromatograficznej dostarcza sodu nadtechnecjanu (99mTc) do wstrzykiwań w postaci jałowego roztworu.
99Mo na kolumnie jest w stanie równowagi z wytworzonym izotopem pochodnym 99mTc. Generatory dostarczane są z określoną poniżej aktywnością 99Mo na dzień kalibracji, tak aby otrzymać odpowiednią ilość eluatu technetu (99mTc), zakładając 100% teoretyczną wydajność i 24 godzinny odstęp czasu od ostatniej elucji oraz około 87% udział bezpośredniego rozpadu 99Mo.
99mTc (maksymalna teoretyczna elucyjna aktywność na dzień kalibracji, 06.00 h CET) | 1.90 | 3.81 | 5.71 | 7.62 | 9.53 | 11.43 | 15.24 | 19.05 | 22.86 | 26.67 | 30.48 | 38.10 | GBq |
99Mo (na dzień kalibracji, 06.00 h CET) | 2,15 | 4,30 | 6,45 | 8,60 | 10,75 | 12,90 | 17,20 | 21,50 | 25,80 | 30,10 | 34,40 | 43,00 | GBq |
Ilość sodu nadtechnecjan (99mTc) otrzymywana podczas pojedyńczej elucji zależy od rzeczywistej wydajności użytego generator deklarowanej przez producenta i zatwierdzonej przez właściwy organ krajowy.
Substancja pomocnicza o znanym działaniu:
Każdy 1 ml roztworu sodu nadtechnecjanu (99mTc) zawiera 3,5 mg sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Generator radionuklidu
Produkt leczniczy stosowany wyłącznie do diagnostyki.
Eluat otrzymywany z generatora radionuklidu (sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań) jest stosowany do:
Dawkowanie
Jeśli sodu nadtechnecjan (99mTc) jest podawany dożylnie, stosowane dawki radioaktywności mogą się znacznie różnić w zależności od wymaganych informacji klinicznych oraz stosowanej aparatury. Podanie aktywności powyżej diagnostycznego poziomu referencyjnego dawek określonego przez lokalne przepisy (DRL) powinno być uzasadnione wskazaniami. Zalecane dawki aktywności wynoszą:
Dorośli (70 kg) i osoby w podeszłym wieku:
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Możliwość wystąpienia nadwrażliwości lub reakcji anafilaktycznych
Jeżeli wystąpią reakcje nadwrażliwości lub reakcje anafilaktyczne, należy natychmiast przerwać podawanie produktu leczniczego i, jeżeli jest to konieczne, rozpocząć leczenie dożylne. W celu podjęcia natychmiastowego leczenia należy zapewnić dostępność niezbędnych produktów leczniczych i sprzętu, takiego jak rurka intubacyjna i respirator.
Uzasadnienie indywidualnego stosunku korzyści do ryzyka
U każdego pacjenta narażenie na promieniowanie jonizujące musi być uzasadnione w oparciu o spodziewane korzyści kliniczne. Podana dawka radioaktywności powinna być w każdym przypadku możliwie jak najniższa do uzyskania założonego efektu diagnostycznego.
Niewydolność czynności nerek
Ze względu na możliwy wzrost narażenia na promieniowanie należy uważnie ocenić stosunek korzyści do
ryzyka w tej grupie pacjentów.
Dzieci i młodzież
Informacje dotyczące stosowania produktu leczniczego u dzieci i młodzieży, patrz punkt 4.2.
Zasadność stosowania produktu leczniczego w tej grupie pacjentów należy dokładnie rozważyć, gdyż dawka
skuteczna w przeliczeniu na 1 MBq jest wyższa niż w przypadku dorosłych (patrz punkt 11). Blokowanie czynności tarczycy jest szczególnie istotne w grupie dzieci i młodzieży, z wyjątkiem scyntygrafii tarczycy.
Przygotowanie pacjenta
W niektórych wskazaniach może być konieczne wstępne podanie środków blokujących czynność tarczycy. Pacjent powinien być dobrze nawodniony przed rozpoczęciem badania oraz poinformowany o konieczności jak najczęstszego oddawania moczu w ciągu pierwszych godzin po podaniu produktu leczniczego w celu usunięcia z organizmu substancji promieniotwórczych.
W celu zmniejszenia prawdopodobieństwa nieprawidłowej interpretacji i zminimalizowania narażenia na promieniowanie poprzez obniżenie wychwytu nadtechnecjanu przez tarczycę i gruczoły ślinowe konieczne jest blokowanie czynności tarczycy.
Stosuje się je przy scyntygrafii kanalików łzowych oraz scyntygrafii uchyłku Meckela. NIE WOLNO stosować środków blokujących czynność tarczycy przed badaniem scyntygraficznym tarczycy, przytarczyc i gruczołów ślinowych.
Przed podaniem roztworu sodu nadtechnecjanu (99mTc) w scyntygrafii uchyłku Meckela pacjent powinien być na czczo przez 3– 4 godziny w celu ograniczenia perystaltyki jelit.
Po znakowaniu w warunkach in vivo erytrocytów z wykorzystaniem redukcji jonami cyny sodu nadtechnecjan (99mTc) wbudowuje się głównie w erytrocyty. Dlatego scyntygrafię uchyłku Meckela należy przeprowadzać przed tym badaniem lub kilka dni po wyznakowaniu erytrocytów w warunkach in vivo.
Po badaniu
Należy unikać kontaktu z małymi dziećmi i kobietami w ciąży przez 12 godzin po badaniu.
Specjalne ostrzeżenia
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań zawiera 3,5 mg sodu na 1 ml roztworu.
W zależności od czasu podania ilość sodu otrzymanego przez pacjenta może w niektórych przypadkach przekraczać 1 mmol (23 mg). Należy to wziąć pod uwagę w przypadku pacjentów stosujących dietę niskosodową.
W sytuacji wykorzystywania roztworu sodu nadtechnecjanu (99mTc) do znakowania zestawów podczas określania całkowitej zawartości sodu należy uwzględnić sód otrzymany z eluatu i zestawu. Należy zapoznać się z treścią ulotki załączoną do zestawu.
W scyntygrafii gruczołów ślinowych należy spodziewać się niższej swoistości metody w porównaniu do
sialografii MR.
Środki ostrożności w odniesieniu do zagrożenia dla środowiska naturalnego, patrz punkt 6.6.
Atropina, izoprenalina i leki przeciwbólowe mogą powodować opóźnienie opróżniania żołądka i spowalniać redystrybucję nadtechnecjanu (99mTc) w obrazowaniu jamy brzusznej.
Należy unikać podawania środków przeczyszczających, gdyż powodują one podrażnienie przewodu pokarmowego. Należy unikać wykonywania badań z użyciem środka kontrastowego (np. siarczanu baru) i badań górnego odcinka przewodu pokarmowego w okresie 48 godzin przed podaniem nadtechnecjanu (99mTc) na potrzeby badania scyntygraficznego uchyłka Meckela.
Wiele znanych produktów leczniczych ma wpływ na zmianę właściwości wychwytu przez tarczycę.
Kobiety w wieku rozrodczym
Przed podaniem radiofarmaceutyku kobiecie w wieku rozrodczym należy upewnić się, że nie jest ona
w ciąży. Każdą kobietę, u której nie wystąpiła regularna miesiączka, należy do wykluczenia traktować jako kobietę w ciąży. W razie wątpliwości dotyczących możliwej ciąży (jeśli u kobiety nie wystąpiła miesiączka, jeśli miesiączki są bardzo nieregularne itp.) należy zaproponować pacjentce alternatywne metody diagnostyczne, bez użycia promieniowania jonizującego (jeśli takie istnieją).
Ciąża
Podanie sodu nadtechnecjanu (99mTc) kobiecie, która jest w ciąży, dopuszcza się wyłącznie w sytuacji, gdy spodziewane korzyści przewyższają ryzyko na jakie narażona jest matka i płód.
Należy rozważyć alternatywne metody diagnostyczne, bez użycia promieniowania jonizującego.
99mTc (w postaci wolnego nadtechnecjanu) przechodzi przez barierę łożyskową.
Karmienie piersią
Przed podaniem radiofarmaceutyku kobiecie karmiącej piersią należy rozważyć możliwość odroczenia podania izotopu promieniotwórczego do chwili zakończenia przez matkę karmienia piersią i wybrać najkorzystniejszy radiofarmaceutyk pod względem aktywności wydzielania do mleka. Jeśli podanie radiofarmaceutyku zostanie uznane za konieczne, karmienie piersią należy przerwać na 12 godzin po podaniu produktu leczniczego, a pokarm wydzielony w tym czasie usunąć.
Należy unikać bliskiego kontaktu z dzieckiem w tym czasie.
Sodu nadtechnecjan (99mTc) roztwór do wstrzykiwań nie wpływa na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Informacje na temat działań niepożądanych pochodzą ze spontanicznych zgłoszeń. Odnotowano następujące rodzaje reakcji: reakcje anafilaktoidalne, reakcje wegetatywne oraz różne reakcje w miejscu podania. Sodu nadtechnecjan (99mTc) otrzymywany z generatora radionuklidu Ultra-Technekow FM jest stosowany do znakowania różnych związków. Związki te charakteryzuje większe prawdopodobieństwo wywołania działań niepożądanych niż w przypadku sodu nadtechnecjanu 99mTc. Dlatego odnotowane działania niepożądane są raczej związane ze stosowaniem wyznakowanych związków niż 99mTc. Możliwe rodzaje interakcji, jakie
mogą wystąpić po dożylnym podaniu produktu leczniczego wyznakowanego roztworem nadtechnecjanu (99mTc) sodu, mogą być różne w zależności od użytej substancji. Informacje te można znaleźć w Charakterystyce Produktu Leczniczego dołączonej do zestawu do sporządzania radiofarmaceutyku.
Lista działań niepożądanych
Częstość występowania działań niepożądanych klasyfikuje się następująco: Nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia układu immunologicznego Częstość nieznana*: reakcje anafilaktoidalne (np. duszność, śpiączka, pokrzywka, rumień, wysypka, świąd, obrzęk różnych miejsc ciała np. obrzęk twarzy) |
Zaburzenia układu nerwowego Częstość nieznana*: reakcje wazowagalne (np. omdlenie, częstoskurcz, rzadkoskurcz, zawroty głowy, bóle głowy, niewyraźne widzenie, zaczerwienienie) |
Zaburzenia żołądka i jelit Częstość nieznana*: wymioty, nudności, biegunka |
Zaburzenia ogólne i stany w miejscu podania Częstość nieznana*: reakcje w miejscu wstrzyknięcia (np. zapalenie tkanki łącznej, ból, rumień i obrzęk) |
* Działania niepożądane pochodzące ze spontanicznych zgłoszeń.
Narażenie na promieniowanie jonizujące jest związane z indukcją nowotworów oraz możliwością rozwoju wad wrodzonych. Ponieważ dawka skuteczna wynosi 5,2 mSv, w związku z podaniem maksymalnej zalecanej dawki aktywności wynoszącej 400 MBq istnieje małe prawdopodobieństwo wystąpienia tych działań niepożądanych.
Opis wybranych działań niepożądanych
Reakcje anafilaktyczne/anafilaktoidalne (np. duszność, śpiączka, pokrzywka, rumień, wysypka, świąd, obrzęk różnych miejsc ciała np. obrzęk twarzy)
Obserwowano reakcje anafilaktyczne/anafilaktoidalne po podaniu dożylnym sodu nadtechnecjanu (99mTc) , które dotyczyły różnych zmian skórnych lub problemów z oddychaniem, np. podrażnienie skóry, obrzęk lub duszność.
Reakcje wegetatywne (układu nerwowego i zaburzenia żołądkowo-jelitowe)
Odnotowano pojedyncze przypadki ciężkich reakcji wegetatywnych, jednak większość zgłaszanych reakcji wegetatywnych to reakcje ze strony przewodu pokarmowego, takie jak nudności lub wymioty. Inne to reakcje wazowagalne, takie jak ból lub zawroty głowy. Reakcje wegetatywne uważane są raczej za związane ze świadomością pacjenta, że jest poddawany badaniu, niż z samym zastosowaniem technetu (99mTc); dotyczy to szczególnie pacjentów odczuwających lęk.
Zaburzenia ogólne i stany w miejscu podania
Inne zgłoszenia opisują miejscowe reakcje w miejscu wstrzyknięcia. Reakcje w miejscu wstrzyknięcia są związane z wynaczynieniem roztworu radiofarmaceutyku podczas wstrzykiwania i mogą przybierać postać od lokalnego obrzęku do zapalenia tkanki łącznej. W zależności od podanej radioaktywności i znakowanego związku rozległe wynaczynienie może wymagać leczenia chirurgicznego.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych Al. Jerozolimskie 181C PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu
W przypadku przedawkowania radioaktywności sodu nadtechnecjanu (99mTc) należy dążyć do obniżenia dawki pochłoniętej przez pacjenta poprzez przyspieszenie wydalania radionuklidu z organizmu przez częste wypróżnienia, wymuszoną diurezę i oddawanie moczu. Wychwyt przez tarczycę, ślinianki i śluzówkę przewodu pokarmowego może być znacznie zmniejszony, gdy po przypadkowym podaniu wysokich dawek sodu nadtechnecjanu (99mTc) natychmiast poda się nadchloran sodu lub potasu.
Grupa farmakoterapeutyczna: Różne środki radiofarmaceutyczne stosowane w diagnostyce tarczycy, kod
ATC: V09FX01
W zakresie diagnostycznie stosowanych dawek nie zaobserwowano aktywności farmakologicznej.
Dystrybucja
Jon nadtechnecjanowy ma podobną dystrybucję biologiczną do jonu jodowego i nadchloranowego - gromadzi się przejściowo w śliniankach, splocie naczyniówkowym, śluzówce żołądka oraz tarczycy. Jest uwalniany z tych narządów w niezmienionej postaci. Jon nadtechnecjanowy gromadzi się w obszarach
o bogatym unaczynieniu lub w miejscach, gdzie naczynia mają nieprawidłową przepuszczalność. Dzieje się tak szczególnie wtedy, gdy wcześniej podane pacjentowi środki blokują pobieranie produktu leczniczego przez struktury gruczołowe. Przy nienaruszonej barierze krew-mózg sodu nadtechnecjan (99mTc) nie przechodzi do tkanki mózgowej.
Wychwyt przez narządy
We krwi 70–80% wstrzykniętego dożylnie sodu nadtechnecjanu (99mTc) wiąże się z białkami, głównie w sposób niespecyficzny z albuminami. Wolne frakcje (20–30%) gromadzone są czasowo w tarczycy i gruczołach ślinowych, żołądku i błonie śluzowej nosa, a także w splocie naczyniówkowym.
W przeciwieństwie do jodu sodu nadtechnecjanu (99mTc) nie jest wykorzystywany do syntezy hormonów tarczycy (organifikacja) ani nie wchłania się w jelicie cienkim. Maksymalny poziom akumulacji w tarczycy, w zależności od statusu czynnościowego i nasycenia jodem (w eutyreozie ok. 0,3–3%, w nadczynności tarczycy i zaburzeniach z niedoboru jodu do 25%) jest osiągany po ok. 20 minutach od wstrzyknięcia, a następnie szybko maleje. Dotyczy to również komórek przyściennych błony śluzowej żołądka oraz komórek groniastych ślinianek.
W przeciwieństwie do tarczycy, która uwalnia sodu nadtechnecjan (99mTc) do krwi, gruczoły ślinowe
i żołądek wydzielają sodu nadtechnecjan (99mTc) odpowiednio do śliny i soków żołądkowych. Akumulacja w gruczołach ślinowych jest na poziomie 0,5% podanej aktywności. Przy czym maksymalny poziom osiągnięty jest po około 20 minutach. Po godzinie od wstrzyknięcia stężenie w ślinie jest od około 10– do 30-krotnie większe niż w osoczu. Wydzielanie można przyspieszyć poprzez podanie soku z cytryny lub stymulację przywspółczulnego układu nerwowego. Nadchloran powoduje zmniejszenie absorpcji.
Eliminacja
Okres półtrwania w osoczu wynosi około 3 godziny. Sodu nadtechnecjan (99mTc) nie jest metabolizowany
w organizmie. Jedna frakcja jest wydalana przez nerki bardzo szybko, reszta wolniej z kałem, śliną i płynem łzowym. Przez pierwsze 24 godziny od podania związek jest wydalany głównie z moczem (około 25%), przez następne 48 godzin - z kałem. Około 50% dawki jest wydalane w czasie 50 godzin od podania. Jeśli podano wcześniej produkt blokujący wychwyt nadtechnecjanu (99mTc) przez narządy gruczołowe, wydalanie odbywa się w sposób opisany powyżej, klirens nerkowy jest jednak wyższy.
Powyższe dane nie dotyczą zastosowania sodu nadtechnecjanu (99mTc) do znakowania innych
radiofarmaceutyków.
Brak danych dotyczących ostrej, podostrej oraz przewlekłej toksyczności po podaniu pojedynczej dawki oraz dawek wielokrotnych. Ilość sodu nadtechnecjanu (99mTc) podawanego podczas badań diagnostycznych jest bardzo mała. Nie obserwowano innych reakcji poza alergicznymi.
Produkt leczniczy nie jest przeznaczony do regularnego ani ciągłego stosowania.
Nie prowadzono badań mutagenności ani długoterminowych badań dotyczących działania kancerogennego.
Toksyczność reprodukcyjna
Stopień przechodzenia 99mTc z podanego dożylnie roztworu sodu nadtechnecjanu (99mTc) przez łożysko badano u myszy. Jeśli nie podano wcześniej nadchlorku, w ciężarnej macicy gromadziło się nawet 60% podanej dawki 99mTc. Badania prowadzone u myszy ciężarnych, w trakcie ciąży, w ciąży i karmiących oraz tylko karmiących wykazały zmiany u potomstwa, takie jak zmniejszenie wagi, brak owłosienia oraz bezpłodność.
Sodu chlorek
Woda do wstrzykiwań
Nie mieszać produktu leczniczego z innymi produktami leczniczymi z wyjątkiem tych wymienionych w
punkcie 12.
Generator: 21 dni od daty produkcji i 9 dni od daty kalibracji.
Data kalibracji i termin ważności są podane na etykiecie.
Eluat sodu nadtechnecjanu (99mTc): Powinien być zużyty w ciągu 8 godzin od jego elucji. Brak specjalnych
zaleceń dotyczących przechowywania produktu leczniczego. Fiolki do elucji (Techne Vial i Sterile Vial): 36 miesięcy.
Nie przechowywać w temperaturze powyżej 25 °C. Nie zamrażać.
Eluat: warunki przechowywania produktu leczniczego po elucji patrz punkt 6.3.
Zaleca się przechowywanie generatora w sejfie ‘Ultra-Technekow Safe” (zapewniającym odpoweidnią ochronę przed ołowiem) lub za odpowiednią osłoną laboratoryjną.
Pozostałe warunki przechowywania powinny być zgodne z obowiązującymi przepisami dotyczącymi materiałów radioaktywnych.
Generator
Generator jest zbudowany z kolumny wypełnionej tlenkiem glinu, na którym zaadsorbowany jest 99Mo. Kolumna jest chroniona dwoma filtrami zapobiegającymi wydostaniu się tlenku glinu z kolumny. Z jednej strony kolumna jest podłączona do pokrytej osłoną, jałowej igły zasilającej, znajdującej się w uchwycie eluentu. Druga strona jest podłączona do okrytej podobną osłoną jałowej igły wylotowej w stacji elucyjnej. Druga jałowa igła w uchwycie eluentu ma na celu usuwanie w jałowych warunkach podciśnienia w fiolce eluentu. Kolumna generatora jest otoczona osłoną ołowianą o grubości uzależnionej od aktywności 99Mo. Generator z osłoną oraz wbudowaną stacją i uchwytem eluentu jest zapakowany w hermetycznie zamknięte pudełko metalowe, które również stanowi opakowanie. Elucja odbywa się poprzez umieszczenie fiolki eluentu na igłach w uchwycie eluentu, a następnie całkowite lub częściowe wypełnienie opróżnionych fiolek.
Akcesoria
Generator Ultra-Technekow FM jest dostarczany z następującymi elementami:
Ogólne ostrzeżenia
Radiofarmaceutyk może być otrzymywany, używany i podawany chorym tylko przez osoby mające
odpowiednie uprawnienia, w specjalistycznych, wyznaczonych do tego placówkach klinicznych. Otrzymywanie, magazynowanie, użycie, przenoszenie i utylizacja podlegają przepisom i (lub) odpowiednim licencjom właściwych organizacji.
Radiofarmaceutyki powinny być przygotowywane w sposób odpowiedni do wymagań dotyczących zarówno zasad bezpieczeństwa radiologicznego, jak i jakości farmaceutyków. Powinno zapewnić się odpowiednie warunki aseptyczne.
Nie należy stosować generatora lub fiolki z eluatem, jeżeli zauważy się jakiekolwiek ślady uszkodzenia. Produkt leczniczy należy podawać w taki sposób, aby zminimalizować ryzyko zanieczyszczenia produktu leczniczego i napromieniowania osoby go podającej. Konieczne jest stosowanie odpowiednich osłon.
Podawanie chorym radioaktywnych produktów leczniczych stwarza niebezpieczeństwo skażenia dla osób postronnych, np. moczem lub wymiocinami pacjenta. Należy zatem przestrzegać zasad ochrony radiologicznej zgodnych z obowiązującymi przepisami krajowymi.
Przed utylizacją generatora należy określić jego pozostałą radioaktywność.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi
przepisami.
Curium Netherlands B.V.
Westerduinweg 3
1755 LE Petten Holandia
20661
DATA PRZEDŁUŻENIA POZWOLENIA
22 października 2012
PRODUKTU LECZNICZEGO
15 maj 2019
Dane wymienione poniżej pochodzą z ICRP 80 i są obliczane według następujących założeń:
Narząd | Dawka pochłonięta na jednostkę podanej aktywności [mGy/MBq], gdy pacjent otrzymał produkt blokujący | ||||
Dorośli | 15 lat | 10 lat | 5 lat | 1 rok | |
Nadnercza | 0,0029 | 0,0037 | 0,0056 | 0,0086 | 0,016 |
Ściana pęcherza moczowego | 0,030 | 0,038 | 0,048 | 0,050 | 0,091 |
Powierzchnia kości | 0,0044 | 0,0054 | 0,0081 | 0,012 | 0,022 |
Mózg | 0,0020 | 0,0026 | 0,0042 | 0,0071 | 0,012 |
Sutki | 0,0017 | 0,0022 | 0,0032 | 0,0052 | 0,010 |
Pęcherzyk żółciowy | 0,0030 | 0,0042 | 0,0070 | 0,010 | 0,013 |
Przewód pokarmowy | |||||
- Ściana żołądka | 0,0027 | 0,0036 | 0,0059 | 0,0086 | 0,015 |
- Jelito cienkie | 0,0035 | 0,0044 | 0,0067 | 0,010 | 0,018 |
- Okrężnica | 0,0036 | 0,0048 | 0,0071 | 0,010 | 0,018 |
- Ściana – okrężnicy wstępującej | 0,0032 | 0,0043 | 0,0064 | 0,010 | 0,017 |
- Ściana – okrężnicy zstępującej | 0,0042 | 0,0054 | 0,0081 | 0,011 | 0,019 |
Serce | 0,0027 | 0,0034 | 0,0052 | 0,0081 | 0,014 |
Nerki | 0,0044 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Wątroba | 0,0026 | 0,0034 | 0,0053 | 0,0082 | 0,015 |
Płuca | 00023 | 0,0031 | 0,0046 | 0,0074 | 0,013 |
Mięśnie | 0,0025 | 0,0031 | 0,0047 | 0,0072 | 0,013 |
Przełyk | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Jajniki | 0,0043 | 0,0054 | 0,0078 | 0,011 | 0,019 |
Trzustka | 0,0030 | 0,0039 | 0,0059 | 0,0093 | 0,016 |
Szpik kostny | 0,0025 | 0,0032 | 0,0049 | 0,0072 | 0,013 |
Skóra | 0,0016 | 0,0020 | 0,0032 | 0,0052 | 0,0097 |
Śledziona | 0,0026 | 0,0034 | 0,0054 | 0,0083 | 0,015 |
Jądra | 0,0030 | 0,0040 | 0,0060 | 0,0087 | 0,016 |
Grasica | 0,0024 | 0,0031 | 0,0046 | 0,0075 | 0,014 |
Tarczyca | 0,0024 | 0,0031 | 0,0050 | 0,0084 | 0,015 |
Macica | 0,0060 | 0,0073 | 0,011 | 0,014 | 0,023 |
Pozostałe narządy | 0,0025 | 0,0031 | 0,0048 | 0,0073 | 0,013 |
Dawka skuteczna (mSv/MBq) | 0,0042 | 0,0054 | 0,0077 | 0,011 | 0,019 |
Dawka skuteczna po podaniu dożylnym 400 MBq sodu nadtechnecjanu (99mTc) dorosłemu pacjentowi o masie ciała 70 kg wynosi 5,2 mSv.
Po zastosowaniu produktu o właściwościach blokujących i podaniu 400 MBq sodu nadtechnecjanu (99mTc)
dorosłemu pacjentowi o masie ciała 70 kg dawka skuteczna wynosi 1,7 mSv.
Dawka promieniowania pochłonięta przez soczewkę oka po podaniu sodu nadtechnecjanu (99mTc) celem wykonania scyntygrafii kanałów łzowych jest szacowana na 0,038 mGy/MBq. Podanie aktywności wynoszącej 4 MBq powoduje pochłonięcie dawki skutecznej nieprzekraczającej 0,01 mSv. Podane dawki promieniowania mają zastosowanie w przypadku, kiedy narządy pochłaniające sodu nadtechnecjan (99mTc) funkcjonują prawidłowo.
Nadczynność/niedoczynność (np. tarczycy, błony śluzowej żołądka i nerek) oraz długotrwałe procesy z zaburzeniem bariery krew-mózg lub upośledzeniem eliminacji przez nerki mogą prowadzić do zmian w narażeniu na promieniowanie, prowadząc lokalnie do jego bardzo znacznego wzrostu.
Dawki promieniowania na powierzchnię i pochłaniane zależą od wielu czynników. Należy kontrolować poziom promieniowania w środowisku i podczas pracy.
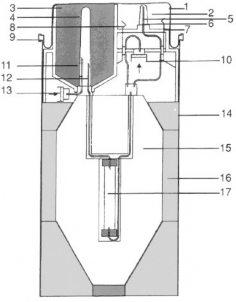
Schemat generatora Ultra-Technekow FM:
Górna pokrywa
Stacja elucyjna
Komora butelki z eluentem
Plastikowa osłona igły eluentu
Gumowa osłona igły eluatu
Igła wylotowa eluatu
Zawór bezpieczeństwa
Zawór do elucji częściowej
Pierścień zamykający
Filtr powietrza do elucji częściowej
Igła wlotowa dla sterylnego powietrza
Igła zasilająca w eluent
Filtr powietrza dla butelki z eluentem
Obudowa
Osłona ołowiana (ekran)
Obudowa osłony ołowianej
Kolumna generatora
Instrukcja stosowania
Elucja musi być przeprowadzana w miejscu zapewniającym zachowanie sterylności generatora.
Przygotowanie
Zdjąć uszczelkę, otworzyć pierścień zamykający i odłożyć razem z górną pokrywą.
Umieścić generator Ultra-Technekow FM za odpowiednią osłoną laboratoryjną, ustawiając tak, aby stacja elucyjna skierowana była ku przodowi.
UWAGA: Igły pod osłonami są sterylne, a generator pod pokrywą jest czysty. Dlatego dezynfekcja z zastosowaniem środków odkażających zawierających alkohol nie jest pożądana i może niekorzystnie wpłynąć na wydajność uzyskiwania (99mTc)-nadtechnecjanu.
Zdjąć samozatrzaskową pokrywkę z komory butelki eluentu, zdjąć (i zachować) plastikową osłonę igły wlotowej i osadzić butelkę z eluentem w uchwycie.
Zdjąć samozatrzaskową pokrywkę z komory sterylnej fiolki i umieścić ją w sterylnej osłonie fiolki.
Zdjąć (i zachować) gumową osłonę z igły wylotowej i osadzić sterylną fiolkę w osłonie w stacji
elucyjnej.
Elucja
Zdjąć samozatrzaskową pokrywkę z komory określonej fiolki Techne Vial, zdezynfekować korek, odczekać, aż środek odkażający całkowicie wyparuje i umieścić fiolkę w osłonie Ultra Vial. (Uwaga: osłona Ultra Vial nie znajduje się w opakowaniu produktu).
(Fiolka Techne Vial zawiera resztkową ilość wody, pozostałą po procesie sterylizacji.)
Zastąpić sterylną fiolkę w osłonie osłoną Ultra Vial, upewniając się, że okienko ze szkła ołowiowego
skierowane jest ku przodowi.
Rozpoczyna się elucja. Proces można przerwać, zależnie od żądanej objętości eluatu ((99mTc)- nadtechnecjanu; stężenie/ml). Elucję zawsze kończy się, przekręcając osłonę Ultra Vial o ćwierć obrotu, popychając ją ku dołowi i odczekując kilka sekund (działanie to powoduje napełnienie fiolki Techne Vial sterylnym powietrzem).
Zastąpić fiolkę Techne Vial w osłonie nową, nie używaną, sterylną fiolką w osłonie.
Nie wolno przerywać elucji, ciągnąc fiolkę Techne Vial ku górze, bez wykonania ćwierćobrotu! Eluaty, które nie są klarowne lub bezbarwne należy odrzucić.
Usuwanie odpadów i zwrot generatora
Zdjąć i usunąć używaną sterylną fiolkę oraz butelkę z eluentem.
Ponownie założyć oryginalną osłonę na igły wlotowe.
Przeprowadzić elucję pozostałych mililitrów płynu z generatora (patrz: Elucja). Generator jest teraz
suchy.
Ponownie założyć oryginalną osłonę na igłę wylotową.
Zamknąć system generatora górną pokrywą i zamknąć pierścień zamykający.
Umieścić generator w odpowiednim miejscu do chwili spadku promieniowania do poziomu odpowiedniego, dla jego usunięcia.
Uwaga: W niektórych krajach istnieje możliwość zwrotu zużytych generatorów. Aby uzyskać informacje na temat takiej możliwości lub szczegółowe dane dotyczące rozbiórki, należy skontaktować się z lokalnym przedstawicielem producenta.
Elucję generatora należy prowadzić w pomieszczeniach zgodnych z krajowymi przepisami dotyczącymi bezpieczeństwa posługiwania się produktami radioaktywnymi.
Roztwór eluowany jest przezroczystym i bezbarwnym roztworem pertechnetu sodu (99mTc) o pH pomiędzy 4 a 8 I czystości radiochemicznej równej lub większej niż 99%.
Jeżeli roztwór pertechnetu sodu (99mTc) jest zatsosowany do oznakowania zastawu, należy zapoznać się z ulotką dołączoną do opakowania tego zestawu.
Kontrola jakości
Radioaktywność oraz tzw. „przebicie” molibdenu (99Mo) muszą być sprawdzone przed użyciem.
Sprawdzenie „przebicia” molibdenu (99Mo) może być przeprowadzone zgodnie z Farmakopeą Europejską (Ph. . Eur. ) lub też każdą inną zwalidowaną metodą umożliwiającą określenie zawartości molibdenu (99Mo) poniżej 0.1% całkowitej radioaktywności na dzień i godzinę podania.
Pierwszy odciek otrzymany z tego generatora mogą być zwykle stosowane, jeśli nie podano inaczej. Eluaty nawet wymywany jest później niż 24 godzin od ostatniego wymywania mogą być stosowane do znakowania zestawu, chyba że jest to wyłączone przez specyfikacje odpowiedniego zestawu ChPL.











