Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
czasu nebulizacji
objętości komory
właściwości technicznych kompresora nebulizatora
objętości wdechowej i wydechowej pacjenta do przestrzeni martwej;
stosowania ustnika lub maski na twarz.
Przygotować nebulizator do użycia zgodnie z instrukcjami wytwórcy.
Otworzyć foliową saszetkę i wyjąć pasek z ampułkami. Oddzielić jedną ampułkę z paska poprzez przekręcenie i pociągnięcie (Rys. 1).
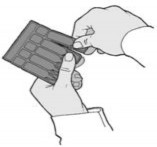 (Rys. 1)
(Rys. 1)Delikatnie, okrężnymi ruchami wstrząsać ampułką przez około 10 sekund lub do chwili, gdy osad przestanie być widoczny.
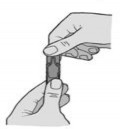
Trzymając ampułkę w pozycji pionowej odkręcić górną część ampułki (Rys. 2).
(Rys. 2)
Odwrócić ampułkę do góry nogami i wycisnąć zawartość ampułki do komory nebulizatora (Rys. 3).
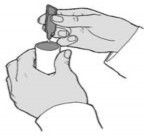 (Rys. 3)
(Rys. 3)Ampułki służą do jednorazowego użycia. Dlatego po każdym zastosowaniu należy usunąć wszelkie niewykorzystane pozostałości leku oraz umyć i oczyścić komorę nebulizatora. Komorę nebulizatora, ustnik i maskę na twarz należy myć ciepłą wodą lub łagodnym detergentem. Dokładnie wypłukać
i osuszyć podłączając komorę nebulizatora do wlotu sprężonego powietrza kompresora.
Należy pouczyć pacjentów, aby po inhalacji przepisanej dawki płukali jamę ustną wodą w celu zmniejszenia ryzyka kandydozy jamy ustnej i gardła.
Pacjenci stosujący maskę na twarz powinni również po użyciu maski przemyć twarz wodą w celu uniknięcia podrażnienia.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
Nebbud, 0,25 mg/2 ml, zawiesina do nebulizacji
Nebbud, 0,25 mg/2 ml, zawiesina do nebulizacji:
Każda ampułka o pojemności 2 ml zawiera 0,25 mg budezonidu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zawiesina do nebulizacji.
Zawiesina o barwie białej do białawej w ampułce zawierającej jedną dawkę.
Budezonid w postaci zawiesiny do nebulizacji jest wskazany do stosowania u pacjentów dorosłych, młodzieży oraz u niemowląt i dzieci w wieku sześciu miesięcy i starszych.
Astma
Budezonid w postaci zawiesiny do nebulizacji jest wskazany w leczeniu przewlekłej astmy oskrzelowej u pacjentów, u których stosowanie inhalatora ciśnieniowego lub inhalatora proszkowego jest niezadowalające lub niewłaściwe.
Pseudokrup
Bardzo ciężkie zapalenie krtani - pseudokrup (laryngitis subglottica), w którym zalecana jest hospitalizacja.
Przewlekła obturacyjna choroba płuc (POChP)
Zaostrzenia przewlekłej obturacyjnej choroby płuc (POChP) jako alternatywa dla kortykosteroidów
ogólnoustrojowych.
Dawkowanie
Ogólnie
Produkt Nebbud jest stosowany przy użyciu odpowiedniego nebulizatora (nebulizator kompresorowy z ustnikiem i maską na twarz). Dawka budezonidu dostarczana pacjentowi przez nebulizator jest różna i zależy między innymi od następujących czynników:
Astma
Dawkę leku należy przyjmować dwa razy na dobę. Stosowanie leku raz na dobę należy rozważyć
u pacjentów ze stabilną astmą o lekkim lub umiarkowanym przebiegu.
Dawka początkowa
Dawkę początkową należy dostosować do stopnia ciężkości choroby, a następnie do indywidualnych potrzeb pacjenta. Zalecane dawki wymieniono poniżej, ale zawsze należy stosować najmniejszą skuteczną dawkę.
Dzieci w wieku 6 miesięcy i starsze:
0,25 do 1 mg na dobę. U dzieci przyjmujących doustne steroidy jako leczenie podtrzymujące należy rozważyć zastosowanie większej dawki początkowej do 2,0 mg na dobę.
Dorośli (w tym osoby w podeszłym wieku) i młodzież w wieku powyżej 12 lat: 0,5 do 2,0 mg na dobę. W bardzo ciężkich przypadkach dawkę można zwiększyć.
Dawka podtrzymująca
Dawkę podtrzymującą należy dostosować do indywidualnych potrzeb pacjenta, biorąc pod uwagę nasilenie choroby oraz kliniczną odpowiedź pacjenta. Po uzyskaniu pożądanego działania klinicznego dawkę podtrzymującą należy zmniejszyć do najmniejszej dawki, zapewniającej skuteczną kontrolę objawów.
Dzieci w wieku 6 miesięcy i starsze:
0,25 do 1,0 mg na dobę.
Dorośli (w tym osoby w podeszłym wieku) i młodzież w wieku powyżej 12 lat:
0,5 do 2,0 mg na dobę. W bardzo ciężkich przypadkach dawkę można dodatkowo zwiększyć.
Pseudokrup
Zwykle stosowana dawka u niemowląt i dzieci z pseudokrupem to 2 mg budezonidu podane w postaci
nebulizacji. Można podać tę dawkę w całości lub podzielić ją na dwie i podać dwie dawki po 1 mg
w odstępie 30 minut. Ten sposób dawkowania może być powtarzany co 12 godzin, maksymalnie do 36
godzin lub do uzyskania poprawy stanu klinicznego.
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania i skuteczności produktu leczniczego Nebbud u niemowląt
w wieku poniżej sześciu miesięcy.
Zaostrzenia POChP
Zalecana dawka produktu Nebbud wynosi od 4 do 8 mg na dobę, podzielona na 2 do 4 dawki. Leczenie należy prowadzić aż do uzyskania poprawy stanu klinicznego, przy czym nie zaleca się leczenia dłuższego niż przez 10 kolejnych dni.
W warunkach domowych należy zapewnić odpowiedni poziom przeszkolenia w zakresie leczenia
nebulizatorami.
Nie badano stosowania produktu Nebbud u pacjentów z POChP z zapaleniem płuc lub wymagających
inwazyjnej wentylacji mechanicznej.
Sposób podawania Podanie wziewne.
Astma
Stosowanie leku raz na dobę
Stosowanie leku raz na dobę należy rozważyć u dzieci i dorosłych ze stabilną astmą o przebiegu lekkim do umiarkowanego, którzy otrzymują dawkę podtrzymującą od 0,25 mg do 1,0 mg budezonidu na dobę.
Podawanie raz na dobę można rozpocząć u pacjentów, którzy nie są leczeni kortykosteroidami oraz
u pacjentów z dobrze kontrolowanymi objawami choroby, którzy przyjmują wziewne steroidy. Dawkę leku można podawać rano lub wieczorem. Jeżeli objawy astmy nasilą się, należy zwiększyć dawkę dobową poprzez podawanie dawki dwa razy na dobę.
Początek działania
Poprawa stanu klinicznego u pacjentów z astmą może nastąpić w ciągu 3 dni od rozpoczęcia leczenia budezonidem. Pełne działanie lecznicze uzyskuje się dopiero po 2 - 4 tygodniach leczenia.
Pacjenci leczeni doustnymi glikokortykosteroidami w terapii podtrzymującej:
Stosowanie produktu Nebbud może pozwolić na zastąpienie lub zmniejszenie dawki doustnych glikokortykosteroidów przy jednoczesnym zachowaniu lub poprawieniu kontroli astmy. Podczas zmiany leczenia z doustnych glikokortykosteroidów na leczenie wziewnym budezonidem pacjent powinien być w stanie stabilnym.
Początkowo należy stosować duże dawki wziewnego budezonidu. Budezonid można stosować jednocześnie z wcześniej stosowanym glikokortykosteroidem doustnym przez około 10 dni. Następnie dawkę doustnego glikokortykosteroidu należy stopniowo zmniejszać (np. o 2,5 mg prednizolonu lub równoważną dawkę innego glikokortykosteroidu na miesiąc) do możliwie najmniejszej dawki. U wielu pacjentów stosowanie doustnego glikokortykosteroidu można całkowicie zastąpić wziewnym budezonidem.
Podczas zmniejszania dawek kortykosteroidów o działaniu ogólnoustrojowym, u niektórych pacjentów mogą wystąpić objawy odstawienia steroidu, np. ból mięśni i (lub) stawów, brak energii i depresja, a nawet zmniejszenie czynności płuc. Takich pacjentów należy poinformować, że należy wówczas kontynuować terapię wziewnym budezonidem, oraz należy ich zbadać, czy nie występują obiektywne objawy niewydolności kory nadnerczy. Jeśli takie objawy występują, należy tymczasowo zwiększyć dawkę kortykosteroidów o działaniu ogólnoustrojowym, a następnie zmniejszać ją jeszcze wolniej. W okresie narażenia na stres lub jeśli występują ciężkie napady astmy, u pacjentów w fazie przejściowej może być konieczne leczenie kortykosteroidami o działaniu ogólnoustrojowym. Dalsze informacje dotyczące przerwania stosowania glikokortykosteroidów, patrz punkt 4.4.
Schemat dawkowania
Należy przestrzegać przedstawionego poniżej schematu dawkowania:
Dawka (mg) | Objętość zawiesiny produktu leczniczego | ||||
0,25 mg/2 ml | 0,5 mg/2 ml | 1 mg/2 ml | |||
0,25 | 2 ml | ||||
0,5 | 4 ml | lub | 2 ml | ||
0,75*** | 2 ml | plus | 2 ml | ||
1* | 4 ml | lub | 2 ml | ||
1,5** | 2 ml | plus | 2 ml | ||
2 | 4 ml | ||||
* albo 2 ampułki produktu 0,5 mg/2 ml, zawiesina do nebulizacji, albo jedna ampułka produktu 1 mg/2 ml,
zawiesina do nebulizacji
** jedna ampułka produktu 0,5 mg/2 ml, zawiesina do nebulizacji plus jedna ampułka produktu 1 mg/2 ml,
zawiesina do nebulizacji
*** jedna ampułka produktu 0,25 mg/2 ml, zawiesina do nebulizacji plus jedna ampułka produktu
0,5 mg/2 ml, zawiesina do nebulizacji.
Podział dawki i możliwość mieszania z innymi substancjami
Produkt leczniczy Nebbud może być mieszany z 0,9% roztworem chlorku sodu oraz z roztworami do inhalacji zawierającymi terbutalinę, salbutamol, kromoglikan sodowy lub bromek ipratropiowy.
Nebulizator:
Produkt Nebbud musi być podawany za pomocą nebulizatora strumieniowego z zastosowaniem ustnika lub maski na twarz. Nebulizator należy połączyć ze sprężarką powietrza o odpowiednim przepływie powietrza (6-8 l/min), a objętość napełniania powinna wynosić 2-4 ml.
Między nebulizatorami, nawet tej samej marki i modelu mogą wystąpić różnice w wydajności
(w dostarczanej dawce).
Uwaga! Nebulizatory ultradźwiękowe nie są odpowiednie do nebulizacji zawiesiny Nebbud i nie zaleca się ich używania w tym celu.
Instrukcja stosowania
W celu zminimalizowania ryzyka infekcji grzybiczych jamy ustnej i gardła pacjent powinien wypłukać wodą jamę ustną po inhalacji.
Nadwrażliwość na budezonid lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Nebbud nie jest wskazany do stosowania w leczeniu ostrej duszności oraz stanu astmatycznego. W takich przypadkach należy stosować krótko działające beta-sympatykomimetyki i inne leki rozszerzające oskrzela.
Zmiana leczenia doustnym kortykosteroidem na kortykosteroid wziewny oraz dalsze leczenie wymaga zachowania szczególnej ostrożności. Pacjenci powinni być w stosunkowo stabilnym stanie przed rozpoczęciem leczenia dużymi dawkami wziewnego kortykosteroidu, w uzupełnieniu do dotychczas stosowanej dawki podtrzymującej kortykosteroidu o działaniu ogólnoustrojowym. Po upływie około 10 dni rozpoczyna się odstawianie kortykosteroidu o działaniu ogólnoustrojowym poprzez stopniowe zmniejszanie dawki dobowej (na przykład o 2,5 mg prednizolonu lub równoważną dawkę odpowiednika na miesiąc) aż do osiągnięcia możliwie najmniejszej dawki. Możliwe jest całkowite zastąpienie doustnego kortykosteroidu kortykosteroidem wziewnym. U pacjentów, u których po zmianie na leczenie kortykosteroidem wziewnym wystąpią zaburzenia czynności kory nadnerczy, może być konieczne leczenie uzupełniające kortykosteroidami o działaniu ogólnoustrojowym w okresach stresu związanego np. z zabiegami chirurgicznymi, zakażeniem lub nasileniem napadów astmy.
Pacjenci, u których konieczne było nagłe zastosowanie dużych dawek kortykosteroidów lub długotrwałe leczenie wziewnymi kortykosteroidami w największej zalecanej dawce, także mogą być narażeni na ryzyko zaburzeń czynności kory nadnerczy. U tych pacjentów mogą wystąpić objawy niewydolności kory nadnerczy pod wpływem silnego stresu. Należy rozważyć dodatkowe leczenie ogólnoustrojowymi kortykosteroidami w okresach stresu lub przed planowanym zabiegiem chirurgicznym.
Podczas zmiany terapii doustnej na terapię wziewnym budezonidem mogą wystąpić objawy wcześniej tłumione przez leczenie glikokortykosteroidami o działaniu ogólnoustrojowym, na przykład objawy alergicznego zapalenia błony śluzowej nosa, wyprysk, bóle mięśni i stawów. Należy zastosować odpowiednie leczenie tych objawów.
U pacjentów, którzy wcześniej byli leczeni doustnymi kortykosteroidami mogą, w wyniku długotrwałej terapii ogólnoustrojowymi kortykosteroidami, wystąpić zaburzenia czynności kory nadnerczy. Po zaprzestaniu leczenia kortykosteroidem doustnym poprawa stanu pacjenta może zająć dużo czasu i dlatego u pacjentów leczonych steroidami doustnymi i zmieniających leczenie na budezonid ryzyko zaburzeń
czynności kory nadnerczy może utrzymywać się przez dłuższy czas. W takich przypadkach należy regularnie monitorować czynność kory nadnerczy.
Podczas odstawiania ogólnoustrojowych kortykosteroidów u niektórych pacjentów mogą wystąpić niespecyficzne objawy złego samopoczucia, pomimo utrzymywania lub nawet poprawy czynności układu oddechowego. Tacy pacjenci powinni być zachęcani do kontynuowania leczenia wziewnym budezonidem i zaprzestania stosowania doustnych kortykosteroidów, chyba że istnieją objawy kliniczne wskazujące na przeciwwskazania, na przykład objawy wskazujące na niewydolność nadnerczy. W takich przypadkach czasami konieczne jest tymczasowe zwiększenie dawki doustnego glikokortykosteroidu.
Zaburzenia czynności wątroby mogą mieć wpływ na eliminację kortykosteroidów. Szybkość eliminacji jest zmniejszona, a ekspozycja ogólnoustrojowa zwiększona. Należy oczekiwać wystąpienia działań niepożądanych. Jednak farmakokinetyka budezonidu po podaniu dożylnym była podobna u pacjentów
z marskością wątroby jak i u zdrowych ochotników. Jednak doustne podawanie budezonidu miało wpływ na farmakokinetykę u pacjentów z zaburzeniami czynności wątroby: zwiększona dostępność ogólnoustrojowa. Może to mieć znaczenie kliniczne u pacjentów z ciężkimi zaburzeniami czynności wątroby.
Podobnie, jak w przypadku innych leków wziewnych, może wystąpić paradoksalny skurcz oskrzeli
z nasileniem świstów bezpośrednio po podaniu dawki. Jeśli wystąpi taka reakcja, należy natychmiast przerwać stosowanie budezonidu wziewnego. Należy ocenić stan pacjenta i w razie konieczności rozpocząć leczenie alternatywne.
Jeśli pomimo dobrze kontrolowanego leczenia u pacjenta wystąpi ostry napad duszności, należy zastosować szybko działający, wziewny lek rozszerzający oskrzela i rozważyć ponowną ocenę leczenia. Jeśli pomimo zastosowania maksymalnych dawek kortykosteroidów wziewnych nie udaje się w odpowiednim stopniu opanować objawów astmy, może być konieczne zastosowanie krótkotrwałego leczenia kortykosteroidami działającymi ogólnoustrojowo. W takich przypadkach konieczne jest kontynuowanie leczenia kortykosteroidami wziewnymi w skojarzeniu z leczeniem ogólnoustrojowym.
Możliwe jest wystąpienie ogólnoustrojowych działań kortykosteroidów wziewnych, szczególnie jeśli te leki stosuje się w dużych dawkach przez długi okres. Wystąpienie takich działań jest dużo mniej prawdopodobne po zastosowaniu wziewnych glikokortykosteroidów niż podczas leczenia kortykosteroidami doustnymi.
Możliwe działania ogólnoustrojowe to: zespół Cushinga, wygląd jak w zespole Cushinga, zahamowanie czynności nadnerczy, opóźnienie wzrostu u dzieci i młodzieży, zmniejszenie gęstości mineralnej kości, zaćma, jaskra oraz, rzadziej, szereg objawów psychicznych i zmian zachowania, w tym nadmierna aktywność psychoruchowa, zaburzenia snu, lęk, depresja lub agresja (szczególnie u dzieci). Dlatego też ważne jest, aby dawkę kortykosteroidu wziewnego zmniejszyć do najmniejszej skutecznej dawki utrzymującej kontrolę objawów astmy.
Zaburzenie widzenia może wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
Nasilenie klinicznych objawów astmy może być spowodowane ostrą bakteryjną infekcją dróg oddechowych, wówczas może być konieczne leczenie odpowiednimi antybiotykami. U tych pacjentów może być konieczne zwiększenie dawki budezonidu oraz krótkotrwałe leczenie doustnymi kortykosteroidami. Szybko działający wziewny lek rozszerzający oskrzela należy stosować jako lek „ratujący życie” w celu złagodzenia ostrych objawów astmy.
Szczególną ostrożność należy zachować u pacjentów z czynną lub nieaktywną gruźlicą płuc oraz
u pacjentów z grzybiczymi lub wirusowymi infekcjami dróg oddechowych. Jeśli pacjent ma zakażenie układu oddechowego, należy wziąć to pod uwagę podczas leczenia astmy; zarówno astmę, jak i infekcję dróg oddechowych należy odpowiednio leczyć.
U pacjentów z nadmiernym wydzielaniem śluzu w drogach oddechowych, konieczne może być krótkotrwałe
leczenie doustnymi kortykosteroidami.
Podczas leczenia wziewnymi kortykosteroidami może wystąpić kandydoza jamy ustnej. Wówczas konieczne może być podanie odpowiedniego leku przeciwgrzybiczego, u niektórych pacjentów konieczne może być przerwanie leczenia kortykosteroidami (patrz punkt 4.2).
W celu uniknięcia miejscowego podrażnienia skóry twarzy zaleca się, aby do nebulizacji kortykosteroidu stosować raczej ustnik niż maskę na twarz. Jeśli pacjent stosuje maskę na twarz, powinien umyć twarz wodą po zakończeniu nebulizacji.
Komorę nebulizatora oraz ustnik (lub maskę na twarz) należy myć ciepłą wodą z dodatkiem łagodnego detergentu po każdym użyciu. Następnie należy dokładnie przepłukać je wodą i osuszyć poprzez podłączenie komory nebulizatora do sprężarki.
Należy unikać jednoczesnego podawania ketokonazolu, inhibitorów proteazy HIV oraz innych silnych inhibitorów CYP3A4. Jeśli nie jest to możliwe, przerwa pomiędzy podaniem tych leków powinna być jak najdłuższa (patrz punkt 4.5).
Zapalenie płuc u pacjentów z POChP
U pacjentów z POChP otrzymujących wziewne kortykosteroidy zaobserwowano zwiększenie częstości występowania zapalenia płuc, w tym zapalenia płuc wymagającego hospitalizacji. Istnieją pewne dowody na zwiększone ryzyko wystąpienia zapalenia płuc wraz ze zwiększeniem dawki steroidów, ale nie zostało to jednoznacznie wykazane we wszystkich badaniach.
Nie ma jednoznacznych dowodów klinicznych na różnice między produktami zawierającymi wziewne kortykosteroidy, dotyczące stopnia ryzyka występowania zapalenia płuc.
Lekarze powinni szczególnie wnikliwie obserwować pacjentów z POChP, czy nie rozwija się u nich zapalenie płuc, ponieważ kliniczne objawy takich zakażeń oraz zaostrzenia POChP często się nakładają.
Do czynników ryzyka zapalenia płuc u pacjentów z POChP należą aktualne palenie tytoniu, starszy
wiek, niski wskaźnik masy ciała (BMI) i ciężka postać POChP.
Dzieci i młodzież
Nie ma wystarczających danych dotyczących ewentualnego hamującego wzrost działania budezonidu u dzieci
w wieku od sześciu miesięcy do czterech lat.
Wpływ na wzrost
Zaleca się systematyczną kontrolę wzrostu dzieci, które długotrwale przyjmują glikokortykosteroidy wziewne. Jeśli wzrost jest spowolniony, należy zweryfikować sposób leczenia zmniejszając stosowaną dawkę glikokortykosteroidów wziewnych. Przed podjęciem decyzji o rozpoczęciu leczenia należy dokładnie rozważyć korzyści wynikające ze stosowania glikokortykosteroidu i ryzyko związane ze spowolnieniem wzrostu. Ponadto wskazana jest konsultacja z lekarzem specjalizującym się w chorobach układu oddechowego u dzieci.
Budezonid jest metabolizowany głównie przez izoenzym CYP3A4. W związku z tym inhibitory tego enzymu, np. ketokonazol, itrakonazol i inhibitory proteazy HIV (rytonawir i sakwinawir) mogą zwiększać ekspozycję ogólnoustrojową na budezonid (patrz punkt 4.4). Ponieważ nie ma danych dotyczących dostosowania dawek, należy unikać jednoczesnego stosowania tych leków. Jeśli nie jest to możliwe, przerwa między przyjmowaniem poszczególnych leków powinna być możliwie jak najdłuższa. Należy również rozważyć zmniejszenie dawki budezonidu.
Spodziewane jest, że jednoczesne podawanie inhibitorów CYP3A, w tym produktów zawierających kobicystat, zwiększy ryzyko ogólnoustrojowych działań niepożądanych. Należy unikać łączenia leków, chyba że korzyść przewyższa zwiększone ryzyko ogólnoustrojowych działań niepożądanych związanych ze stosowaniem glikokortykosteroidów; w takim przypadku pacjenta należy obserwować w celu wykrycia ogólnoustrojowych działań glikokortykosteroidów.
Ze względu na możliwe zahamowanie czynności kory nadnerczy, test stymulacji ACTH wykonywany
w celu wykrycia niedoczynności przysadki może wskazywać fałszywe wyniki (małe wartości).
Ograniczone dane dotyczące tej interakcji wziewnego budezonidu w dużej dawce wskazują, że znaczne zwiększenie stężenia w osoczu (średnio cztery razy) może wystąpić, jeśli itrakonazol w dawce 200 mg raz na dobę jest podawany jednocześnie z wziewnym budezonidem (pojedyncza dawka 1000 µg).
Inne silne inhibitory CYP3A4, takie jak erytromycyna i klarytromycyna, mogą również znacząco zwiększać stężenie budezonidu w osoczu.
Zwiększone stężenie w osoczu i nasilone działanie glikokortykosteroidów było obserwowane u kobiet leczonych estrogenami i steroidami antykoncepcyjnymi. Nie obserwowano takiego działania podczas jednoczesnego przyjmowania budezonidu i małych dawek doustnych środków antykoncepcyjnych.
Jednoczesne podawanie cymetydyny może powodować niewielkie zwiększenie stężenia budezonidu
w osoczu, które jest zazwyczaj nieistotne klinicznie.
Jednoczesne stosowanie budezonidu ze steroidami o działaniu ogólnoustrojowym lub podawanymi donosowo prowadzi do addytywnego działania hamującego czynność nadnerczy.
Nie zaobserwowano interakcji między budezonidem a innymi lekami stosowanymi w leczeniu astmy.
Ciąża
Większość wyników z prospektywnego badania epidemiologicznego oraz dane zebrane po wprowadzeniu produktu do obrotu nie wykazały zwiększonego ryzyka szkodliwego wpływu na płód i noworodka związanego ze stosowaniem wziewnego budezonidu w czasie ciąży. Ważne jest zarówno dla płodu jak i dla matki utrzymanie odpowiedniego leczenia astmy podczas ciąży. Podobnie jak w przypadku innych leków podawanych podczas ciąży, należy określić stosunek korzyści wynikających z podawania budezonidu matce względem ryzyka dla płodu.
Karmienie piersią
Budezonid przenika do mleka matki. Jednak w przypadku stosowania budezonidu w dawkach leczniczych
nie przewiduje się żadnego wpływu leku na karmione piersią niemowlę. Budezonid można stosować
w okresie karmienia piersią.
Po zastosowaniu podtrzymujących dawek budezonidu w postaci wziewnej (200 lub 400 mikrogramów dwa razy na dobę) u kobiet z astmą karmiących piersią ogólnoustrojowe narażenie dzieci karmionych piersią na budezonid było nieistotne.
W badaniu farmakokinetyki, szacowana dawka dobowa, którą otrzymywało niemowlę, stanowiła 0,3% dawki dobowej u matki po zastosowaniu obu powyższych dawek budezonidu, a średnie stężenie w osoczu u dzieci szacowano na poziomie 1/600 stężenia występującego w osoczu matki, zakładając całkowitą biodostępność przyjętego doustnego leku u dziecka. Stężenia budezonidu w próbkach osocza dzieci były poniżej granicy oznaczalności.
Na podstawie danych dotyczących budezonidu podawanego wziewnie oraz faktu, że właściwości farmakokinetyczne budezonidu są liniowe w zakresie dawek leczniczych po podaniu donosowym, wziewnym, doustnym lub doodbytniczym, przewidywana ekspozycja na budezonid u karmionego piersią dziecka jest mała.
Produkt Nebbud nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów
i obsługiwania maszyn.
Sporadycznie mogą wystąpić objawy działań niepożądanych wynikających ze stosowania ogólnoustrojowych glikokortykosteroidów z glikokortykosteroidami wziewnymi, prawdopodobnie zależne od dawki, czasu ekspozycji, jednoczesnych i poprzednich ekspozycji na kortykosteroidy oraz od indywidualnej wrażliwości.
Zestawienie działań niepożądanych
Częstość występowania działań niepożądanych została zdefiniowana następująco: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000) oraz częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Częstość występowania | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Często | Kandydoza jamy ustnej i gardła Zapalenie płuc (u pacjentów |
Klasyfikacja układów i narządów | Częstość występowania | Działania niepożądane |
z POChP) | ||
Zaburzenia układu immunologicznego | Rzadko | Natychmiastowe i opóźnione reakcje nadwrażliwości*, w tym wysypka, kontaktowe zapalenie skóry, pokrzywka, obrzęk naczynioruchowy i reakcja anafilaktyczna |
Zaburzenia endokrynologiczne | Rzadko | Przedmiotowe i podmiotowe objawy działania ogólnoustrojowego kortykosteroidów, w tym zahamowanie czynności nadnerczy i opóźnienie wzrostu** |
Zaburzenia psychiczne | Niezbyt często | Lęk, depresja, zaburzenia snu, nadpobudliwość psychoruchowa, agresja |
Rzadko | Niepokój, nerwowość, zmiany w zachowaniu (głównie u dzieci). | |
Zaburzenia układu nerwowego | Niezbyt często | Drżenie |
Zaburzenia oka | Niezbyt często | Zaćma, nieostre widzenie (patrz także punkt 4.4) |
Nieznana | Jaskra | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Często | Kaszel, chrypka, podrażnienie gardła |
Rzadko | Skurcz oskrzeli, dysfonia | |
Zaburzenia żołądka i jelit | Często | Podrażnienie błony śluzowej jamy ustnej, trudności w połykaniu |
Zaburzenia skóry i tkanki podskórnej | Rzadko | Siniaczenie, reakcje skórne, świąd, rumień |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Niezbyt często | Skurcz mięśni |
Rzadko | Opóźnienie wzrostu | |
Badania diagnostyczne | Bardzo rzadko | Zmniejszenie gęstości kości |
* Patrz poniżej: Opis wybranych działań niepożądanych; podrażnienie skóry twarzy.
** Patrz poniżej: Dzieci i młodzież.
Opis wybranych działań niepożądanych
Podrażnienie skóry twarzy, jako przykład reakcji nadwrażliwości, wystąpiło w niektórych przypadkach po zastosowaniu nebulizatora z maską na twarz. Aby zapobiec wystąpieniu podrażnienia skóry twarzy, po zastosowaniu maski należy przemyć skórę twarzy wodą.
W badaniach kontrolowanych placebo, zaćma była również niezbyt często obserwowana w grupie placebo.
Badania kliniczne z udziałem 13 119 pacjentów oraz 7 278 pacjentów przyjmujących wziewny budezonid zostały połączone. Częstość występowania lęku wyniosła 0,52% w grupie przyjmującej wziewny budezonid i 0,63% w grupie placebo; częstość występowania depresji wynosiła 0,67% w grupie przyjmującej wziewny budezonid i 1,15% w grupie placebo.
Istnieje zwiększone ryzyko zapalenia płuc u pacjentów z nowo rozpoznaną POChP, u których leczenie rozpoczęto wziewnymi kortykosteroidami. Jednak ważona ocena 8 badań klinicznych z udziałem 4643 pacjentów z POChP leczonych budezonidem i 3643 pacjentów przydzielonych losowo do grupy otrzymującej leczenie bez wziewnych kortykosteroidów nie wykazały zwiększonego ryzyka zapalenia płuc. Wyniki z pierwszych 7 z 8 badań zostały opublikowane w metaanalizie.
Leczenie wziewnym budezonidem może powodować zakażenie grzybicze jamy ustnej i gardła.
Z doświadczenia wynika, że zakażenia drożdżakami występują rzadziej, jeśli pacjent wykonuje inhalacje przed posiłkami i (lub) płucze jamę ustną po inhalacji. W większości przypadków kandydoza odpowiadała na miejscowe leczenie przeciwgrzybicze bez przerywania leczenia wziewnym budezonidu.
Zazwyczaj można zapobiec wystąpieniu kaszlu poprzez wdychanie agonisty receptora β2-adrenergicznego (np. terbutaliny) 5 do 10 minut przed podaniem produktu Nebbud.
Ogólnoustrojowe działania wziewnych kortykosteroidów mogą wystąpić, szczególnie jeśli te leki są przyjmowane w dużych dawkach przez dłuższy okres. Do tych działań należą: zaburzenia czynności nadnerczy, spowolnienie wzrostu u dzieci i młodzieży, zmniejszenie gęstości mineralnej kości, zaćma
i jaskra oraz podatność na infekcje. Może być osłabiona zdolność radzenia sobie ze stresem. Wystąpienie wymienionych działań ogólnoustrojowych podczas stosowania wziewnego budezonidu jest znacznie mniej prawdopodobne niż podczas stosowania kortykosteroidów doustnych.
Dzieci i młodzież
Ze względu na ryzyko spowolnienia wzrostu u dzieci i młodzieży, należy kontrolować wzrost jak opisano
w punkcie 4.4.
Istnieją ograniczone dane dotyczące bezpieczeństwa stosowania i skuteczności budezonidu w postaci zawiesiny do nebulizacji u dzieci z nadwagą lub otyłością, jednak jako kluczowy cel należy rozważyć zmniejszenie masy ciała dziecka.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301, Faks: + 48 22 49 21 309,
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Ostre przedawkowanie budezonidu, nawet w dużych dawkach, nie powinno stanowić problemu klinicznego.
Objawy
Jedynym szkodliwym działaniem po przyjęciu dużej ilości aerozolu w krótkim okresie jest zahamowanie czynności kory nadnerczy. W przypadku długotrwałego stosowania bardzo dużych dawek może wystąpić zanik kory nadnerczy oraz zahamowanie czynności nadnerczy.
Leczenie
Ostre przedawkowanie: nie ma konieczności podejmowania szczególnych działań doraźnych. Należy kontynuować leczenie budezonidem w możliwie najmniejszej dawce podtrzymującej. Prawidłowa czynność kory nadnerczy powraca samoistnie w ciągu kilku dni.
Przedawkowanie przewlekłe: U pacjentów stosujących przewlekle nadmierne dawki budezonidu może wystąpić ogólnoustrojowe działanie glikokortykosteroidowe, takie jak hiperkortycyzm i zahamowanie czynności kory nadnerczy (patrz punkt 4.4). Pacjentów otrzymujących dawki wyższe niż zatwierdzone należy ściśle monitorować, a dawkę należy stopniowo zmniejszać. Należy postępować tak, jak w przypadku pacjentów leczonych wcześniej steroidami i zastosować odpowiednią dawkę podtrzymującą steroidu
o działaniu ogólnoustrojowym, np. prednizolonu. Kiedy stan pacjenta ustabilizuje się, pacjent powinien kontynuować leczenie budezonidem wziewnym w zalecanej dawce.
Grupa farmakoterapeutyczna: Glikokortykosteroidy, Kod ATC: R03B A02
Mechanizm działania
Budezonid jest glikokortykosteroidem niezawierającym halogenów, wykazującym silne miejscowe działanie przeciwzapalne z niewielką liczbą działań ogólnoustrojowych. Dzieje się tak, ponieważ po wchłonięciu budezonid jest szybko inaktywowany w wątrobie (patrz również punkt 5.2). Dokładny mechanizm działania glikokortykosteroidów w leczeniu astmy nie jest w pełni poznany. Prawdopodobnie ważną rolę odgrywają reakcje przeciwzapalne (w tym komórki T, komórki kwasochłonne i komórki tuczne), takie jak hamowanie uwalniania mediatorów reakcji zapalnej i hamowanie odpowiedzi immunologicznej zależnej od cytokin.
Po podaniu doustnym pojedynczej dawki wziewnego budezonidu za pomocą inhalatora, poprawę czynności płuc można wykazać w ciągu kilku godzin. Jednak działanie terapeutyczne podawanego doustnie wziewnego budezonidu jest maksymalizowane dopiero po kilku tygodniach.
Działanie farmakodynamiczne
Badanie kliniczne z udziałem pacjentów z astmą porównujące działanie budezonidu wziewnego i doustnego w dawkach zapewniających zbliżoną biodostępność ogólnoustrojową wykazały, w porównaniu z placebo, statystycznie istotną skuteczność budezonidu wziewnego, ale nie doustnego. Dlatego też, działanie terapeutyczne standardowych dawek wziewnego budezonidu można w większości wytłumaczyć jego bezpośrednim działaniem na drogi oddechowe.
W testach prowokacyjnych u zwierząt doświadczalnych oraz u pacjentów budezonid wykazywał działanie przeciwanafilaktyczne i przeciwzapalne. Działanie to widoczne było jako zmniejszona obturacja oskrzeli zarówno w natychmiastowej, jak i późnej reakcji alergicznej.
Wykazano również, że budezonid zmniejsza reaktywność dróg oddechowych na histaminę i metacholinę
u pacjentów z nadreaktywnością oskrzeli. Leczenie budezonidem wziewnym jest skuteczne w zapobieganiu astmie wywołanej wysiłkiem fizycznym.
Wpływ na stężenia kortyzolu w osoczu
Badania z udziałem zdrowych ochotników stosujących budezonid wykazały zależny od dawki wpływ na stężenie kortyzolu w osoczu i w moczu. W teście ACTH wykazano, że budezonid przyjmowany
w zalecanych dawkach powoduje znacznie mniejszy wpływ na czynność nadnerczy niż prednizon w dawce
10 mg.
W badaniach klinicznych wykazano, że budezonid ma dobrą skuteczność w astmie oskrzelowej, a działania niepożądane związane z leczeniem podtrzymującym są zwykle łagodne.
Zaostrzenia POChP
Kilka badań wykazało, że nebulizowany budezonid w dawce 4-8 mg na dobę skutecznie leczy zaostrzenia
POChP.
W randomizowanym, kontrolowanym placebo badaniu z podwójnie ślepą próbą, obejmującym 199
pacjentów z ostrymi zaostrzeniami POChP, pacjenci byli leczeni nebulizowanym budezonidem w dawce
8 mg na dobę (2 mg cztery razy na dobę (n=71)) lub prednizolonem podawanym doustnie w dawce 30 mg co
12 godzin (n=62) lub placebo (n=66) przez 3 dni. Poprawa FEV1 po rozszerzeniu dróg oddechowych
w porównaniu z placebo wyniosła 0,10 l dla budezonidu i 0,16 l dla prednizolonu; różnica między dwoma aktywnymi terapiami nie była statystycznie istotna. Odsetek pacjentów z kliniczną poprawą FEV1 o co najmniej 0,15 l po rozszerzeniu dróg oddechowych był większy w grupie nebulizowanej budezonidem (34%) i w grupie prednizolonu (48%) niż w grupie placebo (18%). Różnice były statystycznie istotne dla obu aktywnych terapii w porównaniu z placebo (p<0,05), ale nie pomiędzy aktywnymi terapiami.
Dzieci i młodzież
Ograniczone dane pochodzące z długotrwałych badań wskazują, że większość dzieci i młodzieży leczonych wziewnym budezonidem osiąga ostatecznie swój przewidywany wzrost w wieku dorosłym. Jednakże, obserwuje się początkowo niewielkie, ale przemijające opóźnienie wzrostu (o około 1 cm), występujące najczęściej w pierwszym roku leczenia (patrz punkt 4.4).
Astma – badania kliniczne
Skuteczność budezonidu w postaci zawiesiny do nebulizacji oceniano w dużej liczbie badań i wykazano, że produkt jest skuteczny zarówno u pacjentów dorosłych, jak i u dzieci po podaniu raz lub dwa razy na dobę w leczeniu profilaktycznym przewlekłej astmy.
Pseudokrup – badania kliniczne
Budezonid w postaci zawiesiny do nebulizacji był porównywany z placebo w szeregu badań klinicznych u dzieci z pseudokrupem. Przykłady reprezentatywnych badań służących ocenie stosowania budezonidu w postaci zawiesiny do nebulizacji w leczeniu dzieci z pseudokrupem podano poniżej.
Skuteczność u dzieci z łagodnym do umiarkowanego pseudokrupem
U 87 dzieci w wieku od 7 miesięcy do 9 lat przyjętych do szpitala z klinicznym rozpoznaniem pseudokrupu przeprowadzono randomizowane, podwójnie zaślepione badanie kliniczne kontrolowane placebo, w celu określenia, czy budezonid w postaci zawiesiny do nebulizacji łagodzi objawy pseudokrupu w ocenie punktowej lub skraca czas pobytu pacjenta w szpitalu. Podawano początkową dawkę 2 mg budezonidu lub placebo, a następnie co 12 godzin podawano lek w dawce 1 mg albo placebo. Budezonid powodował statystycznie znamienną poprawę punktacji objawów pseudokrupu po 12 oraz po 24 godzinach stosowania, a także po 2 godzinach od podania w podgrupie pacjentów z początkową punktacją objawów pseudokrupu powyżej 3. Zaobserwowano również skrócenie okresu hospitalizacji o 33%.
Skuteczność u dzieci z umiarkowanym do ciężkiego pseudokrupem
W randomizowanym, podwójnie zaślepione badaniu klinicznym kontrolowanym placebo porównywano skuteczność budezonidu w postaci zawiesiny do nebulizacji i placebo w leczeniu pseudokrupu u 83 niemowląt i dzieci (w wieku od 6 miesięcy do 8 lat), przyjętych do szpitala z powodu pseudokrupu. Pacjenci
otrzymywali budezonid w dawce 2 mg lub placebo co 12 godzin, lecz przez okres nie dłuższy niż 36 godzin lub do momentu wypisania ze szpitala. Łączna punktacja objawów pseudokrupu była oceniana 0, 2, 6, 12, 24, 36 oraz 48 godzin po podaniu pierwszej dawki. Po 2 godzinach zarówno grupa przyjmujących budezonid jak i grupa otrzymujących placebo wykazywały podobną poprawę w zakresie punktacji objawów pseudokrupu, nie stwierdzono statystycznie znamiennej różnicy pomiędzy tymi grupami. Po 6 godzinach po podaniu punktacja w zakresie objawów pseudokrupu w grupie przyjmujących budezonid w postaci zawiesiny do nebulizacji uległa statystycznie znamiennej poprawie w porównaniu z grupą placebo i ta poprawa była podobna po 12 oraz po 24 godzinach.
Wchłanianie
U osób dorosłych ogólnoustrojowa biodostępność budezonidu po podaniu budezonidu w postaci zawiesiny do nebulizacji za pomocą nebulizatora pneumatycznego wynosi około 15% dawki nominalnej oraz 40% do 70% dawki dostarczonej pacjentowi. Niewielka ilość leku dostępna ogólnoustrojowo pochodzi z połkniętej części leku. Po jednorazowym podaniu dawki wynoszącej 2 mg maksymalne stężenie leku w osoczu występuje 10 do 30 minut po rozpoczęciu nebulizacji i wynosi około 4 nmol/l.
Dystrybucja
U osób dorosłych objętość dystrybucji budezonidu wynosi około 3,0 l/kg masy ciała. Budezonid wiąże się
z białkami osocza w mniej więcej 85 do 90%.
Metabolizm
W wyniku efektu pierwszego przejścia przez wątrobę z udziałem CYP3A4 około 90% budezonidu ulega przemianie do metabolitów o małej aktywności glikokortykosteroidowej. Aktywność glikokortykosteroidowa głównych metabolitów, 6-β-hydroksybudezonidu i 16-α-hydroksyprednizolonu, wynosi mniej niż 1% aktywności budezonidu.
Eliminacja
Metabolity budezonidu są wydalane w postaci wolnej lub sprzężonej, przede wszystkim przez nerki. Budezonid w postaci niezmienionej nie jest wykrywany w moczu. U zdrowych, dorosłych osób budezonid ma duży klirens układowy (około 1,2 l/min), a średni okres półtrwania budezonidu w fazie eliminacji po podaniu dożylnym wynosi około 2-3 godzin.
Liniowość
Farmakokinetyka budezonidu stosowanego w dawkach leczniczych jest proporcjonalna do dawki.
Dzieci i młodzież
U dzieci z astmą w wieku 4 do 6 lat ogólnoustrojowy klirens budezonidu wynosi około 0,5 l/min.
W przeliczeniu na kg masy ciała klirens budezonidu u dzieci jest o 50% większy niż u dorosłych. U dzieci chorych na astmę okres półtrwania budezonidu po inhalacji wynosi w przybliżeniu 2,3 godziny i jest prawie taki sam jak okres półtrwania u zdrowych dorosłych. U dzieci z astmą w wieku 4 do 6 lat ogólnoustrojowa biodostępność budezonidu po podaniu za pomocą nebulizatora pneumatycznego (Pari LC Jet Plus®
z kompresorem Pari Master®) wynosi w przybliżeniu 6% dawki nominalnej oraz 26% dawki dostarczonej pacjentowi. Ogólnoustrojowa biodostępność u dzieci jest w przybliżeniu o połowę mniejsza niż u dorosłych.
U dzieci z astmą w wieku 4 do 6 lat maksymalne stężenie w osoczu występuje 20 minut po rozpoczęciu nebulizacji 1 mg budezonidu i wynosi około 2,4 nmol/l. Ekspozycja na budezonid (Cmax i AUC) u dzieci
w wieku 4-6 lat po jednorazowym podaniu dawki 1 mg leku w nebulizacji jest porównywalna do ekspozycji obserwowanej u dorosłych, którym podawano taką samą dawkę dostarczoną za pomocą takiego samego zestawu do nebulizacji.
Ostra toksyczność budezonidu jest mała, a jej nasilenie i rodzaj są podobne jak w przypadku innych glikokortykosteroidów. Wyniki badań toksyczności podostrej i przewlekłej, a także genotoksyczności
i rakotwórczości nie wykazały żadnego szczególnego zagrożenia dla ludzi stosujących budezonid
w dawkach terapeutycznych.
Chociaż odnotowano zwiększenie częstości występowania glejaków mózgu u samców szczurów, wyniki te nie zostały potwierdzone w kolejnym badaniu. Dostępne doświadczenie kliniczne nie wskazuje, aby budezonid powodował glejaki mózgu lub inne pierwotne nowotwory u ludzi.
Glikokortykosteroidy, w tym budezonid, wykazywały działanie teratogenne w badaniach na zwierzętach, w tym rozszczep podniebienia i wady rozwoju kośćca. Wystąpienie podobnych działań u ludzi stosujących zalecane dawki uważa się za mało prawdopodobne.
Wyniki badań na zwierzętach wykazały również związek między ekspozycją na mniejsze niż teratogenne dawki glikokortykosteroidów w okresie prenatalnym a zwiększonym ryzykiem opóźnienia wewnątrzmacicznego rozwoju płodu, chorób układu krążenia w wieku dorosłym, trwałych zmian w ilości receptorów glikokortykosteroidowych, zmian w metabolizmie i działaniu neuroprzekaźników, a także zmian w zachowaniu.
Disodu edetynian Sodu chlorek Polisorbat 80
Kwas cytrynowy jednowodny Sodu cytrynian
Woda do wstrzykiwań
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 6.6.
Przed otwarciem: 2 lata
Po pierwszym otwarciu foliowej saszetki: 3 miesiące.
Po otwarciu ampułki: zużyć natychmiast. Wszelkie niewykorzystane resztki produktu leczniczego należy usunąć.
Nie zamrażać.
Przechowywać w pozycji pionowej. Po otwarciu saszetki ampułkę przechowywać w saszetce, w tekturowym pudełku w celu ochrony przed światłem i nie należy ich zamrażać. Okres ważności po otwarciu saszetek, patrz punkt 6.3.
Ampułka z LDPE. 5 połączonych ampułek umieszczonych w saszetce PET/LDPE/Aluminium/LDPE, w tekturowym pudełku.
Każda ampułka zawiera 2 ml zawiesiny.
Wielkości opakowań:
5, 10, 15, 20, 25, 30, 40, 50 lub 60 ampułek do jednorazowego użycia. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Produkt leczniczy Nebbud, zawiesina do nebulizacji, może być mieszany z 0,9% roztworem chlorku sodu
oraz z roztworami terbutaliny, salbutamolu, kromoglikanu sodowego lub bromku ipratropiowego.
Mieszaninę należy zużyć w ciągu 30 minut od chwili przygotowania.
Każda ampułka jest przeznaczona wyłączenie do jednorazowego użycia. Należy wyrzucić niewykorzystaną zawiesinę.
Produkt jest jałowy do czasu otwarcia opakowania.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi
przepisami.
OBROTU
Teva Pharmaceuticals Polska Sp. z o.o. ul. Emilii Plater 53
00-113 Warszawa
21768
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 19.03.2014 r.
Data ostatniego przedłużenia pozwolenia: 25.03.2019 r.
PRODUKTU LECZNICZEGO
2022.10.03











