Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Ciężkie zaburzenia czynności wątroby, marskość żółciowa wątroby, cholestaza.
Drugi i trzeci trymestr ciąży (patrz punkty 4.4 i 4.6).
Jednoczesne stosowanie antagonistów receptora angiotensyny II (AIIRA), w tym walsartanu lub inhibitorów konwertazy angiotensyny (ACE) z aliskirenem u pacjentów z cukrzycą
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania Valzek 80 mg
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
VALZEK, 80 mg, tabletki VALZEK, 160 mg, tabletki
Każda tabletka Valzek, 80 mg zawiera 80 mg walsartanu (Valsartanum). Każda tabletka Valzek, 160 mg zawiera 160 mg walsartanu (Valsartanum).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletki.
Białe, okrągłe, obustronnie wypukłe tabletki z rowkiem dzielącym po jednej stronie. Tabletkę można podzielić na równe dawki.
Nadciśnienie tętnicze
Leczenie samoistnego nadciśnienia tętniczego u dorosłych pacjentów oraz nadciśnienia u dzieci i młodzieży w wieku od 6 do 18 lat.
Stan po świeżo przebytym zawale mięśnia sercowego
Leczenie dorosłych pacjentów w stabilnym stanie klinicznym z objawową niewydolnością serca lub bezobjawową niewydolnością skurczową lewej komory po świeżo przebytym (12 godzin do 10 dni) zawale mięśnia sercowego (patrz punkty 4.4 i 5.1).
Niewydolność serca
Leczenie objawowej niewydolności serca u dorosłych pacjentów, w przypadku, gdy inhibitory konwertazy angiotensyny (ACE) nie są tolerowane lub u pacjentów nietolerujących beta- adrenolityków, jako leczenie skojarzone z inhibitorami konwertazy angiotensyny (ACE), jeśli nie można zastosować antagonistów receptora mineralokortykoidowego (patrz punkty 4.2, 4.4, 4.5 i 5.1).
Dawkowanie
Nadciśnienie tętnicze
Zalecana dawka początkowa produktu leczniczego Valzek wynosi 80 mg raz na dobę. Działanie przeciwnadciśnieniowe jest wyraźnie zauważalne w ciągu 2 tygodni, a maksymalne staje się w ciągu 4 tygodni. W przypadku niektórych pacjentów, u których nie uzyska się odpowiedniej kontroli ciśnienia tętniczego, dawkę można zwiększyć do 160 mg, a maksymalnie do 320 mg.
Produkt leczniczy Valzek może być stosowany jednocześnie z innym lekami przeciwnadciśnieniowymi. Dodatkowe zastosowanie leku moczopędnego, takiego jak
hydrochlorotiazyd, powoduje większe obniżenie ciśnienia tętniczego u tych pacjentów (patrz punkty 4.3, 4.4, 4.5 i 5.1).
Stan po świeżo przebytym zawale mięśnia sercowego
U pacjentów w stabilnym stanie klinicznym leczenie może być rozpoczęte już po 12 godzinach od rozpoznania zawału mięśnia sercowego.
Po zastosowaniu dawki początkowej 20 mg dwa razy na dobę, dawkę walsartanu należy stopniowo zwiększać przez następnych kilka tygodni, do 40 mg, 80 mg i 160 mg dwa razy na dobę.
Maksymalną dawką docelową jest 160 mg podawane dwa razy na dobę. Zwykle zaleca się, aby pacjenci osiągali dawkę 80 mg dwa razy na dobę w ciągu dwóch tygodni po rozpoczęciu leczenia, a maksymalną dawkę docelową wynoszącą 160 mg dwa razy na dobę — w ciągu trzech miesięcy, w zależności od tolerancji leku przez pacjenta. Jeśli wystąpi objawowe niedociśnienie tętnicze lub zaburzenie czynności nerek, należy rozważyć zmniejszenie dawki.
Walsartan może być stosowany u pacjentów przyjmujących inne leki stosowane w leczeniu zawału mięśnia sercowego, takie jak leki trombolityczne, kwas acetylosalicylowy, leki blokujące receptory β- adrenergiczne, statyny i leki moczopędne. Nie zaleca się jednoczesnego stosowania z inhibitorami ACE (patrz punkty 4.4 i 5.1).
Ocena stanu pacjenta po przebytym zawale mięśnia sercowego powinna zawsze uwzględniać ocenę czynności nerek.
Niewydolność serca
Zalecana dawka początkowa walsartanu to 40 mg dwa razy na dobę. Zwiększanie dawki kolejno do 80 mg i 160 mg dwa razy na dobę powinno być przeprowadzane w odstępach co najmniej dwutygodniowych, do uzyskania największej dawki tolerowanej przez pacjenta. W przypadku jednoczesnego stosowania leku moczopędnego należy rozważyć zmniejszenie jego dawki.
Maksymalna dawka dobowa zastosowana w badaniach klinicznych wynosiła 320 mg walsartanu w dawkach podzielonych.
Walsartan może być stosowany u pacjentów przyjmujących inne leki stosowane w leczeniu niewydolności serca. Jednakże nie zaleca się jednoczesnego podawania trzech leków - inhibitora ACE, walsartanu i leku blokującego receptory β-adrenergiczne lub diuretyku oszczędzającego potas (patrz punkty 4.4 i 5.1).
Ocena stanu pacjentów z niewydolnością serca powinna zawsze uwzględniać ocenę czynności nerek.
Dodatkowe informacje dotyczące szczególnych populacji
Stosowanie u osób w podeszłym wieku
Nie ma konieczności zmiany dawkowania u osób w podeszłym wieku.
Stosowanie u pacjentów z zaburzeniami czynności nerek
Nie ma konieczności dostosowania dawki u dorosłych pacjentów z klirensem kreatyniny >10 ml/min (patrz punkty 4.4 i 5.2).
Jednoczesne stosowanie walsartanu z aliskirenem jest przeciwwskazane u pacjentów z zaburzeniami czynności nerek (GFR <60 ml/min/1,73 m2) (patrz punkt 4.3)
Cukrzyca
Jednoczesne stosowanie walsartanu z aliskirenem jest przeciwwskazane u pacjentów z cukrzycą (patrz punkt 4.3).
Stosowanie u pacjentów z zaburzeniami czynności wątroby
Stosowanie produktu leczniczego Valzek jest przeciwwskazane u pacjentów z ciężkimi zaburzeniami czynności wątroby, żółciową marskością wątroby oraz u pacjentów z cholestazą (patrz punkty 4.3, 4.4 i 5.2). U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności wątroby bez cholestazy nie należy stosować dawek większych niż 80 mg walsartanu na dobę.
Dzieci i młodzież
Nadciśnienie tętnicze u dzieci i młodzieży
Dzieci i młodzież w wieku od 6 do 18 lat
Dawka początkowa wynosi 40 mg raz na dobę w przypadku dzieci o masie ciała mniejszej niż 35 kg oraz 80 mg raz na dobę w przypadku dzieci o masie ciała 35 kg lub większej. Dawkę produktu leczniczego należy dostosować w zależności od uzyskanych wartości ciśnienia tętniczego.
Maksymalne dawki walsartanu oceniane w badaniach klinicznych podano w poniższej tabeli. Dawki większe od wymienionych nie były oceniane w badaniach klinicznych i dlatego nie są zalecane.
Masa ciała | Maksymalna dawka walsartanu oceniana w badaniach klinicznych |
≥18 kg do <35 kg | 80 mg |
≥35 kg do <80 kg | 160 mg |
≥80 kg do ≤160 kg | 320 mg |
Dzieci w wieku poniżej 6 lat
Dostępne dane przedstawiono w punktach 4.8, 5.1 oraz 5.2. Jednak nie ustalono skuteczności i bezpieczeństwa stosowania walsartanu u dzieci w wieku od roku do 6 lat.
Stosowanie u dzieci i młodzieży w wieku od 6 do 18 lat z zaburzeniami czynności nerek
Nie badano stosowania produktu leczniczego u dzieci i młodzieży z klirensem kreatyniny <30 ml/min oraz poddawanych dializoterapii, dlatego w tej grupie pacjentów nie zaleca się stosowania walsartanu. Nie ma konieczności dostosowania dawki u dzieci i młodzieży z klirensem kreatyniny większym niż 30 ml/min. Należy ściśle kontrolować czynność nerek oraz stężenie potasu w surowicy (patrz punkty 4.4 i 5.2).
Stosowanie u dzieci i młodzieży w wieku od 6 do 18 lat z zaburzeniami czynności wątroby Podobnie jak w przypadku dorosłych pacjentów, stosowanie produkt leczniczego Valzek jest przeciwwskazane u dzieci i młodzieży z ciężkimi zaburzeniami czynności wątroby, żółciową marskością wątroby oraz u pacjentów z cholestazą (patrz punkty 4.3, 4.4 i 5.2). Doświadczenie kliniczne dotyczące podawania walsartanu dzieciom i młodzieży z łagodnymi do umiarkowanych
zaburzeniami czynności wątroby jest ograniczone. U tych pacjentów dawka walsartanu nie może być większa niż 80 mg.
Niewydolność serca i stan po świeżym zawale mięśnia sercowego u dzieci i młodzieży
Nie zaleca się stosowania produktu leczniczego Valzek w leczeniu niewydolności serca lub świeżego zawału mięśnia sercowego u dzieci i młodzieży w wieku poniżej 18 lat, ze względu na brak danych dotyczących bezpieczeństwa stosowania i skuteczności.
Sposób podawania
Podanie doustne
Produkt leczniczy Valzek może być przyjmowany niezależnie od posiłków i powinien być przyjmowany wraz z wodą.
lub zaburzeniami czynności nerek (GFR <60 ml / min/1,73 m2) (patrz punkty 4.4 i 4.5 ).
Hiperkaliemia
Nie zaleca się jednoczesnego stosowania suplementów potasu, leków moczopędnych oszczędzających potas, zamienników soli kuchennej zawierających potas lub innych leków, które mogą powodować zwiększenie stężenia potasu (heparyna itp.). Należy odpowiednio kontrolować stężenie potasu.
Zaburzenia czynności nerek
Ponieważ jak dotąd brak doświadczeń odnośnie bezpieczeństwa stosowania u pacjentów z klirensem kreatyniny <10 ml/min i pacjentów poddawanych dializoterapii, dlatego należy zachować ostrożność stosując walsartan w tej grupie pacjentów. Nie ma konieczności dostosowania dawki u dorosłych pacjentów z klirensem kreatyniny >10 ml/min (patrz punkty 4.2 i 5.2).
Jednoczesne stosowanie antagonistów receptora angiotensyny II, w tym walsartanu lub inhibitorów ACE z aliskirenem jest przeciwwskazane u pacjentów z zaburzeniami czynności nerek (GFR <60 ml/min /1,73 m2) (patrz punkty 4.3 i 4.5).
Zaburzenia czynności wątroby
Produkt leczniczy Valzek należy stosować ostrożnie u pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności wątroby, przebiegającymi bez cholestazy (patrz punkty 4.2 i 5.2).
Pacjenci z niedoborem sodu i (lub) odwodnieni
W rzadkich przypadkach na początku leczenia walsartanem u pacjentów ze znacznym niedoborem sodu i (lub) odwodnionych, np. z powodu przyjmowania dużych dawek leków moczopędnych, może wystąpić objawowe niedociśnienie tętnicze.
Przed rozpoczęciem leczenia walsartanem należy wyrównać niedobór sodu i (lub) objętość krwi krążącej, np. zmniejszając dawkę leku moczopędnego.
Zwężenie tętnicy nerkowej
Nie ustalono bezpieczeństwa stosowania walsartanu w przypadku pacjentów z obustronnym zwężeniem tętnicy nerkowej lub zwężeniem tętnicy jednej czynnej nerki.
Krótkotrwałe podawanie walsartanu 12 pacjentom z wtórnym nadciśnieniem naczyniowo-nerkowym, spowodowanym jednostronnym zwężeniem tętnicy nerkowej, nie wywołało istotnych zmian hemodynamicznych w nerkach ani nie wpłynęło na stężenie kreatyniny w surowicy lub azotu mocznikowego (BUN) we krwi. Jednakże, ponieważ inne leki działające na układ renina-angiotensyna mogą powodować zwiększenie stężenia mocznika we krwi i kreatyniny w surowicy u pacjentów
z jednostronnym zwężeniem tętnicy nerkowej, dlatego zaleca się monitorowanie czynności nerek u pacjentów leczonych walsartanem.
Stan po przeszczepieniu nerki
Dotychczas brak doświadczeń w zakresie bezpieczeństwa stosowania walsartanu u pacjentów, którym niedawno przeszczepiono nerkę.
Hiperaldosteronizm pierwotny
Nie należy stosować walsartanu u pacjentów z pierwotnym hiperaldosteronizmem, ponieważ układ renina-angiotensyna nie jest pobudzony u tych osób.
Zwężenie zastawki aorty i zastawki dwudzielnej, kardiomiopatia przerostowa ze zwężeniem drogi odpływu z lewej komory
Podobnie jak w przypadku innych leków rozszerzających naczynia krwionośne, wskazana jest szczególna ostrożność u pacjentów, u których występuje zwężenie zastawki aorty lub zastawki dwudzielnej albo kardiomiopatia przerostowa ze zwężeniem drogi odpływu z lewej komory.
Ciąża
Nie należy rozpoczynać leczenia antagonistami receptora angiotensyny II (AIIRA) w trakcie ciąży. Jeśli dalsze leczenie AIIRA nie jest konieczne, u pacjentek planujących ciążę należy zastosować alternatywne leczenie przeciwnadciśnieniowe o ustalonym profilu bezpieczeństwa stosowania
w trakcie ciąży. W przypadku stwierdzenia ciąży leczenie AIIRA należy natychmiast przerwać i, jeśli to właściwe, rozpocząć alternatywne leczenie (patrz punkty 4.3 i 4.6).
Stan po świeżo przebytym zawale mięśnia sercowego
Wykazano, że jednoczesne stosowanie kaptoprylu z walsartanem nie przynosi żadnej dodatkowej korzyści klinicznej, natomiast zwiększa ryzyko wystąpienia działań niepożądanych w porównaniu monoterapią jednym lub drugim lekiem (patrz punkty 4.2 i 5.1). Dlatego nie zaleca się jednoczesnego stosowania walsartanu i inhibitora ACE.
Należy zachować ostrożność na początku leczenia pacjentów po zawale mięśnia sercowego. Ocena stanu pacjenta po przebytym zawale mięśnia sercowego powinna zawsze uwzględniać ocenę czynności nerek (patrz punkt 4.2).
Stosowanie walsartanu u pacjentów po zawale mięśnia sercowego zwykle powoduje pewne obniżenie ciśnienia tętniczego, ale przerwanie leczenia ze względu na utrzymujące się objawowe niedociśnienie tętnicze nie jest zwykle konieczne, pod warunkiem, że pacjent przestrzega zaleceń odnośnie dawkowania (patrz punkt 4.2).
Niewydolność serca
Ryzyko działań niepożądanych, zwłaszcza niedociśnienia, hiperkaliemii oraz pogorszenia czynności nerek (w tym ostrej niewydolności nerek) może być zwiększone, jeśli produkt leczniczy Valzek jest stosowany jednocześnie z inhibitorem ACE. U pacjentów z niewydolnością serca potrójne leczenie skojarzone inhibitorem ACE, beta-adrenolitykiem i i walsartanem nie wykazało żadnej klinicznej korzyści (patrz punkt 5.1). Takie leczenie skojarzone wyraźnie zwiększa ryzyko wystąpienia działań niepożądanych i z tego powodu nie jest zalecane. Również nie zaleca się potrójnego leczenia skojarzonego inhibitorem ACE, antagonistą receptora mineralokortykoidowego i walsartanem. Takie leczenie skojarzone należy prowadzić pod nadzorem lekarza i często kontrolować czynność nerek, stężenie elektrolitów i ciśnienie tętnicze.
Należy zachować ostrożność na początku leczenia pacjentów z niewydolnością serca. Ocena stanu pacjenta z niewydolnością serca powinna zawsze uwzględniać ocenę czynności nerek (patrz punkt 4.2). Stosowanie walsartanu u pacjentów z niewydolnością serca zwykle powoduje pewne obniżenie ciśnienia tętniczego, ale przerwanie leczenia ze względu na utrzymujące się objawowe niedociśnienie tętnicze nie jest zwykle konieczne, pod warunkiem, że pacjent przestrzega zaleceń odnośnie dawkowania (patrz punkt 4.2). U pacjentów, u których czynność nerek może zależeć od aktywności układu renina-angiotensyna (np. pacjenci z ciężką zastoinową niewydolnością serca), leczenie inhibitorami ACE związane było z oligurią i (lub) postępującą azotemią oraz, w rzadkich przypadkach, z ostrą niewydolnością nerek i (lub) zgonem. Ponieważ walsartan jest antagonistą receptora angiotensyny II, nie można wykluczyć, że stosowanie produktu leczniczego Valzek może być związane z zaburzeniami czynności nerek.
Nie należy stosować jednocześnie inhibitora ACE i antagonisty receptora angiotensyny II u pacjentów z nefropatią cukrzycową.
Obrzęk naczynioruchowy w wywiadzie
U pacjentów leczonych walsartanem obserwowano obrzęk naczynioruchowy, w tym obrzęk krtani
i głośni, powodujący zwężenie dróg oddechowych i (lub) obrzęk twarzy, warg, gardła i (lub) języka; u niektórych z tych pacjentów już wcześniej występował obrzęk naczynioruchowy po zastosowaniu innych leków, w tym inhibitorów ACE. Należy natychmiast przerwać leczenie produktem leczniczym Valzek u pacjentów, u których wystąpił obrzęk naczynioruchowy oraz nie należy ponownie podawać produktu leczniczego Valzek u tych pacjentów (patrz punkt 4.8).
Podwójna blokada układu renina-angiotensyna-aldosteron (RAAS)
Istnieją dowody potwierdzające, że jednoczesne stosowanie inhibitorów ACE, antagonistów receptora angiotensyny II lub aliskirenu zwiększa ryzyko niedociśnienia tętniczego, hiperkaliemii i pogorszenia czynności nerek (w tym ostrej niewydolności nerek). Dlatego nie zaleca się podwójnej blokady układu RAA za pomocą jednoczesnego stosowania inhibitorów ACE, antagonistów receptora angiotensyny
II lub aliskirenu (patrz punkt 4.5 i 5.1).
Jeśli zastosowanie podwójnej blokady jest uważane za niezbędne, należy ją stosować tylko pod nadzorem lekarza i często kontrolować czynność nerek, stężenie elektrolitów i ciśnienie tętnicze. Nie
należy stosować jednocześnie inhibitora ACE i antagonisty receptora angiotensyny II u pacjentów z nefropatią cukrzycową.
Dzieci i młodzież
Zaburzenia czynności nerek
Nie badano stosowania produktu leczniczego u dzieci i młodzieży z klirensem kreatyniny <30 ml/min oraz poddawanych dializoterapii, dlatego w tej grupie pacjentów nie zaleca się stosowania walsartanu. Nie ma konieczności dostosowania dawki u dzieci i młodzieży z klirensem kreatyniny większym niż 30 ml/min (patrz punkty 4.2 i 5.2). Należy ściśle kontrolować czynność nerek oraz stężenie potasu
w surowicy podczas leczenia walsartanem. Dotyczy to zwłaszcza sytuacji, gdy walsartan jest stosowany podczas występowania innych zaburzeń (gorączka, odwodnienie), które mogą wpływać na czynność nerek. Jednoczesne stosowanie antagonistów receptora angiotensyny II, w tym walsartanu lub inhibitorów ACE inhibitorów z aliskirenem jest przeciwwskazane u pacjentów z zaburzeniami czynności nerek (GFR <60 ml / min / 1,73 m2) (patrz punkty 4.3 i 4.5).
Zaburzenia czynności wątroby
Podobnie jak u dorosłych pacjentów, produkt leczniczy Valzek jest przeciwwskazany do stosowania u dzieci i młodzieży z ciężkimi zaburzeniami czynności wątroby, żółciową marskością wątroby oraz u pacjentów z cholestazą (patrz punkty 4.3 i 5.2). Doświadczenie kliniczne z podawaniem walsartanu dzieciom i młodzieży z łagodnymi do umiarkowanych zaburzeniami czynności wątroby jest ograniczone. U tych pacjentów dawka walsartanu nie może być większa 80 mg.
Podwójna blokada układu renina-angiotensyna (RAS) za pomocą antagonisty receptora angiotensyny II, inhibitora ACE lub aliskirenu:
Dane uzyskane z badań klinicznych wykazały, że podwójna blokada układu renina-angiotensyna (RAS) za pomocą jednoczesnego stosowania inhibitorów ACE, antagonistów receptora angiotensyny II lub aliskirenu jest związana z większą częstością występowania działań niepożądanych, takich jak niedociśnienie tętnicze, hiperkaliemia i pogorszenie czynności nerek (w tym ostra niewydolność nerek), w porównaniu do stosowania pojedynczego leku działającego na RAS (patrz punkty 4.3, 4.4 i 5.1).
Jednoczesne stosowanie antagonistów receptora angiotensyny II (AIIRA), w tym walsartanu lub inhibitorów konwertazy angiotensyny (ACE) z aliskirenem jest przeciwwskazane u pacjentów
z cukrzycą lub zaburzeniami czynności nerek (GFR <60 ml / min / 1,73 m2) (patrz punkty 4.3 i 4.4).
Jednoczesne stosowanie, które nie jest zalecane
Lit
Zgłaszano przypadki odwracalnego zwiększenia stężenia litu w surowicy i nasilenia jego toksyczności podczas jednoczesnego stosowania inhibitorów ACE lub antagonistów receptora angiotensyny II (AIIRA), w tym walsartanu. Jeśli takie leczenie skojarzone okaże się konieczne, zaleca się ścisłe kontrolowanie stężenia litu w surowicy krwi. W przypadku jednoczesnego stosowania leku moczopędnego, ryzyko toksycznego działania litu może być prawdopodobnie dodatkowo zwiększone.
Leki moczopędne oszczędzające potas, suplementy potasu, zamienniki soli kuchennej zawierające potas i inne substancje, które mogą zwiększać stężenie potasu
Jeśli zostanie stwierdzona konieczność zastosowania produktu leczniczego wpływającego na stężenie potasu jednocześnie z walsartanem, zaleca się kontrolowanie stężenia potasu w osoczu.
Wymagana ostrożność podczas jednoczesnego stosowania
Niesteroidowe leki przeciwzapalne (NLPZ), w tym selektywne inhibitory COX-2, kwas acetylosalicylowy w dawce >3 g/dobę i nieselektywne NLPZ
W przypadku jednoczesnego podawania antagonistów receptora angiotensyny II z NLPZ może nastąpić osłabienie działania przeciwnadciśnieniowego. Ponadto jednoczesne stosowanie antagonistów receptora angiotensyny II i NLPZ może prowadzić do podwyższonego ryzyka pogorszenia czynności nerek i zwiększenia stężenia potasu w surowicy krwi. Dlatego zaleca się kontrolę czynności nerek na początku leczenia, jak również zapewnienie odpowiedniego nawodnienia pacjenta.
Białka transportujące
Dane z badań in vitro wskazują, że walsartan jest substratem transportera wychwytu wątrobowego OATP1B1/OATP1B3 i transportera wyrzutu wątrobowego MRP2. Znaczenie kliniczne tych obserwacji jest nieznane. Jednoczesne stosowanie inhibitorów transportera wychwytu (np. ryfampicyny, cyklosporyny) lub transportera wyrzutu (np. rytonawiru) może zwiększyć ogólnoustrojowe narażenie na walsartan. Należy zachować właściwą ostrożność podczas rozpoczynania lub kończenia jednoczesnego podawania tych leków.
Inne
W badaniach interakcji lekowych walsartanu nie stwierdzono istotnych klinicznie interakcji walsartanu z żadną z następujących substancji: cymetydyna, warfaryna, furosemid, digoksyna, atenolol, indometacyna, hydrochlorotiazyd, amlodypina i glibenklamid.
Dzieci i młodzież
W nadciśnieniu tętniczym u dzieci i młodzieży, u których często współistnieją zaburzenia czynności nerek, zaleca się ostrożność podczas jednoczesnego stosowania walsartanu i innych substancji hamujących układ renina-angiotensyna-aldosteron, mogących zwiększać stężenie potasu w surowicy. Należy ściśle kontrolować czynności nerek oraz stężenie potasu w surowicy.
Ciąża
Nie zaleca się stosowania antagonistów receptora angiotensyny II (AIIRA) w trakcie pierwszego trymestru ciąży (patrz punkt 4.4). Stosowanie AIIRA jest przeciwwskazane w trakcie drugiego
i trzeciego trymestru ciąży (patrz punkty 4.3 i 4.4).
Dane epidemiologiczne dotyczące ryzyka teratogenności po podaniu inhibitorów ACE w trakcie pierwszego trymestru ciąży nie są jednoznaczne, jednak nie można wykluczyć niewielkiego zwiększenia ryzyka. Brak danych z kontrolowanych badań epidemiologicznych dotyczących ryzyka związanego ze stosowaniem AIIRA, niemniej takie ryzyko może istnieć dla tej grupy leków. Jeśli dalsze leczenie AIIRA nie jest konieczne, u pacjentek planujących ciążę należy zastosować alternatywne leczenie przeciwnadciśnieniowe o ustalonym profilu bezpieczeństwa stosowania
w trakcie ciąży. W przypadku stwierdzenia ciąży leczenie AIIRA należy natychmiast przerwać i, jeśli to właściwe, rozpocząć alternatywne leczenie. Stwierdzono, że przyjmowanie AIIRA w drugim
i trzecim trymestrze ciąży powoduje toksyczne działanie na płód (pogorszenie czynności nerek, małowodzie, opóźnienie kostnienia czaszki) oraz noworodka (niewydolność nerek, niedociśnienie, hiperkaliemia) – patrz również punkt 5.3.
W razie narażenia na AIIRA począwszy od drugiego trymestru ciąży zaleca się kontrolne badania ultrasonograficzne czynności nerek i rozwoju czaszki płodu.
Noworodki, których matki stosowały AIIRA, należy uważnie obserwować ze względu na możliwość wystąpienia niedociśnienia (patrz również punkty 4.3 i 4.4).
Karmienie piersią
Ponieważ brak informacji dotyczących stosowania walsartanu w trakcie karmienia piersią, nie zaleca się podawania produktu leczniczego Valzek i zaleca się zastosowanie leków o lepiej ustalonym profilu bezpieczeństwa w okresie karmienia piersią, szczególnie podczas karmienia noworodka lub wcześniaka.
Płodność
Walsartan nie wpływał niekorzystnie na sprawność reprodukcyjną samców i samic szczura po podaniu doustnym dawek do 200 mg/kg mc./dobę. Dawka ta stanowi 6-krotność maksymalnej dawki zalecanej do stosowania u ludzi, w przeliczeniu na mg/m2 pc. (obliczenia zakładają podanie doustne dawki
320 mg/dobę pacjentowi o masie ciała 60 kg).
Nie przeprowadzono badań nad wpływem produktu leczniczego na zdolność prowadzenia pojazdów. W trakcie prowadzenia pojazdów lub obsługiwania maszyn należy wziąć pod uwagę możliwość sporadycznego występowania zawrotów głowy lub uczucia zmęczenia.
W kontrolowanych badaniach klinicznych z udziałem dorosłych pacjentów z nadciśnieniem tętniczym ogólna częstość występowania działań niepożądanych w grupie leczonej walsartanem była porównywalna z częstością występującą w grupie otrzymującej placebo i odpowiadała jego właściwościom farmakologicznym. Wydaje się, że częstość występowania działań niepożądanych nie była związana z dawką ani czasem trwania leczenia; nie wykazano również związku z płcią, wiekiem lub rasą pacjentów.
Działania niepożądane zgłaszane w trakcie badań klinicznych, po wprowadzeniu walsartanu do obrotu i z badań laboratoryjnych są wymienione w tabeli poniżej zgodnie z klasyfikacją układów i narządów.
Działania niepożądane zostały sklasyfikowane według częstości ich występowania (najczęstsze działania wymieniono w pierwszej kolejności) w następujący sposób: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), w tym pojedyncze przypadki. W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Dla działań niepożądanych zgłoszonych po wprowadzeniu walsartanu do obrotu i w badaniach laboratoryjnych niemożliwe jest ustalenie częstości ich występowania, dlatego wymienione są z określeniem częstości jako „nieznana”.
Nadciśnienie tętnicze
Zaburzenia krwi i układu chłonnego | |
Nieznana | Zmniejszenie stężenia hemoglobiny, zmniejszenie wartości hematokrytu, neutropenia, małopłytkowość |
Zaburzenia układu immunologicznego | |
Nieznana | Nadwrażliwość, w tym choroba posurowicza |
Zaburzenia metabolizmu i odżywiania | |
Nieznana | Zwiększenie stężenia potasu w surowicy, hiponatremia |
Zaburzenia ucha i błędnika | |
Niezbyt często | Zawroty głowy pochodzenia błędnikowego |
Zaburzenia naczyniowe | |
Nieznana | Zapalenie naczyń krwionośnych |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | |
Niezbyt często | Kaszel |
Zaburzenia żołądka i jelit | |
Niezbyt często | Ból brzucha |
Zaburzenia wątroby i dróg żółciowych | |
Nieznana | Zwiększenie aktywności enzymów wątrobowych, zwiększenie stężenia bilirubiny w surowicy |
Zaburzenia skóry i tkanki podskórnej | |
Nieznana | Obrzęk naczynioruchowy, pęcherzowe zapalenie skóry, wysypka, świąd |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | |
Nieznana | Ból mięśni |
Zaburzenia nerek i dróg moczowych | |
Nieznana | Niewydolność i zaburzenia czynności nerek, zwiększenie stężenia kreatyniny w surowicy |
Zaburzenia ogólne i stany w miejscu podania | |
Niezbyt często | Uczucie zmęczenia |
Dzieci i młodzież
Nadciśnienie tętnicze
Działanie przeciwnadciśnieniowe walsartanu oceniano w dwóch randomizowanych, podwójnie zaślepionych badaniach klinicznych z udziałem 561 pacjentów pediatrycznych w wieku od 6 do 18 lat. Za wyjątkiem pojedynczych zaburzeń żołądka i jelit (takich jak ból brzucha, nudności, wymioty) oraz zawrotów głowy, nie stwierdzono istotnych różnic w odniesieniu do rodzaju, częstości i nasilenia działań niepożądanych pomiędzy profilem bezpieczeństwa w populacji pacjentów pediatrycznych
w wieku od 6 do 18 lat, a wcześniej zgłaszanym profilem bezpieczeństwa u pacjentów dorosłych.
Ocena funkcji neuropoznawczych oraz rozwoju pacjentów pediatrycznych w wieku od 6 do 16 lat wykazała, że trwające do jednego roku leczenie walsartanem nie miało całościowego, istotnego klinicznie, niekorzystnego wpływu na te funkcje.
W podwójnie zaślepionym, randomizowanym badaniu z udziałem 90 dzieci w wieku 1-6 lat, kontynuowanym jako 12-miesięczne przedłużone badanie otwarte odnotowano dwa zgony
i pojedyncze przypadki znacznego zwiększenia aktywności transaminaz wątrobowych. Zdarzenia te wystąpiły w populacji pacjentów z istotnymi współistniejącymi chorobami. Związek przyczynowy z leczeniem walsartanem nie został ustalony. W drugim badaniu, do którego włączono 75 dzieci
w wieku 1-6 lat nie odnotowano przypadków znacznego zwiększenia aktywności transaminaz wątrobowych ani zgonów związanych z leczeniem walsartanem.
U dzieci i młodzieży w wieku od 6 do 18 lat ze współistniejącą przewlekłą chorobą nerek częściej obserwowano hiperkaliemię.
Profil bezpieczeństwa obserwowany w kontrolowanych badaniach klinicznych u dorosłych pacjentów po zawale mięśnia sercowego i (lub) z niewydolnością serca różni się od ogólnego profilu bezpieczeństwa stwierdzanego u pacjentów z nadciśnieniem tętniczym. Może być to związane
z chorobą podstawową pacjenta. Działania niepożądane, które wystąpiły u dorosłych pacjentów po zawale mięśnia sercowego i (lub) z niewydolnością serca są wymienione poniżej:
Stan po zawale mięśnia sercowego i (lub) niewydolność serca (badane wyłącznie u dorosłych pacjentów)
Zaburzenia krwi i układu chłonnego | |
Nieznana | Małopłytkowość |
Zaburzenia układu immunologicznego | |
Nieznana | Nadwrażliwość, w tym choroba posurowicza |
Zaburzenia metabolizmu i odżywiania | |
Niezbyt często | Hiperkaliemia |
Nieznana | Zwiększenie stężenia potasu w surowicy, hiponatremia |
Zaburzenia układu nerwowego | |
Często | Zawroty głowy pochodzenia ośrodkowego, zawroty głowy związane z pozycją ciała |
Niezbyt często | Omdlenie, bóle głowy |
Zaburzenia ucha i błędnika | |
Niezbyt często | Zawroty głowy pochodzenia błędnikowego |
Zaburzenia serca | |
Niezbyt często | Niewydolność serca |
Zaburzenia naczyniowe | |
Często | Niedociśnienie tętnicze, niedociśnienie ortostatyczne |
Nieznana | Zapalenie naczyń krwionośnych |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | |
Niezbyt często | Kaszel |
Zaburzenia żołądka i jelit | |
Niezbyt często | Nudności, biegunka |
Zaburzenia wątroby i dróg żółciowych | |
Nieznana | Zwiększenie aktywności enzymów wątrobowych |
Zaburzenia skóry i tkanki podskórnej | |
Niezbyt często | Obrzęk naczynioruchowy |
Nieznana | Pęcherzowe zapalenie skóry, wysypka, świąd |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | |
Nieznana | Ból mięśni |
Zaburzenia nerek i dróg moczowych | |
Często | Niewydolność i zaburzenia czynności nerek |
Niezbyt często | Ostra niewydolność nerek, zwiększenie stężenia kreatyniny w surowicy |
Nieznana | Zwiększenie stężenia azotu mocznikowego we krwi |
Zaburzenia ogólne i stany w miejscu podania | |
Niezbyt często | Osłabienie, uczucie zmęczenia |
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa,
tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy
Przedawkowanie walsartanu może spowodować znaczne niedociśnienie tętnicze, co może doprowadzić do zaburzeń świadomości, zapaści krążeniowej i (lub) wstrząsu.
Leczenie
Postępowanie po przedawkowaniu zależy od czasu przyjęcia produktu leczniczego oraz rodzaju i nasilenia objawów, najważniejsze jest ustabilizowanie krążenia. W przypadku wystąpienia
niedociśnienia tętniczego pacjenta należy położyć na plecach i skorygować objętość krwi krążącej. Zastosowanie hemodializy w celu usunięcia walsartanu z krążenia jest mało skuteczne.
Grupa farmakoterapeutyczna: Antagoniści receptorów angiotensyny II, preparaty proste;
kod ATC: C09CA03
Walsartan jest czynnym po podaniu doustnym, silnym i specyficznym antagonistą receptora angiotensyny II (Ang II). Działa wybiórczo na podtyp receptora AT1, który jest odpowiedzialny za znane działania angiotensyny II. Zwiększone stężenie angiotensyny II w osoczu po zablokowaniu receptora AT1 przez walsartan może stymulować odblokowany receptor AT2, który wydaje się działać antagonistycznie w stosunku do działania receptora AT1. Walsartan nie wykazuje nawet częściowej aktywności agonistycznej w stosunku do receptora AT1 i ma dużo większe (około 20 000 razy) powinowactwo do receptora AT1 niż do receptora AT2. Nie stwierdzono, aby walsartan wiązał się lub blokował inne receptory hormonów lub kanały jonowe, o których wiadomo, że są istotne
w regulacji sercowo-naczyniowej.
Walsartan nie hamuje aktywności konwertazy angiotensyny (ACE, znanej również jako kininaza II), która przekształca Ang I w Ang II i powoduje rozpad bradykininy. Z uwagi na brak wpływu na ACE i brak nasilania działania bradykininy lub substancji P, prawdopodobieństwo wystąpienia kaszlu
w przypadku stosowania antagonistów receptora angiotensyny II jest niewielkie. W badaniach klinicznych, w których walsartan był porównywany z inhibitorem ACE, częstość występowania suchego kaszlu była znamiennie mniejsza (P<0,05) u pacjentów leczonych walsartanem niż
u pacjentów, którzy otrzymywali inhibitor ACE (odpowiednio 2,6% i 7,9%). W badaniu klinicznym pacjentów z suchym kaszlem w trakcie leczenia inhibitorami ACE w wywiadzie, u 19,5% osób otrzymujących walsartan i 19,0% przyjmujących tiazydowe leki moczopędne wystąpił kaszel
w porównaniu z 68,5% pacjentów leczonych inhibitorami ACE (P<0,05).
Nadciśnienie tętnicze
Podawanie walsartanu pacjentom z nadciśnieniem tętniczym powoduje zmniejszenie ciśnienia tętniczego bez wpływu na częstość tętna. U większości pacjentów po podaniu pojedynczej dawki doustnej, początek działania przeciwnadciśnieniowego występuje w ciągu 2 godzin, a maksymalne obniżenie ciśnienia tętniczego jest osiągane w ciągu 4 do 6 godzin. Działanie przeciwnadciśnieniowe utrzymuje się przez 24 godziny od przyjęcia dawki. Podczas wielokrotnego podawania działanie przeciwnadciśnieniowe jest wyraźnie zauważalne w ciągu 2 tygodni, a maksymalne staje się w ciągu 4 tygodni i utrzymuje się w czasie długotrwałego leczenia. Leczenie skojarzone z hydrochlorotiazydem znacząco zwiększa działanie przeciwnadciśnieniowe produktu leczniczego.
Nagłe przerwanie leczenia walsartanem nie było związane z występowaniem tzw. nadciśnienia z odbicia ani zdarzeniami niepożądanymi o znaczeniu klinicznym. U pacjentów z nadciśnieniem
tętniczym i cukrzycą typu 2 oraz mikroalbuminurią wykazano, że walsartan zmniejsza wydalanie albumin w moczu. W badaniu MARVAL (ang. Micro Albuminuria Reduction with Valsartan) oceniono zmniejszanie wydalania albumin w moczu (UAE) podczas leczenia walsartanem (80-160 mg/dobę) w porównaniu z amlodypiną (5-10 mg/dobę) u 332 pacjentów z cukrzycą typu 2 (średnia wieku: 58 lat; 265 mężczyzn) z mikroalbuminurią (walsartan: 58 μg/min; amlodypina: 55,4 μg/min), prawidłowym lub wysokim ciśnieniem tętniczym oraz z zachowaną czynnością nerek (stężenie kreatyniny we krwi <120 μmol/l). Po 24 tygodniach UAE zmniejszyło się (p<0,001) o 42% (–
24,2 μg/min; 95% przedział ufności: –40,4 do –19,1) u pacjentów leczonych walsartanem i o około 3% (–1,7 μg/min; 95% przedział ufności: –5,6 do 14,9) u pacjentów leczonych amlodypiną, pomimo podobnych wskaźników zmniejszenia ciśnienia tętniczego w obu grupach. W badaniu DROP (ang. Diovan Reduction of Proteinuria) dokonano dalszej oceny skuteczności walsartanu w zakresie
zmniejszania UAE u 391 pacjentów z nadciśnieniem tętniczym (ciśnienie tętnicze =150/88 mmHg)
z cukrzycą typu 2, albuminurią (średnia = 102 μg/min; 20-700 μg/min) i zachowaną czynnością nerek (średnie stężenie kreatyniny w surowicy = 80 μmol/l). Przeprowadzono randomizację pacjentów do jednej z grup przyjmujących walsartan w 3 dawkach (160, 320 i 640 mg/dobę). Leczenie prowadzono przez 30 tygodni. Celem badania było ustalenie optymalnej dawki walsartanu w zakresie zmniejszania UAE u pacjentów z nadciśnieniem tętniczym i cukrzycą typu 2. Po 30 tygodniach nastąpiło znamienne zmniejszenie procentowe UAE o 36% w stosunku do wartości wyjściowych w grupie leczonej walsartanem w dawce 160 mg (95% przedział ufności: 22% do 47%) i o 44% w grupie leczonej walsartanem w dawce 320 mg (95% przedział ufności: 31% do 54%). Stwierdzono, że dawka 160- 320 mg walsartanu powodowała klinicznie istotne zmniejszenie UAE u pacjentów z nadciśnieniem tętniczym i cukrzycą typu 2.
Stan po świeżo przebytym zawale mięśnia sercowego
Badanie VALIANT (ang. VALsartan In Acute myocardial iNfarcTion) było randomizowanym, kontrolowanym, międzynarodowym badaniem z zastosowaniem podwójnie ślepej próby, przeprowadzonym z udziałem 14 703 pacjentów z ostrym zawałem mięśnia sercowego oraz
z objawami przedmiotowymi, podmiotowymi lub potwierdzeniem radiologicznym zastoinowej niewydolności serca i (lub) lewokomorowej niewydolności skurczowej (objawiającej się frakcją wyrzutową serca ≤40% w wentrykulografii radioizotopowej lub ≤35% w echokardiografii lub angiografii kontrastowej). Pacjenci w czasie od 12 godzin do 10 dni po wystąpieniu objawów zawału mięśnia sercowego byli losowo przypisywani do jednej z trzech grup terapeutycznych: walsartanu, kaptoprylu lub walsartanu w skojarzeniu z kaptoprylem. Średni czas leczenia wynosił dwa lata.
Pierwszorzędowym punktem końcowym był czas do zgonu z jakiejkolwiek przyczyny. Walsartan był równie skuteczny jak kaptopryl w zmniejszaniu śmiertelności z jakiejkolwiek przyczyny po zawale mięśnia sercowego. Procent zgonów z jakiejkolwiek przyczyny był podobny we wszystkich grupach (walsartan: 19,9%, kaptopryl: 19,5% i walsartan + kaptopryl: 19,3%). Dodanie walsartanu do kaptoprylu nie przyniosło żadnych dodatkowych korzyści w porównaniu do podawania samego kaptoprylu. Nie stwierdzono żadnych różnic pomiędzy walsartanem a kaptoprylem w zakresie śmiertelności z jakiejkolwiek przyczyny w zależności od wieku, płci, rasy, leczenia podstawowego czy choroby podstawowej. Walsartan zwiększał również czas przeżycia i zmniejszał śmiertelność
z powodu zaburzeń układu sercowo-naczyniowego oraz skracał czas hospitalizacji z powodu niewydolności serca, powtórnego zawału mięśnia sercowego, resuscytacji krążeniowej i udaru niezakończonego zgonem (drugorzędowy złożony punkt końcowy). U pacjentów leczonych po przebytym zawale mięśnia sercowego profil bezpieczeństwa walsartanu odpowiadał przebiegowi klinicznemu. W zakresie czynności nerek zaobserwowano podwojenie stężenia kreatyniny w surowicy u 4,2% pacjentów leczonych walsartanem, u 4,8% pacjentów otrzymujących leczenie skojarzone walsartanem i kaptoprylem oraz u 3,4% pacjentów leczonych kaptoprylem. Leczenie przerwano
z powodu różnego typu zaburzeń czynności nerek u 1,1% pacjentów leczonych walsartanem, u 1,3% pacjentów leczonych walsartanem i kaptoprylem oraz u 0,8% pacjentów leczonych kaptoprylem.
W ramach oceny pacjentów po przebytym zawale mięśnia sercowego należy przeprowadzić ocenę czynności nerek. Nie stwierdzono różnic w całkowitej śmiertelności, śmiertelności z powodu zaburzeń układu sercowonaczyniowego oraz chorobowości, podczas jednoczesnego podawania leków blokujących receptory β-adrenergiczne z walsartanem i kaptoprylem, podawania wyłącznie walsartanu lub wyłącznie kaptoprylu. Niezależnie od zastosowanego leku, śmiertelność była mniejsza w grupie pacjentów leczonych lekami blokującymi receptory β-adrenergiczne, co potwierdza znane korzyści ze stosowania leków blokujących receptory β-adrenergiczne w tej populacji pacjentów.
Niewydolność serca
Badanie Val-HeFT było randomizowanym, kontrolowanym, międzynarodowym badaniem klinicznym porównującym walsartan do placebo pod względem chorobowości i śmiertelności u 5010 pacjentów
z niewydolnością serca (62% klasa II, 36% klasa III i 2% klasa IV wg NYHA), otrzymujących standardowe leczenie, z frakcją wyrzutową lewej komory LVEF <40% i średnicą wewnętrzną lewej komory w czasie rozkurczu LVIDD >2,9 cm/m2. Podstawowa terapia składała się z inhibitorów ACE (93%), leków moczopędnych (86%), digoksyny (67%) i leków blokujących receptory β-adrenergiczne (36%). Średni okres obserwacji wyniósł prawie dwa lata. Średnia dawka dobowa walsartanu
w badaniu Val-HeFT wynosiła 254 mg. W badaniu oceniono dwa pierwszorzędowe punkty końcowe: śmiertelność z jakiejkolwiek przyczyny (czas przeżycia) oraz punkt końcowy złożony - śmiertelność i chorobowość w związku z niewydolnością serca (czas do pierwszego incydentu chorobowego), zdefiniowany jako zgon, nagły zgon z resuscytacją, hospitalizacja z powodu niewydolności serca lub podawanie dożylne leków inotropowych lub rozszerzających naczynia przez co najmniej 4 godziny bez hospitalizacji. Śmiertelność z jakiejkolwiek przyczyny była podobna (p=NS) w grupie leczonej walsartanem (19,7%) i otrzymującej placebo (19,4%). Podstawową korzyścią było zmniejszenie
o 27,5% (95% przedział ufności: 17% do 37%) ryzyka dotyczącego czasu do pierwszej hospitalizacji w związku z niewydolnością serca (odpowiednio 13,9% i 18,5%). Wyniki wskazujące wyższość placebo (złożony punkt końcowy śmiertelności i chorobowości wynosił 21,9% w grupie otrzymującej placebo i 25,4% w grupie leczonej walsartanem) obserwowano u tych pacjentów, u których zastosowano leczenie skojarzone trzema lekami: inhibitorem ACE, lekiem blokującym receptory β- adrenergiczne i walsartanem. Korzyści w zakresie chorobowości były największe w podgrupie pacjentów nieotrzymujących inhibitora ACE (n=366). W tej podgrupie pacjentów śmiertelność
z jakiejkolwiek przyczyny była znacząco mniejsza, o 33%, podczas leczenia walsartanem
w porównaniu z placebo (95% przedział ufności: –6% do 58%) (odpowiednio 17,3% dla walsartanu i 27,1% dla placebo), a złożone ryzyko śmiertelności i chorobowości było mniejsze o 44% (odpowiednio 24,9% dla walsartanu i 42,5% dla placebo). Wśród pacjentów otrzymujących inhibitor ACE bez leku blokującego receptory β-adrenergiczne śmiertelność z jakiejkolwiek przyczyny była podobna (p=NS) w grupie leczonej walsartanem (21,8%) i grupie otrzymującej placebo (22,5%).
Złożone ryzyko śmiertelności i chorobowości było znacząco mniejsze, o 18,3% (95% przedział ufności: 8% do 28%), dla walsartanu w porównaniu z placebo (odpowiednio 31,0% i 36,3%). W całej populacji, która wzięła udział w badaniu Val-HeFT, u pacjentów leczonych walsartanem stwierdzono znaczącą poprawę wg kryteriów NYHA, a także objawów przedmiotowych i podmiotowych niewydolności serca, takich jak duszność, zmęczenie, obrzęki i szmery oddechowe, w porównaniu do pacjentów przyjmujących placebo. Jakość życia pacjentów leczonych walsartanem była lepsza, jak wykazała w punkcie końcowym zmiana w punktacji wg Minnesota Living with Heart Failure Quality of Life w stosunku do stanu początkowego, w porównaniu z placebo. Frakcja wyrzutowa w punkcie końcowym u pacjentów leczonych walsartanem znacząco zwiększyła się, a średnica wewnętrzna lewej komory w czasie rozkurczu (LVIDD) znacząco zmalała w stosunku do stanu początkowego
w porównaniu z placebo.
W dwóch dużych, randomizowanych, kontrolowanych badaniach (ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) i VA NEPHRON-D (The Veterans Affairs Nephropathy in Diabetes)) oceniano jednoczesne stosowanie inhibitora ACE
z antagonistą receptora angiotensyny II.
ONTARGET było badaniem przeprowadzonym z udziałem pacjentów z chorobami sercowo- naczyniowymi lub naczyniowo-mózgowymi w wywiedzie lub z cukrzycą typu 2, z potwierdzonym uszkodzeniem narządów docelowych. VA NEPHRON-D było badaniem z udziałem pacjentów
z cukrzycą typu 2 i nefropatią cukrzycową.
Badania te nie wykazały znaczącego korzystnego wpływu na parametry nerkowe i (lub) chorobowość oraz śmiertelność z przyczyn sercowo-naczyniowych, natomiast zaobserwowano zwiększone ryzyko hiperkaliemii, ostrego uszkodzenia nerek i (lub) niedociśnienia tętniczego w porównaniu do monoterapii. Biorąc pod uwagę ich podobne właściwości farmakodynamiczne, wyniki te odnoszą się również do innych inhibitorów ACE i antagonistów receptora angiotensyny II. Dlatego u pacjentów
z nefropatią cukrzycową nie należy jednocześnie stosować inhibitorów ACE i antagonistów receptora angiotensyny II.
ALTITUDE (Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints) było badaniem zaprojektowanym w celu zbadania korzyści z dodania aliskirenu do standardowego leczenia inhibitorem ACE lub antagonistą receptora angiotensyny II u pacjentów z cukrzycą typu 2
i przewlekłą chorobą nerek, chorobą sercowo-naczyniową lub obiema. Badanie zostało przedwcześnie przerwane z powodu zwiększonego ryzyka działań niepożądanych. Zgony z przyczyn sercowo- naczyniowych i udary mózgu występowały częściej w grupie otrzymującej aliskiren, w porównaniu do grupy otrzymującej placebo. W grupie otrzymującej aliskiren odnotowano również częstsze
występowanie zdarzeń niepożądanych, w tym ciężkich zdarzeń niepożądanych (hiperkaliemia, niedociśnienie tętnicze i zaburzenia czynności nerek), w porównaniu do grupy placebo.
Dzieci i młodzież
Nadciśnienie tętnicze
Działanie przeciwnadciśnieniowe walsartanu oceniano w czterech randomizowanych, podwójnie zaślepionych badaniach klinicznych z udziałem 561 pacjentów pediatrycznych w wieku od 6 do 18 lat oraz 165 w wieku od 1 do 6 lat. Do najczęstszych chorób współistniejących o potencjalnym wpływie na występowanie nadciśnienia tętniczego u uczestników badania należały zaburzenia nerek i układu moczowego oraz otyłość.
Doświadczenie kliniczne u dzieci w wieku od 6 lat
W badaniu klinicznym z udziałem 261 pacjentów pediatrycznych w wieku od 6 do 16 lat z nadciśnieniem tętniczym, pacjenci o masie ciała <35 kg otrzymywali tabletki walsartanu w dawce 10, 40 lub 80 mg na dobę (dawki małe, średnie i duże), a pacjenci o masie ciała ≥ 35 kg otrzymywali tabletki walsartanu w dawce 20, 80 lub 160 mg na dobę (dawki małe, średnie i duże). Pod koniec 2- tygodniowego okresu leczenia walsartan spowodował zmniejszenie zarówno skurczowego, jak
i rozkurczowego ciśnienia tętniczego w sposób zależny od dawki. Podsumowując, trzy wielkości dawek walsartanu (małe, średnie i duże) spowodowały istotne zmniejszenie skurczowego ciśnienia tętniczego względem wartości wyjściowych, odpowiednio o 8, 10 i 12 mmHg. Pacjentów ponownie zrandomizowano do grupy kontynuującej leczenie tą samą dawką walsartanu lub do grupy placebo. U pacjentów kontynuujących leczenie średnimi lub dużymi dawkami walsartanu, najniższe wartości skurczowego ciśnienia tętniczego były o -4 i -7 mmHg mniejsze od wartości uzyskanych
w grupie placebo. U pacjentów leczonych małymi dawkami walsartanu najniższe skurczowe ciśnienie tętnicze było podobne do obserwowanego w grupie placebo. Podsumowując, walsartan konsekwentnie wywierał zależne od dawki działanie przeciwnadciśnieniowe we wszystkich podgrupach zróżnicowanych demograficznie.
W innym badaniu klinicznym z udziałem 300 pacjentów pediatrycznych w wieku od 6 do 18 lat z nadciśnieniem tętniczym, osoby spełniające kryteria włączenia zrandomizowano do grupy otrzymującej tabletki walsartanu lub enalaprylu przez 12 tygodni. Dzieci o masie ciała pomiędzy
≥18 kg a <35 kg otrzymywały 80 mg walsartanu lub 10 mg enalaprylu; dzieci o masie ciała od ≥35 kg do <80 kg otrzymywały 160 mg walsartanu lub 20 mg enalaprylu, a dzieciom o masie ciała ≥80 kg podawano 320 mg walsartanu lub 40 mg enalaprylu. U pacjentów leczonych walsartanem zmniejszenie skurczowego ciśnienia tętniczego było porównywalne do efektu uzyskanego u pacjentów leczonych enalaprylem (odpowiednio 15 mmHg i 14 mmHg) (wartość p <0,0001 w badaniu równoważności). Podobne wyniki uzyskano dla rozkurczowego ciśnienia tętniczego, ze zmniejszeniem o 9,1 mmHg w grupie walsartanu i 8,5 mmHg w grupie enalaprylu.
Doświadczenie kliniczne u dzieci w wieku poniżej 6 lat
Pacjenci w wieku od 1 do 6 lat uczestniczyli w dwóch badaniach klinicznych (odpowiednio po 90 i 75 pacjentów). Do badań tych nie włączono dzieci w wieku poniżej 1 roku. W pierwszym badaniu skuteczność walsartanu porównywano z placebo, jednak nie udało się wykazać zależności reakcji na leczenie od dawki. W drugim badaniu, podawanie większych dawek walsartanu było związane
z większym obniżeniem ciśnienia tętniczego, jednak zależność reakcji na leczenie od dawki nie osiągnęła znamienności statystycznej, a różnica pomiędzy grupą, w której podawano substancję czynną, a grupą przyjmującą placebo nie była istotna (patrz punkt 4.8).
Europejska Agencja Leków uchyliła obowiązek przedstawienia wyników badań walsartanu we wszystkich podgrupach pacjentów pediatrycznych z niewydolnością serca oraz z niewydolnością serca po świeżo przebytym zawale mięśnia sercowego. Patrz punkt 4.2, informacja dotycząca stosowania leku u dzieci i młodzieży.
Wchłanianie
Po podaniu doustnym samego walsartanu maksymalne stężenie walsartanu w osoczu występuje po 2-4 godzinach w przypadku tabletek oraz po 1-2 godzinach w przypadku roztworu. Średnia bezwzględna biodostępność leku wynosi 23% i 39% odpowiednio po podaniu tabletek i roztworu. W przypadku podania walsartanu z pokarmem pole pod krzywą (AUC) dla walsartanu jest zmniejszone o około 40%, a maksymalne stężenie w osoczu (Cmax) o około 50%, chociaż od około 8. godziny po podaniu dawki stężenia walsartanu w osoczu są podobne w grupie przyjmującej lek z posiłkiem i w grupie przyjmującej lek na czczo. Wraz ze zmniejszeniem AUC nie następuje jednak klinicznie znamienne osłabienie działania terapeutycznego, dlatego walsartan można podawać niezależnie od posiłków.
Dystrybucja
Objętość dystrybucji walsartanu w stanie stacjonarnym po podaniu dożylnym wynosi około 17 litrów, co wskazuje na brak rozległej dystrybucji walsartanu w tkankach. Walsartan w dużym stopniu wiąże się z białkami osocza (94–97%), głównie z albuminami.
Metabolizm
Walsartan nie ulega biotransformacji w większym stopniu, ponieważ jedynie około 20% dawki jest wykrywane w postaci metabolitów. Hydroksymetabolit został wykryty w osoczu w małych stężeniach (poniżej 10% AUC dla walsartanu). Metabolit ten jest farmakologicznie
nieczynny.
Eliminacja
Walsartan wykazuje wielowykładniczą kinetykę procesu eliminacji (t½α <1 h i t½ß około 9 h). Walsartan jest wydalany przede wszystkim z żółcią w kale (około 83% dawki) i przez nerki w moczu (około 13% dawki), głównie w postaci niezmienionej. Po podaniu dożylnym klirens walsartanu
z osocza wynosi około 2 l/h, a klirens nerkowy około 0,62 l/h (około 30% całkowitego klirensu). Okres półtrwania walsartanu wynosi 6 godzin.
Pacjenci z niewydolnością serca:
Przeciętny czas do osiągnięcia maksymalnego stężenia oraz okres półtrwania w fazie eliminacji walsartanu u pacjentów z niewydolnością serca i zdrowych ochotników są podobne. Wartości AUC i Cmax walsartanu są niemalże proporcjonalne do zwiększanej dawki w klinicznym zakresie
dawkowania (40 mg do 160 mg walsartanu dwa razy na dobę). Średni współczynnik kumulacji wynosi ok. 1,7. Klirens walsartanu po podaniu doustnym wynosi ok. 4,5 l/h. Wiek nie wpływa na obserwowany klirens u pacjentów z niewydolnością serca.
Specjalne grupy pacjentów
Pacjenci w podeszłym wieku
U niektórych pacjentów w podeszłym wieku obserwowano nieco zwiększone narażenie ogólnoustrojowe na walsartan w porównaniu z osobami młodymi, jednakże nie wykazano, aby miało to jakiekolwiek znaczenie kliniczne.
Zaburzenia czynności nerek
Zgodnie z oczekiwaniami w stosunku do substancji, której klirens nerkowy wynosi tylko 30% całkowitego klirensu osoczowego, nie zaobserwowano korelacji między czynnością nerek
i ogólnoustrojowym narażeniem na walsartan. Nie ma zatem konieczności modyfikacji dawkowania leku u pacjentów z zaburzeniami czynności nerek (klirens kreatyniny >10 ml/min). Obecnie brak doświadczeń dotyczących bezpiecznego stosowania leku u pacjentów z klirensem kreatyniny
<10 ml/min i pacjentów dializowanych, dlatego walsartan należy stosować ostrożnie w tych grupach pacjentów (patrz punkty 4.2 i 4.4).
Walsartan w dużym stopniu wiąże się z białkami osocza, dlatego zastosowanie dializy w celu usunięcia walsartanu z krążenia jest mało skuteczne.
Zaburzenia czynności wątroby
Około 70% wchłanianej dawki jest wydalane z żółcią, zasadniczo w niezmienionej postaci. Walsartan nie ulega biotransformacji w istotnym stopniu. U pacjentów z niewydolnością wątroby w stopniu łagodnym do umiarkowanego zaobserwowano podwojenie narażenia (AUC) w porównaniu ze zdrowymi osobami. Jednakże nie zaobserwowano korelacji między stężeniem walsartanu w osoczu,
a stopniem zaburzenia czynności wątroby. Nie przeprowadzono badań walsartanu u pacjentów z ciężkimi zaburzeniami czynności wątroby (patrz punkty 4.2, 4.3 i 4.4).
Dzieci i młodzież
W badaniu z udziałem 26 pacjentów pediatrycznych (w wieku od 1 do 16 lat) z nadciśnieniem tętniczym, otrzymujących pojedynczą dawkę zawiesiny walsartanu (średnio 0,9 do 2 mg/kg mc., maksymalna dawka 80 mg), klirens (l/h/kg) walsartanu był porównywalny w całym zakresie wieku od 1 do 16 lat i był podobny do klirensu obserwowanego u dorosłych pacjentów otrzymujących produkt leczniczy w tej samej postaci.
Zaburzenia czynności nerek
Nie badano stosowania produktu leczniczego u dzieci i młodzieży z klirensem kreatyniny <30 ml/min oraz poddawanych dializoterapii, dlatego w tej grupie pacjentów nie zaleca się stosowania walsartanu. Nie ma konieczności dostosowania dawki u dzieci i młodzieży z klirensem kreatyniny >30 ml/min.
Należy ściśle kontrolować czynność nerek oraz stężenie potasu w surowicy podczas leczenia walsartanem (patrz punkty 4.2 i 4.4).
Dane niekliniczne, uzyskane na podstawie konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, toksyczności po podaniu wielokrotnym, genotoksyczności i potencjalnego działania rakotwórczego, nie ujawniają występowania szczególnego zagrożenia dla człowieka.
U szczurów toksyczne dawki u matki (600 mg/kg mc./dobę) w trakcie ostatnich dni ciąży i laktacji prowadziły do mniejszego wskaźnika przeżywalności, mniejszego przyrostu masy ciała i opóźnienia rozwoju (oddzielnie małżowiny usznej i otwór w kanale słuchowym) u potomstwa (patrz punkt 4.6). Dawki stosowane u szczurów (600 mg/kg mc./dobę) są około 18-krotnie większe od maksymalnej zalecanej dawki u ludzi wyrażonej w mg/m2 pc. (w obliczeniach przyjęto doustną dawkę 320 mg/dobę i pacjenta o masie ciała 60 kg). W przedklinicznych badaniach bezpieczeństwa duże dawki walsartanu (od 200 do 600 mg/kg mc.) powodowały u szczurów zmniejszenie parametrów krwinek czerwonych (erytrocyty, hemoglobina, hematokryt) i zmiany w hemodynamice nerek (nieznaczne zwiększenie stężenia mocznika w osoczu, rozrost kanalików nerkowych i bazofilię u samców). Dawki stosowane
u szczurów (200 do 600 mg/kg mc./dobę) są około 6-krotnie i 18-krotnie większe od maksymalnej zalecanej dawki u ludzi wyrażonej w mg/m2 pc. (w obliczeniach przyjęto doustną dawkę 320 mg/dobę i pacjenta o masie ciała 60 kg).U małp szerokonosych po zastosowaniu podobnych dawek zmiany były zbliżone, choć cięższe, szczególnie ze strony nerek, gdzie zmiany rozwinęły się w nefropatię, obejmującą również zwiększone stężenie mocznika i kreatyniny. W przypadku obu gatunków zaobserwowano również przerost komórek aparatu przykłębuszkowego. Stwierdzono, że wszystkie zmiany zostały spowodowane farmakologicznym działaniem walsartanu, który powoduje długo utrzymujące się niedociśnienie tętnicze, szczególnie u małp szerokonosych. W przypadku stosowania walsartanu u ludzi w dawkach terapeutycznych wydaje się, że przerost komórek aparatu przykłębuszkowego raczej nie występuje.
Dzieci i młodzież
Codzienne doustne podawanie walsartanu w dawce 1 mg/kg mc./dobę (stanowiącej około 10 - 35% maksymalnej zalecanej dawki u pacjentów pediatrycznych wynoszącej 4 mg/kg mc./dobę, obliczonej na podstawie narażenia ogólnoustrojowego) nowonarodzonym lub młodym szczurom (od 7 do 70 dnia po urodzeniu) spowodowało trwałe, nieodwracalne uszkodzenie nerek. Wyżej wymienione działania stanowią przewidywane nasilenie działań farmakologicznych inhibitorów konwertazy angiotensyny oraz antagonistów receptora 1 angiotensyny II; działania te obserwuje się w wyniku leczenia szczurów w pierwszych 13 dniach życia. Okres ten pokrywa się z 36 tygodniem ciąży u ludzi, a niekiedy może
wydłużyć się do 44 tygodni od poczęcia. W badaniu z walsartanem na młodych osobnikach szczury otrzymywały dawki maksymalnie do 70 dnia po urodzeniu i nie można wykluczyć wpływu leczenia walsartanem na dojrzewanie nerek (4-6 tygodni po urodzeniu). Czynnościowe dojrzewanie nerek jest procesem zachodzącym w pierwszym roku życia człowieka. Dlatego nie można wykluczyć, że dane te mają znaczenie kliniczne dla dzieci w wieku <1 roku, podczas gdy dane przedkliniczne nie budzą zastrzeżeń, co do bezpieczeństwa stosowania leku u dzieci starszych niż 1 rok.
Celuloza mikrokrystaliczna Wapnia wodorofosforan bezwodny Krospowidon
Krzemionka koloidalna bezwodna Magnezu stearynian
Nie dotyczy.
3 lata
Przechowywać w temperaturze poniżej 30°C, w oryginalnym opakowaniu.
Wielkość opakowania: 28 szt. tabletek.
Opakowanie bezpośrednie stanowi pojemnik z HDPE o pojemności 30 ml z zakrętką z PP zawierającą środek suszący, z pierścieniem gwarancyjnym i zamknięciem zabezpieczającym przed dostępem dzieci, w tekturowym pudełku.
Valzek 160 mg
Wielkość opakowania: 28 szt. tabletek.
Opakowanie bezpośrednie stanowi pojemnik z HDPE o pojemności 30 ml z zakrętką z PP zawierającą środek suszący, z pierścieniem gwarancyjnym i zamknięciem zabezpieczającym przed dostępem dzieci, w tekturowym pudełku.
W celu ochrony produktu leczniczego przed dostępem osób niepowołanych i dzieci zakrętka opakowania zaopatrzona jest w plombę gwarancyjną i mechanizm blokady odkręcania.
Należy postępować zgodnie z poniższymi rysunkami w celu prawidłowego otwarcia opakowania:
WCISNĄĆ MOCNO ZAKRĘTKĘ | WCIŚNIĘTĄ ZAKRĘTKĘ PRZEKRĘCIĆ O PÓŁ OBROTU |
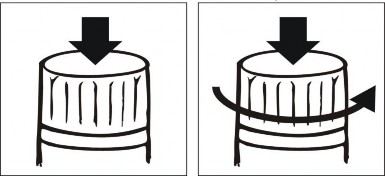
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie lokalnymi przepisami.
Celon Pharma S.A
ul. Ogrodowa 2A, Kiełpin 05-092 Łomianki
tel.: +48 22 751 59 33
Valzek 80 mg: 22209
Valzek 160 mg: 22210
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 8.12.2014 Data przedłużenia pozwolenia: 23.10.2020











