Spis treści:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
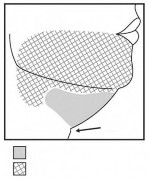
Nie wykonywać wstrzyknięć powyżej brzegu dolnego żuchwy.
Nie wykonywać wstrzyknięć w obrębie obszaru określonego przez linię 1-1,5 cm poniżej brzegu dolnego (od kąta żuchwy do bródki).
Wstrzyknięcia produktu leczniczego Belkyra wykonywać tylko w obrębie leczonego obszaru docelowego tkanki tłuszczowej podbródka (patrz Rysunek 1 i 3).
Przeciwwskazania
Nadwrażliwość na kwas deoksycholowy lub jakąkolwiek inną substancję pomocniczą wymienioną w punkcie 6.1
Obecność zakażenia w planowanym obszarze wykonania wstrzyknięć.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Bardzo często (≥1/10)
- Często (≥1/100 do <1/10)
Niezbyt często (≥1/1000 do <1/100)
- Rzadko (≥1/10 000 do <1/1000)
Bardzo rzadko (< 1/10 000)
Nieznana (nie może być określona na podstawie dostępnych danych).
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego
Belkyra, 10 mg/ml, roztwór do wstrzykiwań
1 ml roztworu do wstrzykiwań zawiera 10 mg kwasu deoksycholowego. Każda fiolka o objętości 2 ml zawiera 20 mg kwasu deoksycholowego.
Substancja pomocnicza o znanym działaniu:
Każdy ml zawiera 4,23 mg sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań (wstrzyknięcia).
Przezroczysty, bezbarwny, niezawierający cząstek stałych roztwór.
Produkt leczniczy ma pH wynoszące 8,3, dostosowane kwasem solnym lub sodu wodorotlenkiem oraz toniczność roztworu dostosowaną do tkanek i płynów biologicznych o osmolalności na poziomie
300 mOsm/kg.
– Produkt leczniczy Belkyra jest wskazany w leczeniu umiarkowanej lub ciężkiej wypukłości bądź pełnego podbródka, związanych z występowaniem tkanki tłuszczowej w podbródku
u pacjentów dorosłych, u których ma to istotny wpływ na stan psychiczny.
Dawkowanie
Całkowita wstrzykiwana objętość oraz liczba wykonanych zabiegów powinny być dostosowane
do rozkładu tkanki tłuszczowej w podbródku danego pacjenta oraz planowanych efektów leczenia.
Należy wstrzykiwać 0,2 ml (2 mg) produktu leczniczego na każde miejsce wstrzyknięcia, oddalone od siebie o 1 cm. Podczas jednego zabiegu nie należy przekraczać maksymalnej dawki 10 ml (100 mg kwasu deoksycholowego, co odpowiada 50 wstrzyknięciom).
Można przeprowadzić maksymalnie 6 zabiegów. U większości pacjentów poprawa następuje po 2–4
zabiegach.
Przerwa pomiędzy kolejnymi zabiegami powinna wynosić co najmniej 4 tygodnie.
W celu poprawy komfortu pacjenta podczas wykonywania wstrzyknięć pracownicy fachowego personelu medycznego mogą podjąć decyzję o zastosowaniu doustnych leków przeciwbólowych lub
niesteroidowych leków przeciwzapalnych (NLPZ), podaniu miejscowo lub we wstrzyknięciu środków znieczulających (np. lidokainy) do znieczulenia miejscowego i (lub) o chłodzeniu miejsc wstrzyknięcia za pomocą żelowych wkładów chłodzących.
Populacje specjalne
Zaburzenia czynności nerek
Dostosowywanie dawki nie jest uważane za konieczne (patrz punkt 5.2).
Zaburzenia czynności wątroby
Dostosowywanie dawki nie jest uważane za konieczne (patrz punkt 5.2).
Osoby w podeszłym wieku (w wieku 65 lat lub starsze)
Dostosowywanie dawki nie jest uważane za konieczne. Należy zachować szczególną ostrożność podczas stosowania produktu leczniczego u osób w podeszłym wieku (patrz punkt 4.4).
Dzieci i młodzież
Produktu leczniczego Belkyra nie stosuje się u dzieci i młodzieży.
Sposób podawania
Produkt leczniczy jest przeznaczony wyłącznie do podania podskórnego.
Produkt leczniczy Belkyra powinien być podawany wyłącznie przez odpowiednio wykwalifikowanych lekarzy, którzy mają odpowiednie doświadczenie w przeprowadzaniu zabiegu oraz wiedzę dotyczącą budowy anatomicznej podbródka. W krajach, w których pozwalają na to przepisy, produkt leczniczy Belkyra może być podawany przez odpowiednio wykwalifikowany fachowy personel medyczny pod nadzorem lekarza. Bezpieczeństwo oraz skuteczność stosowania produktu leczniczego Belkyra zależą od właściwego doboru pacjentów, co obejmuje znajomość wywiadu medycznego pacjenta w zakresie wcześniejszych interwencji medycznych oraz ich potencjalnego wpływu na zmianę anatomii powierzchni odcinka szyjnego. Należy zachować ostrożność podczas stosowania produktu leczniczego Belkyra u pacjentów z nadmierną wiotkością skóry, wystającym mięśniem szerokim szyi lub u których występują inne stany, w których redukcja tkanki tłuszczowej w okolicy podbródka może prowadzić do niepożądanego wyniku.
Produkt leczniczy Belkyra musi zostać zużyty podczas jednego zabiegu u danego pacjenta, a niewykorzystany produkt powinien zostać w odpowiedni sposób zutylizowany.
Produkt leczniczy Belkyra jest dostarczany w postaci gotowych do użycia fiolek jednorazowego użytku. Przed użyciem należy kilkakrotnie delikatnie obrócić fiolkę. Nie rozcieńczać.
W celu wykonania wstrzyknięcia produktu leczniczego Belkyra należy umieścić igłę prostopadle do
skóry.
Właściwe umieszczenie igły w stosunku do żuchwy jest bardzo ważne, ponieważ zmniejsza ryzyko urazu gałęzi brzeżnej żuchwy – gałęzi ruchowej nerwu twarzowego. Uszkodzenie nerwu prowadzi do występowania asymetrycznego uśmiechu ze względu na niedowład mięśnia obniżacza kąta ust.
Aby uniknąć uszkodzenia gałęzi brzeżnej żuchwy:
Rysunek 1. Unikać obszaru gałęzi brzeżnej żuchwy
Wcięcie
tarczowe
Leczony obszar
Nie wstrzykiwać
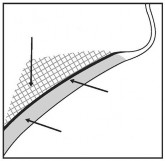
Unikać wstrzyknięć w mięsień szeroki szyi. Przed każdym zabiegiem należy palpacyjnie zbadać obszar podbródka w celu upewnienia się, że występuje tam odpowiednia ilość tkanki tłuszczowej oraz w celu zidentyfikowania podskórnej tkanki tłuszczowej znajdującej się pomiędzy skórą oraz mięśniem szerokim szyi w obrębie docelowego leczonego obszaru (Rysunek 2).
Rysunek 2. Przekrój strzałkowy obszaru mięśnia (m.) szerokiego szyi
Tkanka tłuszczowa pod m. szerokim szyi
m. szeroki szyi
Tkanka
tłuszczowa przed
m. szerokim szyi
Należy oznaczyć zaplanowany obszar leczenia flamastrem chirurgicznym oraz umieścić 1 cm2 siatki
w celu oznaczenia miejsc wstrzyknięcia (Rysunki 2 i 3).
Rysunek 3. Obszar leczenia oraz wzór wykonywania wstrzyknięć
Wcięcie
tarczowe
Leczony obszar
Miejsca wstrzyknięć
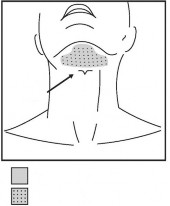
Nie należy wstrzykiwać produktu leczniczego Belkyra poza określone miejsca.
Przed użyciem roztworu do wstrzykiwań należy ocenić go wzrokowo. Do użycia nadaje się wyłącznie przezroczysty, bezbarwny oraz niezawierający cząstek stałych roztwór.
Należy podawać wyłącznie podskórnie. Wstrzyknięcia w pobliżu obszarów wrażliwych
Nie należy wykonywać wstrzyknięć w odległości 1 cm do 1,5 cm od wrażliwych struktur
anatomicznych.
Produktu leczniczego Belkyra nie należy wstrzykiwać do lub w bliskiej odległości od gałęzi brzeżnej żuchwy nerwu twarzowego, aby uniknąć możliwości wystąpienia neuropraksji i zaburzeń motorycznych mięśni, co przejawia się w postaci asymetrycznego uśmiechu lub osłabienia mięśni twarzy. W badaniach klinicznych wszystkie przypadki uszkodzenia nerwu były tymczasowe, a ich objawy ustąpiły.
Należy zachować ostrożność, aby zapobiec przypadkowemu podaniu śródskórnemu lub domięśniowemu. Produkt leczniczy Belkyra powinien być podawany w połowie podskórnej warstwy tkanki tłuszczowej pokrywającej mięsień szeroki szyi w obrębie podbródka. Nieprawidłowa technika wstrzykiwania, taka jak wstrzyknięcia śródskórne, domięśniowe lub donaczyniowe i wstrzyknięcia bez siatki do oznaczania skóry, mogą powodować owrzodzenia skóry i martwicę skóry, a także powstanie blizny (patrz punkt 4.8). Podczas wykonywania wstrzyknięcia nie należy wyciągać igły
z podskórnej tkanki tłuszczowej, ponieważ mogłoby to zwiększyć ryzyko ekspozycji śródskórnej i potencjalnego wystąpienia owrzodzenia i martwicy skóry. Nigdy nie należy ponownie podawać
produktu leczniczego Belkyra, jeśli wystąpiło owrzodzenie lub martwica w miejscu wstrzyknięcia. Zgłaszano przypadki zakażenia w miejscu wstrzyknięcia, z których niektóre obejmowały zapalenie tkanki łącznej i ropień, wymagające dodatkowego leczenia. Należy rozważyć wstrzymanie kolejnych zabiegów do czasu ustąpienia zakażenia w miejscu wstrzyknięcia.
Należy zachować ostrożność, aby uniknąć przypadkowego wstrzyknięcia bezpośrednio do tętnicy lub żyły, ponieważ może to spowodować uszkodzenie naczyń krwionośnych.
Należy unikać wstrzyknięcia w gruczoły ślinowe, tarczycę, węzły chłonne oraz mięśnie.
Bezpieczeństwo i skuteczność stosowania produktu leczniczego Belkyra poza obszarem podskórnej tkanki tłuszczowej lub w dawkach większych od zalecanych nie zostały określone. Produktu leczniczego Belkyra nie należy stosować u pacjentów otyłych (BMI ≥ 30) ani u pacjentów cierpiących na dysmorfofobię.
Wcześniejsze schorzenia/zabiegi lecznicze wykonywane w pobliżu obszaru leczenia
Przed zastosowaniem produktu leczniczego Belkyra pacjenci powinni zostać zbadani pod kątem innych potencjalnych przyczyn występowania wypukłości bądź pełnego podbródka (np. powiększenie tarczycy i węzłów chłonnych szyi).
Należy zachować ostrożność w przypadku zastosowania produktu leczniczego Belkyra u pacjentów, u których w proponowanym miejscu wykonywania wstrzyknięć występuje stan zapalny lub stwardnienie oraz u pacjentów z objawami dysfagii.
Należy również zachować ostrożność w przypadku zastosowania produktu leczniczego Belkyra
u pacjentów, u których w obszarze podbródka wykonywano wcześniej zabieg chirurgiczny lub zabieg medycyny estetycznej. Zmiany w anatomii lub ślady obecności tkanki bliznowatej mogą wpływać na możliwość bezpiecznego podania produktu leczniczego Belkyra lub uzyskania oczekiwanego rezultatu.
Osoby w podeszłym wieku
Badania kliniczne produktu leczniczego Belkyra nie obejmowały wystarczającej liczby uczestników w wieku 65 lat i starszych, aby można było określić, czy odpowiadają oni na leczenie w inny sposób niż młodsi uczestnicy; w związku z tym w przypadku tych pacjentów należy zachować szczególną ostrożność.
Substancja pomocnicza o znanym działaniu
Produkt leczniczy zawiera 4,23 mg sodu na 1 ml, co odpowiada 0,2% zalecanej przez WHO
maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
Dla produktu leczniczego Belkyra nie prowadzono badań klinicznych dotyczących interakcji z innymi
produktami leczniczymi.
Ciąża
Badanie rozrodczości przeprowadzono na szczurach i królikach, u których zastosowano ekspozycję 1,8 razy większą (u szczurów) i 12 razy większą (u królików) niż maksymalna zalecana ekspozycja u ludzi. Choć nie wykazano bezpośredniego ani pośredniego szkodliwego wpływu na reprodukcję, stwierdzono występowanie braku pośredniego płata płuca u królików w badaniu toksyczności
w stosunku do zarodka i płodu (patrz punkt 5.3), co jednak nie doprowadziło do żadnych
dodatkowych wniosków.
Nie przeprowadzono odpowiednich badań z prawidłowo dobraną grupą kontrolną kobiet w ciąży. W ramach ostrożności nie jest zalecane stosowanie produktu leczniczego Belkyra w okresie ciąży.
Karmienie piersią
Nie są dostępne informacje dotyczące obecności kwasu deoksycholowego w ludzkim mleku, wpływu produktu leczniczego na karmione piersią dziecko lub wpływu produktu leczniczego na wytwarzanie mleka. Nie przeprowadzono badań z udziałem matek karmiących piersią, dlatego należy zachować szczególną ostrożność podczas stosowania produktu leczniczego Belkyra u kobiet karmiących piersią.
Płodność
Brak danych klinicznych dotyczących wpływu na płodność.
Produkt leczniczy Belkyra podawany w dawkach do 50 mg/kg, co odpowiada odpowiednio około pięciokrotności i trzykrotności wartości granicznej zalecanej dawki maksymalnej u ludzi (patrz punkt 5.3), nie wpływa na ogólną zdolność rozrodczą ani na płodność u samców i samic szczurów.
Nie przeprowadzono badań dotyczących wpływu na zdolność prowadzenia pojazdów i obsługiwania
maszyn.
W tabeli poniżej przedstawiono działania niepożądane zgłaszane przez pacjentów, u których zastosowano produkt leczniczy Belkyra, biorących udział w badaniach klinicznych, w których oceniano stosowanie produktu leczniczego Belkyra w leczeniu nadmiaru tkanki tłuszczowej w obrębie podbródka lub zgłaszane przez pacjentów, którzy zostali poddani ocenie w okresie po wprowadzeniu do obrotu produktu leczniczego Belkyra.
Poniższe działania niepożądane wystąpiły u pacjentów biorących udział w badaniach klinicznych z poniżej przedstawioną częstością:
Klasyfikacja układów i narządów | Częstość | Działania niepożądane |
Zaburzenia układu nerwowego | Często | Bóle głowy |
Niezbyt często | Zaburzenia smaku | |
Nieznana | Hipoestesia (osłabienie czucia jamy ustnej), parestesia (czucie opatrzne jamy ustnej) | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Niezbyt często | Dysfonia |
Zaburzenia żołądka i jelit | Często | Dysfagia, mdłości |
Zaburzenia skóry i tkanki podskórnej | Często | Napięcie skóry |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Miejsce wstrzyknięcia: ból, obrzęk, opuchlizna, znieczulenie, guzki, krwiaki, parestezje, stwardnienie, rumień, świąd. |
Często | Miejsce wstrzyknięcia: krwotok, uczucie dyskomfortu, uczucie ciepła, odbarwienie. | |
Niezbyt często | Miejsce wstrzyknięcia: łysienie, pokrzywka, wrzody, nadwrażliwość, blizna**. | |
Nieznana | Miejsce wstrzyknięcia: Hipoestesia (osłabienie czucia), martwica*, matrwica tętnicy, zakażenie w miejscu wstrzyknięcia*** | |
Urazy, zatrucia i powikłania po zabiegach | Często | Uszkodzenie nerwu w miejscu wstrzyknięcia |
Nieznana | Uraz naczyniowy spowodowany niezamierzonym wstrzyknięciem donaczyniowym |
* Zgłaszano działania niepożądane dotyczące martwicy w miejscu wstrzyknięcia jako martwicę tkanki tłuszczowej, martwicę, martwicę skóry i martwicę tkanek miękkich. Zdarzenia te występowały
w okolicy miejsca leczenia a zajęty obszar miał od 0,5 cm do 3 cm. W rzadkich przypadkach zajęta była cała okolica podbródka.
** Powstawanie blizny w miejscu wstrzyknięcia zgłaszano jako wynik owrzodzenia lub martwicy skóry (patrz punkt 4.4) oraz jako tkankę bliznowatą po wstrzyknięciu.
***Zgłaszano zakażenia w miejscu wstrzyknięcia, z których niektóre obejmowały zapalenie tkanki łącznej i ropień (patrz punkt 4.4).
Większość działań niepożądanych ustępowała w czasie pomiędzy zabiegami. Poniższa tabela przedstawia działania niepożądane zgłaszane jako trwające dłużej niż czas pomiędzy wstrzyknięciami wynoszący 4 tygodnie, w oparciu o wyniki pochodzące z czterech badań fazy III (N=758) u pacjentów leczonych produktem leczniczym Belkyra.
Działania niepożądane | Belkyra | Średni czas do ustąpienia a (zakres) |
Uszkodzenie nerwu w miejscu wstrzyknięcia | 3,6% | 53 dni (1–334 dni) |
Stwardnienie w miejscu wstrzyknięcia | 23,4% | 41 dni (1–292 dni) |
Guzki w miejscu wstrzyknięcia | 12,0% | 48 dni (1-322 dni) |
Ból w miejscu wstrzyknięcia | 74,1% | 12 dni (1-333 dni) |
Objawy czuciowe w miejscu wstrzyknięcia | 66,4% | 46 dni (1-349 dni) |
Znieczulenie w miejscu wstrzyknięcia | 61,6% | 50 dni (1-349 dni) |
Parestezja w miejscu wstrzyknięcia | 11,3% | 27 dni (1-297 dni) |
Obrzęk w miejscu wstrzyknięcia | 78,6% | 15 dni (1-218 dni) |
Dysfagia | 1,5% | 22 dni (1-142 dni) |
a: Dotyczy wyłącznie produktów leczniczych z grupy Belkyra
W badaniach klinicznych niektóre miejscowe reakcje, takie jak stwardnienie, guzki, znieczulenie, ból oraz obrzęk w miejscu wstrzyknięcia oraz uszkodzenie nerwu ruchowego, były zgłaszane jako nieustępujące w trakcie trwania badań klinicznych.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie odnotowano przypadku przedawkowania produktu leczniczego Belkyra u ludzi.
W przypadku wstrzyknięcia większej objętości produktu leczniczego lub zmniejszenia odstępu pomiędzy wstrzyknięciami produktu leczniczego Belkyra należy spodziewać się zwiększenia ryzyka występowania miejscowych działań niepożądanych. W czasie prowadzenia badań klinicznych przy podaniu dawek do 200 mg zdarzenia niepożądane w obszarach nieleczonych jak również ogólnoustrojowe nie występowały zbyt często.
Grupa farmakoterapeutyczna: inne leki dermatologiczne Kod ATC: D11AX24
Mechanizm działania
Kwas deoksycholowy jest lekiem cytolitycznym, który po wstrzyknięciu w tkankę tłuszczową umiejscowioną pod skórą fizycznie rozbija błonę komórkową adipocytów. Zniszczenie adipocytów wywołuje odpowiedź tkankową, w której makrofagi przyciągane są do danego obszaru w celu wyeliminowania pozostałości komórkowych i lipidów, które są następnie rozkładane w procesach naturalne przebiegających w organizmie. Następnie pojawiają się fibroblasty i obserwowane jest zagęszczanie przegród włóknistych, co wskazuje na zwiększenie ilości całkowitego kolagenu (tj. neokolagenezę).
Skuteczność kliniczna i bezpieczeństwo stosowania
Przeprowadzono cztery wieloośrodkowe, randomizowane, kontrolowane placebo badania fazy III prowadzone metodą podwójnie ślepej próby (dwa identyczne badania prowadzone w Unii Europejskiej [UE] oraz dwa identyczne badania prowadzone w Ameryce Północnej) oceniające
zastosowanie produktu leczniczego Belkyra w leczeniu wypukłości bądź pełnego podbródka związanych z obecnością tkanki tłuszczowej w podbródku u osób dorosłych, u których jego obecność ma wpływ na stan psychiczny pacjenta. We wszystkich badaniach ocena głównego punktu końcowego była wykonywana po 12 tygodniach po zabiegu końcowym. We wszystkich badaniach fazy III spełniono kryteria określone dla głównego punktu końcowego i wykazano polepszenie stanu psychicznego w porównaniu z placebo.
Do badań włączono osoby dorosłe (w wieku od 19 do 65 lat) z umiarkowaną lub ciężką wypukłością bądź pełnym podbródkiem, które były związane z występowaniem tkanki tłuszczowej w podbródku (tj. w stopniu 2 lub 3 w 5-stopniowej skali, gdzie 0=brak, 4=skrajny), ocenianą zarówno przez lekarza, jak i uczestnika. Pacjenci zostali poddani maksymalnie 4 zabiegom w badaniach prowadzonych w UE oraz 6 zabiegom w badaniach prowadzonych w Ameryce Północnej, z użyciem produktu leczniczego Belkyra (N=757 we wszystkich czterech badaniach) lub placebo (N=746) wykonywanym w odstępach 28-dniowych. Leczenie zakończono po uzyskaniu oczekiwanej odpowiedzi. Wstrzykiwana objętość
to 0,2 ml na każde miejsce wstrzyknięcia w tkankę tłuszczową podbródka, oddalone od siebie o 1 cm, co odpowiada dawce 2 mg/cm2 w danym obszarze. W każdej grupie leczenia maksymalna dawka dopuszczalna do zastosowania podczas zabiegu w całym leczonym obszarze wynosiła 100 mg
(10 ml).
Średni wiek uczestników badania w UE wynosił 46 lat, a średnia wartość BMI 26. Większość pacjentów to kobiety (75%) rasy kaukaskiej (94%). W punkcie początkowym badania stopień otłuszczenia podbródka oceniany przez lekarza u 68% pacjentów był umiarkowany, a u 32% ciężki. Średni wiek uczestników badania w regionie Ameryki Północnej wynosił 49 lat, a średnia wartość BMI 29 kg/m2. Większość pacjentów to kobiety (85%) rasy kaukaskiej (87%). W punkcie początkowym badania stopień otłuszczenia podbródka oceniany przez lekarza u 51% pacjentów był umiarkowany, a u 49% ciężki.
Równorzędne główne punkty końcowe w badaniach prowadzonych w UE to stopień otłuszczenia podbródka oceniany przez lekarza (ang. Clinician-reported ratings of SMF, CR-SMFRS) oraz ocena zadowolenia pacjenta (ang. Subject Self Rating Scale, SSRS). Oceniano również stopień otłuszczenia podbródka oceniany przez pacjenta (ang. Patient-reported rating of SMF, PR-SMFRS). Wpływ psychologiczny występowania tkanki tłuszczowej w podbródku oceniano z wykorzystaniem wielu metod pomiaru, w tym z użyciem Skali wyglądu Derriforda 24 (ang. Derriford Appearance Scale 24, DAS-24), Skali jakości życia związanego z wyglądem ciała (ang. Body Image Quality of Life Inventory, BIQLI) oraz 6-elementowego kwestionariusza dotyczącego ocenianego przez pacjenta wpływu otłuszczenia podbródka na stan psychiczny (ang. Patient Reported–Submental Fat Impact Scale, PR-SMFIS) (oceniającego poczucie szczęścia, zakłopotania, pewności siebie, skrępowania, poczucia że wygląda się staro lub że jest się otyłym). Statystycznie znaczącą poprawę stopnia oceny otłuszczenia podbródka dokonywanej przez lekarza i pacjenta, satysfakcji pacjenta oraz zmniejszenia wpływu występowania otłuszczenia podbródka na stan psychiczny zaobserwowano częściej w grupie u której zastosowano produkt leczniczy Belkyra niż w grupie, która otrzymała placebo (Tabela 1).
Zmniejszenie ilości tkanki tłuszczowej w podbródku potwierdzono poprzez wykonanie pomiarów
cyrklem.
W badaniach przeprowadzonych w Ameryce Północnej ocenę równorzędnych głównych punktów końcowych oceny skuteczności oparto na poprawie stanu o co najmniej 2 stopnie oraz co najmniej 1 stopień dotyczący wypukłości podbródka oraz pełności podbródka w ramach oceny otłuszczenia podbródka złożonej z oceny lekarza (CR-SMFRS) i pacjenta (PR-SMFRS) po 12 tygodniach
od zabiegu końcowego. Wpływ występowania otłuszczenia podbródka na stan psychiczny oceniano z wykorzystaniem tego samego 6-elementowego kwestionariusza, który stosowano w badaniach na terenie UE. Dodatkowo w podgrupie pacjentów (N=449, w kilku badaniach) oceniono zmianę objętości tkanki tłuszczowej w podbródku z wykorzystaniem obrazowania metodą rezonansu magnetycznego (MRI). Zmniejszenie ilości tkanki tłuszczowej w podbródku potwierdzono zarówno w badaniu MRI, jak i poprzez wykonanie pomiarów cyrklem.
Poniżej zamieszczona Tabela 1 przedstawia wyniki w 1-stopniowej skali odpowiedzi na leczenie dotyczącej stopnia otłuszczenia podbródka według oceny lekarza (CR-SMFRS), odpowiedź względem zadowolenia pacjenta (SSRS) oraz wpływ na poprawę stanu psychicznego pacjenta (PR- SMFIS) uzyskane w wyniku wszystkich czterech badań fazy III. Rysunek 4 przedstawia współczynniki odpowiedzi na podstawie oceny otłuszczenia wykonywanej przez lekarza podczas każdej z wizyty odbywanej w ramach badania.
Tabela 1: Ocena otłuszczenia podbródka dokonana przez lekarza i pacjenta, ocena zadowolenia oraz wpływu na stan psychiczny po 12 tygodniach od ostatniego zabiegu
Badania prowadzone w UE a | Badania prowadzone w Ameryce Północnej b | |||
Punkt końcowy | Belkyra (N=243) | Placebo (N=238) | Belkyra (N=514) | Placebo (N=508) |
1-stopniowa skala odpowiedzi na leczenie dotycząca stopnia otłuszczenia podbródka według oceny lekarza (CR-SMFRS) c | 63,8% | 28,6% | 78,5% | 35,3% |
1-stopniowa skala odpowiedzi na leczenie dotycząca stopnia otłuszczenia podbródka według oceny pacjenta (PR-SMFRS) c | 63,1% | 34,3% | 80,3% | 38,1% |
Odpowiedź względem zadowolenia pacjenta (SSRS) d | 65,4% | 29% | 69,1% | 30,5% |
Procentowa średnia poprawa stanu psychicznego pacjenta (PR-SMFIS) względem wartości w punkcie początkowym e | 44,6% | 18,0% | 48,6% | 17,3% |
a Dozwolone jest wykonanie do 4 zabiegów
b Dozwolone jest wykonanie do 6 zabiegów
c Zmniejszenie o co najmniej 1 stopień w skali oceny otłuszczenia podbródka wykonywanej przez
lekarza po 12 tygodniach od ostatniego zabiegu
d Ocena pacjenta na poziomie „bardzo zadowolony”, „zadowolony” lub „trochę zadowolony” w skali
SSRS po 12 tygodniach od ostatniego zabiegu
e Procentowe średnie polepszenie względem wartości w punkcie początkowym obliczone jako średnia zmiana względem wartości wyjściowej w wyniku PR-SMFIS podzielona przez średnią wartość
w punkcie początkowym
Rysunek 4: Ocena stopnia otłuszczenia podbródka wykonywana przez lekarza (CR-SMFRS) wg. 1-stopniowego wskaźnika odpowiedzi podczas każdej wizyty w ramach badania; łączne dane zgromadzone podczas badań prowadzonych w UE (strona lewa) oraz w Ameryce Północnej (strona prawa)*
Placebo ATX-101
100%
80%
60%
40%
20%
0%
Punkt

Placebo ATX-101

Współczynnik odpowiedzi (% pacjenci)
Współczynnik odpowiedzi (% pacjenci)
100%
80%
60%
40%
20%
Ocena
Ocena
Ocenal
4tygodnie
12 tygodni
Punkt
Ocena
Ocena
Ocena
Ocena
Ocena 4 tygodnie
12 tygodni
24 tygodni
wyjściowy
Tx 1
Tx 2
Tx 3
po ostatnim Tx
po ostatnim Tx
wyjściowy
Tx 1
Tx 2
Tx 3
Tx 4
Tx 5
po ostatnim Tx
po ostatnim Tx
Po ostatnim Tx
Ocena leczenia w punktach czasowych
Ocena leczenia w punktach czasowych
* p <0,001 dla wszystkich punktów czasowych, Belkyra w porównaniu z placebo
Mimo że u większości pacjentów wystąpiło zmniejszenie objętości tkanki tłuszczowej w podbródku, po 12 tygodniach od ostatniego zabiegu w porównaniu z punktem początkowym badania odpowiednio u 90% i u 92% pacjentów biorących udział w badaniach w UE i w USA/Kanadzie nie wystąpiła żadna zmiana (68,9% i 70,5%) lub poprawa (21,6% i 22,9%) w poziomie napięcia skóry.
Po zastosowaniu produktu leczniczego Belkyra przeprowadzono ocenę długotrwalego bezpieczeństwa stosowania oraz czasu utrzymywania się efektu leczenia. Podgrupa pacjentów, którzy odpowiedzieli na początkowe leczenie produktem leczniczym Belkyra kontynuowało udział w kontrolnych badaniach obserwacyjnych, w których wykazano, że efekt leczenia utrzymywał się przez okres do
5 lat.
Dzieci i młodzież
Nie zaleca się stosowania produktu leczniczego Belkyra u osób w wieku poniżej 18 lat.
Europejska Agencja Leków wyraziła zgodę na odstąpienie od wymogu przedłożenia wyników badań dotyczących zastosowania produktu leczniczego Belkyra u dzieci i młodzieży w leczeniu umiarkowanej lub ciężkiej wypukłości bądź pełnego podbródka związanych z występowaniem tkanki tłuszczowej w podbródku u osób dorosłych, u których jego obecność na wpływ na stan psychiczny pacjenta (patrz punkt 4.2 Dzieci i młodzież).
Endogenne stężenie kwasu deoksycholowego w osoczu jest bardzo zmienne oraz wykazuje zmienność osobniczą; większość wtórnego kwasu żółciowego podlega krążeniu wątrobowo-jelitowemu.
Farmakokinetyka egzogennego kwasu deoksycholowego podawanego w czasie leczenia produktem
leczniczym Belkyra została porównana względem kwasu endogennego jako tła. Wchłanianie
Po wykonaniu wstrzyknięcia podskórnego kwas deoksycholowy pochodzący z produktu leczniczego Belkyra ulega natychmiastowej absorbcji. Po podaniu maksymalnej zalecanej dawki produktu leczniczego Belkyra podczas jednego zabiegu (o wartości 100 mg), stężenie maksymalne leku
w osoczu (średnie Cmax) zaobserwowano po średnim czasie tmax wynoszącym 6 minut po wykonaniu wstrzyknięcia. Średnia wartość Cmax wyniosła 1036 ng/ml i była 2,3-krotnie większa niż średnia wartość Cmax zaobserwowana podczas 24-godzinnego okresu obserwacji początkowego endogennego stężenia kwasu deoksycholowego, bez obecności produktu leczniczego Belkyra. Po podaniu maksymalnej zalecanej dawki dla pojedynczego zabiegu (100 mg), ekspozycja na kwas deoksycholowy (AUC0-24) była mniejsza niż dwukrotna ekspozycja endogenna. Wartość AUC0-24
w osoczu zwiększała się w sposób proporcjonalny do dawki, do wartości 100 mg. Stężenie kwasu
deoksycholowego w osoczu po leczeniu powracało do stężenia endogennego po upływie 24 godzin. Przy proponowanej częstości przeprowadzania zabiegów nie przewiduje się, że nastąpi jego kumulacja.
Dystrybucja
Szacunkowa objętość dystrybucji wynosi 193 l i jest niezależna od dawki do wartości 100 mg. Kwas deoksycholowy silnie wiąże się z białkami osocza (98%).
Eliminacja
Endogenny kwas deoksycholowy powstaje w wyniku metabolizmu cholesterolu i jest wydalany wraz z kałem. Kwas deoksycholowy pochodzący z produktu leczniczego Belkyra jest dołączany do puli endogennej i wydzielany wraz endogennym kwasem deoksycholowym. Kwas deoksycholowy jest usuwany z krwi poprzez wątrobowe białka transporterowe do żółci bez znaczącego wpływu na metabolizm.
W warunkach in vitro kwas deoksycholowy nie jest inhibitorem izoenzymów CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6 i 3A4. Kwas deoksycholowy w stężeniu leczniczym nie wywołuje indukcji CYP1A, 2B6 i 3A.
W warunkach in vitro kwas deoksycholowy nie jest inhibitorem transporterów BSEP, MRP2, MRP4, MDR1, BCRP, OATP1B1, OATP1B3, OAT1, OAT3, OCT1, OCT2, OATP2B1 i ASBT.
W warunkach in vitro kwas deoksycholowy hamuje NTCP z IC50 wynoszącym 2,14 µM. Zaburzenia czynności nerek
Nie badano stosowania produktu leczniczego Belkyra u pacjentów z zaburzeniami czynności nerek. Kwasy żółciowe, w tym kwas deoksycholowy, są wydzielane wraz z moczem w nieznacznej ilości; jest bardzo mało prawdopodobne, by zaburzenia czynności nerek wpływały na farmakokinetykę kwasu deoksycholowego.
Zaburzenia czynności wątroby
Nie badano stosowania produktu leczniczego Belkyra u pacjentów z zaburzeniami czynności wątroby. Biorąc pod uwagę częstość i przerwy w podawaniu dawek oraz niewielką wielkość dawki, która stanowi około 3% całkowitej puli kwasów żółciowych, jak również wysoką zmienność endogennego stężenia kwasu deoksycholowego, jest mało prawdopodobne, aby farmakokinetyka kwasu deoksycholowego po zastosowaniu produktu leczniczego Belkyra we wstrzyknięciach miała wpływ na zaburzenia czynności wątroby.
Osoby w podeszłym wieku
Dostosowywanie dawki nie jest uważane za konieczne. Należy zachować szczególną ostrożność podczas stosowania produktu leczniczego u osób w podeszłym wieku (patrz punkt 4.4).
Dane niekliniczne uwzględniające wyniki konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania, badań toksyczności po podaniu wielokrotnym, genotoksyczności
i toksyczności w stosunku do układu rozrodczego i rozwoju nie ujawniają występowania szczególnego zagrożenia dla człowieka.
Rakotwórczość
W badaniach toksyczności po podaniu wielokrotnym trwającym do 6 miesięcy u szczurów
i 9 miesięcy u psów nie wykazano miejscowych ani ogólnoustrojowych reakcji przednowotworowych w odpowiedzi na podskórne podanie produktu leczniczego Belkyra. W tych badaniach maksymalna planowana dawka kliniczna została przekroczona odpowiednio 2,5 do 12,5-krotnie (w przeliczeniu na mg/na miejsce wstrzyknięcia) i dwukrotnie do trzykrotnie (na podstawie zmierzonej ekspozycji ogólnoustrojowej) u szczurów i psów. Ponadto, w przeciwieństwie do maksymalnego zalecanego klinicznego schematu comiesięcznych wstrzykiwań obejmującego 6 zabiegów, produkt leczniczy Belkyra podawano dwa razy w miesiącu aż do podania łącznie 13 dawek u szczurów i 20 dawek
u psów. Nie prowadzono badań klinicznych dotyczących działania rakotwórczego produktu
leczniczego Belkyra.
Genotoksyczność
W badaniach toksyczności genetycznej produktu leczniczego Belkyra, standardowym panelu badań in
vitro (test bakteryjny poziomu mutacji powrotnych oraz test aberracji chromosomalnych) oraz
w badaniu in vivo (test mikrojądrowy) uzyskano wynik ujemny. Toksyczne działanie na rozwój
Odnotowano brak pośredniego płata płuca u królików w badaniu toksyczności w stosunku do zarodka i płodu, co jednak nie doprowadziło do żadnych dodatkowych wniosków. Stwierdzano to znacznie częściej w grupie otrzymującej dawkę 30 mg/kg mc., ale również stwierdzano w grupie otrzymującej najmniejszą dawkę o wartości 10 mg/kg mc. Dawka ta była związana z występowaniem miejscowego działania toksycznego na matkę. Znaczenie kliniczne tych wyników nie jest jasne.
Woda do wstrzykiwań
Sodu chlorek
Sodu wodorotlenek (do rozpuszczenia i ustalenia pH) Disodu fosforan bezwodny
Kwas solny (do ustalenia pH)
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności.
30 miesięcy
Produkt leczniczy należy zużyć natychmiast po nakłuciu korka zamykającego fiolkę.
Jeśli produkt leczniczy nie zostanie użyty natychmiast po przygotowaniu, za czas i warunki przechowywania odpowiada użytkownik.
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Informacje dotyczące przechowywania produktu leczniczego po pierwszym otwarciu znajdują się
w punkcie 6.3.
4 fiolki po 2 ml roztworu, w tekturowym pudełku
Fiolka ze szkła (typu I) z korkiem z gumy chlorobutylowej i aluminiowym uszczelnieniem
z wieczkiem typu flip-top z polipropylenu.
do stosowania
Każda fiolka przeznaczona jest do zastosowania wyłącznie u jednego pacjenta. Po użyciu należy wyrzucić niewykorzystany produkt leczniczy.
Produkt leczniczy Belkyra należy przygotować do wstrzyknięcia w następujący sposób:
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
DOPUSZCZENIE DO OBROTU
AbbVie Sp. z o.o. ul. Postępu 21B 02-676 Warszawa
Pozwolenie nr 23575
OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 28 listopada 2016
Data ostatniego przedłużenia pozwolenia: 12 stycznia 2022
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
04/2023











