Spis treści:
- Hipercholesterolemia pierwotna
- Stosowanie u pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie Udowodniono korzystny wpływ produktu leczniczego Ezolip 10 mg stosowanego ze statyną o udokumentowanych korzyściach sercowo-naczyniowych na dodatkową redukcję incydentów sercowo- naczyniowych u pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie.
- Szczególne grupy pacjentów
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
Hipercholesterolemia pierwotna
Stosowanie u pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie Udowodniono korzystny wpływ produktu leczniczego Ezolip 10 mg stosowanego ze statyną o udokumentowanych korzyściach sercowo-naczyniowych na dodatkową redukcję incydentów sercowo- naczyniowych u pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie.
Enzymy wątrobowe
Produkty lecznicze zobojętniające
Tabelaryczny wykaz działań niepożądanych (Badania kliniczne oraz doświadczenie po wprowadzeniu do obrotu)
SKUTECZNOŚĆ KLINICZNA I BEZPIECZEŃSTWO STOSOWANIA
Szczególne grupy pacjentów
Przedkliniczne dane o bezpieczeństwie
Badania na zwierzętach dotyczące przewlekłego działania toksycznego nie wskazały na istnienie narządów narażonych na takie działanie. U psów, którym podawano ezetymib przez cztery tygodnie (≥0,03 mg/kg na dobę) stwierdzono zwiększenie stężenia cholesterolu w żółci znajdującej się w pęcherzyku żółciowym o 2,5 do 3,5 razy. W badaniu trwającym rok, przeprowadzonym u psów otrzymujących ezetymib w dawkach do 300 mg/kg/dobę, nie stwierdzono zwiększenia częstości występowania kamicy żółciowej lub innego wpływu na wątrobę i drogi żółciowe. Nie wiadomo, czy wyniki tych badań mają jakieś odniesienie do ludzi. Nie można wykluczyć ryzyka powstawania kamieni żółciowych w przypadku stosowania ezetymibu. W badaniach, w których ezetymib stosowany był w skojarzeniu ze statynami, działania toksyczne były typowe, jak przy stosowaniu statyn. Niektóre z tych działań były nasilone przy skojarzonym stosowaniu produktów leczniczych w porównaniu ze stosowaniem statyn w monoterapii. Efekt ten ma związek z farmakokinetycznymi i farmakodynamicznymi interakcjami pomiędzy produktami leczniczymi stosowanymi w leczeniu skojarzonym. Nie obserwowano takich interakcji podczas badań klinicznych. Miopatia występowała u szczurów dopiero po podaniu dawek kilkakrotnie większych od dawki terapeutycznej stosowanej u ludzi (około 20-krotnie większa wartość AUC dla statyn oraz 500-2000 razy większa wartość AUC dla czynnych metabolitów ezetymibu).
W szeregu badań in vivo i in vitro nie stwierdzono działania genotoksycznego ezetymibu stosowanego w monoterapii lub w skojarzeniu ze statynami.
Wyniki badań rakotwórczego działania ezetymibu podczas długotrwałego stosowania były negatywne.
Ezetymib nie miał wpływu na płodność samic i samców szczurów, jak również nie wykazywał działania teratogennego na szczury czy króliki, nie miał też wpływu na rozwój zarodków i noworodków. Ezetymib przenikał przez barierę łożyskową u ciężarnych szczurów i królików podczas stosowania wielokrotnych dawek po 1000 mg/kg/dobę. Nie zaobserwowano działania teratogennego u szczurów podczas jednoczesnego stosowania ezetymibu w skojarzeniu ze statyną. U ciężarnych królików odnotowano
niewielką liczbę zaburzeń rozwoju kośćca płodu (połączenie kręgów piersiowych i ogonowych, zmniejszenie liczby kręgów ogonowych). Stosowanie ezetymibu w skojarzeniu z lowastatyną wywierało działanie letalne na zarodki.
Ezolip podawany w skojarzeniu z inhibitorem reduktazy HMG-CoA (statyną) jest wskazany jako produkt leczniczy wspomagający wraz z dietą u pacjentów z pierwotną hipercholesterolemią (heterozygotyczną rodzinną lub nierodzinną), u których stosowanie samej statyny okazało się niewystarczająco skuteczne.
Ezolip w monoterapii jest wskazany jako produkt leczniczy wspomagający wraz z dietą u pacjentów z pierwotną hipercholesterolemią (heterozygotyczną rodzinną lub nierodzinną), u których stosowanie statyny jest niewskazane lub ten produkt leczniczy nie jest tolerowany.
Zapobieganie wystąpieniu incydentów sercowo-naczyniowych
Ezolip podawany dodatkowo u pacjentów wcześniej leczonych statyną lub włączany do leczenia jednocześnie ze statyną jest wskazany do stosowania, w celu zmniejszenia ryzyka wystąpienia incydentów sercowo-naczyniowych (patrz punkt 5.1) u pacjentów z chorobą wieńcową (ang. CHD, Coronary Heart Disease) i ostrym zespołem wieńcowym w wywiadzie (ang. ACS, Acute Coronary Syndrome).
Homozygotyczna hipercholesterolemia rodzinna
Ezolip w skojarzeniu ze statyną jest wskazany jako produkt leczniczy wspomagający wraz z dietą u pacjentów z homozygotyczną hipercholesterolemią rodzinną. U pacjentów mogą być również stosowane dodatkowe metody leczenia (np. afereza LDL).
Homozygotyczna sitosterolemia (fitosterolemia)
Ezolip jest wskazany do stosowania jako produkt leczniczy wspomagający wraz z dietą u pacjentów z homozygotyczną sitosterolemią rodzinną.
Jednoczesne stosowanie z produktami leczniczymi wiążącymi kwasy żółciowe
Ezolip należy przyjmować co najmniej 2 godziny przed lub co najmniej 4 godziny po przyjęciu produktu leczniczego wiążącego kwasy żółciowe.
Osoby w podeszłym wieku
Nie jest wymagane dostosowanie dawki produktu leczniczego dla pacjentów w podeszłym wieku (patrz punkt 5.2).
Dzieci i młodzież
Leczenie należy rozpocząć pod nadzorem lekarza specjalisty.
Dzieci i młodzież w wieku 6 lat i powyżej: Nie określono bezpieczeństwa stosowania ani skuteczności ezetymibu u dzieci w wieku od 6 do 17 lat. Aktualne dane przedstawiono w punktach 4.4, 4.8, 5.1 i 5.2, ale brak zaleceń dotyczących dawkowania.
Jeśli produkt leczniczy Ezolip jest podawany w skojarzeniu ze statyną, dawkowanie statyny u dzieci należy omówić z lekarzem.
Dzieci w wieku poniżej 6 lat: Nie określono bezpieczeństwa stosowania ani skuteczności ezetymibu u dzieci w wieku poniżej 6 lat. Nie ma dostępnych danych.
Zaburzenia czynności wątroby
U pacjentów z łagodnymi zaburzeniami czynności wątroby (5-6 punktów wg skali Child-Pugh) nie jest wymagane dostosowanie dawkowania. Stosowanie produktu leczniczego Ezolip nie jest zalecane u pacjentów z umiarkowanymi (7-9 punktów wg skali Child-Pugh) lub ciężkimi (>9 punktów wg skali Child- Pugh) zaburzeniami czynności wątroby. (Patrz punkty 4.4 i 5.2).
Zaburzenia czynności nerek
Nie jest konieczne dostosowanie dawkowania u pacjentów z zaburzeniami czynności nerek (patrz punkt 5.2).
W kontrolowanych badaniach klinicznych, w których pacjenci przyjmowali ezetymib w skojarzeniu ze statyną, obserwowano zwiększenie aktywności aminotransferaz (≥ 3 razy powyżej górnej granicy wartości prawidłowych). W przypadku jednoczesnego stosowania ezetymibu i statyny należy przeprowadzać testy czynnościowe wątroby przed rozpoczęciem leczenia oraz zgodnie z zaleceniami ChPL dotyczącymi danej statyny. (Patrz punkt 4.8).
W badaniu IMPROVE-IT (ang. IMProved Reduction of Outcomes: Vytorin Efficacy International Trial)
18 144 pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie przydzielano w sposób losowy do grupy otrzymującej ezetymib z symwastatyną w dawce 10 mg + 40 mg na dobę (n=9067) lub symwastatynę w dawce 40 mg na dobę (n=9077). Podczas okresu obserwacji, którego mediana wynosiła 6,0 lat, częstość występowania kolejnych wzrostów poziomu transaminaz (≥ 3x GGN) w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 2,5% i 2,3%. (Patrz punkt 4.8).
W kontrolowanym badaniu klinicznym z udziałem ponad 9000 pacjentów z przewlekłą chorobą nerek pacjenci zostali losowo przydzieleni do grup otrzymujących ezetymib w dawce 10 mg w skojarzeniu z symwastatyną w dawce 20 mg na dobę (n=4650) lub placebo (n=4620) (średni czas obserwacji 4,9 roku). Częstość występowania kolejnych zwiększeń aktywności aminotransferaz (> 3 x GGN) wynosiła 0,7% dla ezetymibu w skojarzeniu z symwastatyną i 0,6% w grupie placebo (patrz punkt 4.8).
Mięśnie szkieletowe
Po wprowadzeniu leku do obrotu zgłaszano przypadki wystąpienia miopatii i rabdomiolizy podczas stosowania ezetymibu. Większość pacjentów, u których doszło do rabdomiolizy przyjmowała statynę w skojarzeniu z ezetymibem. Jednak bardzo rzadko zgłaszano również występowanie rabdomiolizy w przypadku monoterapii oraz w przypadku jednoczesnego stosowania ezetymibu z innymi produktami leczniczymi, których związek ze zwiększeniem ryzyka rabdomiolizy jest znany. Jeśli podejrzewany jest rozwój miopatii na podstawie objawów ze strony mięśni lub zostanie ona potwierdzona zwiększeniem aktywności kinazy kreatynowej (CK) przekraczającym 10 razy górną granicę wartości prawidłowych, należy niezwłocznie zaprzestać stosowania ezetymibu, statyn i każdego stosowanego jednocześnie produktu leczniczego z opisanej wyżej grupy. Wszyscy pacjenci rozpoczynający leczenie ezetymibem powinni być poinformowani o ryzyku wystąpienia miopatii i o konieczności natychmiastowego zgłaszania wszelkich niewyjaśnionych bólów mięśni, ich tkliwości lub osłabienia (patrz punkt 4.8).
W badaniu IMPROVE-IT 18 144 pacjentów z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie przydzielano w sposób losowy do grupy otrzymującej ezetymib z symwastatyną w dawce 10 mg
+ 40 mg na dobę (n=9067) lub symwastatynę w dawce 40 mg na dobę (n=9077). Podczas okresu obserwacji, którego mediana wynosiła 6,0 lat, częstość występowania miopatii w grupie otrzymującej ezetymib z symwastatyną oraz w grupie przyjmującej symwastatynę wynosiła odpowiednio 0,2% i 0,1%. Miopatię zdefiniowano jako niewyjaśnione osłabienie mięśni lub ból ze zwiększoną aktywnością kinazy kreatynowej (CK) w surowicy wynoszącej ≥ 10x GGN lub dwa kolejne epizody zwiększenia aktywności CK wynoszące
≥ 5 i < 10x GGN. Częstość występowania rabdomiolizy w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 0,1% i 0,2%. Rabdomiolizę zdefiniowano jako niewyjaśnione osłabienie mięśni lub ból ze zwiększoną aktywnością CK w surowicy wynoszącej ≥ 10x GGN i objawami uszkodzenia nerek, dwa kolejne epizody zwiększenia aktywności CK wynoszącej ≥ 5 i < 10x GGN z objawami uszkodzenia nerek lub CK ≥ 10 000 j.m./l bez objawów uszkodzenia nerek. (Patrz punkt 4.8.).
W kontrolowanym badaniu klinicznym z udziałem ponad 9000 pacjentów z przewlekłą chorobą nerek pacjenci zostali losowo przydzieleni do grup otrzymujących ezetymib w dawce 10 mg w skojarzeniu z symwastatyną w dawce 20 mg na dobę (n=4650) lub placebo (n=4620) (średni czas obserwacji 4,9 roku). Częstość występowania miopatii i (lub)/ rabdomiolizy wynosiła 0,2% w grupie stosującej ezetymib w skojarzeniu z symwastatyną i 0,1% w grupie przyjmującej placebo (patrz punkt 4.8).
Zaburzenia czynności wątroby
Ze względu na to, że nie są znane skutki długotrwałego stosowania ezetymibu u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami wątroby, nie zaleca się stosowania ezetymibu u tych pacjentów (patrz punkt 5.2).
Dzieci i młodzież
Bezpieczeństwo i skuteczność stosowania ezetymibu u pacjentów w wieku 6 do 10 lat z heterozygotyczną hipercholesterolemią rodzinną lub nierodzinną oceniono w trwającym 12 tygodni badaniu klinicznym, kontrolowanym placebo. W tej grupie wiekowej nie oceniano działania ezetymibu stosowanego przez okres ponad 12 tygodni (patrz punkty 4.2, 4.8, 5.1 i 5.2).
Nie badano ezetymibu u pacjentów w wieku poniżej 6 lat (patrz punkty 4.2 i 4.8).
Bezpieczeństwo i skuteczność stosowania ezetymibu w skojarzeniu z symwastatyną u pacjentów w wieku od 10 do 17 lat z heterozygotyczną hipercholesterolemią rodzinną oceniono w badaniu klinicznym z grupą kontrolną z udziałem dorastających chłopców (w skali Tannera, w fazie II i powyżej) oraz dziewcząt, u których pierwsza miesiączka wystąpiła co najmniej 1 rok wcześniej.
W tym ograniczonym badaniu z grupą kontrolną, ogólnie nie stwierdzono wykrywalnego wpływu na wzrost lub dojrzewanie płciowe u dorastających chłopców lub dziewcząt, ani na długość cyklu miesiączkowego u dziewcząt. Nie przeprowadzono jednak badań dotyczących wpływu stosowania ezetymibu przez okres > 33 tygodni na wzrost i proces dojrzewania płciowego (patrz punkt 4.2 oraz punkt 4.8).
Nie przeprowadzono oceny bezpieczeństwa i skuteczności stosowania ezetymibu podawanego w skojarzeniu
z symwastatyną w dawkach przekraczających 40 mg na dobę u dzieci i młodzieży w wieku od 10 do 17 lat.
Nie przeprowadzono badań dotyczących oceny wpływu ezetymibu podawanego w skojarzeniu z symwastatyną u dzieci i młodzieży w wieku poniżej 10 lat (patrz punkty 4.2 oraz 4.8.).
Nie przeprowadzono oceny długotrwałej skuteczności stosowania ezetymibu u pacjentów w wieku poniżej 17 lat w zakresie zmniejszenia zachorowalności i śmiertelności w wieku dojrzałym.
Fibraty
Nie ustalono bezpieczeństwa i skuteczności stosowania ezetymibu w skojarzeniu z fibratami.
Jeśli u pacjentów przyjmujących ezetymib i fenofibrat podejrzewa się wystąpienie kamicy żółciowej, wskazane są badania pęcherzyka żółciowego, a leczenie to należy przerwać (patrz punkt 4.5 i 4.8).
Cyklosporyna
Należy zachować ostrożność na początku stosowania ezetymibu u pacjentów przyjmujących cyklosporynę. Należy monitorować stężenia cyklosporyny u pacjentów przyjmujących ezetymib i cyklosporynę (patrz punkt 4.5).
Substancje przeciwzakrzepowe
W przypadku stosowania ezetymibu jednocześnie z warfaryną, inną substancją przeciwzakrzepową z grupy pochodnych kumaryny lub fluindionem, należy odpowiednio monitorować wartości INR (międzynarodowy wskaźnik znormalizowany) (patrz punkt 4.5).
Substancja pomocnicza
Ezolip zawiera laktozę
Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub z zespołem złego wchłaniania glukozy-galaktozy.
Ezolip zawiera sód
Lek zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy lek uznaje się za „wolny od sodu”.
Jednoczesne przyjmowanie produktów leczniczych zobojętniających zmniejszało szybkość wchłaniania ezetymibu, ale nie miało wpływu na jego dostępność biologiczną. Zmniejszenie szybkości wchłaniania nie jest uważane za znamienne klinicznie.
Kolestyramina
Jednoczesne podawanie kolestyraminy zmniejsza średnią wartość pola pod krzywą (AUC) ezetymibu całkowitego (ezetymib + glukuronian ezetymibu) o około 55%. Efekt zwiększonej redukcji stężenia cholesterolu LDL po włączeniu ezetymibu do leczenia kolestyraminą może ulec osłabieniu w wyniku tej interakcji (patrz punkt 4.2).
Fibraty
Lekarze powinni wziąć pod uwagę możliwe ryzyko wystąpienia kamicy żółciowej i choroby pęcherzyka żółciowego u pacjentów przyjmujących fenofibrat i ezetymib (patrz punkty 4.4 i 4.8).
Jeśli u pacjentów przyjmujących ezetymib i fenofibrat podejrzewa się wystąpienie kamicy żółciowej, wskazane są badania pęcherzyka żółciowego, a leczenie to należy przerwać (patrz punkt 4.8).
Podczas jednoczesnego przyjmowania fenofibratu lub gemfibrozylu następuje nieznaczne zwiększenie całkowitego stężenia ezetymibu (odpowiednio o 1,5 i 1,7 razy).
Nie przeprowadzono badań dotyczących jednoczesnego stosowania ezetymibu w skojarzeniu z innymi fibratami.
Fibraty mogą zwiększać wydalanie cholesterolu do żółci, co prowadzi do kamicy żółciowej. W badaniu na zwierzętach, ezetymib czasem zwiększał stężenie cholesterolu w żółci zawartej w pęcherzyku żółciowym, ale nie u wszystkich gatunków (patrz punkt 5.3). Nie można wykluczyć ryzyka powstawania kamieni w pęcherzyku żółciowym związanego z leczeniem ezetymibem.
Statyny
Nie stwierdzono znamiennych interakcji farmakokinetycznych podczas jednoczesnego stosowania ezetymibu z atorwastatyną, symwastatyną, prawastatyną, lowastatyną, fluwastatyną lub rozuwastatyną.
Cyklosporyna
W badaniu z udziałem 8 pacjentów po przeszczepieniu nerki (klirens kreatyniny > 50 ml/min.), którzy przyjmowali ustaloną dawkę cyklosporyny, po podaniu pojedynczej dawki 10 mg ezetymibu stwierdzono 3,4 krotne (zakres od 2,3 do 7,9 razy) zwiększenie średniej wartości AUC całkowitego ezetymibu w porównaniu z grupą osób zdrowych, otrzymujących ezetymib w monoterapii z innego badania (n=17). W innym badaniu u pacjenta po zabiegu przeszczepienia nerki, u którego rozwinęły się ciężkie zaburzenia czynności nerek i który przyjmował cyklosporynę i wiele innych produktów leczniczych, wykazano 12-krotne zwiększenie ekspozycji na całkowity ezetymib w porównaniu z grupą kontrolną otrzymującą ezetymib w monoterapii. W badaniu skrzyżowanym złożonym z dwóch okresów, w którym uczestniczyło dwunastu zdrowych ochotników, stosowanie 20 mg ezetymibu na dobę przez 8 dni z podaniem pojedynczej dawki cyklosporyny wielkości 100 mg w dniu 7. badania spowodowało średnie zwiększenie AUC cyklosporyny o 15 % (zakres wynosił od 10% zmniejszenia do 51 % zwiększenia) w porównaniu z podaniem wyłącznie pojedynczej dawki cyklosporyny wielkości 100 mg. Nie przeprowadzono badania kontrolowanego dotyczącego wpływu jednoczesnego stosowania ezetymibu na ekspozycję na cyklosporynę u pacjentów po przeszczepieniu nerki. Należy zachować ostrożność rozpoczynając leczenie ezetymibem w trakcie stosowania cyklosporyny.
Należy monitorować stężenie cyklosporyny u pacjentów przyjmujących jednocześnie ezetymib i
cyklosporynę (patrz punkt 4.4).
Leki przeciwzakrzepowe
Jednoczesne stosowanie ezetymibu (10 mg raz na dobę) nie miało istotnego wpływu na dostępność biologiczną warfaryny i czas protrombinowy w badaniu przeprowadzonym z udziałem dwunastu zdrowych dorosłych mężczyzn. Jednakże istnieją doniesienia z okresu po wprowadzeniu do obrotu dotyczące zwiększenia wartości INR u pacjentów stosujących warfarynę lub fluindion, u których włączono leczenie ezetymibem. W przypadku stosowania ezetymibu jednocześnie z warfaryną, inną substancją przeciwzakrzepową z grupy pochodnych kumaryny lub fluindionem, należy odpowiednio monitorować INR (patrz punkt 4.4).
Dzieci i młodzież
Badania dotyczące interakcji przeprowadzono wyłącznie u dorosłych.
W przeprowadzonych badaniach klinicznych trwających do 112 tygodni 2396 pacjentom podawano ezetymib w dawce 10 mg na dobę w monoterapii, 11 308 pacjentom w skojarzeniu ze statyną oraz 185 pacjentom w skojarzeniu z fenofibratem. Działania niepożądane były zwykle łagodne i przemijające. Ogólna częstość występowania działań niepożądanych w badaniach była podobna do częstości ich występowania podczas stosowania placebo. Stwierdzono również, że liczba pacjentów, którzy przerwali leczenie z powodu działań niepożądanych była porównywalna w grupie przyjmującej ezetymib i placebo.
Ezetymib w monoterapii lub w skojarzeniu ze statyną:
Poniżej przedstawiono działania niepożądane obserwowane u pacjentów leczonych ezetymibem w monoterapii (n=2396), które pojawiły się z większą częstością niż u pacjentów przyjmujących placebo (n=1159) lub u pacjentów leczonych ezetymibem w skojarzeniu ze statyną (n=11 308), które pojawiły się z większą częstością niż u pacjentów przyjmujących jedynie statynę (n=9361). Działania niepożądane obserwowane po wprowadzeniu leku do obrotu pochodzą ze zgłoszeń dotyczących ezetymibu stosowanego w monoterapii lub w skojarzeniu ze statyną. W Tabeli 1 przedstawiono działania niepożądane obserwowane w badaniach klinicznych ezetymibu (stosowanego w monoterapii lub w skojarzeniu ze statyną) oraz działania niepożądane obserwowane po wprowadzeniu produktu leczniczego do obrotu, pochodzące ze zgłoszeń dotyczących ezetymibu stosowanego w monoterapii lub w skojarzeniu ze statyną. Działania te przedstawiono według klasyfikacji układów i narządów oraz częstości występowania.
Częstości występowania określono jako występujące: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1000), bardzo rzadko (< 1/10 000) oraz częstość nieznana (nie może być określona na podstawie dostępnych danych).
Tabela 1
Działania niepożądane
Klasyfikacja układów i narządów Częstość | Działania niepożądane |
Zaburzenia krwi i układu chłonnego | |
Nieznana | trombocytopenia |
Zaburzenia układu immunologicznego | |
Nieznana | nadwrażliwość, w tym wysypka, pokrzywka, anafilaksja i obrzęk naczynioruchowy |
Zaburzenia metabolizmu i odżywiania | |
Niezbyt często | zmniejszone łaknienie |
Zaburzenia psychiczne | |
Nieznana | depresja |
Zaburzenia układu nerwowego | |
Często | ból głowy |
Niezbyt często | parestezje |
Nieznana | zawroty głowy |
Zaburzenia naczyniowe | |
Niezbyt często | nagłe zaczerwienienie twarzy; nadciśnienie tętnicze |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | |
Niezbyt często | kaszel |
Nieznana | duszność |
Zaburzenia żołądka i jelit | |
Często | bóle brzucha; biegunka; wzdęcia z oddawaniem wiatrów |
Niezbyt często | niestrawność, choroba refluksowa przełyku; nudności; suchość w jamie ustnej; zapalenie żołądka |
Nieznana | zapalenie trzustki; zaparcia |
Zaburzenia wątroby i dróg żółciowych | |
Nieznana | zapalenie wątroby; kamica żółciowa; zapalenie pęcherzyka żółciowego |
Zaburzenia skóry i tkanki podskórnej | |
Niezbyt często | świąd, wysypka, pokrzywka |
Nieznana | rumień wielopostaciowy |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | |
Często | bóle mięśni |
Niezbyt często | bóle stawów; kurcze mięśni; bóle karku; bóle pleców; osłabienie mięśni; bóle kończyn |
Nieznana | bóle mięśni; miopatia i (lub) rabdomioliza (patrz punkt 4.4) |
Zaburzenia ogólne i stany w miejscu podania | |
Często | zmęczenie |
Niezbyt często | ból w klatce piersiowej; ból; osłabienie; obrzęki obwodowe |
Badania diagnostyczne | |
Często | zwiększenie aktywności AlAT i (lub) AspAT |
Niezbyt często | zwiększenie aktywności CPK we krwi; zwiększenie aktywności gammaglutamylotransferazy; nieprawidłowe wyniki testów czynności wątroby |
Ezetymib w skojarzeniu z fenofibratem Zaburzenia żołądka i jelit: bóle brzucha (często).
W kontrolowanym placebo klinicznym badaniu wieloośrodkowym, z podwójnie ślepą próbą, uczestniczyli pacjenci z mieszaną hiperlipidemią, spośród których 625 leczonych było przez 12 tygodni, a 576 przez 1 rok. W badaniu tym, 172 pacjentów przyjmujących ezetymib i fenofibrat ukończyło 12-tygodniowe leczenie, a 230 pacjentów przyjmujących ezetymib i fenofibrat (w tym 109 przyjmujących ezetymib w monoterapii przez pierwszych 12 tygodni) ukończyło leczenie trwające 1 rok. Celem badania nie było porównanie leczonych grup pacjentów pod względem występowania rzadkich działań niepożądanych. Wskaźnik występowania (przedział ufności 95%) klinicznie znamiennego zwiększenia aktywności aminotransferaz w surowicy (> 3 razy powyżej górnego zakresu wartości prawidłowych, podczas kolejnych oznaczeń) wynosił odpowiednio 4,5% (1,9; 8,8) dla fenofibratu stosowanego w monoterapii i 2,7% (1,2; 5,4) dla ezetymibu podawanego w skojarzeniu z fenofibratem, dostosowany do odpowiedzi na leczenie. Natomiast wskaźnik występowania przypadków wycięcia pęcherzyka żółciowego wynosił odpowiednio, dla fenofibratu stosowanego w monoterapii 0,6% (0,0; 3,1) i dla ezetymibu podawanego w skojarzeniu z fenofibratem l,7% (0,6; 4,0) (patrz punkty 4.4 i 4.5).
Dzieci i młodzież (w wieku od 6 do 17 lat)
W badaniu z udziałem dzieci i młodzieży (w wieku od 6 do 10 lat) z heterozygotyczną hipercholesterolemią rodzinną lub nierodzinną (n=138) obserwowano zwiększenie aktywności AlAT i (lub) AspAT (≥ 3 razy powyżej górnego zakresu wartości prawidłowych, podczas kolejnych oznaczeń) u 1,1% pacjentów (1 osoba) w grupie stosującej ezetymib w porównaniu do 0% pacjentów w grupie placebo. Nie odnotowano zwiększenia aktywności CPK (≥ 10 razy powyżej górnego zakresu wartości prawidłowych). Nie zgłaszano przypadków miopatii.
W osobnym badaniu z udziałem dzieci i młodzieży (w wieku od 10 do 17 lat) z heterozygotyczną hipercholesterolemią rodzinną (n=248), u 3% pacjentów (4 osoby) leczonych ezetymibem w skojarzeniu z symwastatyną obserwowano podwyższenie aktywności AlAT i (lub) AspAT (≥ 3 razy powyżej górnego zakresu wartości prawidłowych, podczas kolejnych oznaczeń) w porównaniu z 2% pacjentów (2 osoby) z grupy stosującej symwastatynę w monoterapii; podwyższenie aktywności CPK (≥10 razy powyżej górnego zakresu wartości prawidłowych) stwierdzono odpowiednio u 2% (2 pacjentów) i 0% uczestników badania. Nie zaobserwowano przypadków miopatii.
Te badania nie były dostosowane do oceny porównawczej rzadko występujących działań niepożądanych.
Pacjenci z chorobą wieńcową i ostrym zespołem wieńcowym w wywiadzie
W badaniu IMPROVE-IT (patrz punkt 5.1) z udziałem 18 144 pacjentów leczonych ezetymibem z symwastatyną w dawce 10 mg + 40 mg (n=9067, przy czym u 6% pacjentów dawkę ezetymibu i symwastatyny zwiększono do 10 mg + 80 mg) lub symwastatyną w dawce 40 mg (n=9077, przy czym u 27% pacjentów dawkę symwastatyny zwiększono do 80 mg) w okresie obserwacji, którego mediana wynosiła 6,0 lat, obserwowano zbliżone profile bezpieczeństwa. Wskaźnik przerwania leczenia z powodu działań niepożądanych wynosił 10,6% u pacjentów leczonych ezetymibem z symwastatyną oraz 10,1% u pacjentów leczonych symwastatyną. Częstość występowania miopatii w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 0,2% i 0,1%. Miopatię zdefiniowano, jako niewyjaśnione osłabienie mięśni lub ból ze zwiększoną aktywnością CK w surowicy wynoszącą ≥ 10x GGN lub dwa kolejne epizody zwiększenia aktywności CK wynoszące ≥ 5 i < 10x GGN. Częstość występowania rabdomiolizy w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 0,1% i 0,2%. Rabdomiolizę zdefiniowano jako niewyjaśnione osłabienie mięśni lub ból ze zwiększoną aktywnością CK w surowicy wynoszącą ≥ 10x GGN i objawami uszkodzenia nerek, dwa kolejne epizody zwiększenia aktywności CK wynoszącej ≥ 5 i < 10x GGN z objawami uszkodzenia nerek lub CK ≥ 10 000 j.m./l bez objawów uszkodzenia nerek. Częstość występowania kolejnych wzrostów poziomu transaminaz (≥ 3x GGN) w grupie otrzymującej ezetymib z symwastatyną oraz w grupie otrzymującej symwastatynę wynosiła odpowiednio 2,5% i 2,3%. (Patrz punkt 4.4.). Działania niepożądane ze strony pęcherzyka żółciowego zgłoszono u 3,1% pacjentów z grupy otrzymującej ezetymib z symwastatyną oraz u 3,5% pacjentów z grupy leczonej symwastatyną. Częstość hospitalizacji z powodu cholecystektomii w obu leczonych grupach wynosiła 1,5%. Nowotwór (zdefiniowany jako dowolny nowy nowotwór) zdiagnozowano podczas badania u odpowiednio 9,4% i 9,5% pacjentów.
Pacjenci z przewlekłą chorobą nerek
W badaniu SHARP (ang. Study of Heart and Renal Protection; patrz punkt 5.1) obejmującym ponad 9000 pacjentów otrzymujących codziennie produkt złożony zawierający 10 mg ezetymibu i 20 mg symwastatyny (n=4650) albo placebo (n=4620), profile bezpieczeństwa były porównywalne w okresie obserwacji o medianie 4,9 lat. W badaniu tym rejestrowano jedynie ciężkie zdarzenia niepożądane i przypadki przerywania leczenia z powodu jakichkolwiek zdarzeń niepożądanych. Wskaźniki przerywania leczenia z powodu zdarzeń niepożądanych były porównywalne (10,4% u pacjentów leczonych ezetymibem w skojarzeniu z symwastatyną, 9,8% u pacjentów otrzymujących placebo). Częstość występowania miopatii i (lub) rabdomiolizy wynosiła 0,2% u pacjentów leczonych ezetymibem w skojarzeniu z symwastatyną i 0,1% u pacjentów otrzymujących placebo. Do zwiększenia aktywności aminotransferaz (>3 x górna granica normy) doszło u 0,7% pacjentów leczonych ezetymibem w skojarzeniu z symwastatyną w porównaniu z 0,6% pacjentów otrzymujących placebo (patrz punkt 4.4). W tym badaniu nie stwierdzono istotnego statystycznie zwiększenia częstości występowania określonych wcześniej zdarzeń niepożądanych, takich jak nowotwory (9,4% w grupie ezetymibu z symwastatyną, 9,5% w grupie placebo), zapalenie wątroby, cholecystektomia lub powikłania kamicy żółciowej czy zapalenie trzustki.
Wpływ na parametry laboratoryjne
W badaniach z grupą kontrolną, w których produkt leczniczy był stosowany w monoterapii, częstość występowania klinicznie znamiennego zwiększenia aktywności aminotransferaz w surowicy (zwiększenie aktywności AlAT i (lub) AspAT 3 razy powyżej górnego zakresu wartości prawidłowych) była podobna w grupie przyjmujących ezetymib (0,5%) oraz placebo (0,3%). W badaniach, w których produkty lecznicze stosowano w skojarzeniu, częstość występowania wspomnianego uprzednio zwiększenia aktywności
aminotransferaz w surowicy wynosiła 1,3% w grupie pacjentów przyjmujących ezetymib w skojarzeniu ze statyną oraz 0,4 % w grupie pacjentów przyjmujących wyłącznie statynę. Zwiększenie aktywności enzymów przebiegało na ogół bez objawów; nie stwierdzano cech zastoju żółci. Aktywność aminotransferaz powracała do wartości początkowych po zaprzestaniu przyjmowania produktów leczniczych albo podczas dalszego ich stosowania (patrz punkt 4.4).
W badaniach klinicznych zgłaszano zwiększenie aktywności CPK przekraczające 10 razy górną granicę wartości prawidłowych u 4 spośród 1647 (0,2%) pacjentów stosujących ezetymib w monoterapii w porównaniu z l spośród 786 (0, l%) pacjentów stosujących placebo oraz u l spośród 917 (0, l%) pacjentów stosujących jednocześnie ezetymib i statynę w porównaniu z 4 spośród 929 (0,4%) pacjentów stosujących wyłącznie statynę. Nie stwierdzono większej liczby przypadków miopatii lub rabdomiolizy związanych ze stosowaniem produktu zawierającego ezetymib w porównaniu z odpowiednią grupą kontrolną (placebo lub wyłącznie statyny) (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301,
fax: +48 22 49-21-309, Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W kontrolowanych badaniach klinicznych ezetymib stosowany w monoterapii lub w skojarzeniu ze statyną znacząco zmniejszał stężenie cholesterolu całkowitego, cholesterolu LDL, apolipoproteiny B (Apo B) oraz trójglicerydów, a także zwiększał stężenie cholesterolu HDL u pacjentów z hipercholesterolemią.
Hipercholesterolemia pierwotna
W trwającym 8 tygodni badaniu klinicznym z podwójnie ślepą próbą, kontrolowanym placebo, wzięło udział 769 pacjentów z hipercholesterolemią, którzy przyjmowali statynę w monoterapii i u których nie osiągnięto docelowego stężenia cholesterolu LDL (2,6 do 4,1 mmol/l [100 do 160 mg/dl], w zależności od stężenia początkowego) wg. National Cholesterol Education Program (NCEP). Pacjentów losowo przydzielono do grup przyjmujących ezetymib w dawce 10 mg lub placebo, w skojarzeniu ze stosowaną już statyną.
Wśród pacjentów leczonych statyną, u których nie osiągnięto docelowego stężenia cholesterolu LDL (ok. 82%), znamiennie więcej pacjentów przyjmujących ezetymib uzyskało docelowe stężenie cholesterolu LDL na zakończenie okresu obserwacji niż pacjentów przydzielonych losowo do grupy placebo, odpowiednio
72 % i 19 %. Znaczne różnice obserwowano również w redukcji stężenia cholesterolu LDL (25% i 4%, odpowiednio u pacjentów przyjmujących ezetymib i placebo). Ponadto dołączenie ezetymibu do leczenia statyną znacząco zmniejszało stężenie cholesterolu całkowitego, apolipoproteiny B i trójglicerydów, a także zwiększało stężenie cholesterolu HDL, w porównaniu z grupą pacjentów otrzymujących placebo. Dołączenie ezetymibu lub placebo do trwającego leczenia statyną zmniejszało medianę stężenia białka C-reaktywnego odpowiednio o 10% lub 0%, w porównaniu z wartościami początkowymi.
W dwóch randomizowanych badaniach klinicznych z podwójnie ślepą próbą, kontrolowanych placebo, prowadzonych przez 12 tygodni u 1719 pacjentów z hipercholesterolemią pierwotną, obserwowano znaczące zmniejszenie stężenia cholesterolu całkowitego (o 13%), cholesterolu LDL (o 19%), apolipoproteiny B (o 14%) oraz trójglicerydów (o 8%), a także zwiększenie stężenia cholesterolu HDL (o 3%) po zastosowaniu ezetymibu w dawce 10 mg, w porównaniu z grupą placebo. Ponadto ezetymib nie miał wpływu na osoczowe stężenie rozpuszczalnych w tłuszczach witamin A, D i E oraz na czas protrombinowy, a także, podobnie jak inne środki zmniejszające stężenie lipidów, nie zaburzał wytwarzania hormonów sterydowych kory nadnerczy.
W wieloośrodkowym, podwójnie ślepym, kontrolowanym badaniu klinicznym (ENHANCE) 720 pacjentów z heterozygotyczną hipercholesterolemią rodzinną podzielono losowo do leczenia ezetymibem 10 mg w skojarzeniu z symwastatyną 80 mg (n=357) lub samą symwastatyną w dawce 80 mg (n=363) przez 2 lata.
Głównym celem tego badania była ocena wpływu terapii skojarzonej ezetymibem/symwastatyną na grubość kompleksu blaszki wewnętrznej i środkowej tętnicy szyjnej (intima-media thickness; IMT) w porównaniu z monoterapią symwastatyną. Znaczenie tego markera zastępczego dla zachorowalności i śmiertelności sercowo-naczyniowej wciąż nie zostało potwierdzone.
Główny punkt końcowy, zmiana średniej IMT wszystkich 6 odcinków tętnicy szyjnej, oceniana na podstawie badania USG w prezentacji B, nie różniła się istotnie (p=0,29) między dwiema ocenianymi grupami. W czasie dwuletniej obserwacji w grupie ezetymibu 10 mg w skojarzeniu z symwastatyną 80 mg grubość kompleksu blaszki wewnętrznej i środkowej zwiększyła się o 0,0111 mm zaś w grupie samej symwastatyny 80 mg o 0,0058 mm (wyjściowa średnia IMT tętnicy szyjnej wynosiła w tych grupach odpowiednio 0,68 mm i 0,69 mm).
Ezetymib w dawce 10 mg w skojarzeniu z symwastatyną 80 mg zmniejszał stężenie cholesterolu LDL, cholesterolu całkowitego, Apo B i trójglicerydów istotnie silniej niż symwastatyna 80 mg. Procentowy wzrost stężenia cholesterolu HDL był podobny w obu badanych grupach. Działania niepożądane opisywane w przypadku ezetymibu 10 mg w skojarzeniu z symwastatyną 80 mg były zgodne z dotychczas poznanym profilem bezpieczeństwa tego produktu leczniczego.
Dzieci i młodzież
W wieloośrodkowym, kontrolowanym badaniu klinicznym z podwójnie ślepą próbą, 138 pacjentów (59 chłopców i 79 dziewcząt), w wieku od 6 do 10 lat (średnia wieku 8,3 lat) z heterozygotyczną rodzinną lub nie-rodzinną hipercholesterolemią (HeFH) z początkowym stężeniem LDL-C pomiędzy 3,74 i 9,92 mmol/l przydzielono losowo do grupy otrzymującej ezetymib w dawce 10 mg lub placebo przez 12 tygodni.
W 12 tygodniu wykazano, że ezetymib w porównaniu z placebo znacząco obniżał stężenie cholesterolu całkowitego (-21% w porównaniu z 0%), LDL-C (-28% w porównaniu z -1%), Apo B (- 22% w porównaniu z -1%) i nie-HDL-C (-26% w porównaniu z 0%). W odniesieniu do stężenia trójglicerydów (TG) i HDL-C wyniki otrzymane w obu grupach leczonych były zbliżone (odpowiednio -6% w porównaniu z +8% i +2% w porównaniu z +1%).
W wieloośrodkowym badaniu z podwójnie ślepą próbą i grupą kontrolną, 142 chłopców (w skali Tannera w fazie II i powyżej) oraz 106 dziewcząt, u których wystąpiła już pierwsza miesiączka, w wieku 10 do 17 lat (średnia wieku 14,2 roku) z heterozygotyczną hipercholesterolemią rodzinną (HeFH) i stężeniem wyjściowym LDL-C pomiędzy 4,1 a 10,4 mmol/l przydzielono losowo albo do grupy przyjmującej ezetymib w dawce 10 mg w skojarzeniu z symwastatyną (10, 20 lub 40 mg), albo do grupy otrzymującej wyłącznie symwastatynę (10, 20 lub 40 mg) przez okres 6 tygodni, ezetymib podawany w skojarzeniu z symwastatyną w dawce 40 mg lub symwastatynę w monoterapii w dawce 40 mg przez okres kolejnych 27 tygodni, a następnie metodą terapii otwartej ezetymib w skojarzeniu z symwastatyną (10, 20 lub 40 mg) przez kolejne 20 tygodni.
W tygodniu 6. wykazano, że ezetymib stosowany w skojarzeniu z symwastatyną (we wszystkich dawkach) znacząco obniżał stężenie cholesterolu całkowitego (38% w porównaniu z 26%), LDL-C (49% w porównaniu z 34%), apo B (39% w porównaniu z 27%) i nie-HDL-C (47% w porównaniu z 33%) w porównaniu z symwastatyną w monoterapii (we wszystkich dawkach). W odniesieniu do stężenia trójglicerydów (TG) i HDL-C wyniki otrzymane w obu grupach leczonych były zbliżone (odpowiednio - 17% w porównaniu z -12% oraz +7% w porównaniu z +6%). W tygodniu 33. uzyskane wyniki były zgodne z otrzymanymi w tygodniu 6. i znacząco większa liczba pacjentów otrzymujących ezetymib w skojarzeniu z symwastatyną w dawce 40 mg (62%), osiągnęła idealną docelową wartość stężenia LDL-C według kryteriów NCEP AAP (< 2,8 mmol/l [110 mg/dl]) w porównaniu z pacjentami przyjmującymi wyłącznie symwastatynę w dawce 40 mg (25%). W tygodniu 53, pod koniec fazy przedłużenia badania prowadzonego metodą terapii otwartej, utrzymywały się wyniki leczenia w zakresie parametrów lipidowych.
Nie przeprowadzono oceny bezpieczeństwa i skuteczności leczenia skojarzonego ezetymibem i symwastatyną w dawkach większych niż 40 mg na dobę u dzieci i młodzieży w wieku 10 do 17 lat. Skuteczność i bezpieczeństwo stosowania ezetymibu w skojarzeniu z symwastatyną nie były badane u dzieci w wieku <10 lat. Nie przeprowadzono oceny długoterminowej skuteczności leczenia ezetymibem u pacjentów w wieku poniżej 17 lat w zakresie zmniejszenia zachorowalności i śmiertelności w wieku dojrzałym.
Zapobieganie wystąpieniu incydentów sercowo-naczyniowych
Badanie IMPROVE-IT było wieloośrodkowym, randomizowanym badaniem klinicznym, z podwójnie ślepą próbą i grupą kontrolną przyjmującą aktywny lek, przeprowadzonym z udziałem 18 144 pacjentów włączonych do badania w ciągu 10 dni od hospitalizacji z powodu wystąpienia ostrego zespołu wieńcowego
(OZW, tj. ostrego zawału mięśnia sercowego lub niestabilnej dławicy piersiowej). W czasie przyjęcia do szpitala z powodu OZW u pacjentów, którzy nie przyjmowali leczenia obniżającego poziom lipidów, stężenie cholesterolu LDL wynosiło ≤ 125 mg/dl (≤ 3,2 mmol/l), a u pacjentów, którzy przyjmowali leczenie obniżające poziom lipidów, wynosiło ≤ 100 mg/dl (≤ 2,6 mmol/l). Wszystkich pacjentów przydzielano w sposób losowy w stosunku 1:1 do grupy otrzymującej ezetymib z symwastatyną w dawce 10 mg+ 40 mg (n=9067) lub symwastatynę w dawce 40 mg (n=9077). Mediana okresu obserwacji wynosiła 6,0 lat.
Średnia wieku pacjentów wynosiła 63,6 lat. 76% pacjentów stanowili mężczyźni, 84% pacjentów było rasy białej, a 27% pacjentów chorowało na cukrzycę. Średnie stężenie cholesterolu LDL w czasie wystąpienia incydentu kwalifikującego do badania u pacjentów przyjmujących leczenie obniżające poziom lipidów (n=6390) i u tych, którzy nie przyjmowali leczenia obniżającego poziom lipidów (n=11 594) wynosiło odpowiednio 80 mg/dl (2,1 mmol/l) i 101 mg/dl (2,6 mmol/l). Przed hospitalizacją z powodu wystąpienia OZW kwalifikującego do badania 34% pacjentów przyjmowało statynę. Po upływie jednego roku średnie stężenie cholesterolu LDL u pacjentów kontynuujących leczenie wynosiło 53,2 mg/dl (1,4 mmol/l) w grupie otrzymującej ezetymib z symwastatyną i 69,9 mg/dl (1,8 mmol/l) w grupie przyjmującej symwastatynę w monoterapii. Poziom lipidów badano na ogół u pacjentów, którzy w dalszym ciągu przyjmowali badane leczenie.
Na pierwszorzędowy punkt końcowy składał się zgon z przyczyn naczyniowo-sercowych, poważne incydenty wieńcowe (zdefiniowane jako zawał mięśnia sercowego niezakończony zgonem, udokumentowana niestabilna dławica piersiowa wymagająca hospitalizacji lub jakakolwiek procedura rewaskularyzacji wieńcowej przeprowadzona przynajmniej 30 dni po losowym przydzieleniu leczenia) oraz udar mózgu niezakończony zgonem. Badanie wykazało, że leczenie ezetymibem w skojarzeniu z symwastatyną pozwalało uzyskać dodatkowe korzyści w zmniejszeniu pierwszorzędowego złożonego punktu końcowego, tj. zgonu z przyczyn sercowo-naczyniowych, poważnego incydentu wieńcowego i udaru mózgu niezakończonego zgonem, w porównaniu z samą symwastatyną (zmniejszenie ryzyka względnego o 6,4%, p=0,016). Pierwszorzędowy punkt końcowy wystąpił u 2572 z 9067 pacjentów (7-letni wskaźnik Kaplana-Meiera [KM] wynosił 32,72%) w grupie przyjmującej ezetymib z symwastatyną oraz u 2742 z 9077 pacjentów (7-letni wskaźnik KM wynosił 34,67%) w grupie otrzymującej samą symwastatynę (patrz Rycina 1 i Tabela 1.). Oczekuje się, że w przypadku jednoczesnego podawania innych statyn o udowodnionej skuteczności w zmniejszeniu ryzyka incydentów sercowo-naczyniowych korzyści te będą zbliżone.
Całkowita liczba zgonów w tej grupie podwyższonego ryzyka nie uległa zmianie (patrz Tabela 2).
Stwierdzono ogólną korzyść w przypadku wszystkich udarów mózgu; jakkolwiek odnotowano niewielkie, nieistotne zwiększenie liczby udarów krwotocznych w grupie ezetymib-symwastatyna w porównaniu do grupy pacjentów otrzymujących samą symwastatynę (patrz Tabela 2). Ryzyko udaru krwotocznego w przypadku jednoczesnego podawania ezetymibu w skojarzeniu ze statyną o silniejszym działaniu nie zostało ocenione w długoterminowych badaniach.
Efekt leczenia ezetymibem z symwastatyną był na ogół spójny z efektami uzyskiwanymi w szeregu podgrup, tj. zależnie od płci, wieku, rasy, cukrzycy w wywiadzie, wyjściowego poziomu lipidów, wcześniejszego leczenia statyną, przebytego udaru mózgu i nadciśnienia.
Rycina 1: Wpływ leczenia skojarzonego ezetymibem z symwastatyną na pierwszorzędowy złożony punkt końcowy, tj. zgon z przyczyn sercowo-naczyniowych, poważny incydent wieńcowy lub udar mózgu niezakończony zgonem
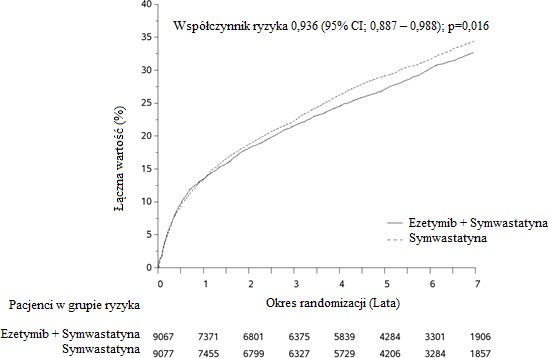
Tabela 2
Poważne incydenty sercowo-naczyniowe u wszystkich przydzielanych w sposób losowy pacjentów w badaniu IMPROVE-IT z podziałem na grupy leczenia
Wynik | Ezetymib + Symwastatyna a 10 + 40 mg (n=9067) | Symwastatyna b 40 mg (n=9077) | Współczynnik ryzyka (95% CI) | Wartość p | ||
n | K-M % c | n | K-M % c | |||
Pierwszorzędowy złożony punkt końcowy skuteczności | ||||||
(zgon z przyczyn sercowo- naczyniowych, poważny incydent wieńcowy i udar mózgu niezakończony zgonem) | 2572 | 32,72% | 2742 | 34,67% | 0,936 (0,887, 0,988) | 0,016 |
Drugorzędowe złożone punkty końcowe skuteczności | ||||||
Zgon związany z chorobą wieńcową, zawał mięśnia sercowego niezakończony zgonem, rewaskularyzacja wieńcowa w trybie pilnym po 30 dniach | 1322 | 17,52% | 1448 | 18,88% | 0,912 (0,847, 0,983) | 0,016 |
Poważny incydent wieńcowy, udar mózgu niezakończony zgonem, zgon (z dowolnej przyczyny) | 3089 | 38,65% | 3246 | 40,25% | 0,948 (0,903, 0,996) | 0,035 |
Zgon z przyczyn sercowo- naczyniowych, zawał mięśnia sercowego | 2716 | 34,49% | 2869 | 36,20% | 0,945 (0,897, 0,996) | 0,035 |
niezakończony zgonem, niestabilna dławica piersiowa wymagająca hospitalizacji, jakakolwiek procedura rewaskularyzacji, udar mózgu niezakończony zgonem | ||||||
Składowe pierwszorzędowego złożonego punktu końcowego skuteczności i wybrane punkty końcowe skuteczności (pierwsze wystąpienie określonego zdarzenia w dowolnym momencie) | ||||||
Zgon z przyczyn sercowo- naczyniowych | 537 | 6,89% | 538 | 6,84% | 1,000 (0,887, 1,127) | 0,997 |
Poważny incydent wieńcowy: | ||||||
zawał mięśnia sercowego niezakończony zgonem | 945 | 12,77% | 1083 | 14,41% | 0,871 (0,798, 0,950) | 0,002 |
niestabilna dławica piersiowa wymagająca hospitalizacji | 156 | 2,06% | 148 | 1,92% | 1,059 (0,846, 1,326) | 0,618 |
rewaskularyzacja wieńcowa po 30 dniach | 1690 | 21,84% | 1793 | 23,36% | 0,947 (0,886, 1,012) | 0,107 |
Udar mózgu niezakończony zgonem | 245 | 3,49% | 305 | 4,24% | 0,802 (0,678, 0,949) | 0,010 |
Wszystkie przypadki zawału mięśnia sercowego (zakończone i niezakończone zgonem) | 977 | 13,13% | 1118 | 14,82% | 0,872 (0,800, 0,950) | 0,002 |
Wszystkie przypadki udaru (zakończone i niezakończone zgonem) | 296 | 4,16% | 345 | 4,77% | 0,857 (0,734, 1,001) | 0,052 |
d Udar niekrwotoczny | 242 | 3,48% | 305 | 4,23% | 0,793 (0,670, 0,939) | 0,007 |
Udar krwotoczny | 59 | 0,77% | 43 | 0,59% | 1,377 (0,930, 2,040) | 0,110 |
Zgon z dowolnej przyczyny | 1215 | 15,36% | 1231 | 15,28% | 0,989 (0,914, 1,070) | 0,782 |
a
u 6% pacjentów dawkę ezetymibu + symwastatyny zwiększono do 10 + 80 mg.
b
u 27% pacjentów dawkę symwastatyny zwiększono do 80 mg.
c
estymator Kaplana-Meiera po 7 latach.
d
w tym udar niedokrwienny mózgu lub udar niekreślonego rodzaju.
Zapobieganie poważnym zdarzeniom naczyniowym w przewlekłej chorobie nerek
Badanie Study of Heart and Renal Protection (SHARP) było to międzynarodowe, randomizowane, kontrolowane placebo, podwójnie ślepe badanie kliniczne obejmujące 9438 pacjentów z przewlekłą chorobą nerek, z których 1/3 od początku badania była leczona dializami. W sumie 4650 zostało przydzielonych do grupy leczonej produktem złożonym, zawierającym 10 mg ezetymibu i 20 mg symwastatyny, a 4620 pacjentów do grupy otrzymującej placebo. Pacjentów obserwowano przez okres czasu o medianie 4,9 lat.
Średni wiek pacjentów wynosił 62 lata, 63% badanych stanowili mężczyźni, 72% były to osoby rasy białej, 23% chorzy na cukrzycę. U pacjentów, którzy nie byli dializowani średni szacowany współczynnik przesączania kłębuszkowego (ang. estimated glomerular filtration rate; eGFR) wynosił 26,5 ml/min/1,73 m2.
Nie było ustalonych lipidowych kryteriów włączenia. Średnie wyjściowe stężenie cholesterolu LDL wynosiło 108 mg/dl. Po roku, uwzględniając pacjentów, którzy przerwali przyjmowanie badanego produktu leczniczego, stężenie cholesterolu LDL zmniejszyło się o 26% względem placebo przy stosowaniu samej symwastatyny w dawce 20 mg i o 38% przy stosowaniu ezetymibu w dawce 10 mg w skojarzeniu z symwastatyną w dawce 20 mg.
Głównym porównaniem określonym w protokole badania SHARP była analiza „poważnych zdarzeń naczyniowych” (ang. major vascular event; MVE) (zdefiniowanych jako niezakończony zgonem zawał mięśnia sercowego, zgon sercowy, udar mózgu lub zabieg rewaskularyzacji) w populacji wyodrębnionej zgodnie z zamiarem leczenia, wyłącznie u pacjentów randomizowanych początkowo do grupy terapii skojarzonej ezetymibem i symwastatyną (n=4193) lub do grupy placebo (n=4191). Analizy dodatkowe obejmowały ten sam złożony punkt końcowy analizowany dla całej kohorty randomizowanej (na początku badania lub po roku) do terapii skojarzonej ezetymibem i symwastatyną (n=4650) lub placebo (n=4620) oraz poszczególne elementy tego złożonego punktu końcowego.
Analiza głównego punktu końcowego wykazała, że ezetymib w skojarzeniu z symwastatyną istotnie zmniejszał ryzyko poważnych zdarzeń naczyniowych (749 pacjentów z takimi zdarzeniami w grupie placebo w porównaniu z 639 pacjentami w grupie terapii skojarzonej ezetymibem i symwastatyną), z redukcją ryzyka względnego 16% (p=0,001).
Konstrukcja badania nie pozwoliła jednak na określenie udziału samego ezetymibu w skuteczności zmniejszania ryzyka poważnych zdarzeń naczyniowych u pacjentów z przewlekłą chorobą nerek.
Poszczególne elementy MVE u wszystkich pacjentów objętych randomizacją przedstawiono w tabeli 3. Ezetymib w skojarzeniu z symwastatyną w istotny sposób zmniejszał ryzyko udaru mózgu i konieczności rewaskularyzacji, przy nieistotnych liczbowych różnicach na korzyść terapii skojarzonej ezetymibem i symwastatyną dla niezakończonego zgonem zawału mięśnia sercowego i zgonu sercowego.
Tabela 3
Poważne zdarzenia naczyniowe z rozdziałem na poszczególne grupy badania u wszystkich pacjentów objętych randomizacją w badaniu SHARPa
Punkt końcowy | Ezetymib 10 mg w skojarzeniu z symwastatyną 20 mg (N=4650) | Placebo (N=4620) | Współczynnik ryzyka (95% CI) | Wartość P |
Poważne zdarzenia naczyniowe | 701 (15,1%) | 814 (17,6%) | 0,85 (0,77-0,94) | 0,001 |
Zawał mięśnia sercowego niezakończony zgonem | 134 (2,9%) | 159 (3,4%) | 0,84 (0,66-1,05) | 0,12 |
Zgon sercowy | 253 (5,4%) | 272 (5,9%) | 0,93 (0,78-1,10) | 0,38 |
Udar mózgu | 171 (3,7%) | 210 (4,5%) | 0,81 (0,66-0,99) | 0,038 |
Udar niekrwotoczny | 131 (2,8%) | 174 (3,8%) | 0,75 (0,60-0,94) | 0,011 |
Udar krwotoczny | 45 (1,0%) | 37 (0,8%) | 1,21 (0,78-1,86) | 0,4 |
Zabieg rewaskularyzacji | 284 (6,1%) | 352 (7,6%) | 0,79 (0,68-0,93) | 0,004 |
Poważne zdarzenie na tle miażdżycyb | 526 (11,3%) | 619 (13,4%) | 0,83 (0,74-0,94) | 0,002 |
a Analiza w populacji wyodrębnionej zgodnie z zamiarem leczenia obejmująca wszystkich pacjentów z badania SHARP randomizowanych do grupy otrzymującej ezetymib w skojarzeniu z symwastatyną lub do grupy otrzymującej placebo, czy to na początku badania, czy po roku.
b Poważne zdarzenia na tle miażdżycy; zdefiniowane jako złożony punkt końcowy obejmujący niezakończony zgonem zawał mięśnia sercowego, zgon wieńcowy, niekrwotoczny udar mózgu lub zabieg rewaskularyzacji.
Bezwzględne zmniejszenie stężenia cholesterolu LDL uzyskane podczas stosowania ezetymibu w skojarzeniu z symwastatyną było mniejsze u pacjentów z mniejszym wyjściowym stężeniem cholesterolu LDL (<2,5 mmol/l) i u pacjentów dializowanych w momencie rozpoczynania badania w porównaniu z pozostałymi pacjentami, a redukcje ryzyka w tych 2 grupach były odpowiednio mniejsze.
Homozygotyczna hipercholesterolemia rodzinna
W randomizowanym badaniu klinicznym z podwójnie ślepą próbą, trwającym 12 tygodni, wzięło udział 50 pacjentów z rozpoznaną klinicznie i (lub) na podstawie badań genetycznych homozygotyczną hipercholesterolemią rodzinną, przyjmujących atorwastatynę lub symwastatynę (w dawce 40 mg) w monoterapii lub w skojarzeniu z aferezą LDL lub bez. Jednoczesne stosowanie ezetymibu z atorwastatyną (w dawce 40 lub 80 mg) lub symwastatyną (w dawce 40 lub 80 mg) powodowało znaczące zmniejszenie stężenia cholesterolu LDL (o 15%), w porównaniu z przyjmowaniem zwiększonych dawek atorwastatyny lub symwastatyny (z 40 mg do 80 mg) w monoterapii.
Homozygotyczna sitosterolemia (phytosterolemia)
W badaniu kontrolowanym placebo, z podwójnie ślepą próbą i randomizacją, trwającym 8 tygodni wzięło udział 37 pacjentów z sitosterolemią homozygotyczną. Przydzielono ich losowo do grup przyjmujących ezetymib w dawce 10 mg (n=30) lub placebo (n=7). Niektórzy pacjenci przyjmowali także inne leki (np. statyny, żywice). Ezetymib istotnie zmniejszał stężenia dwóch najważniejszych steroli roślinnych, sitosterolu i kampesterolu, odpowiednio o 21% i o 24% od wartości wyjściowych. Nie jest znany wpływ zmniejszenia stężenia sitosterolu na zachorowalność i śmiertelność w tej populacji.
Zwężenie zastawki aorty
Badanie Simvastatin and Ezetimibe for the Treatment of Aortic Stenosis (SEAS) było wieloośrodkowym, podwójnie ślepym, kontrolowanym placebo badaniem klinicznym, z medianą czasu trwania 4,4 lat i udziałem 1873 pacjentów z bezobjawowym zwężeniem zastawki aortalnej (ang. aortic stenosis; AS), udokumentowanym poprzez maksymalną prędkość przepływu w badaniu dopplerowskim między 2,5 a 4,0 m/s. Do badania włączono wyłącznie tych pacjentów, którzy nie wymagali leczenia statyną w celu zmniejszenia ryzyka choroby sercowo-naczyniowej na tle miażdżycy. Pacjentów przydzielano losowo w stosunku 1:1 do grupy otrzymującej placebo lub ezetymib w dawce 10 mg w skojarzeniu z symwastatyną w dawce 40 mg na dobę.
Pierwszorzędowym punktem końcowym badania był złożony punkt obejmujący poważne zdarzenia
sercowo-naczyniowe (ang. major cardiovascular event; MCE), takie jak zgon sercowo-naczyniowy, operacja wymiany zastawki aortalnej (ang. aortic valve replacement; AVR), zastoinowa niewydolność serca (ang. congestive heart failure; CHF) na skutek progresji stenozy zastawki aortalnej (ang. aortic stenosis; AS), zawał mięśnia sercowego niezakończony zgonem, operacja pomostowania tętnic wieńcowych (ang. coronary artery bypass grafting; CABG), przezskórna interwencja wieńcowa (ang. percutaneous coronary inrervention; PCI), hospitalizacja z powodu niestabilnej dławicy piersiowej oraz niekrwotoczny udar mózgu. Najważniejsze drugorzędowe punkty końcowe obejmowały zestawienia podzbiorów określonych kategorii zdarzeń z pierworzędowego punktu końcowego.
W porównaniu z placebo leczenie skojarzone ezetymibem z symwastatyną w dawce 10/40 mg nie powodowało istotnego zmniejszenia ryzyka MCE. Główny punkt końcowy wystąpił u 333 pacjentów (35,3%) w grupie ezetymibu/symwastatyny i u 355 pacjentów (38,2%) w grupie placebo (współczynnik ryzyka w grupie ezetymibu/symwastatyny 0,96; 95% przedział ufności 0,83 do 1,12; p=0,59). Operację wymiany zastawki aortalnej przeprowadzono u 267 pacjentów (28,3%) w grupie ezetymibu/symwastatyny i u 278 pacjentów (29,9%) w grupie placebo (współczynnik ryzyka 1,00; 95% przedział ufności 0,84 do 1,18; p=0,97). Niedokrwienne zdarzenia sercowo-naczyniowe wystąpiły u mniejszej liczby pacjentów z grupy ezetymibu/symwastatyny (n=148) niż z grupy placebo (n=187) (współczynnik ryzyka 0,78; 95% przedział ufności 0,63 do 0,97; p=0,02), głównie z powodu mniejszej liczby pacjentów poddanych operacji pomostowania tętnic wieńcowych.
Nowotwory występowały częściej w grupie ezetymibu/symwastatyny (105 w porównaniu z 70, p=0,01). Kliniczne znaczenie tej obserwacji nie jest pewne, gdyż w większym badaniu SHARP całkowite liczby pacjentów z nowo rozpoznanym nowotworem (438 w grupie ezetymibu/symwastatyny w porównaniu z 439 w grupie placebo) nie różniły się. Ponadto w badaniu IMPROVE-IT całkowita liczba pacjentów z nowo zdiagnozowanym nowotworem złośliwym (853 w grupie ezetymib/symwastatyna w stosunku do 863 w grupie otrzymującej tylko symwastatynę) nie różniła się znacząco, a zatem wyniki uzyskane w badaniu SEAS nie zostały potwierdzone przez badanie SHARP lub IMPROVE-IT.
Dzieci i młodzież
Farmakokinetyka ezetymibu jest podobna u dzieci w wieku 6 lat i powyżej i u dorosłych. Brak danych dotyczących farmakokinetyki produktu leczniczego u dzieci w wieku poniżej 6 lat. Doświadczenie kliniczne obejmuje dzieci i młodzież z homozygotyczną hipercholesterolemią rodzinną i heterozygotyczną hipercholesterolemią rodzinną.
Osoby w podeszłym wieku
Stężenie całkowitego ezetymibu w osoczu było około dwukrotnie większe u pacjentów w podeszłym wieku (≥ 65 lat), niż u młodszych osób (od 18 do 45 lat). Zmniejszenie stężenia cholesterolu LDL oraz profil bezpieczeństwa były porównywalne po zastosowaniu ezetymibu w obu grupach. W związku z tym nie ma konieczności modyfikacji dawkowania u pacjentów w podeszłym wieku.
Zaburzenia czynności wątroby
Po podaniu ezetymibu w pojedynczej dawce 10 mg u pacjentów z łagodnymi zaburzeniami czynności wątroby (5 lub 6 punktów wg skali Child-Pugh), stwierdzono około 1,7- krotne zwiększenie średniej wartości pola pod krzywą (AUC) dla całkowitego ezetymibu, w porównaniu ze zdrowymi osobami. W 14- dniowym badaniu, w którym podawano dawki wielokrotne produktu leczniczego (10 mg na dobę) u pacjentów z umiarkowanymi zaburzeniami czynności wątroby (od 7 do 9 punktów wg skali Child-Pugh), średnia wartość AUC dla ezetymibu całkowitego zwiększyła się około 4-krotnie między pierwszym, a czternastym dniem badania, w porównaniu ze zdrowymi osobami. U pacjentów z łagodnymi zaburzeniami czynności wątroby nie jest konieczne dostosowanie dawkowania. Ze względu na brak danych dotyczących wpływu zwiększonej ekspozycji na ezetymib u pacjentów z umiarkowanymi lub ciężkimi (>9 punktów wg skali Child-Pugh) zaburzeniami czynności wątroby, nie zaleca się stosowania ezetymibu w tej grupie pacjentów (patrz punkt 4.4).
Zaburzenia czynności nerek
Po podaniu ezetymibu w pojedynczej dawce 10 mg u pacjentów z ciężkimi zaburzeniami czynności nerek (n=8, średni klirens kreatyniny ≤30 ml/min./1,73 m2), średnia wartość AUC dla ezetymibu całkowitego zwiększyła się około 1,5-krotnie w porównaniu ze zdrowymi osobami (n=9). Różnice te nie są istotne klinicznie i nie ma konieczności dostosowania dawkowania u pacjentów z zaburzeniami czynności nerek.
U jednego pacjenta biorącego udział w tym badaniu (poddanego przeszczepieniu nerki i przyjmującego wiele produktów leczniczych, w tym cyklosporynę) stwierdzono 12-krotne zwiększenie ekspozycji na całkowity ezetymib.
Płeć
Stężenie całkowitego ezetymibu w osoczu jest nieco większe (o około 20%) u kobiet, niż u mężczyzn. Zmniejszenie stężenia cholesterolu LDL i profil bezpieczeństwa produktu leczniczego były porównywalne u kobiet i u mężczyzn leczonych ezetymibem. Nie ma zatem potrzeby dostosowania dawkowania w zależności od płci pacjenta.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Laktoza jednowodna Sodu laurylosiarczan Kroskarmeloza sodowa Powidon (K-30) Magnezu stearynian
Niezgodności farmaceutyczne
Nie dotyczy.
Okres ważności
2 lata
Okres ważności po pierwszym otwarciu butelki: 200 dni.
Specjalne środki ostrożności podczas przechowywania
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. Tylko w przypadku butelki: Zużyć w ciągu 200 dni od pierwszego otwarcia.
Rodzaj i zawartość opakowania
Blistry PCV/Aclar/Aluminium, w tekturowym pudełku Wielkość opakowań: 14, 28, 30, 50, 90, 98 lub 100 tabletek
Butelki z HDPE z wieczkiem z polipropylenu zabezpieczającym przed dostępem dzieci i z wkładką
uszczelniającą, w tekturowym pudełku. Wielkość opakowań: 100 tabletek
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Bez specjalnych wymagań.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO
OBROTU
Orion Corporation Orionintie 1
02200 Espoo Finlandia
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
23570
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 28.11.2016 r.
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
PRODUKTU LECZNICZEGO
03.05.2021











