Spis treści:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Łagodne zaburzenia czynności wątroby (A wg skali Child-Pugh) – zalecana dawka to 7,5 mg na dobę.
Umiarkowane zaburzenia czynności wątroby (B wg skali Child-Pugh) – zalecana
dawka to 5 mg na dobę.
Ciężkie zaburzenia czynności wątroby (C wg skali Child-Pugh) – stosowanie ewerolimusu jest zalecane tylko wtedy, kiedy pożądane korzyści z leczenia przewyższają ryzyko. W takiej sytuacji nie należy przekraczać dawki 2,5 mg na dobę.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
Everolimus Teva, 2,5 mg, tabletki
Everolimus Teva, 5 mg, tabletki Everolimus Teva, 7,5 mg, tabletki Everolimus Teva, 10 mg, tabletki
Każda tabletka zawiera 2,5 mg ewerolimusu. Każda tabletka zawiera 5 mg ewerolimusu. Każda tabletka zawiera 7,5 mg ewerolimusu. Każda tabletka zawiera 10 mg ewerolimusu.
Substancja pomocnicza o znanym działaniu: Każda tabletka zawiera 74 mg laktozy.
Każda tabletka zawiera 149 mg laktozy.
Każda tabletka zawiera 223 mg laktozy. Każda tabletka zawiera 297 mg laktozy.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Everolimus Teva, 2,5 mg, to białe, podłużne, płaskie ze skośnymi krawędziami tabletki, o długości okolo 10 mm i szerokości około 4 mm, z wytłoczonym napisem “EV” na jednej stronie i “2,5”
na drugiej.
Everolimus Teva, 5 mg, to białe, podłużne, płaskie, ze skośnymi krawędziami tabletki, o długości około 12 mm i szerokości około 5 mm, z wytłoczonym napisem “EV” na jednej stronie i „5” na drugiej.
Everolimus Teva, 7,5 mg, to białe, podłużne, płaskie, ze skośnymi krawędziami tabletki, o długości około 14 mm i szerokości około 5,5 mm, z wytłoczonym napisem “EV” na jednej stronie i „7,5” na drugiej.
Everolimus Teva, 10 mg, to białe, podłużne, płaskie, ze skośnymi krawędziami tabletki, o długości około 15 mm i szerokości około 6 mm, z wytłoczonym napisem “EV” z jednej strony i „10” z drugiej strony.
Zaawansowany rak piersi z ekspresją receptorów hormonalnych
Produkt leczniczy Everolimus Teva jest wskazany w leczeniu zaawansowanego raka piersi z ekspresją receptorów hormonalnych, bez nadekspresji HER2/neu, w skojarzeniu z eksemestanem
u kobiet po menopauzie bez objawowego zajęcia narządów wewnętrznych, po wystąpieniu wznowy lub progresji po leczeniu niesteroidowym inhibitorem aromatazy.
Nowotwory neuroendokrynne układu pokarmowego lub płuc
Everolimus Teva jest wskazany w leczeniu nieoperacyjnych lub z przerzutami, wysoko zróżnicowanych (stopień G1 lub G2), hormonalnie nieczynnych nowotworów neuroendokrynnych układu pokarmowego lub płuc u dorosłych pacjentów z chorobą o przebiegu postępującym (patrz punkt 4.4 i 5.1).
Rak nerkowokomórkowy
Everolimus Teva jest wskazany w leczeniu pacjentów z zaawansowanym rakiem nerkowokomórkowym,
u których postęp choroby nastąpił w trakcie lub po przebytej terapii anty-VEGF (czynnik wzrostu śródbłonka naczyniowego).
Leczenie produktem leczniczym Everolimus Teva powinno być rozpoczęte i nadzorowane przez lekarza doświadczonego w stosowaniu leków przeciwnowotworowych.
Dawkowanie
W celu umożliwienia odpowiedniego dawkowania, Everolimus Teva jest dostępny w postaci tabletek w dawkach 2.5 mg, 5 mg, 7.5 mg i 10 mg.
Zalecana dawka ewerolimusu wynosi 10 mg raz na dobę. Leczenie należy kontynuować tak długo, jak długo obserwuje się korzyści kliniczne lub do wystąpienia objawów niemożliwej do zaakceptowania toksyczności.
W przypadku pominięcia dawki, nie należy przyjmować dodatkowej dawki, ale przyjąć kolejną dawkę o zwykłej porze.
Dostosowanie dawkowania ze względu na działania niepożądane
W przypadku wystąpienia poważnych i (lub) niemożliwych do zaakceptowania działań niepożądanych, może wystąpić konieczność zmniejszenia dawkowania i (lub) tymczasowego przerwania leczenia produktem leczniczym Everolimus Teva. Dostosowanie dawki zazwyczaj nie jest wymagane w przypadku działań niepożądanych 1. stopnia. Jeżeli konieczne jest zmniejszenie dawki, zalecana dawka to 5 mg na dobę i nie może być mniejsza niż 5 mg na dobę.
W Tabeli 1 zestawiono zalecenia dotyczące dostosowania dawki w przypadku różnych działań niepożądanych (patrz także punkt 4.4).
Tabela 1 Zalecenia dotyczące dostosowania dawki produktu leczniczego Everolimus Teva
Działanie niepożądane | Nasilenie1 | Zalecenia dotyczące dostosowania dawki produktu leczniczego Everolimus Teva |
Nieinfekcyjne zapalenie płuc | 2. stopień | Rozważyć przerwanie leczenia, aż do czasu złagodzenia objawów do ≤1 stopnia. Wznowić leczenie w dawce 5 mg. Zakończyć leczenie, jeśli poprawa nie nastąpi w ciągu 4 tygodni. |
3. stopień | Przerwać leczenie do czasu złagodzenia objawów do ≤1 stopnia. Rozważyć wznowienie leczenia w dawce 5 mg. Jeśli toksyczność 3. stopnia wystąpi ponownie, należy rozważyć zakończenie leczenia. | |
4. stopień | Zakończyć leczenie. | |
Zapalenie jamy ustnej | 2. stopień | Okresowo przerwać podawanie leku aż do czasu złagodzenia objawów do 1 stopnia. Wznowić leczenie w tej samej dawce. W przypadku nawrotu zapalenia jamy ustnej 2. stopnia przerwać podawanie produktu leczniczego, aż do czasu złagodzenia objawów do 1 stopnia. Wznowić leczenie w dawce 5 mg. |
3. stopień | Okresowo przerwać podawanie produktu leczniczego, aż do złagodzenia objawów do 1 stopnia. Wznowić leczenie w dawce 5 mg. | |
4. stopień | Zakończyć leczenie. | |
Inne niehematologicz ne objawy toksyczności (z wyjątkiem zaburzeń metabolicznyc h) | 2. stopień | Jeśli objawy toksyczności są tolerowane, nie ma konieczności dostosowania dawki. Jeśli objawy toksyczności nie są tolerowane, należy okresowo przerwać leczenie, aż do czasu złagodzenia objawów do 1 stopnia. Wznowić leczenie w tej samej dawce. Jeśli objawy toksyczności 2. stopnia wystąpią ponownie, należy przerwać leczenie, aż do czasu złagodzenia objawów do 1 stopnia. Wznowić leczenie w dawce 5 mg. |
3. stopień | Okresowo przerwać leczenie, aż do czasu złagodzenia objawów do 1 stopnia. Rozważyć wznowienie leczenia w dawce 5 mg. Jeśli toksyczność 3. stopnia wystąpi ponownie, należy rozważyć zakończenie leczenia. | |
4. stopień | Zakończyć leczenie. | |
Zaburzenia metaboliczne (np. hiperglikemia dyslipidemia) | 2. stopień | Brak konieczności dostosowania dawki. |
3. stopień | Okresowo przerwać leczenie. Wznowić leczenie w dawce 5 mg. | |
4. stopień | Zakończyć leczenie. | |
Trombocytopenia | 2. stopień (<75, ≥50x109/l) | Okresowo przerwać leczenie, aż do czasu złagodzenia objawów do 1 stopnia (≥75x109/l). Wznowić leczenie w tej samej dawce. |
3. i 4. stopień (<50x109/l) | Okresowo przerwać leczenie, aż do złagodzenia objawów do 1 stopnia (≥75x109/l). Wznowić leczenie w dawce 5 mg. | |
Neutropenia | 2. stopień (≥1x109/l) | Brak konieczności dostosowania dawki. |
3. stopień (<1, ≥0,5x109/l) | Okresowo przerwać leczenie, aż do czasu złagodzenia objawów do 2 stopnia (≥1x109/l). Wznowić leczenie w tej samej dawce. |
4. stopień (<0,5x109/l) | Okresowo przerwać leczenie, aż do czasu złagodzenia objawów do 2 stopnia (≥1x109/l). Wznowić leczenie w dawce 5 mg. | |
Gorączka neutropenicz na | 3. stopień | Okresowo przerwać leczenie, aż do czasu złagodzenia objawów do 2 stopnia (≥1,25x109/l) i ustąpienia gorączki. Wznowić leczenie w dawce 5 mg. |
4. stopień | Zakończyć leczenie. | |
1 Stopniowanie nasilenia objawów według National Cancer Institute (NCI) Common Terminology Criteria for Adverse Events (CTCAE) wersja 3.0 | ||
Szczególne grupy pacjentów
Osoby w podeszłym wieku (≥65 lat)
Dostosowanie dawkowania nie jest konieczne (patrz punkt 5.2).
Pacjenci z zaburzeniami czynności nerek
Dostosowanie dawkowania nie jest konieczne (patrz punkt 5.2).
Pacjenci z zaburzeniami czynności wątroby
Jeśli w trakcie leczenia stan wątroby pacjenta (wg skali Child-Pugh) ulegnie zmianie, dawkowanie należy dostosować (patrz także punkty 4.4 i 5.2).
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Everolimus Teva u dzieci w wieku 0 do 18 lat. Dane nie są dostępne.
Sposób podawania
Everolimus Teva powinien być podawany doustnie, raz na dobę o tej samej porze, z posiłkiem lub bez (patrz punkt 5.2). Everolimus Teva w postaci tabletek należy połykać w całości popijając szklanką wody. Tabletek nie należy żuć ani rozgryzać.
Nadwrażliwość na substancję czynną, na inne pochodne rapamycyny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Nieinfekcyjne zapalenie płuc
Nieinfekcyjne zapalenie płuc jest efektem klasowym pochodnych rapamycyny, w tym ewerolimusu. Przypadki wystąpienia nieinfekcyjnego zapalenia płuc (m.in. śródmiąższowego zapalenia płuc) były często zgłaszane u pacjentów przyjmujących ewerolimus (patrz punkt 4.8). Niektóre przypadki były niekiedy ciężkie, a w rzadkich przypadkach, choroba prowadziła do śmierci. Rozpoznanie nieinfekcyjnego zapalenia płuc należy rozważyć u pacjentów z niespecyficznymi objawami przedmiotowymi i podmiotowymi ze strony układu oddechowego, takimi jak niedotlenienie, wysięk do opłucnej, kaszel lub duszność oraz u pacjentów, u których
wykluczono, za pomocą odpowiednich metod diagnostycznych, zakaźne, nowotworowe lub niemedyczne przyczyny występujących objawów. W diagnostyce różnicowej nieinfekcyjnego zapalenia płuc należy wykluczyć zakażenia oportunistyczne, takie jak pneumocystozowe zapalenie płuc wywołane przez Pneumocystis jiroveci (carinii) (PJP, PCP) (patrz punkt
„Zakażenia” poniżej). Pacjentów należy poinformować o konieczności natychmiastowego zgłaszania nowych lub pogorszeniu istniejących objawów ze strony układu oddechowego.
Jeżeli u pacjentów wystąpią zmiany w obrazie radiologicznym sugerujące nieinfekcyjne zapalenie płuc, a jednocześnie występują nieliczne objawy kliniczne lub objawy nie występują, podawanie produktu leczniczego Everolimus Teva można kontynuować bez konieczności zmiany dawkowania.
W przypadku wystąpienia objawów o umiarkowanym nasileniu (2. stopnia) lub ciężkim nasileniu
(3. stopnia) wskazane może być podawanie kortykosteroidów, aż do momentu ustąpienia objawów klinicznych.
U pacjentów, u których konieczne jest podanie kortykosteroidów w leczeniu nieinfekcyjnego zapalenia płuc należy rozważyć profilaktykę pneumocystozowego zapalenia płuc (PJP, PCP).
Zakażenia
Ewerolimus ma właściwości immunosupresyjne i może zwiększać podatność pacjentów na zakażenia bakteryjne, grzybicze, wirusowe lub pierwotniakowe, w tym zakażenia patogenami oportunistycznymi (patrz punkt 4.8). U pacjentów przyjmujących ewerolimus występowały zakażenia miejscowe
i ogólnoustrojowe, w tym zapalenie płuc, inne zakażenia bakteryjne, inwazyjne zakażenia grzybicze, takie jak aspergiloza, kandydoza lub pneumocystozowe zapalenie płuc wywołane przez Pneumocystis jirovecii (carinii) (PJP. PCP) i zakażenia wirusowe, w tym reaktywacja wirusowego zapalenia wątroby typu B. Niektóre z wyżej wymienionych zakażeń charakteryzował ciężki przebieg (np. wystąpienie posocznicy, niewydolności oddechowej lub niewydolności wątroby), a część z nich prowadziła do śmierci.
Lekarze i pacjenci powinni być świadomi zwiększonego ryzyka wystąpienia zakażenia w trakcie leczenia produktem leczniczym Everolimus Teva. Przed rozpoczęciem podawania produktu leczniczego Everolimus Teva należy całkowicie wyleczyć wszystkie istniejące zakażenia.
Podczas podawania produktu leczniczego Everolimus Teva, należy uważnie obserwować, czy nie pojawiają się podmiotowe i przedmiotowe objawy zakażenia: jeśli rozpoznano zakażenie, należy natychmiast rozpocząć właściwe leczenie i rozważyć przerwanie lub zaprzestanie podawania produktu leczniczego Everolimus Teva.
Jeżeli rozwinie się inwazyjne zakażenie grzybicze, należy natychmiast przerwać na stałe podawanie produktu leczniczego Everolimus Teva, a pacjentowi podać odpowiednie leki przeciwgrzybicze.
U pacjentów otrzymujących ewerolimus zgłaszano przypadki pneumocystozowego zapalenia płuc wywołanego przez Pneumocystis jirovecii (carinii) (PJP, PCP), z których część zakończyła się zgonem pacjenta. Występowanie PJP/PCP może być związane z jednoczesnym stosowaniem kortykosteroidów lub innych leków immunosupresyjnych. Należy rozważyć profilaktykę PJP, PCP u pacjentów wymagających jednoczesnego stosowania kortykosteroidów lub innych leków immunosupresyjnych.
Reakcje nadwrażliwości
U pacjentów stosujących ewerolimus obserwowano reakcje nadwrażliwości, obejmujące m. in. anafilaksję, duszność, nagłe zaczerwienienie zwłaszcza twarzy, ból w klatce piersiowej lub obrzęk naczynioruchowy (np. obrzęk dróg oddechowych lub języka z zaburzeniami oddychania
lub bez tych zaburzeń) (patrz punkt 4.3).
Jednoczesne stosowanie inhibitorów konwertazy angiotensyny (ACE)
U pacjentów leczonych jednocześnie inhibitorem ACE (np. ramiprylem) może wystąpić zwiększone ryzyko obrzęku naczynioruchowego (np. obrzęk dróg oddechowych lub języka z zaburzeniami układu oddechowego lub bez zaburzeń) (patrz punkt 4.5).
Owrzodzenie jamy ustnej
Zapalenie jamy ustnej, w tym owrzodzenia jamy ustnej i zapalenie błony śluzowej jamy ustnej jest najczęściej zgłaszanym działaniem niepożądanym obserwowanym u pacjentów leczonych ewerolimusem (patrz punkt 4.8). Zapalenie jamy ustnej występuje głównie w ciągu pierwszych 8 tygodni leczenia. Wyniki badania z jedną grupą terapeutyczną z udziałem pacjentek po menopauzie z rakiem piersi leczonych ewerolimusem w skojarzeniu z eksemestanem sugerowały, że stosowanie bezalkoholowego doustnego roztworu kortykosteroidu podawanego jako płyn do płukania jamy ustnej w pierwszych 8 tygodniach leczenia może zmniejszyć częstość występowania i nasilenie zapalenia jamy ustnej (patrz punkt 5.1). Postępowanie w zapaleniu jamy ustnej może zatem obejmować profilaktyczne i (lub) terapeutyczne stosowanie terapii miejscowych, takich jak bezalkoholowy doustny roztwór kortykosteroidu w postaci płynu do płukania jamy ustnej. Należy jednak unikać stosowania produktów zawierających alkohol, nadtlenek wodoru, jod i wyciągi z tymianku, ponieważ mogą one zaostrzać objawy. Zaleca się monitorowanie pod kątem zakażenia grzybiczego i jego leczenia, zwłaszcza u pacjentów otrzymujących leki na bazie steroidów. Nie należy stosować leków przeciwgrzybiczych, jeżeli nie zdiagnozowano zakażenia grzybiczego (patrz punkt 4.5).
Przypadki niewydolności nerek
U pacjentów leczonych ewerolimusem obserwowano przypadki niewydolności nerek (w tym ostrą niewydolność nerek), niektóre ze skutkiem śmiertelnym (patrz punkt 4.8). Należy kontrolować czynność nerek szczególnie u pacjentów, u których występują inne czynniki ryzyka, które dodatkowo mogą zaburzać czynność nerek.
Badania laboratoryjne
Czynność nerek
Zgłaszano zwiększone stężenie kreatyniny w surowicy, najczęściej niewielkie, i białkomocz (patrz punkt 4.8). Zaleca się, aby przed rozpoczęciem podawania produktu leczniczego Everolimus Teva oraz okresowo w trakcie leczenia kontrolować czynność nerek, w tym stężenie azotu mocznikowego we krwi (BUN), stężenie białka w moczu i stężenie kreatyniny w surowicy.
Stężenie glukozy we krwi
Obserwowano przypadki hiperglikemii (patrz punkt 4.8). Zaleca się, aby przed rozpoczęciem podawania produktu leczniczego Everolimus Teva oraz okresowo w trakcie leczenia kontrolować stężenie glukozy w surowicy na czczo. Częstsze kontrolowanie zaleca się, kiedy produkt leczniczy Everolimus Teva jest podawany jednocześnie z innymi produktami leczniczymi, które mogą spowodować hiperglikemię. Jeśli jest to możliwe, należy dążyć do uzyskania optymalnej kontroli glikemii przed rozpoczęciem podawania produktu leczniczego Everolimus Teva.
Stężenie lipidów we krwi
U pacjentów przyjmujących produkt leczniczy Everolimus Teva obserwowano przypadki dyslipidemii (w tym hipercholesterolemii i hipertriglicerydemii). Zaleca się, aby przed rozpoczęciem podawania produktu leczniczego Everolimus Teva oraz okresowo w trakcie leczenia, kontrolować stężenie cholesterolu i triglicerydów we krwi, a także zastosować odpowiednie leczenie.
Parametry hematologiczne
Zgłaszano zmniejszone stężenia hemoglobiny i liczby limfocytów, neutrofilii i płytek krwi
(patrz punkt 4.8). Zaleca się, aby przed rozpoczęciem podawania produktu leczniczego Everolimus Teva oraz okresowo w trakcie leczenia kontrolować wyniki morfologii krwi.
Hormonalnie czynne rakowiaki
W randomizowanym, podwójnie zaślepionym, wieloośrodkowym badaniu z udziałem pacjentów
z hormonalnie czynnymi rakowiakami, ewerolimus w skojarzeniu z długo działającym oktreotydem porównywano z placebo w skojarzeniu z długo działającym oktreotydem. W badaniu nie uzyskano pierwszorzędowego punktu końcowego skuteczności (PFS, ang. progression free survival),
a pośrednia analiza (OS, ang. overall survival) wykazała liczbową przewagę na korzyść grupy otrzymującej placebo w skojarzeniu z długo działającym oktreotydem. Z tego względu, bezpieczeństwo stosowania i skuteczność ewerolimusu u pacjentów z hormonalnie czynnymi rakowiakami nie zostały ustalone.
Czynniki prognostyczne w nowotworach neuroendokrynnych układu pokarmowego lub płuc U pacjentów z hormonalnie nieczynnymi nowotworami neuroendokrynnymi układu pokarmowego lub płuc i dobrymi wyjściowymi czynnikami prognostycznymi, np. guzem pierwotnym umiejscowionym
w jelicie krętym i prawidłowymi wartościami chromograniny A lub bez zajęcia kości, należy dokonać indywidualnej oceny korzyści względem ryzyka przed rozpoczęciem leczenia produktem leczniczym Everolimus Teva. Odnotowano ograniczone dowody korzyści w zakresie PFS w podgrupie chorych
na nowotwory neuroendokrynne wywodzące się z jelita krętego (patrz punkt 5.1).
Interakcje
Należy unikać jednoczesnego podawania inhibitorów i induktorów CYP3A4 i (lub) wielolekowej pompy glikoproteiny P (PgP) z produktem leczniczym Everolimus Teva. Jeśli nie można uniknąć jednoczesnego podawania umiarkowanych inhibitorów lub induktorów CYP3A4 i (lub) PgP, należy rozważyć dostosowanie dawki produktu leczniczego Everolimus Teva w oparciu o przewidywane AUC (patrz punkt 4.5).
Jednoczesne podawanie z silnymi inhibitorami CYP3A4 skutkuje dramatycznym zwiększeniem stężenia ewerolimusu w osoczu (patrz punkt 4.5). Obecnie nie ma wystarczających danych pozwalających na dostosowanie dawkowania w takiej sytuacji. Dlatego jednoczesne podawanie produktu leczniczego Everolimus Teva i silnych inhibitorów nie jest zalecane.
Należy zachować ostrożność stosując produkt leczniczy Everolimus Teva w skojarzeniu z doustnymi substratami CYP3A4 o wąskim indeksie terapeutycznym z uwagi na możliwość wystąpienia interakcji. Jeśli produkt leczniczy Everolimus Teva jest podawany z doustnymi substratami CYP3A4 o wąskim indeksie terapeutycznym (np. pimozydem, terfenadyną, astemizolem, cisaprydem, chinidyną lub pochodnymi alkaloidów sporyszu), pacjenta należy monitorować w kierunku działań niepożądanych opisanych w drukach informacyjnych doustnych substratów CYP3A4 (patrz punkt 4.5).
Zaburzenia czynności wątroby
Ekspozycja na ewerolimus była zwiększona u pacjentów z łagodnymi (A wg skali Child-Pugh), umiarkowanymi (B wg skali Child-Pugh) i ciężkimi (C wg skali Child-Pugh) zaburzeniami czynności wątroby (patrz punkt 5.2).
Stosowanie produktu Everolimus Teva jest zalecane wyłącznie u pacjentów z ciężkim zaburzeniem czynności wątroby (C wg skali Child-Pugh), jeśli potencjalna korzyść z leczenia przewyższa ryzyko (patrz punkty 4.2 i 5.2).
Aktualnie brak dostępnych danych dotyczących bezpieczeństwa lub skuteczności klinicznej potwierdzających zalecenia dotyczące dostosowania dawkowania w przypadku działań niepożądanych u pacjentów z zaburzeniami czynności wątroby.
Szczepienia
Należy unikać podawania żywych szczepionek w trakcie leczenia produktem leczniczym Everolimus Teva (patrz punkt 4.5).
Komplikacje związane z gojeniem się ran
Utrudnione gojenie się ran to efekt klasowy pochodnych rapamycyny, w tym ewerolimusu.
Należy zachować ostrożność podczas przyjmowania produktu leczniczego Everolimus Teva w okresie okołooperacyjnym.
Powikłania radioterapii
Po zastosowaniu ewerolimusu w trakcie lub krótko po zakończeniu radioterapii zgłaszano poważne i ciężkie reakcje popromienne (takie jak popromienne zapalenie przełyku, popromienne zapalenie płuc i popromienne uszkodzenia skóry), w tym przypadki śmiertelne. Dlatego u pacjentów stosujących ewerolimus należy zachować ostrożność w przypadku nasilenia toksyczności w ścisłym związku czasowym z radioterapią.
Ponadto, u pacjentów leczonych ewerolimusem, którzy byli w przeszłości poddawani radioterapii, zgłaszano zespół popromienny (RRS, ang. radiation recall syndrome). W przypadku wystąpienia RRS należy rozważyć przerwanie lub zaprzestanie leczenia ewerolimusem.
Substancje pomocnicze
Laktoza
Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
Ewerolimus jest substratem CYP3A4. Jest również substratem i umiarkowanym inhibitorem PgP. Tym samym, substancje, które działają na CYP3A4 i (lub) PgP wpływają na wchłanianie
i wydalanie ewerolimusu. W warunkach in vitro ewerolimus jest kompetencyjnym inhibitorem CYP3A4 oraz mieszanym inhibitorem CYP2D6.
W Tabeli 2 poniżej przedstawiono zarówno znane, jak i teoretycznie możliwe interakcje z wybranymi inhibitorami i induktorami CYP3A4 i PgP.
Inhibitory CYP3A4 i PgP zwiększające stężenie ewerolimusu
Substancje będące inhibitorami CYP3A4 lub PgP mogą zwiększać stężenie ewerolimusu we krwi poprzez spowolnienie jego metabolizmu lub przenikanie ewerolimusu z komórek jelita.
Induktory CYP3A4 i PgP zmniejszające stężenie ewerolimusu
Substancje będące induktorami CYP3A4 i PgP mogą zmniejszać stężenie ewerolimusu we krwi poprzez przyspieszenie jego metabolizmu lub nasilenie przenikania ewerolimusu z komórek jelita.
Tabela 2 Wpływ innych substancji czynnych na ewerolimus
Substancja czynna i rodzaj interakcji | Interakcja – Zmiana AUC/Cmax Ewerolimusu Stosunek średnich geometrycznych (obserwowany zakres) | Zalecenia dotyczące leczenia skojarzonego |
Silne inhibitory CYP3A4/PgP | ||
Ketokonazol | AUC ↑15,3- | Jednoczesne podawanie |
krotnie (zakres | everolimusu i silnych inhibitorów | |
11,2-22,5) Cmax | nie jest zalecane. | |
↑4,1-krotnie | ||
(zakres 2,6-7,0) | ||
Itrakonazol, | Nie badano. Należy | |
posakonazol, | spodziewać się dużego | |
worykonazol | zwiększenia stężenia | |
ewerolimusu. | ||
Telitromycyna, | ||
klarytromycyna | ||
Nefazodon | ||
Rytonawir, | ||
atazanawir, | ||
sakwinawir, | ||
darunawir, | ||
indinawir, nelfinawir | ||
Umiarkowane inhibitory CYP3A4/PgP | ||
Erytromycyna | AUC ↑4,4- | Należy zachować ostrożność, |
krotnie (zakres | kiedy nie można uniknąć | |
2,0-12,6) | jednoczesnego podawania | |
Cmax ↑2,0-krotnie (zakres | umiarkowanych inhibitorów | |
0,9-3,5) | CYP3A4 lub PgP. | |
U pacjentów wymagających | ||
jednoczesnego podania | ||
umiarkowanego inhibitora | ||
CYP3A4 lub PgP, należy | ||
rozważyć zmniejszenie dawki do | ||
5 mg na dobę lub 2,5 mg na dobę. | ||
Nie ma danych klinicznych dotyczących takiego | ||
Imatynib | AUC ↑ 3.7-krotnie Cmax ↑ 2.2-krotnie | |
dostosowania dawkowania. W | ||
związku z różnicami pomiędzy pacjentami, zalecane dostosowanie dawkowania może nie być optymalne dla wszystkich pacjentów, dlatego też zaleca się | ||
Werapamil | AUC ↑3,5-krotnie (zakres 2,2-6,3) Cmax ↑2,3-krotnie (zakres 1,3-3.8) | |
ścisłą obserwację działań | ||
Cyklosporyna, doustnie | AUC ↑2,7-krotnie (zakres 1,5-4,7) Cmax ↑1,8-krotnie (zakres 1,3-2,6) | niepożądanych. W przypadku odstawienia umiarkowanego inhibitora CYP3A4 należy wziąć pod uwagę okres wypłukiwania leku z organizmu, trwający co najmniej 2 do 3 dni (przeciętny czas eliminacji większości najczęściej stosowanych umiarkowanych inhibitorów CYP3A4) przed przywróceniem dawki ewerolimusu, stosowanej przed rozpoczęciem leczenia. |
Flukonazol | Nie badano. Przewidywany wzrost AUC. | |
Diltiazem | ||
Dronedaron | Nie badano. Przewidywany wzrost AUC. | |
Amprenawir, fosamprenawir | Nie badano. Przewidywany wzrost AUC. | |
Sok grejpfrutowy lub inne pokarmy wpływające na CYP3A4/PgP | Nie badano. Przewidywany wzrost AUC (znaczne zróżnicowanie wpływu). | Należy unikać jednoczesnego leczenia. |
Silne i umiarkowane induktory CYP3A4/PgP | ||
Ryfampicyna | AUC ↓63% (zakres 0-80%) Cmax ↓58% (zakres 10-70%) | Należy unikać jednoczesnego podawania z silnymi induktorami CYP3A4. Jeśli u pacjenta konieczne jest podanie ewerolimusu z silnym induktorem CYP3A4 należy rozważyć zwiększenie dawki ewerolimusu z 10 mg/dobę nawet do 20 mg/dobę, etapami co 5 mg lub mniej, podawanej w |
Deksametazon | Nie badano. Przewidywane zmniejszenie AUC. | |
Karbamazepina, fenobarbital, fenytoina | Nie badano. Przewidywane zmniejszenie AUC. | |
Efawirenz, newirapina | Nie badano. Przewidywane zmniejszenie AUC. | 4 i 8 dniu następującej po podaniu induktora. Przewiduje się, że taka dawka ewerolimusu spowoduje modyfikację AUC do zakresu wielkości obserwowanych bez podawania induktorów CYP3A4. Brak jest jednak danych klinicznych dotyczących takiej modyfikacji dawkowania. W razie przerwania leczenia induktorem CYP3A4 należy wziąć pod uwagę okres wypłukiwania leku z organizmu, trwający co najmniej 3 do 5 dni (uzasadniony czas odwrócenia indukcji enzymów) przed przywróceniem dawki ewerolimusu do wielkości sprzed skojarzonego leczenia. |
Dziurawiec (Hypericum Perforatum) | Nie badano. Przewidywane duże zmniejszenie stężenia ewerolimusu. | Podczas leczenia ewerolimusem nie należy stosować preparatów zawierających dziurawiec. |
Leki, których stężenie w osoczu może ulec zmianie pod wpływem ewerolimusu
Na podstawie badań in vitro stężenia ogólnoustrojowe uzyskane po podaniu doustnych dawek w wysokości 10 mg na dobę nie powinny spowodować zahamowania aktywności PgP, CYP3A4 i CYP2D6. Nie można jednak wykluczyć zahamowania CYP3A4 i PgP w jelicie. Badanie interakcji u osób zdrowych wykazało, że jednoczesne podanie doustnej dawki midazolamu, przykładowego wrażliwegeo substratu CYP3A, z ewerolimusem spowodowało 25% wzrost wartości Cmax midazolamu i 30% wzrost AUC(0-inf) midazolamu. Efekt ten jest
prawdopodobnie wynikiem zahamowania CYP3A4 w jelicie przez ewerolimus. Dlatego ewerolimus może wpływać na dostępność biologiczną jednocześnie stosowanych doustnych substratów CYP3A4. Nie należy się jednak spodziewać wystąpienia klinicznie istotnego wpływu na ekspozycję na substraty CYP3A4 podawane ogólnoustrojowo (patrz punkt 4.4).
Jednoczesne podawanie ewerolimusu i długo działającego oktreotydu zwiększyło Cmin oktreotydu, przy stosunku średniej geometrycznej (ewerolimus/placebo) wynoszącej 1,47. Nie udało się ustalić, czy ma to istotny klinicznie wpływ na skuteczność odpowiedzi na leczenie ewerolimusem pacjentów z zaawansowanymi nowotworami neuroendokrynnymi.
Jednoczesne podawanie ewerolimusu i eksemestanu spowodowało zwiększenie Cmin i C2h eksemestanu odpowiednio o 45% i 64%. Jednak odpowiednie stężenia estradiolu w stanie stacjonarnym (4 tygodnie) nie różniły się w obu grupach leczenia. U pacjentek z zaawansowanym rakiem piersi z ekspresją receptorów hormonalnych, otrzymujacych to leczenie skojarzone nie obserwowano częściej reakcji niepożądanych związanych z podawaniem eksemestanu. Jest mało prawdopodobne, by zwiększenie stężeń eksemestanu miało wpływ na skuteczność lub bezpieczeństwo stosowania leku.
Jednoczesne stosowanie inhibitorów konwertazy angiotensyny (ACE)
U pacjentów leczonych jednocześnie inhibitorem ACE (np. ramiprylem) może wystąpić zwiększone ryzyko obrzęku naczynioruchowego (patrz punkt 4.4).
Szczepienia
W trakcie leczenia produktem leczniczym Everolimus Teva odpowiedź immunologiczna na szczepienie może być zmieniona i dlatego szczepionka może być mniej skuteczna. Należy unikać stosowania żywych szczepionek w czasie podawania produktu leczniczego Everolimus Teva (patrz punkt 4.4). Przykłady żywych szczepionek to: donosowa szczepionka przeciw grypie, szczepionki przeciw odrze, nagminnemu zapaleniu przyusznic, różyczce, doustna szczepionka przeciw polio, BCG (Bacillus Calmette-Guérin, szczepionka przeciw gruźlicy), przeciw żółtej febrze, ospie wietrznej i szczepionki przeciw durowi brzusznemu TY21.
Powikłania radioterapii
U pacjentów otrzymujących ewerolimus zgłaszano nasilenie toksyczności radioterapii (patrz punkty 4.4 i 4.8).
Kobiety w wieku rozrodczym/Antykoncepcja u mężczyzn i kobiet
Kobiety w wieku rozrodczym w trakcie przyjmowania ewerolimusu i w okresie do 8 tygodni po zakończeniu leczenia muszą stosować wysoce skuteczną antykoncepcję (np. doustną, iniekcyjną, lub implantowaną niezawierającą estrogenów hormonalną metodę kontroli narodzin, antykoncepcję opartą na progesteronie, histerektomię, podwiązanie jajowodów, całkowitą abstynencję, metody
barierowe, wkładkę wewnątrzmaciczną i (lub) sterylizację kobiet /mężczyzn). W przypadku mężczyzn nie ma przeciwwskazań do poczęcia dziecka w trakcie leczenia ewerolimusem.
Ciąża
Nie ma wystarczających danych na temat stosowania ewerolimusu u kobiet w ciąży. Badania na zwierzętach wykazały toksyczny wpływ na reprodukcję, w tym działanie toksyczne na zarodek i płód (patrz punkt 5.3). Potencjalne zagrożenie dla człowieka nie jest znane.
Nie zaleca się podawania ewerolimusu kobietom w ciąży i kobietom w okresie rozrodczym, które nie stosują antykoncepcji.
Karmienie piersią
Brak danych na temat przenikania ewerolimusu do mlekaludzkiego.. U samic szczurów ewerolimus i (lub) jego metabolity z łatwością przenikają do mleka (patrz punkt 5.3). Z tego względu kobiety przyjmujące ewerolimus nie powinny karmić piersią podczas leczenia i przez 2 tygodnie po przyjęciu ostatniej dawki.
Płodność
Nie wiadomo, czy ewerolimus powoduje niepłodność u mężczyzn i kobiet, jednak u pacjentek obserwowano brak miesiączki (wtórny brak miesiączki i inne zaburzenia menstruacyjne) i związane
z tym zaburzenia równowagi hormonu luteinizującego (LH)/hormonu folikulotropowego (FSH). Na podstawie obserwacji nieklinicznych stwierdza się możliwość upośledzenia płodności mężczyzn
i kobiet w trakcie podawania ewerolimusu (patrz punkt 5.3).
Everolimus wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Pacjentów należy poinformować, że powinni zachować ostrożność podczas prowadzenia pojazdów i obsługi maszyn, jeśli w trakcie leczenia produktem Everolimus Teva będą odczuwać zmęczenie.
Podsumowanie profilu bezpieczeństwa
Profil bezpieczeństwa jest oparty o dane zgromadzone od 2 879 pacjentów biorących udział w jedenastu badaniach klinicznych z zastosowaniem ewerolimusu, w skład których wchodziło sześć randomizowanych, z podwójnie zaślepioną próbą, kontrolowanych placebo badań III fazy oraz pięć otwartych badań I fazy i II fazy w ramach zatwierdzonych wskazań.
Najczęstszymi działaniami niepożądanymi (występującymi ≥1/10) zgromadzonymi z danych dotyczących bezpieczeństwa stosowania są (w malejącej kolejności): zapalenie jamy ustnej, wysypka, zmęczenie, biegunka, zakażenia, mdłości, zmniejszenie apetytu, niedokrwistość, zaburzenie smaku, zapalenie płuc, obrzęk obwodowy, hiperglikemia, osłabienie, świąd, zmniejszenie wagi ciała, hipercholesterolemia, krwawienie z nosa, kaszel i ból głowy.
Najczęstsze działania niepożądane stopnia 3-4 (częstość występowania ≥1/100 do <1/10) to zapalenie jamy ustnej, niedokrwistość, hiperglikemia, zakażenia, zmęczenie, biegunka, zapalenie płuc, osłabienie, małopłytkowość, neutropenia, duszność, białkomocz, limfopenia, krwotoki, hipofosfatemia, wysypka, nadciśnienie, zapalenie płuc, zwiększenie aktywności aminotransferazy alaninowej (ALT), zwiększenie aktywności aminotransferazy asparaginianowej (AST) i cukrzyca. Nasilenie działań niepożądanych stopniowano wg CTCAE, wersja 3.0 i 4.03.
Tabelaryczny spis działań niepożądanych
W Tabeli 3 przedstawiono częstość występowania działań niepożądanych na podstawie zbiorczych danych w łącznej populacji ocenianej pod względem bezpieczeństwa. Działania niepożądane zostały przedstawione zgodnie z klasyfikacją układów i narządów MedDRA oraz klasyfikacją częstości. Kategorie częstości określone są zgodnie z następującą konwencją: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do
<1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000); nieznana (nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Tabela 3 Działanie niepożądane zgłoszone w badaniach klinicznych
Zakażenia i zarażenia pasożytnicze | |
Bardzo | Zakażeniaa, * |
Zaburzenia krwi i układu chłonnego | |
Bardzo | Niedokrwistość |
Często | Małopłytkowość, neutropenia, leukopenia, limfopenia |
Niezbyt | Pancytopenia |
Rzadko | Wybiórcza aplazja czerwonokrwinkowa |
Zaburzenia układu immunologicznego | |
Niezbyt | Nadwrażliwość |
Zaburzenia metabolizmu i odżywiania | |
Bardzo | Zmniejszenie apetytu, hiperglikemia, hypercholesterolemia |
Często | Hipertriglicerydemia, hipofosfatemia, cukrzyca, hiperlipidemia, hipokaliemia, odwodnienie, hipokalcemia |
Zaburzenia psychiczne | |
Często | Bezsenność |
Zaburzenia układu nerwowego | |
Bardzo | Zaburzenia smaku, ból głowy |
Niezbyt | Brak smaku |
Zaburzenia oka | |
Często | Obrzęk powiek |
Niezbyt | Zapalenie spojówek |
Zaburzenia serca | |
Niezbyt | Zastoinowa niewydolność serca |
Zaburzenia naczyniowe | |
Często | Krwotok b, nadciśnienie, |
Niezbyt | Nagłe zaczerwienie zwłaszcza twarzy, zakrzepica żył głębokich |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | |
Bardzo | Zapalenie płuc c, krwawienie z nosa, kaszel |
Często | Duszność |
Niezbyt | Krwioplucie, zatorowość płucna |
Rzadko | Zespół ostrej niewydolności oddechowej |
Zaburzenia żołądka i jelit | |
Bardzo | Zapalenie jamy ustnej d, biegunka, mdłości |
Często | Wymioty, suchość jamy ustnej, ból brzucha, zapalenie błon śluzowych, ból jamy usnej, niestrawność, utrudnienia połykania |
Zaburzenia wątroby i dróg żółciowych | |
Często | Zwiększona aktywność aminotransferazy asparaginianowej, zwiększona aktywność aminotransferazy alaninowej |
Zaburzenia skóry i tkanki podskórnej | |
Bardzo | Wysypka, świąd |
Często | Suchość skóry, zmiany w obrębie paznokci, łysienie o łagodnym nasileniu, trądzik, rumień, łamliwość paznokci, zespół ręka-stopa, złuszczanie skóry, |
Rzadko | Obrzęk naczynioruchowy* |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | |
Często | Ból stawów |
Zaburzenia nerek i dróg moczowych | |
Często | Białkomocz*, zwiększenie stężenia kreatyniny we krwi, niewydolność nerek* |
Niezbyt | Zwiększona częstość oddawania moczu w ciągu dnia, ostra niewydolność nerek* |
Zaburzenia układu rozrodczego i piersi | |
Często | Nieregularne miesiączkowanie e |
Niezbyt | Brak miesiączki e* |
Zaburzenia ogólne i stany w miejscu podania | |
Bardzo | Zmęczenie, osłabienie, obrzęk obwodowy |
Często | Gorączka |
Niezbyt | Ból w klatce piersiowej nie pochodzenia sercowego, utrudnione gojenie się ran |
Badania diagnostyczne | |
Bardzo | Zmniejszenie masy ciała |
Urazy, zatrucie i powikłania po zabiegach | |
Częstość nieznana | Zespół przypominający radioterapię, nasilenie reakcji popromiennejf |
* Patrz także podpunkt „Opis wybranych działań niepożądanych”
a W tym wszystkie działania uwzględnione w klasyfikacji “zakażenia i zarażenia pasożytnicze”, w tym (często) zapalenie płuc, zakażenie układu moczowego; (niezbyt często) zapalenie oskrzeli, półpasiec, posocznica, ropnie i pojedyncze przypadki zakażeń oportunistycznych [np.
aspergiloza, kandydoza, pneumocystozowe zapalenie płuc wywołane przez Pneumocystis jirovecii (carinii) (PJP, PCP) i zapalenie wątroby typu B (patrz także punkt 4.4)] oraz (rzadko) wirusowe zapalenie mięśnia sercowego
b W tym inne krwawienia z różnych miejsc niewymienione osobno
c W tym (bardzo często) zapalenie płuc,(często) śródmiąższowe zapalenie płuc, nacieki w płucach i (rzadko) krwotok do pęcherzyków płucnych, reakcje toksyczne ze strony płuc, zapalenie pęcherzyków płucnych
d W tym (bardzo często) zapalenie jamy ustnej, (często) aftowe zapalenie jamy ustnej, owrzodzenie jamy ustnej i języka i (niezbyt często) ból języka, zapalenie języka
e Częstość w oparciu o liczbę kobiet w wieku od 10 do 55 lat w danych zbiorczych
f Działanie niepożądane zidentyfikowane po wprowadzeniu produktu do obrotu
g
Opis wybranych działań niepożądanych
W badaniach klinicznych oraz na podstawie zgłoszeń spontanicznych po wprowadzeniu produktu leczniczego do obrotu, podawanie ewerolimusu wiązano z ciężkimi przypadkami reaktywacji wirusowego zapalenia wątroby typu B, włącznie z przypadkami prowadzącymi do zgonu. Reaktywacja zakażenia jest spodziewanym działaniem w okresie występowania immunosupresji.
W badaniach klinicznych oraz na podstawie zgłoszeń spontanicznych po wprowadzeniu produktu leczniczego do obrotu, stwierdzono związek ewerolimusu z przypadkami niewydolności nerek (włącznie z przypadkami prowadzącymi do śmierci) i białkomoczem. Zaleca się kontrolowanie czynności nerek (patrz punkt 4.4).
W badaniach klinicznych i na podstawie zgłoszeń spontanicznych zebranych po wprowadzeniu produktu leczniczego do obrotu, podawanie ewerolimusu wiązano z przypadkami braku miesiączki (wtórnego braku miesiączki i innych zaburzeń menstruacyjnych).
W badaniach klinicznych i spontanicznych doniesieniach po wprowadzeniu produktu leczniczego do obrotu stwierdzono związek ewerolimusu z przypadkami pneumocystozowego zapalenia płuc wywołanego przez Pneumocystis jirovecii (carinii) (PJP, PCP), z których część zakończyła się zgonem pacjenta (patrz punkt 4.4).
W badaniach klinicznych i spontanicznych doniesieniach po wprowadzeniu produktu leczniczego
do obrotu zgłaszano występowanie obrzęku naczynioruchowego, wraz z jednoczesnym stosowaniem inhibitorów ACE i bez (patrz punkt 4.4).
Osoby w podeszłym wieku
W łączonej populacji, ocenianej pod względem bezpieczeństwa, 37% pacjentów leczonych
ewerolimusem było w wieku ≥65 lat. Liczba pacjentów, u których wystąpiły działania niepożądane prowadzące do zakończenia leczenia była wyższa w grupie pacjentów w wieku
≥65 lat (20% vs. 13%). Najczęstszymi działaniami niepożądanymi prowadzącymi do zakończenia leczenia były: zapalenie płuc (w tym choroba śródmiąższowa płuc), zapalenie jamy ustnej, uczucie zmęczenia
i duszność.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu ważne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309,e-mail: ndl@urpl.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dane na temat przedawkowania u ludzi są bardzo ograniczone. Po podaniu pojedynczej dawki do 70 mg obserwowano akceptowalną tolerancję. W każdym przypadku przedawkowania należy stosować ogólne środki wspomagające.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Grupa farmakoterapeutyczna: Leki przeciwnowotworowe, inne leki przeciwnowotworowe, inhibitory kinaz białkowych, kod ATC: L01EG02
Mechanizm działania
Ewerolimus jest selektywnym inhibitorem mTOR (mammalian target of rapamycin). mTOR jest kluczową kinazą serynowo-treoninową, której aktywność jest nasilona w wielu ludzkich nowotworach. Ewerolimus wiąże się z międzykomórkowym białkiem FKBP-12, tworząc kompleks,
który hamuje działanie kompleksu 1 kinazy mTOR (mTORC1). Zahamowanie szlaku przekazywania sygnałów mTORC1 zaburza translację i syntezę białek, hamując działanie rybosomalnej kinazy S6 (S6K1) oraz 4EBP1 (białka wiążącego eukariotyczny czynnik elongacyjny 4E), które regulują aktywność białek uczestniczących w cyklu komórkowym, angiogenezie i glikolizie. Uważa się,
że substrat S6K1 fosforyluje domenę aktywacyjną 1 receptora estrogenowego, odpowiedzialną za aktywację receptora niezależną od ligandu. Ewerolimus zmniejsza stężenie czynnika wzrostu śródbłonka naczyniowego (VEGF), nasilającego procesy angiogenezy guza. Ewerolimus jest silnym inhibitorem wzrostu i namnażania komórek guza, komórek śródbłonka, fibroblastów i komórek mięśni gładkich naczyń krwionośnych. Wykazano również, że ewerolimus hamuje glikolizę guzów litych
in vitro i in vivo.
Skuteczność kliniczna i bezpieczeństwo stosowania
Zaawansowany rak piersi z ekspresją receptorów hormonalnych
BOLERO-2 (badanie CRAD001Y2301) było randomizowanym, z podwójnie ślepą próbą, wieloośrodkowym badaniem III fazy z zastosowaniem ewerolimus w skojarzeniu z eksemestanem
w porównaniu do placebo w skojarzeniu z eksemestanem, w którym uczestniczyły kobiety po menopauzie z zaawansowanym rakiem piersi z ekspresją receptorów estrogenowych, bez nadekspresjii receptora HER2/neu, u których wystąpiła wznowa lub progresja choroby po wcześniejszym leczeniu letrozolem lub anastrozolem. Randomizacja była stratyfikowana względem udokumentowanej wrażliwości na wcześniej stosowaną terapię hormonalną oraz obecności przerzutów w narządach wewnętrznych. Wrażliwość na wcześniej stosowaną terapię hormonalną definiowano jako (1) udokumentowaną korzyść kliniczną (odpowiedź całkowita [CR], odpowiedź częściowa [PR], stabilizacja choroby ≥24 tygodnie) w trakcie stosowania co najmniej jednej terapii hormonalnej w chorobie zaawansowanej lub (2) co najmniej 24 miesiące hormonalnej terapii uzupełniającej przed wystąpieniem wznowy.
Pierwszorzędowym punktem końcowym badania było przeżycie bez progresji choroby (progression – free survival, PFS) oceniane wg kryteriów RECIST (Kryteria Odpowiedzi na Leczenie w Guzach Litych) na podstawie oceny badacza (badanie radiologiczne oceniane lokalnie). Dodatkowe analizy PFS prowadzono w oparciu o niezależną centralną ocenę radiologiczną.
Do drugorzędowych punktów końcowych należało przeżycie całkowite (OS), wskaźnik obiektywnej odpowiedzi na leczenie, wskaźnik korzyści klinicznej, bezpieczeństwo, zmiana jakości życia (QoL) oraz czas do pogorszenia stanu sprawnościowego wg ECOG (Eastern Cooperative Oncology Group).
Łącznie 724 pacjentki zostały zrandomizowane w stosunku 2:1 do grupy leczenia skojarzonego przyjmującej ewerolimus (10 mg na dobę) + eksemestan (25 mg na dobę) (n=485) lub do grupy przyjmującej placebo + eksemestan (25 mg na dobę) (n=239). W momencie przeprowadzania ostatecznej analizy OS, mediana czasu trwania leczenia ewerolimusem wyniosła 24,0 tygodnie (zakres 1,0–199,1 tygodni). Mediana czasu trwania leczenia eksemestanem była dłuższa w grupie przyjmującej ewerolimus + eksemestan i wyniosła 29,5 tygodni (1,0-199,1) w porównaniu
do 14,1 tygodni (1,0-156,0) w grupie przyjmującej placebo + eksemestan.
W odniesieniu do pierwszorzędowych punktów końcowych wyniki dotyczące skuteczności otrzymano po przeprowadzeniu ostatecznej analizy PFS (patrz Tabela 4 i Rycina 1). W chwili progresji pacjentki z grupy otrzymującej placebo + eksemestan nie przechodziły do grupy przyjmującej ewerolimus.
Tabela 4 Wyniki dotyczące skuteczności w badaniu BOLERO-2
Analiza
Ewerolimusa n=485
Placeboa n=239
Współczynnik ryzyka
Wartość p
Mediana przeżycia bez progresji choroby (miesiące) (95% CI)
Lokalna ocena radiologiczna
7,8
3,2
0,45
<0,0001
(6,9 do 8,5)
(2,8 do 4,1)
(0,38 do 0,54)
Niezależna ocena radiologiczna
11
4,1
0,38
<0,0001
(9,7 do 15,0)
(2,9 do 5,6)
(0,31 do 0,48)
Mediana całkowitego przeżycia (miesiące) (95% CI)
Mediana całkowitego
przeżycia
31
26,6
0,89
0,1426
(28,0 – 34,6)
(22,6 – 33,1)
(0,73 – 1,10)
Najlepsza odpowiedź całkowita (%) (95% CI)
Wskaźnik
12,6%
1,7%
odpowiedzi obiektywnejb
(9,8 do
15,9)
(0,5 do
4,2)
n/ad
<0,0001
e
Wskaźnik korzyści klinicznejc
51,3%
(46,8 do
26,4%
(20,9 do 32,4)
n/ad
<0,0001
e
a W skojarzeniu z eksemestanem
b Wskaźnik odpowiedzi obiektywnej = odsetek pacjentek z odpowiedzią całkowitą lub częściową
c Wskaźnik korzyści klinicznej = odsetek pacjentek z odpowiedzią całkowitą lub częściową, lub chorobą stabilną ≥24 tygodnie
d Nie dotyczy
e Wartość p jest otrzymywana na podstawie dokładnego testu Cochrana-Mantela-Haenszela z użyciem stratyfikowanej wersji testu permutacji Cochrana-Armitage’a.
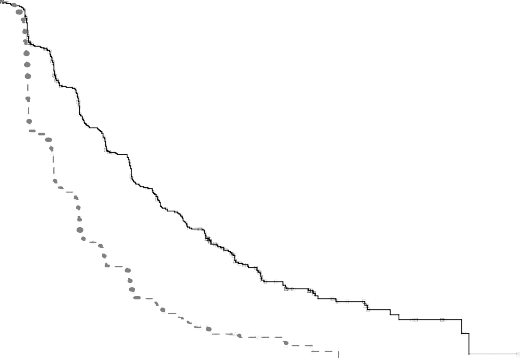
Ryc. 1 Krzywe Kaplana-Meiera dotyczące przeżycia bez progresji choroby w badaniu BOLERO-2 (ocena wyniku badania radiologicznego dokonana przez badacza)
00
80
Wsp.ryzyka = 0,45
95% CI [0,38, 0,54]
p w log. teście rang: <0,0001
Mediany Kaplana-Meiera Ewerolimus 10 mg + eksemestan: 7,82 mies. Placebo + eksemestan:
3,19 mies.
60
310/485)
Punkty ucięcia
Ewerolimus 10 mg + eksemestan (n/N =
Placebo + eksemestan (n/N = 200/239)
40
20
Prawdopodobieństwo (%)
1
0
0 6 12 18 24 30 36 42 48 54 60 66 72
78 84 90 96 102 108 114 120
Liczba pacjentów nadal podlegających ryzyku Czas (tygodnie)
Czas
6
12
18
24
30
36
42
48
54
60
66
72
78
84
90
96
102
108
114
120
Ewerolimus 485
436
366
304
257
221
185
158
124
91
66
50
35
24
22
13
10
8
2
1
0
Placebo 239
190
132
96
67
50
39
30
21
15
10
8
5
3
1
1
1
0
0
0
0
Szacowany wpływ leczenia na PFS został potwierdzony wynikami planowanej analizy podgrup w odniesieniu do PFS wg oceny badacza. We wszystkich analizowanych podgrupach (wiek, wrażliwość na wcześniej stosowaną terapię hormonalną, liczba zajętych narządów, obecność zmian zlokalizowanych wyłącznie w kościach oraz przerzutów do narządów wewnętrznych oraz występowanie we wszystkich najważniejszych podgrupach demograficznych i prognostycznych) pozytywny wpływ leczenia obserwowano w grupie terapii skojarzonej ewerolimusem z eksemestanem z szacowanym współczynnikiem ryzyka wynoszącym od 0,25 do 0,60 w porównaniu z grupą otrzymującą placebo z eksemestanem.
Nie obserwowano różnic w czasie do pogorszenia (≥5%) wyników funkcjonalnych domen QLQ- C30 w obu ramionach.
BOLERO-6 (badanie CRAD001Y2201), trójramienne, randomizowane, otwarte badanie II fazy, oceniające ewerolimus w skojarzeniu z eksemestanem w porównaniu z monoterapią ewerolimusem i w porównaniu z kapecytabiną w leczeniu kobiet po menopauzie z miejscowo zaawansowanym, nawrotowym lub
rozsianym rakiem piersi z ekspresją receptorów estrogenowych, bez nadekspresji HER2/neu, po wystąpieniu wznowy lub progresji w trakcie wcześniejszego leczenia letrozolem lub anastrozolem.
Głównym celem badania było oszacowanie HR dla PFS po zastosowaniu leczenia skojarzonego ewerolimusem z eksemestanem w porównaniu z samym ewerolimusem. Najważniejszym drugorzędowym celem badania było oszacowanie HR dla PFS po zastosowaniu leczenia skojarzonego ewerolimusem z eksemestanem w porównaniu z kapecytabiną.
Inne drugorzędowe cele badania obejmowały ocenę OS, odsetka obiektywnych odpowiedzi, odsetka korzyści klinicznej, bezpieczeństwa stosowania, czasu do pogorszenia stanu sprawności wg ECOG, czasu do pogorszenia jakości życia oraz satysfakcji z leczenia (TSQM). Nie planowano przeprowadzenia formalnych porównań statystycznych.
Łącznie 309 pacjentek zostało losowo przydzielonych w stosunku 1:1:1 do grupy otrzymującej leczenie skojarzone ewerolimusem (w dawce 10 mg na dobę) z eksemestanem (w dawce 25 mg na dobę) (n=104), samym ewerolimusem (10 mg na dobę) (n=103) lub kapecytabiną (w dawce
1250 mg/m2 pc. dwa razy na dobę przez 2 tygodnie, po których następował jeden tydzień przerwy, w cyklach trwających 3 tygodnie) (n=102). W chwili zakończenia zbierania danych mediana czasu trwania leczenia wyniosła 27,5 tygodnia (zakres: 2,0-165,7) w grupie otrzymującej ewerolimus w skojarzeniu z eksemestanem, 20 tygodni (1,3-145,0) w grupie otrzymującej ewerolimus i
26,7 tygodnia (1,4-177,1) w grupie otrzymującej kapecytabinę.
Wyniki ostatecznej analizy PFS przy 154 zdarzeniach PFS obserwowanych w oparciu o lokalną ocenę badacza wykazała szacunkową wartość HR = 0,74 (90% CI: 0,57; 0,97) na korzyść grupy otrzymującej leczenie skojarzone ewerolimusem z eksemestanem w porównaniu z grupą otrzymującą ewerolimus. Mediana PFS wyniosła odpowiednio 8,4 miesiąca (90% CI: 6,6; 9,7) i 6,8 miesiąca (90% CI: 5,5; 7,2).
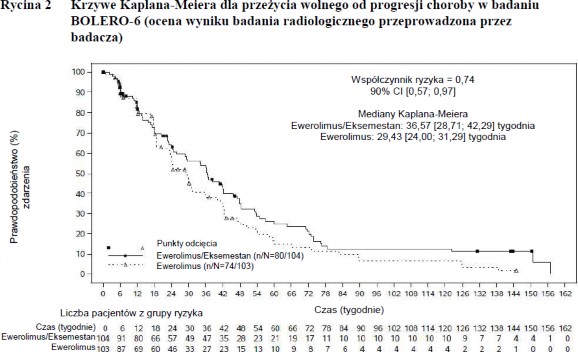
Różnice liczbowe obserwowano w odniesieniu do najważniejszego drugorzędowego punktu końcowego PFS na korzyść kapecytabiny w porównaniu z grupą leczenia skojarzonego ewerolimusem z eksemestanem. Po uwzględnieniu łącznie 148 zdarzeń PFS szacunkowa wartość HR wyniosła 1,26 ((90% CI: 0,96; 1,66).
Wyniki dotyczące drugorzędowego punktu końcowego OS nie były spójne z pierwszorzędowym punktem końcowym PFS i obserwowano tendencję na korzyść grupy otrzymującej sam ewerolimus. Szacunkowa wartość HR wyniosła 1,27 (90% CI: 0,95; 1,70) dla porównania OS w grupie otrzymującej sam ewerolimus z grupą leczenia skojarzonego ewerolimusem z eksemestanem.
Szacunkowa wartość HR dla porównania OS w grupie otrzymującej leczenie skojarzone ewerolimus z eksemestanem z grupą otrzymującą kapecytabinę wyniosła 1,33 (90% CI: 0,99; 1,79).
Tabela 6 RADIANT-4 – Wyniki w zakresie przeżycia wolnego od progresji
Populacja
Ewerolimus n=205
Placebo n=97
Współczyn nik ryzyka (95% CI)
Wartość pa
Mediana przeżycia wolnego od progresji (miesiące) (95% CI)
Niezależna ocena
11,01
3,91
0,48
<0,0001
radiologiczna
(9,2, 13,3)
(3,6, 7,4)
(0,35, 0,67)
Ocena radiologiczna przeprowadzona przez badacza
13,96
(11,2, 17,7)
5,45
(3,7, 7,4)
0,39
(0,28, 0,54)
<0,0001
a Jednostronna wartość p ze stratyfikowanego logarytmicznego testu rang
Rycina 3 RADIANT-4 – Krzywe Kaplana-Meiera przeżycia wolnego do progresji (niezależna ocena radiologiczna)
Wsp. ryzyka = 0.48 95% CI [0.35, 0.67]
Mediana Kaplana Mejera
Ewerolimus + BSC: 11.01 [9.23;13.31] miesięcy
Placebo + BSC: 3.91 [3.58;7.43] miesięcy
P w log tescie rang = <0.001
Punkt ucięcia
Everolimus + BSC (n/N = 113/205) Placebo + BSC (n/N = 65/97)


100
90
80
Prawdopodobieństwo (%) zdarzenia
70
60
50
40
30
20
10
0
0 2 4 6 8 10 12 15 18 21 24 27 30
Czas (miesią ce)
Liczba pacjentów nadal podlegająca ryzyku
Czas
0
2
4
6
8
10
12
15
18
21
24
27
30
Ewerolimus
205
168
145
124
101
81
65
52
26
10
3
0
0
Placebo
97
65
39
30
24
21
17
15
11
6
5
1
0
W analizach wspomagających obserwowano pozytywny wpływ leczenia we wszystkich
podgrupach z wyjątkiem podgrupy pacjentów z guzem pierwotnym pochodzącym z jelita krętego (jelito kręte: HR=1,22 [95% CI: 0,56 do 2,65]; inne miejsca poza jelitem krętym: HR=0,34 [95% CI: 0,22 do0,54];
Płuco: HR=0,43 [95% CI: 0,24 do 0,79]) (patrz Rycina 4).
Rycina 4 RADIANT-4 – Wyniki dotyczące przeżycia bez progresji choroby z uwzględnieniem predefiniowanych podgrup pacjentów (niezależna ocena radiologiczna)
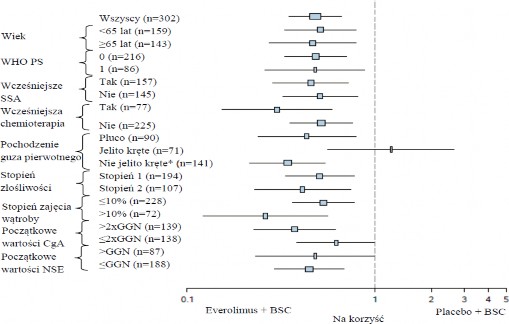
Nie jelito kręte: żołądek, okrężnica, odbytnica, wyrostek robaczkowy, kątnica, dwunastnica, jelito czcze, nowotwór nieznanego pochodzenia lub pochodzący z innych części układu pokarmowego
GGN: Górna granica normy CgA:
Chromogranina A
NSE: Neuronospecyficzna enolaza
Współczynnik ryzyka (95% CI) ze stratyfikowanego modelu Coxa.
Ostateczna analiza przeżycia całkowitego (OS) nie wykazała statystycznie istotnej różnicy między tymi pacjentami, którzy otrzymywali produkt leczniczy Afinitor, a otrzymującymi placebo podczas zaślepionej części leczenia w badaniu (HR=0,90 [95% CI: 0,66 do 1,22]).
Nie obserwowano różnic pomiędzy dwiema grupami w zakresie czasu do definitywnego pogorszenia stanu sprawności wg WHO (HR=1,02; [95% CI: 0,65, 1,61]) i czasu do definitywnego pogorszenia jakości życia (całkowitego wyniku FACT-G HR=0,74; [95% CI: 0,50, 1,10]).
Zaawansowany rak nerkowokomórkowy
RECORD-1 (badanie CRAD001C2240), wieloośrodkowe, międzynarodowe, randomizowane badanie III fazy, z podwójnie ślepą próbą, w którym porównywano podawanie ewerolimusu w dawce 10 mg na dobę i placebo, w połączeniu z najlepszym leczeniem wspomagającym pacjentów raka nerkowokomórkowego z przerzutami, u których nastąpił postęp choroby podczas lub po leczeniu inhibitorami kinazy tyrozynowej receptora naczyniowo- śródbłonkowego czynnika wzrostu
(VEGFR-TKI, vascular endothelial growth factor receptor tyrosine kinase inhibitor), (sunitynibem, sorafenibem lub zarówno sunitynibem, jak i sorafenibem). Dozwolone było również wcześniejsze leczenie bewacyzumabem i interferonem alfa. Pacjentów stratyfikowano według skali prognostycznej Memorial Sloan-Kettering Cancer Center – MSKCC (rokowanie dobre – pośrednie – niekorzystne) i według rodzaju przebytego leczenia przeciwnowotworowego (1 lub 2 leki z grupy VEGFR-TKI).
Pierwszorzędowym punktem końcowym było przeżycie bez progresji choroby, oceniane na podstawie kryteriów RECIST (Response Evaluation Criteria in Solid Tumours, kryteria oceny odpowiedzi na leczenie guzów litych) i które oceniano w ogólnym, niezależnym przeglądzie ze ślepą próbą. Drugorzędowe punkty końcowe badania to bezpieczeństwo stosowania, wskaźnik obiektywnych odpowiedzi guza na leczenie, przeżywalność całkowita, objawy związane z chorobą i jakość życia. Po potwierdzonej radiologicznie progresji choroby badacz mógł ujawnić przynależność pacjenta do grupy: pacjentom, którzy zostali randomizowani do grupy przyjmującej placebo, mogło być zaoferowane leczenie ewerolimusem w dawce 10 mg/dobę. Niezależna Komisja ds. Monitorowania Danych (ang. Independent Data Monitoring Committee) zaleciła zakończenie badań w czasie drugiej analizy w trakcie trwania badania, gdyż osiągnięto pierwszorzędowy punkt końcowy.
Ogółem, 416 pacjentów zrandomizowano w stosunku 2:1 do grupy przyjmującej ewerolimus (n=277) lub placebo (n=139). Pacjenci byli odpowiednio dobrani pod względem demograficznym (zbiorcza mediana wieku: 61 lat; zakres 27-85, 78% mężczyzn, 88% rasy białej, liczba wcześniejszych terapii VEGFR-TKI: [1-74%, 2-26%]. Mediana czasu trwania leczenia zaślepionego wyniosła 141 dni (zakres 19-451 dni) dla pacjentów otrzymujących ewerolimus oraz 60 dni (zakres 21-295 dni) dla pacjentów otrzymujących placebo.
Ewerolimus wykazał przewagę w porównaniu do placebo, jeśli chodzi o pierwszorzędowy punkt końcowy, czyli przeżywalność bez progresji choroby, ze statystycznie istotnym 67% zmniejszeniem ryzyka progresji choroby lub śmierci (patrz Tabela 7 i Rycina 5).
Tabela 7 RECORD-1 – Wyniki przeżywalności bez progresji choroby
Populacja
n
Ewerolimus n=277
Placebo n=139
Współczynni k ryzyka
Wartość
p
Średni czas przeżycia bez progresji (miesiące) (95% CI)
Analiza pierwszorzędowa
Cała (ogólna niezależna
416
4,9
1,9
0,33
<0,0001a
analiza zaślepionej
(4,0-5,5)
(1,8-1,9)
(0,25-0,43)
grupy
pacjentów)
Analizy wspomagające/czułości
Cała (przeglądy
416
5,5
1,9
0,32
<0,0001a
częściowe dokonane
(4,6-5,8)
(1,8-2,2)
(0,25-0,41)
przez badaczy)
Skala prognostyczna MSKCC ( zaślepione niezależne przeglądy dokonane centralnie)
Małe ryzyko
120
5,8
1,9
0,31
<0,0001
(4,0-7,4)
(1,9-2,8)
(0,19-0,50)
Umiarkowane ryzyko
235
4,5
1,8
0,32
<0,0001
(3,8-5,5)
(1,8-1,9)
(0,22-0,44)
Duże ryzyko
61
3,6
1,8
0,44
0,007
(1,9-4,6)
(1,8-3,6)
(0,22-0,85)
a Logarytmiczny test rang z warstwowym doborem prób
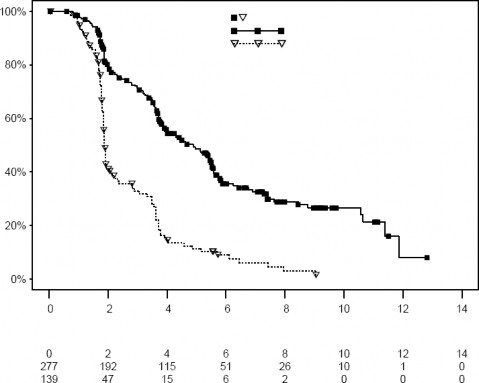
Czasy trwania obserwacji uciętych Ewerolimus (n/N = 155/277) Placebo (n/N = 111/139)
Współczynnik ryzyka = 0,33 95% CI [0,25, 0,43]
Mediany obliczone metodą Kaplana-Meiera Ewerolimus: 4,90 miesiąca
Placebo: 1,87 miesiąca Logrank wartość p =
<0,0001
Prawdopodobieństwo (%)
Rycina 5 RECORD-1 – Krzywe Kaplana-Meiera przeżywalności bez postępu choroby (niezależna ocena centralna)
Liczba pacjentów z grupy ryzyka
Czas (mieś) Ewerolimus Teva Placebo Czas (miesiące)
Wskaźniki przeżywalności bez progresji choroby w okresie sześciu miesięcy wyniosły 36% w grupie przyjmującej ewerolimus w porównaniu z 9% w grupie przyjmującej placebo.
Potwierdzoną odpowiedź obiektywną zaobserwowano u 5 pacjentów (2%) przyjmujących ewerolimus, podczas gdy nie zaobserwowano jej w ogóle w grupie przyjmującej placebo. Tym samym, przeżywalność bez progresji choroby dotyczy głównie populacji z ustabilizowaną chorobą (odpowiadającej 67% grupy przyjmującej ewerolimus).
Nie zaobserwowano statystycznie istotnej różnicy w przeżywalności ogólnej (współczynnik ryzyka 0,87; przedział ufności: 0,65–1,17; p=0,177). Po stwierdzeniu progresji choroby i podaniu
produktu leczniczego ewerolimus pacjentom przydzielonym pierwotnie do grupy placebo, wykazano brak różnic w ogólnej przeżywalności związanych z rodzajem leczenia.
Inne badania
Zapalenie jamy ustnej jest najczęściej zgłaszanym działaniem niepożądanym u pacjentów leczonych produktem leczniczym Afinitor (patrz punkt 4.4 i 4.8). W badaniu z jedną grupą terapeutyczną przeprowadzonym po wprowadzeniu leku do obrotu z udziałem kobiet po menopauzie z zaawansowanym rakiem piersi
(n=92) stosowano miejscowe leczenie bezalkoholowym doustnym roztworem deksametazonu o stężeniu 0,5 mg/5 ml w postaci płynu do płukania jamy ustnej (4 razy na dobę przez pierwsze 8 tygodni), od chwili rozpoczynania leczenia produktem leczniczym Afinitor (w dawce 10 mg/dobę) w skojarzeniu z eksemestanem (w dawce 25 mg/dobę), aby zmniejszyć częstość występowania i nasilenie zapalenia jamy ustnej. Częstość występowania zapalenia jamy ustnej stopnia ≥2. po 8 tygodniach wyniosła 2,4% (n=2/85 pacjentek, u których możliwe było dokonanie oceny), co było wartością mniejszą niż odsetek zgłaszany w przeszłości. Częstość występowania zapalenia jamy ustnej stopnia
Wchłanianie
Mediana czasu do osiągnięcia szczytowych wartości stężeń ewerolimusu Cmax po podaniu doustnym
w dawce 5 mg lub 10 mg na czczo lub z lekkim posiłkiem beztłuszczowym wynosiła 1 godzinę. Wartość Cmax jest proporcjonalna do dawki w zakresie dawek od 5 mg do 10 mg. Ewerolimus jest substratem i umiarkowanym inhibitorem PgP.
Wpływ pokarmu
U zdrowych pacjentów, pokarmy bogate w tłuszcze zmniejszały ogólnoustrojową ekspozycję na ewerolimus w dawce 10 mg (mierzoną wartością pola pod krzywą stężeń, AUC) o 22%, a maksymalne stężenie w osoczu Cmax o 54%. Pokarmy ubogie w tłuszcze zmniejszały AUC o 32%, a Cmax o 42%. Mimo to, jedzenie nie miało wyraźnego wpływu na profil zależności stężenia od czasu po fazie wchłaniania.
Dystrybucja
Stosunek stężenia ewerolimusu we krwi do stężenia w osoczu, zależny od stężenia w zakresie dawek od 5 do 5 000 ng/ml, wyniósł od 17% do 73%. Około 20% stężenia ewerolimusu we krwi pełnej zawiera się w osoczu pacjentów z rakiem leczonych ewerolimusem w dawce 10 mg na dobę. Wiązanie z białkami osocza wynosi około 74% zarówno u zdrowych osób, jak i pacjentów z umiarkowanym zaburzeniem czynności wątroby. U pacjentów z zaawansowanymi guzami litymi, objętość dystrybucji Vd wyniosła 191 l dla kompartmentu centralnego i 517 l dla kompartmentu obwodowego.
Metabolizm
Ewerolimus jest substratem CYP3A4 i PgP. Po podaniu doustnym, ewerolimus jest głównym związkiem obecnym we krwi. W ludzkiej krwi zidentyfikowano sześć głównych metabolitów substancji ewerolimus, m.in. trzy monohydroksylowe pochodne ewerolimusu, dwa produkty hydrolityczne z otwartymi łańcuchami i postać ewerolimusu sprzężonego z fosfatydylocholiną.
Wymienione metabolity wykryto również u zwierząt w badaniach toksyczności. Wykazywały one aktywność około 100 razy mniejszą niż ewerolimus. W związku z tym, uważa się, że ewerolimus jest głównie odpowiedzialny za całą farmakologiczną aktywność ewerolimusu.
Eliminacja
Średni klirens po podaniu doustnym (CL/F) ewerolimusu w dawce 10 mg/dobę u pacjentów z zaawansowanym nowotworem litym wyniósł 24,5 l/h. Średni okres półtrwania ewerolimusu wynosi około 30 godzin.
Nie przeprowadzono specjalnych badań dotyczących wydalania ewerolimusu u pacjentów z rakiem, jednak dostępne są dane z badań przeprowadzonych z udziałem pacjentów po przeszczepach.
Po podaniu jednej dawki ewerolimusu znakowanego izotopowo w połączeniu z cylosporyną 80% radioaktywnej substancji znaleziono w kale, a 5% zostało wydalone z moczem. W moczu i kale nie wykryto leku w postaci niezmienionej.
Właściwości farmakokinetyczne w stanie stacjonarnym
Po podaniu ewerolimusu pacjentom z zaawansowanymi guzami litymi AUC0-γ w stanie stacjonarnym było proporcjonalne do dawki w zakresie dawek od 5 mg do 10 mg na dobę. Stan stacjonarny osiągano w ciągu dwóch tygodni. Wartości Cmax są proporcjonalne do dawki w zakresie od 5 mg
do 10 mg. Tmax występuje od 1 do 2 godzin po podaniu. Stwierdzono znaczącą korelację pomiędzy AUC0-γ oraz minimalnym stężeniem w stanie stacjonarnym, przed podaniem kolejnej dawki leku.
Szczególne grupy pacjentów
Zaburzenia czynności wątroby
Bezpieczeństwo stosowania, tolerancja i farmakokinetyka ewerolimusu były oceniane w dwóch badaniach z podaniem pojedynczej doustnej dawki ewerolimusu w postaci tabletek 8 i 34 pacjentom
z zaburzeniami czynności wątroby i porównane z działaniem leku u osób z prawidłową czynnością wątroby.
W pierwszym badaniu średnia AUC ewerolimusu podanego 8 pacjentom z umiarkowanymi zaburzeniami czynności wątroby (B w skali Child-Pugh) wzrosła dwukrotnie w porównaniu
z 8 pacjentami z prawidłową czynnością wątroby.
W drugim badaniu z udziałem 34 pacjentów z innym zaburzeniem czynności wątroby w porównaniu z osobami zdrowymi odnotowano 1,6-krotny; 3,3-krotny oraz 3,6-krotny wzrost ekspozycji na lek
(tzn. AUC0-inf) odpowiednio u pacjentów z łagodnymi (A wg skali Child-Pugh), umiarkowanymi (B wg skali Child-Pugh) i ciężkimi (C wg skali Child-Pugh) zaburzeniami czynności wątroby.
Symulacje dotyczące farmakokinetyki po podaniu wielokrotnych dawek leku uzasadniają zalecenia dotyczące dawkowania u pacjentów z zaburzeniami czynności wątroby na podstawie klasyfikacji
w skali Child-Pugh.
Na podstawie wyników osiągniętych z dwóch badań, u pacjentów z zaburzeniami czynności wątroby zaleca się dostosowanie dawki leku (patrz punkty 4.2 i 4.4).
Zaburzenia czynności nerek
W populacyjnej analizie farmakokinetycznej przeprowadzonej u 170 pacjentów z
zaawansowanym rakiem litym nie wykryto znaczącego wpływu klirensu kreatyniny (25-178 ml/min) na klirens ewerolimusu. Zaburzenia czynności nerek po przeszczepie (klirens kreatyniny w zakresie
11-107 ml/min) nie wpływały na właściwości farmakokinetyczne ewerolimusu u pacjentów po przebytym przeszczepie.
Pacjenci w podeszłym wieku
W badaniu właściwości farmakokinetycznych u pacjentów z rakiem nie wykryto znaczącego wpływu wieku (27-85 lat) na klirens ewerolimusu podanego doustnie.
Przynależność etniczna
Klirens po podaniu doustnym (CL/F) jest podobny u pacjentów pochodzenia japońskiego i pacjentów rasy białej z podobną czynnością wątroby. W analizie właściwości farmakokinetycznych wykazano, że CL/F jest średnio o 20% większy u pacjentów rasy czarnej po przeszczepie.
Przedkliniczne dane o bezpieczeństwie
Niekliniczny profil bezpieczeństwa ewerolimusu oceniano u myszy, szczurów, miniaturowych świń, małp i królików. Głównymi narządami docelowymi były układy rozrodcze samców i samic (zwyrodnieniowe zmiany w jądrach, zmniejszona zawartość plemników w najądrzach i zanik macicy) u kilku gatunków; płuca (zwiększona liczba makrofagów w pęcherzykach płucnych) szczurów
i myszy; trzustka (degranulacja i wakuolizacja komórek zewnątrzwydzielniczych odpowiednio u małp i świnek miniaturowych oraz zwyrodnienie komórek Langerhansa u małp) oraz oczy (zmętnienia przednich szwów soczewki) - tylko u szczurów. U szczurów (nasilenie powstawania lipofuscyny wraz z wiekiem w nabłonku cewek nerkowych zwiększa się w wodonerczu) i u myszy (zaostrzenie stanu wcześniej istniejących zmian) zaobserwowano nieznaczne zmiany w obrębie nerek. Nie obserwowano toksyczności w obrębie nerek u małp i miniaturowych świń.
Ewerolimus wydaje się zaostrzać stan chorób współistniejących (przewlekłe zapalenie mięśnia sercowego u szczurów, zakażenie osocza i serca wirusem Coxsackie u małp, zakażenie żołądka i jelit miniaturowych świń kokcydiami, zmiany skórne u myszy i małp). Opisane wyżej przypadki obserwowano na ogół przy ekspozycji ogólnoustrojowej w zakresie dawek terapeutycznych lub powyżej tego zakresu, poza przypadkami u szczurów, które wystąpiły poniżej dawek terapeutycznych ze względu na wysoką dystrybucje wewnątrz tkanek.
W badaniu płodności samców szczurów, morfologia jąder była zmieniona przy dawce 0,5 mg/kg mc. i większej; przy 5 mg/kg mc. zmniejszona była ruchliwość plemników, liczba plemników, stężenie testosteronu w osoczu. Dawki te ograniczały płodność samców.
Udowodniono odwracalność tego stanu.
Badania rozrodczości u zwierząt nie wykazały wpływu na płodność samic. Jednak doustne dawki ewerolimusu podane samicom szurów wynoszące ≥0,1 mg/kg (około 4% AUC0-24h u pacjentów otrzymujących dawkę dobową 10 mg) skutkowały zwiększeniem ilości poronień.
Ewerolimus przenikał przez łożysko i wykazywał działanie toksyczne na płód. U szczurów ewerolimus wykazywał toksyczność dla embrionu i płodu przy ekspozycji ogólnoustrojowej poniżej zakresu terapeutycznego, co odzwierciedlała śmiertelność i zmniejszona masa płodów. Ryzyko wystąpienia zmian szkieletowych i wad wrodzonych (np. rozszczepu mostka) wzrosło przy dawce 0,3 i 0,9 mg/kg mc. U królików działanie toksyczne na embriony objawiało się zwiększeniem późnych resorpcji.
W badaniach genotoksyczności spełniających kryteria zakończenia badań w związku
z genotoksycznością nie zaobserwowano działania klastogennego i mutagennego. Podawanie ewerolimusu myszom i szczurom przez okres do 2 lat nie spowodowało działania rakotwórczego nawet przy najwyższych dawkach, będących odpowiednio 3,9 i 0,2 razy większe od szacowanej ekspozycji u ludzi.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Butylohydroksytoluen (E321) Hypromeloza 3cPs
Laktoza jednowodna Laktoza Krospowidon typu A Magnezu stearynian
Niezgodności farmaceutyczne
Nie dotyczy.
Okres ważności
30 miesięcy.
Specjalne środki ostrożności podczas przechowywania
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego.
Rodzaj i zawartość opakowania
Blister OPA/Aluminium/PVC/Aluminium – zawierający 10, 30, 30x1, 50x1, 60 lub 90 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Specjalne środki ostrożności dotyczące usuwania
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
Teva Pharmaceuticals Polska Sp. z o. o. ul. Emilii Plater 53
00-113 Warszawa
Tel.(22) 345 93 00
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
Everolimus Teva, 2,5 mg: 24216
Everolimus Teva, 5 mg: 24217
Everolimus Teva, 7,5 mg: 24218
Everolimus Teva, 10 mg: 24219
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 22.08.2017 r.
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
06.05.2022 r. r











