Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Wartość P <0,05 z użyciem testu Fisher Exact odnosi się do porównań pomiędzy terapią skojarzoną pemetreksedem z cisplatyną a terapią skojarzoną gemcytabiną z cisplatyną
** Definicje określające każdy stopień toksyczności można znaleźć w dokumencie National Cancer Institute CTC (v2.0; NCI 1998)
*** Wg NCI CTC (v2.0; NCI 1998) zaburzenia smaku i łysienie należy zgłaszać jedynie jako objawy toksyczności stopnia 1. lub 2.
W tabeli przyjęto 5% jako wartość progową częstości występowania wszystkich zdarzeń, w przypadku których osoba je rejestrująca brała pod uwagę możliwość związku z podawaniem pemetreksedu
i cisplatyny.
Klinicznie istotne objawy toksyczności, które stwierdzono u ≥1% i ≤5% pacjentów przydzielonych
w sposób losowy do grupy otrzymującej cisplatynę i pemetreksed to: zwiększenie aktywności AspAT, zwiększenie aktywności AlAT, zakażenia, gorączka neutropeniczna, niewydolność nerek, gorączka, odwodnienie, zapalenie spojówek i zmniejszenie klirensu kreatyniny.
Klinicznie istotne objawy toksyczności, które stwierdzono u <1% pacjentów przydzielonych w sposób losowy do grupy leczonej cisplatyną i pemetreksedem to: zwiększenie aktywności GGT, ból w klatce piersiowej, arytmia i neuropatia nerwów ruchowych.
Istotne klinicznie objawy toksyczności w grupach z podziałem według płci były podobne do tych obserwowanych w całkowitej populacji pacjentów otrzymujących pemetreksed i cisplatynę.
W zamieszczonej poniżej tabeli przedstawiono częstość występowania oraz nasilenie działań niepożądanych potencjalnie związanych ze stosowaniem leku jakie zgłoszono u >5% z 800 pacjentów, których przydzielono w sposób losowy do grupy otrzymującej pemetreksed w monoterapii
i u 402 pacjentów, których przydzielono w sposób losowy do grupy otrzymującej placebo, w badaniu poświęconym ocenie leczenia podtrzymującego z zastosowaniem pemetreksedu w monoterapii (JMEN: N = 663) oraz badaniu poświęconym ocenie leczenia podtrzymującego pemetreksedem
w ramach kontynuacji leczenia tym lekiem (PARAMOUNT: N = 539). U wszystkich pacjentów rozpoznano niedrobnokomórkowego raka płuca w stopniu zaawansowania IIIB lub IV i zastosowano
wcześniej chemioterapię opartą na pochodnych platyny. W obu grupach wszystkim pacjentom podawano w odpowiednich dawkach kwas foliowy i witaminę B12.
Klasyfikacja układów
i narządów
Częstość*
Zdarzenie niepożądane**
Pemetreksed***
Placebo***
(N = 800)
(N = 402)
Toksy- czność – wszystkie stopnie
(%)
Toksy- czność - stopień 3 - 4
(%)
Toksy- czność – wszystkie stopnie
(%)
Toksycz ność - stopień 3 - 4
(%)
Zaburzenia krwi i układu chłonnego
Bardzo często
Zmniejszone stężenie
hemoglobiny
18,0
4,5
5,2
0,5
Często
Zmniejszona
liczba leukocytów
5,8
1,9
0,7
0,2
Zmniejszona
liczba neutrofili
8,4
4,4
0,2
0,0
Zaburzenia układu
nerwowego
Często
Neuropatia nerwów
czuciowych
7,4
0,6
5,0
0,2
Zaburzenia żołądka i jelit
Bardzo
często
Nudności
17,3
0,8
4,0
0,2
Jadłowstręt
12,8
1,1
3,2
0,0
Często
Wymioty
8,4
0,3
1,5
0,0
Zapalenie błony śluzowej/
zapalenie jamy ustnej
6,8
0,8
1,7
0,0
Zaburzenia wątroby i dróg żółciowych
Często
Zwiększenie
aktywności AlAT (SGPT)
6,5
0,1
2,2
0,0
Zwiększenie aktywności
AspAT (SGOT)
5,9
0,0
1,7
0,0
Zaburzenia
skóry i tkanki podskórnej
Często
Wysypka/ łuszczenie skóry
8,1
0,1
3,7
0,0
Zaburzenia ogólne i stany w miejscu podania
Bardzo
często
Znużenie
24,1
5,3
10,9
0,7
Często
Ból
7,6
0,9
4,5
0,0
Obrzęk
5,6
0,0
1,5
0,0
Zaburzenia
nerek
Często
Zaburzenia
nerek****
7,6
0,9
1,7
0,0
Skróty: AlAT = aminotransferaza alaninowa, AspAT = aminotransferaza asparaginowa, CTCAE = ang. Common Terminology Criteria for Adverse Event; NCI = ang. National Cancer Institute; SGOT
= aminotransferaza glutaminianowo-szczawiooctowa, SGPT = aminotransferaza glutaminopirogronianowa.
Określenie częstości występowania: bardzo często ≥ 10%; często > 5% i < 10%. W tabeli przyjęto 5% jako wartość progową częstości występowania wszystkich zdarzeń, w przypadku których osoba je rejestrująca brała pod uwagę możliwość związku z podawaniem pemetreksedu.
** Definicje określające każdy stopień toksyczności można znaleźć w dokumencie CTCAE (wersja 3.0 NCI 2003) wg National Cancer Institute. Pokazane częstości występowania są zgodne z wersją 3.0 dokumentu CTCAE.
*** Zbiorcza tabela działań niepożądanych zestawia wyniki badania JMEN poświęconego ocenie leczenia podtrzymującego pemetreksedem (N = 663) oraz badania PARAMOUNT
poświęconego ocenie leczenia podtrzymującego pemetreksedem w ramach kontynuacji leczenia tym lekiem (N = 539).
**** Określenie zbiorcze obejmuje zwiększenie stężenia kreatyniny w surowicy krwi lub we krwi, zmniejszenie szybkości przesączania kłębuszkowego, niewydolność nerek i zaburzenia nerek lub zaburzenia układu moczowo-płciowego – inne.
Klinicznie istotne objawy toksyczności wg CTC, które stwierdzono u ≥1% i ≤5% pacjentów, przydzielonych losowo do grupy otrzymującej pemetreksed: gorączka neutropeniczna, zakażenie, zmniejszona liczba płytek krwi, biegunka, zaparcie, łysienie, świąd, swędzenie, gorączka
(bez neutropenii), choroba warstwy powierzchniowej gałki ocznej (w tym zapalenie spojówek), wzmożone łzawienie, zawroty głowy i neuropatia nerwów ruchowych.
Klinicznie istotne objawy toksyczności wg CTC, które stwierdzono u <1% pacjentów przydzielonych w sposób losowy do grupy otrzymującej pemetreksed to: reakcja alergiczna lub nadwrażliwość, rumień wielopostaciowy, arytmia nadkomorowa i zatorowość płucna.
Bezpieczeństwo oceniono u pacjentów, których przydzielono w sposób losowy do grup otrzymujących pemetreksed (N = 800). Częstość występowania działań niepożądanych została określona na podstawie zgłoszeń od pacjentów, którzy otrzymali ≤ 6 cykli leczenia podtrzymującego pemetreksedem (N = 519) i porównana z częstością obserwowaną u pacjentów, którzy otrzymali
>6 cykli leczenia pemetreksedem (N = 281). Obserwowano zwiększenie częstości występowania zdarzeń niepożądanych (wszystkich stopni) wraz z wydłużeniem czasu ekspozycji. Obserwowano istotne zwiększenie częstości występowania neutropenii stopnia 3. lub 4. potencjalnie związanej ze stosowaniem leku w przypadku dłuższego stosowania pemetreksedu (≤ 6 cykli: 3,3%, > 6 cykli: 6,4%: p=0,046). Nie obserwowano istotnych statystycznie różnic w częstości występowania innych poszczególnych zdarzeń niepożądanych stopnia 3., 4. lub 5. w przypadku dłuższego stosowania produktu leczniczego.
W trakcie badań klinicznych z zastosowaniem pemetreksedu odnotowano niezbyt częste ciężkie zdarzenia niepożądane ze strony układu sercowo – naczyniowego i mózgowo - naczyniowego, w tym zawał mięśnia sercowego, dławica piersiowa, udar mózgu, przemijający atak niedokrwienny, występujące zwykle wtedy, gdy pemetreksed był stosowany w połączeniu z innym lekiem cytotoksycznym. U większości pacjentów, u których wystąpiły opisywane zdarzenia niepożądane, stwierdzono wcześniej wystąpienie czynników ryzyka chorób sercowo - naczyniowych.
Rzadkie przypadki zapalenia wątroby, potencjalnie ciężkie, były zgłaszane w czasie prowadzenia badań klinicznych z pemetreksedem.
Podczas badań klinicznych z pemetreksedem niezbyt często obserwowano pancytopenię.
W trakcie badań klinicznych, u pacjentów leczonych pemetreksedem niezbyt często zgłaszano przypadki zapalenia okrężnicy (w tym krwawienie z jelit i odbytu, czasami prowadzące do zgonu, perforację jelit, martwicę jelit i zapalenie jelita ślepego).
Podczas badań klinicznych u pacjentów leczonych pemetreksedem niezbyt często zgłaszano przypadki śródmiąższowego zapalenia płuc z niewydolnością oddechową, czasami prowadzące do zgonu.
U pacjentów leczonych pemetreksedem niezbyt często zgłaszano przypadki obrzęków.
Podczas badań klinicznych z pemetreksedem niezbyt często obserwowano zapalenie przełyku lub popromienne zapalenie przełyku.
Podczas badań klinicznych z pemetreksedem często zgłaszano wystąpienie posocznicy, niekiedy będącej przyczyną zgonu.
Po wprowadzeniu produktu leczniczego do obrotu u chorych leczonych pemetreksedem obserwowano i zgłoszono następujące objawy niepożądane:
Często zgłaszano hiperpigmentację.
Po zastosowaniu pemetreksedu w monoterapii lub w skojarzeniu z innymi chemioterapeutykami, niezbyt często zgłaszano przypadki ostrej niewydolności nerek (patrz punkt 4.4). Po wprowadzeniu do obrotu notowano również przypadki nefrogennej moczówki prostej i martwicy cewek nerkowych
o nieznanej częstości występowania.
U pacjentów poddawanych radioterapii przed, w trakcie lub po stosowaniu pemetreksedu niezbyt często zgłaszano przypadki popromiennego zapalenia płuc (patrz punkt 4.4).
U pacjentów poddanych uprzednio radioterapii rzadko zgłaszano przypadki nawrotów objawów popromiennych (patrz punkt 4.4).
Niezbyt często zgłaszano przypadki niedokrwienia obwodowego prowadzącego niekiedy do martwicy kończyny.
Rzadko zgłaszano skórne choroby pęcherzowe, w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, w niektórych przypadkach prowadzące do zgonu.
Rzadko u pacjentów leczonych pemetreksedem, zgłaszano występowanie niedokrwistości hemolitycznej o podłożu immunologicznym.
Rzadko zgłaszano przypadki wstrząsu anafilaktycznego.
Zgłaszano występowanie obrzęku rumieniowatego głównie kończyn dolnych o nieznanej częstości.
Zgłaszano występowanie zakaźnych i niezakaźnych zaburzeń skóry właściwej i (lub) tkanki podskórnej, o nieznanej częstości (np. ostre bakteryjne zapalenie skóry i tkanki podskórnej, rzekome zapalenie tkanki łącznej, zapalenie skóry).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa.
Tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, e-mail: ndl@urpl.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
wartość p odnosi się do porównań pomiędzy podgrupami
Mediana (m)
95% CI dla mediany
HR
95% CI dla HR
wartość p dla równoważności efektu (HR)
Mediana
HR (95% CI)
Mediana
HR (95% CI)
Wskaźnik odpowiedzi (%) (95% CI)
Stabilizacja choroby (%)
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Pemetrexed Zentiva, 25 mg/ml, koncentrat do sporządzania roztworu do infuzji
Jeden ml koncentratu zawiera 25 mg pemetreksedu (Pemetrexedum) (w postaci pemetreksedu diargininy).
Jedna fiolka w 4 ml koncentratu zawiera 100 mg pemetreksedu (w postaci pemetreksedu diargininy). Jedna fiolka w 20 ml koncentratu zawiera 500 mg pemetreksedu (w postaci pemetreksedu diargininy). Jedna fiolka w 40 ml koncentratu zawiera 1000 mg pemetreksedu (w postaci pemetreksedu diargininy).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Koncentrat do sporządzania roztworu do infuzji.
Przezroczysty, bezbarwny do jasnożółtego lub brązowego, brązowożółty lub zielonożółty roztwór. pH koncentratu wynosi od 8,3 do 9,0.
Złośliwy międzybłoniak opłucnej
Produkt Pemetrexed Zentiva w skojarzeniu z cisplatyną jest wskazany do stosowania u pacjentów nieleczonych wcześniej chemioterapią z nieoperacyjnym złośliwym międzybłoniakiem opłucnej.
Niedrobnokomórkowy rak płuca
Produkt Pemetrexed Zentiva w skojarzeniu z cisplatyną jest wskazany jako leczenie pierwszego rzutu u pacjentów z niedrobnokomórkowym rakiem płuca w stadium miejscowo zaawansowanym lub
z przerzutami, o histologii innej niż w przeważającym stopniu płaskonabłonkowa (patrz punkt 5.1).
Produkt Pemetrexed Zentiva jest wskazany do stosowania w monoterapii, jako leczenie podtrzymujące u pacjentów z niedrobnokomórkowym rakiem płuca w stadium miejscowo zaawansowanym lub
z przerzutami, o histologii innej niż w przeważającym stopniu płaskonabłonkowa, u których nie nastąpiła progresja choroby bezpośrednio po zakończeniu chemioterapii opartej na pochodnych platyny (patrz punkt 5.1).
Produkt Pemetrexed Zentiva w monoterapii jest wskazany do stosowania, jako leczenie drugiego rzutu u pacjentów, z niedrobnokomórkowym rakiem płuca w stadium miejscowo zaawansowanym lub
z przerzutami, o histologii innej niż w przeważającym stopniu płaskonabłonkowa (patrz punkt 5.1).
Dawkowanie
Produkt Pemetrexed Zentiva należy podawać wyłącznie pod kontrolą lekarza wykwalifikowanego w zakresie stosowania chemioterapii przeciwnowotworowej.
Pemetrexed Zentiva w skojarzeniu z cisplatyną
Zalecana dawka produktu Pemetrexed Zentiva wynosi 500 mg/m2 powierzchni ciała (pc.). Produkt należy podawać we wlewie dożylnym (iv.) trwającym 10 minut, w pierwszym dniu każdego 21- dniowego cyklu. Zalecana dawka cisplatyny wynosi 75 mg/m2 pc. Cisplatynę należy podawać we wlewie dożylnym trwającym 2 godziny, rozpoczynając około 30 minut po zakończeniu wlewu pemetreksedu pierwszego dnia każdego 21-dniowego cyklu leczenia. Pacjentowi należy podać leki przeciwwymiotne oraz płyny w odpowiedniej ilości przed i (lub) po podaniu cisplatyny (szczegółowe dane na temat dawkowania cisplatyny można znaleźć w Charakterystyce Produktu Leczniczego tego leku).
Pemetrexed Zentiva w monoterapii
W przypadku pacjentów z niedrobnokomórkowym rakiem płuca poddawanych wcześniej chemioterapii zalecana dawka produktu Pemetrexed Zentiva wynosi 500 mg/m2 pc. Produkt należy podawać we wlewie dożylnym (iv.) trwającym 10 minut w pierwszym dniu każdego 21-dniowego cyklu leczenia.
Premedykacja
W celu ograniczenia częstości występowania i nasilenia odczynów skórnych, w dniu poprzedzającym podanie pemetreksedu, jak również w dniu podania leku i następnego dnia pacjent powinien otrzymać lek z grupy kortykosteroidów. Dawka kortykosteroidu powinna odpowiadać dawce 4 mg deksametazonu, podawanego doustnie, dwa razy na dobę (patrz punkt 4.4).
W celu ograniczenia objawów toksyczności pacjenci leczeni pemetreksedem powinni również otrzymywać suplementację witaminową (patrz punkt 4.4). Należy codziennie podawać doustnie kwas foliowy lub produkt wielowitaminowy zawierający kwas foliowy (w dawce od 350 do
1000 mikrogramów). W ciągu 7 dni poprzedzających podanie pierwszej dawki pemetreksedu pacjent powinien przyjąć, co najmniej 5 dawek kwasu foliowego. Kwas foliowy należy także podawać przez cały cykl leczenia i przez 21 dni po podaniu ostatniej dawki pemetreksedu. W tygodniu poprzedzającym przyjęcie pierwszej dawki pemetreksedu, a następnie co trzy cykle leczenia pacjenci muszą także otrzymywać domięśniowo witaminę B12 (1000 mikrogramów). Kolejne wstrzyknięcia witaminy B12 można wykonywać w dniu podania pemetreksedu.
Kontrola stanu pacjenta
Przed podaniem każdej dawki pemetreksedu należy wykonać pełną morfologię krwi, w tym oznaczenie wzoru odsetkowego krwinek białych (rozmaz) i liczby płytek krwi. Przed każdym podaniem chemioterapeutyku należy wykonać badania krwi oceniające czynności nerek i wątroby. Warunkiem umożliwiającym rozpoczęcie każdego cyklu chemioterapii są następujące wartości parametrów laboratoryjnych: bezwzględna liczba neutrofilów (ang. Absolute Neutrophil Count, ANC)
≥ 1500 komórek/mm3, liczba płytek krwi ≥ 100 000 komórek/mm3, klirens kreatyniny ≥45 ml/min, bilirubina całkowita ≤ 1,5 razy górna granica wartości uznanych za prawidłowe; fosfataza zasadowa, aminotransferaza asparaginianowa (AspAT), aminotransferaza alaninowa (AlAT) ≤ 3 razy górna granica wartości uznanych za prawidłowe. U pacjentów z przerzutami guza do wątroby dopuszczalne są wartości aktywności fosfatazy zasadowej, AspAT i AlAT ≤ 5-krotnej wartości uznanej za prawidłowe.
Modyfikacja dawki
Decyzję o modyfikacji dawki przed rozpoczęciem kolejnego cyklu chemioterapii należy podejmować na podstawie najniższych wartości parametrów morfologii krwi oznaczonych podczas poprzedniego cyklu lub na podstawie największego nasilenia objawów toksyczności, przy którym nie wystąpiły zmiany w obrazie krwi. Rozpoczęcie kolejnego cyklu można opóźnić, by w ten sposób umożliwić
normalizację stanu zdrowia pacjenta. Po uzyskaniu odpowiedniej poprawy stanu pacjenta należy kontynuować leczenie zgodnie z zasadami przedstawionymi w tabelach 1, 2 i 3, które odnoszą się zarówno do stosowania produktu Pemetrexed Zentiva w monoterapii, jak i w skojarzeniu pemetreksedu z cisplatyną.
Tabela 1 - Modyfikacja dawki pemetreksedu (w monoterapii lub leczeniu skojarzonym) i cisplatyny – zmiany w obrazie krwi | |
Najmniejsza bezwzględna liczba neutrofilów < 500/mm3 i najmniejsza liczba płytek krwi ≥ 50 000/mm3 | 75% poprzedniej dawki (zarówno pemetreksedu jak i cisplatyny) |
Najmniejsza liczba płytek krwi < 50 000/mm3 bez względu na to, jaka jest najmniejsza liczba neutrofilów | 75% poprzedniej dawki (zarówno pemetreksedu jak i cisplatyny) |
Najmniejsza liczba płytek krwi < 50 000/mm3 oraz krwawieniea bez względu na to, jaka jest najmniejsza liczba neutrofilów | 50% poprzedniej dawki (zarówno pemetreksedu jak i cisplatyny) |
a zgodnie z definicją krwawień stopnia 2. lub wyższego wg ogólnych kryteriów toksyczności (ang. Common Toxicity Criteria, CTC, v2.0; NCI 1998) National Cancer Institute.
Jeżeli u pacjenta wystąpią objawy toksyczności niehematologicznej ≥ 3. stopnia (bez objawów toksyczności neurologicznej), należy przerwać stosowanie produktu Pemetrexed Zentiva aż do powrotu ocenianych parametrów do wartości sprzed leczenia lub niższych. Ponowne leczenie należy rozpocząć zgodnie z wytycznymi z tabeli 2.
Tabela 2 - Modyfikacja dawki pemetreksedu (w monoterapii lub leczeniu skojarzonym) i cisplatyny – działania toksyczne inne niż zmiany w obrazie krwi a, b | ||
Dawka pemetreksedu (mg/m2) | Dawka cisplatyny (mg/m2) | |
Jakiekolwiek objawy toksyczności stopnia 3. lub 4. z wyjątkiem zapalenia błon śluzowych | 75% poprzedniej dawki | 75% poprzedniej dawki |
Biegunka wymagająca hospitalizacji (bez względu na nasilenie) lub biegunka stopnia 3. lub 4. | 75% poprzedniej dawki | 75% poprzedniej dawki |
Zapalenie błon śluzowych stopnia 3. lub 4. | 50% poprzedniej dawki | 100% poprzedniej dawki |
a Ogólne kryteria toksyczności (ang. Common Toxicity Criteria, CTC v2.0; NCI 1998) wg National Cancer Institute
b bez objawów toksyczności neurologicznej
Jeżeli wystąpią objawy toksyczności neurologicznej, dawkę pemetreksedu i cisplatyny należy zmodyfikować zgodnie z danymi z tabeli 3. W przypadku wystąpienia toksyczności neurologicznej stopnia 3. lub 4., leczenie należy przerwać.
Tabela 3 - Modyfikacja dawki pemetreksedu (w monoterapii lub leczeniu skojarzonym) i cisplatyny – toksyczność neurologiczna | ||
Nasilenie objawów wg CTCa | Dawka pemetreksedu (mg/m2) | Dawka cisplatyny (mg/m2) |
0 – 1 | 100% poprzedniej dawki | 100% poprzedniej dawki |
2 | 100% poprzedniej dawki | 50% poprzedniej dawki |
a CTC –Ogólne Kryteria Toksyczności (ang. Common Toxicity Criteria, CTC v2.0; NCI 1998) wg National Cancer Institute
Leczenie produktem Pemetrexed Zentiva należy przerwać, jeżeli u pacjenta wystąpią objawy toksyczności hematologicznej lub innego rodzaju stopnia 3. lub 4. po dwukrotnym zmniejszeniu
dawki. Leczenie należy przerwać natychmiast, jeżeli wystąpią objawy toksyczności neurologicznej stopnia 3. lub 4.
Szczególne grupy pacjentów
Pacjenci w podeszłym wieku
W badaniach klinicznych nie stwierdzono, by osoby w wieku 65 lat i starsze były w większym stopniu narażone na występowanie działań niepożądanych, w porównaniu z osobami w wieku poniżej 65 lat. Brak szczególnych zaleceń dotyczących zmniejszania dawki u osób w podeszłym wieku z wyjątkiem zaleceń ustalonych dla wszystkich pacjentów.
Dzieci i młodzież
Stosowanie produktu leczniczego Pemetrexed Zentiva u dzieci i młodzieży, nie jest zalecane w leczeniu złośliwego międzybłoniaka opłucnej i niedrobnokomórkowego raka płuca.
Zaburzenia czynności nerek
(Obniżenie GFR obliczane na podstawie standardowego wzoru Cockrofta i Gaulta lub przez pomiar przesączania kłębuszkowego metodą klirensu Tc99m-DPTA z surowicy): Pemetreksed jest wydalany głównie w postaci niezmienionej przez nerki. W badaniach klinicznych nie stwierdzono konieczności zmiany dawki (z wyjątkiem zaleceń ustalonych dla wszystkich pacjentów) u pacjentów z klirensem kreatyniny ≥ 45 ml/min. Nie zebrano dostatecznych danych na temat stosowania pemetreksedu
u pacjentów z klirensem kreatyniny mniejszym niż 45 ml/min. Z tego względu nie zaleca się stosowania pemetreksedu u tych pacjentów (patrz punkt 4.4).
Zaburzenia czynności wątroby
Nie wykazano związku między aktywnością AspAT, AlAT, całkowitym stężeniem bilirubiny
a farmakokinetyką pemetreksedu. Nie przeprowadzano jednak osobnych analiz dla podgrup pacjentów z objawami zaburzeń czynności wątroby jak np. zwiększenie stężenia bilirubiny > 1,5 krotnie powyżej górnej granicy wartości uznanych za prawidłowe i (lub) zwiększenie aktywności aminotransferaz
> 3 krotnie powyżej górnej granicy wartości uznanych za prawidłowe (u pacjentów bez przerzutów nowotworu do wątroby) lub >5 krotnie powyżej górnej granicy wartości uznanych za prawidłowe (u pacjentów z przerzutami nowotworowymi do wątroby).
Sposób podawania
Podanie dożylne.
Środki ostrożności, które należy podjąć przed użyciem lub podaniem produktu leczniczego Pemetrexed Zentiva, patrz punkt 6.6.
Pemetrexed Zentiva należy podawać we wlewie dożylnym trwającym 10 minut w pierwszym dniu każdego 21-dniowego cyklu. Instrukcja dotycząca rozcieńczania produktu Pemetrexed Zentiva przed podaniem, patrz punkt 6.6.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Karmienie piersią (patrz punkt 4.6).
Jednoczesne podanie szczepionki przeciwko żółtej gorączce (patrz punkt 4.5).
Pemetreksed może wywoływać mielosupresję, objawiającą się neutropenią, małopłytkowością
i niedokrwistością (lub pancytopenią) (patrz punkt 4.8). Wystąpienie tego powikłania jest działaniem toksycznym, którego wystąpienie oznacza zazwyczaj konieczność zmniejszenia dawki produktu
leczniczego. Podczas leczenia należy obserwować, czy nie występują objawy mielosupresji. Pemetreksedu nie należy podawać, aż do momentu gdy całkowita liczba neutrofilów zwiększy się co najmniej do wartości 1500 komórek/mm3, a liczba płytek krwi zwiekszy sie co najmniej do wartości 100 000 komórek/mm3. Decyzje o zmniejszeniu dawki leku podczas kolejnych cyklów chemioterapii należy podejmować na podstawie obserwowanych w poprzednim cyklu najmniejszych wartości liczby neutrofilów i płytek krwi i największego stopnia nasilenia objawów toksyczności niehematologicznej (patrz punkt 4.2).
U pacjentów, którzy przyjmowali kwas foliowy i witaminę B12 przed rozpoczęciem leczenia pemetreksedem stwierdzono mniejszą toksyczność oraz zmniejszenie częstości występowania działań niepożądanych hematologicznych i niehematologicznych stopnia 3. lub 4., np. neutropenii, gorączki neutropenicznej i zakażeń z neutropenią stopnia 3. lub 4. Wszystkim pacjentom leczonym pemetreksedem należy zatem zalecić profilaktyczne stosowanie kwasu foliowego i witaminy B12
w celu ograniczenia działań niepożądanych związanych z leczeniem (patrz punkt 4.2).
U pacjentów, którym przed leczeniem pemetreksedem nie podawano kortykosteroidów, obserwowano odczyny skórne. Częstość występowania i nasilenie odczynów skórnych może zmniejszyć premedykacja deksametazonem (lub innym równoważnym lekiem) (patrz punkt 4.2).
W badaniach leku nie uczestniczyła odpowiednio liczna grupa pacjentów z klirensem kreatyniny mniejszym niż 45 ml/min. Z tego względu nie zaleca się stosowania pemetreksedu u osób z klirensem kreatyniny mniejszym niż 45 ml/min (patrz punkt 4.2).
Pacjenci z łagodnymi do umiarkowanych zaburzeniami czynności nerek (klirens kreatyniny od 45 do 79 ml/min) powinni unikać przyjmowania niesteroidowych leków przeciwzapalnych (NLPZ) takich jak ibuprofen i kwas acetylosalicylowy (>1,3 g na dobę) na 2 dni przed podaniem pemetreksedu, w dniu podania leku i przez 2 dni po podaniu pemetreksedu (patrz punkt 4.5).
U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności nerek, zakwalifikowanych do terapii pemetreksedem, należy przerwać stosowanie NLPZ o długim okresie półtrwania na co najmniej 5 dni przed podaniem pemetreksedu, w dniu podania leku i przez co najmniej 2 dni po podaniu pemetreksedu (patrz punkt 4.5).
Po podaniu pemetreksedu w monoterapii lub w skojarzeniu z innymi lekami chemioterapeutycznymi, zgłaszano wystąpienie ciężkich zdarzeń, w tym ostrej niewydolności nerek. U większości pacjentów, u których pojawiły się te zaburzenia stwierdzono obecność czynników ryzyka wystąpienia tych zdarzeń, w tym odwodnienie, wcześniej rozpoznane nadciśnienie lub cukrzycę. Po wprowadzeniu do obrotu, podczas stosowania pemetreksedu w monoterapii lub w skojarzeniu z innymi lekami chemioterapeutycznymi, notowano również występowanie nefrogennej moczówki prostej i martwicy cewek nerkowych. Większość z tych zaburzeń ustępowała po odstawieniu pemetreksedu. Należy regularnie kontrolować, czy u pacjenta nie występują: ostra martwica cewek nerkowych, zaburzenia czynności nerek oraz przedmiotowe i podmiotowe objawy nefrogennej moczówki prostej
(np. hipernatremia).
Wpływ płynu w trzeciej przestrzeni, np. wysięku do opłucnej lub wodobrzusza, na pemetreksed nie został w pełni określony. W badaniu II fazy, u 31 pacjentów z guzami litymi i stabilnym płynem
w trzeciej przestrzeni, po podaniu dawki pemetreksedu nie obserwowano różnic w znormalizowanym stężeniu w osoczu ani w klirensie w porównaniu z wartościami obserwowanymi u pacjentów,
u których nie stwierdzono nagromadzenia płynu w trzeciej przestrzeni. Dlatego też, należy rozważyć wykonanie drenażu płynu nagromadzonego w trzeciej przestrzeni przed podaniem pemetreksedu, jednak może nie być to konieczne.
Obserwowano przypadki znacznego odwodnienia związanego z toksycznym działaniem pemetreksedu stosowanego w skojarzeniu z cisplatyną na układ pokarmowy. W związku z tym przed podaniem leków należy podać pacjentowi leki przeciwwymiotne oraz przed i (lub) po ich podaniu płyny
w odpowiedniej ilości.
Ciężkie zdarzenia sercowo - naczyniowe, w tym zawał mięśnia sercowego i zdarzenia mózgowo- naczyniowe niezbyt często obserwowano podczas badań klinicznych z zastosowaniem pemetreksedu.
Zdarzenia te występowały zwykle w przypadku gdy pemetreksed był stosowany w skojarzeniu
z innym lekiem cytotoksycznym. U większości pacjentów, u których wystąpiły opisywane zdarzenia niepożądane, występowały wcześniej czynniki ryzyka chorób układu krążenia (patrz punkt 4.8).
U pacjentów chorych na nowotwory złośliwe często stwierdza się upośledzenie układu odpornościowego. W związku z tym nie zaleca się jednoczesnego podawania szczepionek żywych atenuowanych (patrz punkty 4.3 i 4.5).
Pemetreksed może uszkadzać materiał genetyczny. Zaleca się, aby mężczyźni dojrzali płciowo nie decydowali się na poczęcie dziecka podczas leczenia i w okresie 6 miesięcy po jego zakończeniu. Zaleca się stosowanie środków antykoncepcyjnych lub wstrzemięźliwość seksualną. Ze względu na możliwość wywołania przez pemetreksed trwałej niepłodności zaleca się, by przed rozpoczęciem leczenia mężczyźni zwrócili się o poradę do ośrodka specjalizującego się w przechowywaniu nasienia.
Kobiety w wieku rozrodczym muszą stosować skuteczne metody antykoncepcji podczas leczenia pemetreksedem (patrz punkt 4.6).
U pacjentów poddawanych radioterapii przed, w trakcie lub po stosowaniu pemetreksedu zgłaszano przypadki zapalenia płuc po napromienianiu. Należy zwrócić szczególną uwagę podczas leczenia tych pacjentów oraz zachować ostrożność w przypadku stosowania innych środków promieniouwrażliwiających.
U pacjentów, którzy w ciągu poprzedzających tygodni lub lat poddawani byli radioterapii zgłaszano przypadki nawrotu objawów popromiennych.
Pemetreksed jest wydalany głównie przez nerki w postaci niezmienionej w wyniku wydzielania w cewkach nerkowych, a w mniejszym stopniu w wyniku przesączania kłębuszkowego. Równoczesne stosowanie leków nefrotoksycznych (np. antybiotyków aminoglikozydowych, diuretyków pętlowych, związków platyny, cyklosporyny) może potencjalnie prowadzić do opóźnionego oczyszczania organizmu z pemetreksedu. Należy zachować ostrożność, stosując pemetreksed z lekami z wyżej wymienionych grup. Jeżeli zachodzi taka potrzeba, należy ściśle kontrolować klirens kreatyniny.
Równoczesne stosowanie substancji, które również są wydzielane w cewkach nerkowych (np. probenecydu, penicyliny) może potencjalnie prowadzić do opóźnionego usuwania pemetreksedu
z organizmu. Należy zachować ostrożność, stosując pemetreksed z takimi lekami. Jeżeli zachodzi taka potrzeba, należy ściśle kontrolować klirens kreatyniny.
U pacjentów z prawidłową czynnością nerek (klirens kreatyniny ≥80 ml/min), stosowanie dużych dawek niesteroidowych leków przeciwzapalnych (NLPZ, takich jak ibuprofen >1600 mg na dobę) oraz kwasu acetylosalicylowego w większych dawkach (≥1,3 g na dobę) może spowodować zmniejszenie wydalania pemetreksedu a w konsekwencji zwiększenie częstości występowania zdarzeń niepożądanych. Należy zwrócić szczególną uwagę w czasie stosowania dużych dawek NLPZ oraz kwasu acetylosalicylowego równocześnie z pemetreksedem u pacjentów z prawidłową czynnością nerek (klirens kreatyniny ≥80 ml/min).
U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności nerek (klirens kreatyniny od 45 do 79 ml/min), należy unikać równoczesnego podawania pemetreksedu z NLPZ (np. ibuprofenem) lub z kwasem acetylosalicylowym w dużych dawkach 2 dni przed podaniem pemetreksedu, w dniu podania i przez 2 dni po podaniu pemetreksedu (patrz punkt 4.4).
Ze względu na brak danych dotyczących możliwych interakcji z NLPZ o dłuższym okresie półtrwania takich jak piroksykam lub rofekoksyb, u pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności nerek należy przerwać stosowanie tych leków w okresie co najmniej 5 dni przed podaniem
pemetreksedu, w dzień podania leku i co najmniej 2 dni po podaniu pemetreksedu (patrz punkt 4.4). Jeżeli konieczne jest jednoczesne stosowanie NLPZ, należy uważnie kontrolować stan pacjentów w celu wykrycia objawów toksyczności, szczególnie zahamowania czynności szpiku i działania toksycznego ze strony przewodu pokarmowego.
Metabolizm pemetreksedu w wątrobie zachodzi w ograniczonym stopniu. Z badań in vitro
z zastosowaniem mikrosomów z ludzkiej wątroby wynika, że nie należy oczekiwać klinicznie istotnego hamowania przez pemetreksed procesu oczyszczania metabolicznego leków metabolizowanych przez izoenzymy CYP3A, CYP2D6, CYP2C9 i CYP1A2.
Interakcje typowe dla wszystkich leków cytotoksycznych
Ze względu na zwiększone ryzyko zakrzepów u pacjentów chorych na nowotwory złośliwe, często stosuje się leczenie przeciwzakrzepowe. Duże wahania sprawności układu krzepnięcia krwi u tego samego pacjenta w różnych fazach rozwoju choroby i możliwość interakcji doustnych środków przeciwzakrzepowych i chemioterapeutyków przeciwnowotworowych wiążą się z koniecznością częstszego pomiaru wskaźnika INR (ang. International Normalised Ratio), jeżeli podjęto decyzję
o podawaniu pacjentowi leków przeciwzakrzepowych.
Jednoczesne stosowanie przeciwwskazane: szczepionka przeciwko żółtej gorączce – ze względu na możliwość wystąpienia prowadzącego do zgonu uogólnionego odczynu poszczepiennego (patrz punkt 4.3).
Jednoczesne stosowanie niezalecane: szczepionki żywe atenuowane (z wyjątkiem szczepionki przeciwko żółtej gorączce, której jednoczesne stosowanie jest przeciwwskazane) – możliwość wystąpienia układowego odczynu mogącego prowadzić do zgonu pacjenta. Ryzyko wystąpienia odczynu jest większe u pacjentów z zaburzeniem układu odpornościowego spowodowanym chorobą podstawową. Należy stosować szczepionki inaktywowane, jeżeli takie istnieją (poliomyelitis)
(patrz punkt 4.4).
Antykoncepcja u mężczyzn i kobiet
Kobiety w wieku rozrodczym muszą stosować skuteczne metody antykoncepcji w okresie leczenia pemetreksedem. Pemetreksed może uszkadzać materiał genetyczny. Dojrzali płciowo mężczyźni nie powinni decydować się na spłodzenie dziecka podczas leczenia i w okresie 6 miesięcy po jego zakończeniu. Zaleca się stosowanie środków antykoncepcyjnych lub wstrzemięźliwość seksualną.
Ciąża
Brak danych dotyczących stosowania pemetreksedu u kobiet w ciąży, jednak należy podejrzewać, że pemetreksed stosowany w okresie ciąży, podobnie jak inne antymetabolity, może powodować poważne uszkodzenia płodu. W badaniach na zwierzętach wykazano szkodliwy wpływ leku na rozrodczość (patrz punkt 5.3). Pemetreksedu nie należy stosować w okresie ciąży, chyba że po starannym rozważeniu potrzeb matki i ryzyka dla płodu okazuje się to konieczne (patrz punkt 4.4).
Karmienie piersią
Nie wiadomo, czy pemetreksed przenika do mleka matki. Nie można wykluczyć występowania objawów niepożądanych u dzieci karmionych mlekiem matki leczonej pemetreksedem. W okresie leczenia pemetreksedem należy zaprzestać karmienia piersią (patrz punkt 4.3).
Płodność
Ze względu na możliwość wywołania przez pemetreksed trwałej niepłodności zaleca się, by przed rozpoczęciem leczenia mężczyźni zwrócili się o poradę do ośrodka specjalizującego się
w przechowywaniu nasienia.
Nie przeprowadzano badań dotyczących wpływu leku na zdolność prowadzenia pojazdów
i obsługiwania maszyn. Donoszono jednak o występowaniu uczucia zmęczenia u osób leczonych pemetreksedem. Należy ostrzec pacjentów, by nie prowadzili pojazdów i nie obsługiwali maszyn, jeżeli wystąpi uczucie zmęczenia.
Podsumowanie profilu bezpieczeństwa
Do najczęściej zgłaszanych działań niepożądanych podczas stosowania pemetreksedu w monoterapii
i w skojarzeniu należą: zahamowanie czynności szpiku objawiające się niedokrwistością, neutropenią, leukopenią, małopłytkowością; objawy toksyczności w obrębie układu pokarmowego, takie jak: jadłowstręt, nudności, wymioty, biegunka, zaparcie, zapalenie gardła, zapalenie błon śluzowych
i zapalenie jamy ustnej. Do innych działań niepożądanych należą: nefrotoksyczność, zwiększona aktywność aminotransferaz, łysienie, zmęczenie, odwodnienie, wysypka, zakażenie i (lub) posocznica i neuropatia. Rzadko obserwowane objawy to: zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka.
Tabelaryczne zestawienie działań niepożądanych
W zamieszczonej poniżej tabeli przedstawiono częstość występowania oraz nasilenie działań niepożądanych obserwowanych u ponad 5% pacjentów z ogólnej liczby 168 osób z międzybłoniakiem opłucnej, których przydzielono w sposób losowy do grupy leczonej cisplatyną w skojarzeniu
z pemetreksedem i 163 pacjentów z międzybłoniakiem opłucnej, których przydzielono do grupy otrzymującej cisplatynę w monoterapii. W obu grupach wszystkim pacjentom (nie leczonym wcześniej chemioterapią) podawano w odpowiednich dawkach kwas foliowy i witaminę B12.
Działania niepożądane
Ocena częstości: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1000 do
<1/100), rzadko (≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie można określić na podstawie dostępnych danych).
Objawy niepożądane występujące z tą samą częstością są przedstawione w kolejności zmniejszającego się nasilenia objawów.
Klasyfikacja układów i narządów | Częstość | Zdarzenie niepożądane* | Pemetreksed/cisplatna | Cisplatyna | ||
(N = 168) | (N = 163) | |||||
Toksy- czność – wszystkie stopnie (%) | Toksy- czność - stopień 3 - 4 (%) | Toksy- czność – wszystkie stopnie (%) | Toksycz ność - stopień 3 - 4 (%) | |||
Zaburzenia krwi | Bardzo | Zmniejszona | ||||
i układu chłonnego | często | liczba neutrofilów i | 56,0 | 23,2 | 13,5 | 3,1 |
granulocytów | ||||||
Zmniejszona | ||||||
liczba | 53,0 | 14,9 | 16,6 | 0,6 | ||
leukocytów | ||||||
Zmniejszone | ||||||
stężenie | 26,2 | 4,2 | 10,4 | 0,0 | ||
hemoglobiny | ||||||
Zmniejszona | ||||||
liczba płytek | 23,2 | 5,4 | 8,6 | 0,0 | ||
krwi | ||||||
Klasyfikacja układów i narządów | Częstość | Zdarzenie niepożądane* | Pemetreksed/cisplatna | Cisplatyna | ||
(N = 168) | (N = 163) | |||||
Toksy- czność – wszystkie stopnie (%) | Toksy- czność - stopień 3 - 4 (%) | Toksy- czność – wszystkie stopnie (%) | Toksycz ność - stopień 3 - 4 (%) | |||
Zaburzenia metabolizmu i odżywiania | Często | Odwodnienie | 6,5 | 4,2 | 0,6 | 0,6 |
Zaburzenia układu nerwowego | Bardzo często | Neuropatia nerwów czuciowych | 10,1 | 0,0 | 9,8 | 0,6 |
Często | Zaburzenia smaku | 7,7 | 0,0*** | 6,1 | 0,0*** | |
Zaburzenia oka | Często | Zapalenie spojówek | 5,4 | 0,0 | 0,6 | 0,0 |
Zaburzenia żołądka i jelit | Bardzo często | Biegunka | 16,7 | 3,6 | 8,0 | 0,0 |
Wymioty | 56,5 | 10,7 | 49,7 | 4,3 | ||
Zapalenie jamy ustnej/ zapalenie gardła | 23,2 | 3,0 | 6,1 | 0,0 | ||
Nudności | 82,1 | 11,9 | 76,7 | 5,5 | ||
Jadłowstręt | 20,2 | 1,2 | 14,1 | 0,6 | ||
Zaparcie | 11,9 | 0,6 | 7,4 | 0,6 | ||
Często | Niestrawność | 5,4 | 0,6 | 0,6 | 0,0 | |
Zaburzenia skóry i tkanki podskórnej | Bardzo często | Wysypka | 16,1 | 0,6 | 4,9 | 0,0 |
Łysienie | 11,3 | 0,0*** | 5,5 | 0,0*** | ||
Zaburzenia nerek i dróg moczowych | Bardzo często | Zwiększenie stężenia kreatyniny | 10,7 | 0,6 | 9,8 | 1,2 |
Zmniejszenie klirensu kreatyniny** | 16,1 | 0,6 | 17,8 | 1,8 | ||
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Uczucie zmęczenia | 47,6 | 10,1 | 42,3 | 9,2 |
* Definicje określające każdy stopień toksyczności można znaleźć w dokumencie CTC wersja 2. wg National Cancer Institute, z wyjątkiem terminu „zmniejszenie klirensu kreatyniny”
** Wywodzi się od terminu „inne nerkowe/moczowo-płciowe”.
*** Wg NCI CTC (v2.0; NCI 1998) zaburzenia smaku i łysienie należy zgłaszać jedynie jako objawy toksyczności stopnia 1. lub 2.
W tabeli przyjęto 5% jako wartość progową częstości występowania wszystkich zdarzeń, w przypadku których osoba je rejestrująca brała pod uwagę możliwość związku z podawaniem pemetreksedu
i cisplatyny.
Klinicznie istotne objawy toksyczności wg CTC, które stwierdzono u ≥1% i ≤5% pacjentów, przydzielonych losowo do grupy leczonej cisplatyną i pemetreksedem to: niewydolność nerek, zakażenia, gorączka, gorączka neutropeniczna, zwiększenie aktywności AspAT, AlAT i GGT, pokrzywka i ból w klatce piersiowej.
Klinicznie istotne objawy toksyczności wg CTC, które stwierdzono u <1% pacjentów przydzielonych losowo do grupy leczonej cisplatyną i pemetreksedem to: arytmia i neuropatia nerwów ruchowych.
W poniższej tabeli przedstawiono częstość występowania oraz nasilenie działań niepożądanych, które wystąpiły u ponad 5% pacjentów z ogólnej liczby 265 osób przydzielonych w sposób losowy do grupy leczonej pemetreksedem w monoterapii z suplementacją kwasu foliowego i witaminy B12
i 276 pacjentów przydzielonych do grupy otrzymującej docetaksel w monoterapii. U wszystkich pacjentów rozpoznano miejscowo zaawansowany lub dający przerzuty niedrobnokomórkowy rak płuca. Wszyscy pacjenci byli wcześniej poddani chemioterapii.
Klasyfikacja układów i narządów | Częstość | Zdarzenie niepożądane* | Pemetreksed | Docetaksel | ||
N = 265 | N = 276 | |||||
Toksy- czność – wszystkie stopnie (%) | Toksy- czność - stopień 3 - 4 (%) | Toksy- czność – wszystkie stopnie (%) | Toksycz ność - stopień 3 - 4 (%) | |||
Zaburzenia krwi i układu chłonnego | Bardzo często | Zmniejszona liczba neutrofilów/ granulocytów | 10,9 | 5,3 | 45,3 | 40,2 |
Zmniejszona liczba leukocytów | 12,1 | 4,2 | 34,1 | 27,2 | ||
Zmniejszone stężenie hemoglobiny | 19,2 | 4,2 | 22,1 | 4,3 | ||
Często | Zmniejszona liczba płytek krwi | 8,3 | 1,9 | 1,1 | 0,4 | |
Zaburzenia żołądka i jelit | Bardzo często | Biegunka | 12,8 | 0,4 | 24,3 | 2,5 |
Wymioty | 16,2 | 1,5 | 12,0 | 1,1 | ||
Zapalenie jamy ustnej/ zapalenie gardła | 14,7 | 1,1 | 17,4 | 1,1 | ||
Nudności | 30,9 | 2,6 | 16,7 | 1,8 | ||
Jadłowstręt | 21,9 | 1,9 | 23,9 | 2,5 | ||
Często | Zaparcie | 5,7 | 0,0 | 4,0 | 0,0 | |
Zaburzenia wątroby i dróg żółciowych | Często | Zwiększona aktywność AlAT | 7,9 | 1,9 | 1,4 | 0,0 |
Zwiększona aktywność AspAT | 6,8 | 1,1 | 0,7 | 0,0 | ||
Zaburzenia skóry i tkanki podskórnej | Bardzo często | Wysypka/ łuszczenie skóry | 14,0 | 0,0 | 6,2 | 0,0 |
Często | Świąd | 6,8 | 0,4 | 1,8 | 0,0 | |
Łysienie | 6,4 | 0,4** | 37,7 | 2,2** | ||
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Uczucie zmęczenia | 34,0 | 5,3 | 35,9 | 5,4 |
Często | Gorączka | 8,3 | 0,0 | 7,6 | 0,0 | |
* Definicje określające każdy stopień toksyczności można znaleźć w dokumencie CTC wersja 2 wg National Cancer Institute
** Wg NCI CTC (v2.0; NCI 1998) łysienie należy zgłaszać jedynie jako objaw toksyczności stopnia 1. lub 2.
W tabeli przyjęto 5% jako wartość progową częstości występowania wszystkich zdarzeń, w przypadku których osoba je rejestrująca brała pod uwagę możliwość związku z podawaniem pemetreksedu.
Klinicznie istotne objawy toksyczności zgodne z CTC, które stwierdzono u ≥1% i ≤5% pacjentów, przydzielonych losowo do grupy leczonej pemetreksedem to: zakażenie bez neutropenii, gorączka neutropeniczna, reakcja alergiczna i (lub) nadwrażliwość, zwiększenie stężenia kreatyniny, neuropatia nerwów ruchowych, neuropatia nerwów czuciowych, rumień wielopostaciowy i ból brzucha.
Klinicznie istotne objawy toksyczności zgodne z CTC, które stwierdzono u <1% pacjentów przydzielonych losowo do grupy leczonej pemetreksedem to: arytmie nadkomorowe.
Stwierdzono podobieństwo istotnych klinicznie objawów toksyczności stopnia 3. i 4. obserwowanych w badaniach laboratoryjnych wykonanych w przebiegu trzech badań II fazy z zastosowaniem pemetreksedu w monoterapii (n = 164) i w opisanym wyżej badaniu III fazy, również dotyczącym zastosowania pemetreksedu w monoterapii. Różnice dotyczyły częstości występowania neutropenii (odpowiednio 12,8% versus 5,3%) i zwiększonej aktywności aminotransferazy alaninowej (odpowiednio 15,2% versus 1,9%). Stwierdzone różnice prawdopodobnie wynikały ze zróżnicowania populacji pacjentów, ponieważ w badaniach II fazy uczestniczyły zarówno pacjentki z rakiem piersi niepoddawane wcześniej chemioterapii, jak i pacjentki wcześniej intensywnie leczone z powodu raka piersi, z wykrytymi wcześniej przerzutami do wątroby i (lub) nieprawidłowymi wynikami badań czynności wątroby przed rozpoczęciem badań.
W zamieszczonej poniżej tabeli przedstawiono częstość występowania oraz nasilenie działań niepożądanych potencjalnie związanych ze stosowaniem leku jakie zgłoszono u >5% z 839 pacjentów z niedrobnokomórkowym rakiem płuca, których przydzielono w sposób losowy do grupy leczonej cisplatyną w skojarzeniu z pemetreksedem i u 830 pacjentów z niedrobnokomórkowym rakiem płuca, których przydzielono w sposób losowy do grupy otrzymującej cisplatynę w skojarzeniu
z gemcytabiną. Wszyscy pacjenci otrzymali badaną terapię jako leczenie pierwszego rzutu niedrobnokomórkowego raka płuca w stadium miejscowo zaawansowanym lub z przerzutami. W obu grupach wszystkim pacjentom podawano w odpowiednich dawkach kwas foliowy i witaminę B12.
Klasyfikacja układów i narządów | Częstość | Zdarzenie niepożądane** | Pemetreksed/Cisplatyna | Gemcytabina/cisplatyna | ||
(N = 839) | (N = 830) | |||||
Toksy- czność – wszystkie stopnie (%) | Toksy- czność - stopień 3 - 4 (%) | Toksy- czność – wszystkie stopnie (%) | Toksycz ność - stopień 3 - 4 (%) | |||
Zaburzenia krwi i układu chłonnego | Bardzo często | Zmniejszone stężenie hemoglobiny | 33,0* | 5,6* | 45,7* | 9,9* |
Zmniejszona liczba neutrofilów/granu locytów | 29,0* | 15,1* | 38,4* | 26,7* | ||
Zmniejszona liczba leukocytów | 17,8 | 4,8* | 20,6 | 7,6* | ||
Zmniejszona liczba płytek krwi | 10,1* | 4,1* | 26,6* | 12,7* | ||
Zaburzenia układu nerwowego | Często | Neuropatia nerwów czuciowych | 8,5* | 0,0* | 12,4* | 0,6* |
Zaburzenia smaku | 8,1 | 0,0*** | 8,9 | 0,0*** | ||
Zaburzenia żołądka i jelit | Bardzo często | Nudności | 56,1 | 7,2* | 53,4 | 3,9* |
Wymioty | 39,7 | 6,1 | 35,5 | 6,1 | ||
Jadłowstręt | 26,6 | 2,4* | 24,2 | 0,7* | ||
Klasyfikacja układów i narządów | Częstość | Zdarzenie niepożądane** | Pemetreksed/Cisplatyna | Gemcytabina/cisplatyna | ||
(N = 839) | (N = 830) | |||||
Toksy- czność – wszystkie stopnie (%) | Toksy- czność - stopień 3 - 4 (%) | Toksy- czność – wszystkie stopnie (%) | Toksycz ność - stopień 3 - 4 (%) | |||
Zaparcie | 21,0 | 0,8 | 19,5 | 0,4 | ||
Zapalenie jamy ustnej/ zapalenie gardła | 13,5 | 0,8 | 12,4 | 0,1 | ||
Biegunka bez kolostomii | 12,4 | 1,3 | 12,8 | 1,6 | ||
Często | Niestrawność/ Zgaga | 5,2 | 0,1 | 5,9 | 0,0 | |
Zaburzenia skóry i tkanki podskórnej | Bardzo często | Łysienie | 11,9* | 0*** | 21,4* | 0,5*** |
Często | Wysypka/ łuszczenie skóry | 6,6 | 0,1 | 8,0 | 0,5 | |
Zaburzenia nerek i dróg moczowych | Bardzo często | Zwiększenie stężenia kreatyniny | 10,1* | 0,8 | 6,9* | 0,5 |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Uczucie zmęczenia | 42,7 | 6,7 | 44,9 | 4,9 |
Odnotowane objawy przedawkowania to: neutropenia, niedokrwistość, małopłytkowość, zapalenie błon śluzowych, polineuropatia czuciowa i wysypka. Prawdopodobne powikłania przedawkowania to: mielosupresja, objawiająca się neutropenią, małopłytkowością i niedokrwistością. Mogą także wystąpić zakażenia z gorączką lub bez gorączki, biegunka i (lub) zapalenie błon śluzowych. Jeżeli podejrzewane jest przedawkowanie leku należy monitorować stan pacjenta, wykonując morfologię krwi, i w razie potrzeby wdrożyć leczenie podtrzymujące. Jeżeli doszło do przedawkowania pemetreksedu, należy rozważyć zastosowanie folianu wapnia i (lub) kwasu foliowego.
Grupa farmakoterapeutyczna: analogi kwasu foliowego, kod ATC: L01BA04
Pemetreksed to lek przeciwnowotworowy o wielokierunkowym działaniu, antagonista kwasu foliowego zaburzający podstawowe procesy metaboliczne wykorzystujące foliany niezbędne dla podziału komórek.
W badaniach in vitro wykazano, że wielokierunkowe działanie pemetreksedu polega na hamowaniu syntazy tymidylowej (TS), reduktazy dihydrofolianowej (DHFR) i formylotransferazy rybonukleotydu glicynamidowego (GARFT), czyli podstawowych enzymów wykorzystujących foliany, uczestniczących w biosyntezie de novo nukleotydów tymidynowych i purynowych. Transport pemetreksedu do wnętrza komórek odbywa się z udziałem systemu nośnika zredukowanych folianów i białka błonowego wiążącego foliany. W komórce pemetreksed jest szybko i wydajnie przekształcany w poliglutaminiany przez enzym syntetazę folylpoliglutaminianową. Poliglutaminiany pozostają we wnętrzu komórki i wykazują jeszcze silniejsze działanie hamujące TS i GARFT. Proces poliglutaminizacji, którego intensywność zależy od czasu i stężenia, zachodzi w komórkach nowotworowych oraz w mniejszym stopniu w prawidłowych tkankach organizmu. Metabolity powstające w wyniku poliglutaminizacji charakteryzują się przedłużonym okresem półtrwania wewnątrz komórki, co warunkuje dłuższe działanie leku w komórkach nowotworów złośliwych.
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań pemetreksedu we wszystkich podgrupach dzieci i młodzieży w przyznanych wskazaniach (patrz punkt 4.2).
Skuteczność kliniczna
Złośliwy międzybłoniak opłucnej
Badanie EMPHACIS (wieloośrodkowe, randomizowane badanie III fazy z pojedynczą ślepą próbą, porównujące stosowanie pemetreksedu w skojarzeniu z cisplatyną i cisplatyny u nieleczonych wcześniej chemioterapią pacjentów ze złośliwym międzybłoniakiem opłucnej) wykazało, że mediana czasu przeżycia pacjentów leczonych pemetreksedem w skojarzeniu z cisplatyną była o 2,8 miesiąca większa (różnica istotna statystycznie) w porównaniu z osobami leczonymi tylko cisplatyną.
W okresie trwania badania stosowano suplementację małymi dawkami kwasu foliowego i witaminy B12 w celu ograniczenia objawów toksyczności. W głównej analizie wykorzystano dane o wszystkich pacjentach przydzielonych losowo do jednej z podgrup, którzy otrzymali badany lek (pacjenci randomizowani i leczeni). Do analizy podgrup wybrano dane o pacjentach, którzy otrzymywali kwas foliowy i witaminę B12 przez cały okres leczenia ocenianego w badaniu (pacjenci z pełną suplementacją). Wyniki tych analiz skuteczności przedstawiono w poniższej tabeli:
Skuteczność stosowania skojarzenia pemetreksedu i cisplatyny, w porównaniu z monoterapią cisplatyną w leczeniu złośliwego międzybłoniaka opłucnej
Pacjenci randomizowani i leczeni | Pacjenci z pełną suplementacją | |||
Parametr skuteczności | Pemetreksed/ cisplatyna (N=226) | Cisplatyna (N=222) | Pemetreksed/ cisplatyna (N=168) | Cisplatyna (N=163) |
Mediana czasu przeżycia (miesiące) (95% CI) | 12,1 (10,0 - 14,4) | 9,3 (7,8 - 10,7) | 13,3 (11,4 - 14,9) | 10,0 (8,4 - 11,9) |
wartość p* w teście Log Rank | 0,020 | 0,051 | ||
Mediana czasu do progresji choroby (miesiące) (95% CI) | 5,7 (4,9 - 6,5) | 3,9 (2,8 - 4,4) | 6,1 (5,3 - 7,0) | 3,9 (2,8 - 4,5) |
wartość p* w teście Log Rank | 0,001 | 0,008 | ||
Czas do niepowodzenia leczenia (miesiące) (95% CI) | 4,5 (3,9 - 4,9) | 2,7 (2,1 - 2,9) | 4,7 (4,3 - 5,6) | 2,7 (2,2 - 3,1) |
wartość p* w teście Log Rank | 0,001 | 0,001 | ||
Całkowity odsetek odpowiedzi na | 41,3% | 16,7% | 45,5% | 19,6% |
leczenie** (95% CI) | (34,8 - 48,1) | (12,0 - 22,2) | (37,8 - 53,4) | (13,8 - 26,6) |
wartość p* w teście Fisher Exact | < 0,001 | < 0,001 | ||
Skróty: CI – przedział ufności
** w podgrupie pemetreksedu i cisplatyny w skojarzeniu: pacjenci przydzieleni losowo i leczeni (N = 225), pacjenci z pełną suplementacją (N = 167)
Stosując Skalę Objawów Raka Płuca (ang. Lung Cancer Symptom Scale) wykazano istotną statystycznie poprawę w odniesieniu do istotnych klinicznie objawów (ból i duszność) związanych ze złośliwym międzybłoniakiem opłucnej w grupie leczonej schematem pemetreksed i cisplatyna
w skojarzeniu (212 pacjentów), w porównaniu z grupą leczoną cisplatyną w monoterapii (218 pacjentów). Stwierdzono także istotne statystycznie różnice parametrów czynności płuc.
Obserwowane różnice między grupami były wynikiem poprawy stanu czynności płuc w grupie leczonej schematem pemetreksed i cisplatyna w skojarzeniu, jak również pogorszenia czynności płuc wraz z upływem czasu, w grupie kontrolnej.
Istnieją ograniczone dane na temat pacjentów ze złośliwym międzybłoniakiem opłucnej leczonych wyłącznie pemetreksedem. Badano stosowanie pemetreksedu w dawce 500 mg/m2 pc. w monoterapii u 64 pacjentów ze złośliwym międzybłoniakiem opłucnej, u których nie stosowano wcześniej chemioterapii. Całkowity odsetek odpowiedzi na leczenie wyniósł 14,1%.
Niedrobnokomórkowy rak płuca, leczenie drugiego rzutu
W wieloośrodkowym, randomizowanym, otwartym badaniu klinicznym III fazy porównującym stosowanie pemetreksedu i docetakselu u pacjentów z miejscowo zaawansowanym lub dającym przerzuty niedrobnokomórkowym rakiem płuca, otrzymujących wcześniej chemioterapię, wykazano mediany czasu przeżycia wynoszące 8,3 miesiąca w grupie leczonej pemetreksedem (populacja wyodrębniona zgodnie z zaplanowanym leczeniem, ang. Intent-To-Treat, ITT, n = 283) i 7,9 miesiąca w grupie leczonej docetakselem (populacja ITT n = 288). W schemacie leczenia pierwszego rzutu nie stosowano pemetreksedu. Analiza zależności między wynikami leczenia określonymi jako czas całkowitego przeżycia (ang. overall survival – OS), a typem histologicznym niedrobnokomórkowego raka płuca, wykazała przewagę pemetreksedu nad docetakselem u pacjentów
z niedrobnokomórkowym rakiem płuca o histologii innej niż w przeważającym stopniu płaskonabłonkowa (n = 399, 9,3 w porównaniu do 8 miesięcy, skorygowany współczynnik ryzyka (HR) = 0,78; 95% CI = 0,61-1,00, p = 0,047) i przewagę docetakselu u pacjentów z niedrobnokomórkowym rakiem płuca o histologii płaskonabłonkowej (n = 172, 6,2 w porównaniu do 7,4 miesięcy, skorygowany współczynnik ryzyka (HR) = 1,56; 95% CI = 1,08-2,26, p = 0,018). W obrębie poszczególnych podgrup histologicznych nie obserwowano istotnych klinicznie różnic w profilu bezpieczeństwa pemetreksedu.
Ograniczone dane kliniczne pochodzące z pojedynczego randomizowanego, kontrolowanego badania III fazy wskazują, że skuteczność pemetreksedu (mierzona jako czas całkowitego przeżycia – OS i czas przeżycia wolny od progresji choroby nowotworowej - PFS) u pacjentów leczonych wcześniej docetakselem (n=41) jest zbliżona do skuteczności obserwowanej u pacjentów, którzy nie byli wcześniej leczeni docetakselem (n=540).
Skuteczność pemetreksedu i docetakselu w niedrobnokomórkowym raku płuca – populacja wyodrębniona zgodnie z zaplanowanym leczeniem (ITT)
Pemetreksed | Docetaksel | |
Czas przeżycia (miesiące) | (n = 283) 8,3 (7,0 - 9,4) | (n = 288) 7,9 (6,3 - 9,2) |
0,99 (0,82 - 1,20) 0,226 | ||
Pemetreksed | Docetaksel | |
Czas przeżycia wolny od progresji choroby nowotworowej (miesiące) | (n = 283) 2,9 | (n = 288) 2,9 |
0,97 (0,82 – 1,16) | ||
Czas do niepowodzenia leczenia (miesiące) | (n = 283) 2,3 | (n = 288) 2,1 |
0,84 (0,71 - 0,997) | ||
Odpowiedź na leczenie (n: zakwalifikowani do analizy odpowiedzi na leczenie) | (n = 264) 9,1 (5,9 - 13,2) 45,8 | (n = 274) 8,8 (5,7 - 12,8) 46,4 |
Skróty: CI = przedział ufności, HR – współczynnik ryzyka, n = całkowita liczebność populacji
Niedrobnokomórkowy rak płuca, leczenie pierwszego rzutu
W wieloośrodkowym, randomizowanym, otwartym badaniu III fazy z udziałem pacjentów
z niedrobnokomórkowym rakiem płuca w stadium miejscowo zaawansowanym lub z przerzutami (stopień zaawansowania IIIb lub IV) niepoddawanych wcześniej chemioterapii, porównywano skuteczność pemetreksedu w skojarzeniu z cisplatyną oraz gemcytabiny w skojarzeniu z cisplatyną. W przypadku stosowania pemetreksedu w skojarzeniu z cisplatyną (populacja wyodrębniona zgodnie z zaplanowanym leczeniem, ang. Intent-To-Treat, ITT, n = 862) osiągnięto pierwszorzędowy punkt końcowy i uzyskano podobną skuteczność kliniczną, jak w przypadku stosowania gemcytabiny
w skojarzeniu z cisplatyną (ITT n = 863), w zakresie OS (skorygowany współczynnik ryzyka 0,94; 95% CI = 0,84-1,05). Stopień sprawności wszystkich pacjentów biorących udział w badaniu oceniano na 0 lub 1 w skali ECOG.
Pierwotną analizę skuteczności oparto na wynikach uzyskanych w populacji ITT. Analizy wrażliwości dla głównych punktów końcowych związanych ze skutecznością oceniano też w populacji wyodrębnionej zgodnie z protokołem (ang. Protocol Qualified - PQ). Analizy skuteczności oparte na wynikach uzyskanych w populacji PQ są zgodne z wynikami analizami dla populacji ITT
i potwierdzają nie mniejszą skuteczność (ang. non-inferiority) skojarzonej terapii pemetreksedem z cisplatyną, w porównaniu ze skojarzoną terapią gemcytabiną z cisplatyną.
Czas przeżycia wolny od progresji choroby nowotworowej (ang. Progression free survival – PFS) i całkowity odsetek odpowiedzi na leczenie (ORR) były podobne w obydwu ramionach badania. Mediana PFS wynosiła 4,8 miesiąca w przypadku skojarzonego stosowania produktu Pemetrexed
Zentiva z cisplatyną i 5,1 miesiąca w przypadku skojarzonego stosowania gemcytabiny z cisplatyną (skorygowany współczynnik ryzyka 1,04; 95% CI = 0,94-1,15). Całkowity odsetek odpowiedzi na leczenie wynosił 30,6% (95% CI = 27,3- 33,9) w przypadku skojarzonego stosowania pemetreksedu z cisplatyną i 28,2% (95% CI = 25,0-31,4) w przypadku skojarzonego stosowania gemcytabiny
z cisplatyną.
Wyniki PFS zostały po części potwierdzone niezależną oceną (do kontroli w sposób losowy wybrano 400 z 1725 pacjentów).
Analiza wpływu typu histologicznego niedrobnokomórkowego raka płuca na OS wykazała istotne klinicznie różnice czasu przeżycia w zależności od typu histologicznego, patrz tabela poniżej.
Skuteczność skojarzenia pemetreksedu i cisplatyny, w porównaniu ze skojarzoną terapią gemcytabiną z cisplatyną w leczeniu pierwszego rzutu niedrobnokomórkowego raka płuca – populacja ITT (ang. intent-to-treat) i podgrupy histologiczne
Populacja ITT i podział na podgrupy histologiczne | Mediana czasu przeżycia całkowitego w miesiącach (95% CI) | Skorygowany współczynnik ryzyka (HR) (95% CI) | Wartość p | |
pemetreksed + cisplatyna | gemcytabina + cisplatyna | |||
Populacja ITT i podział na podgrupy histologiczne | Mediana czasu przeżycia całkowitego w miesiącach (95% CI) | Skorygowany współczynnik ryzyka (HR) (95% CI) | Wartość p | |||
pemetreksed + cisplatyna | gemcytabina + cisplatyna | |||||
Populacja ITT (N = 1725) | 10,3 (9,8 – 11,2) | N=862 | 10,3 (9,6 – 10,9) | N=863 | 0,94a (0,84 – 1,05) | 0,259 |
Gruczołowy (N=847) | 12,6 (10,7 – 13,6) | N=436 | 10,9 (10,2 – 11,9) | N=411 | 0,84 (0,71–0,99) | 0,033 |
Wielkokomórkow y (N=153) | 10,4 (8,6 – 14,1) | N=76 | 6,7 (5,5 – 9,0) | N=77 | 0,67 (0,48–0,96) | 0,027 |
Inne (N=252) | 8,6 (6,8 – 10,2) | N=106 | 9,2 (8,1 – 10,6) | N=146 | 1,08 (0,81–1,45) | 0,586 |
Płaskonabłonkowy (N=473) | 9,4 (8,4 – 10,2) | N=244 | 10,8 (9,5 – 12,1) | N=229 | 1,23 (1,00–1,51) | 0,050 |
Skróty: CI = przedział ufności, ITT - populacja wyodrębniona zgodnie z zaplanowanym leczeniem,
N=całkowita liczebność populacji
a Statystycznie istotne jest, aby wykazać nie mniejszą skuteczność, przy całkowitym przedziale ufności dla współczynnika ryzyka znacznie poniżej przyjętej granicy 1,17645 (p <0,001).
Krzywe przeżywalności Kaplana Meiera w zależności od typu histologicznego
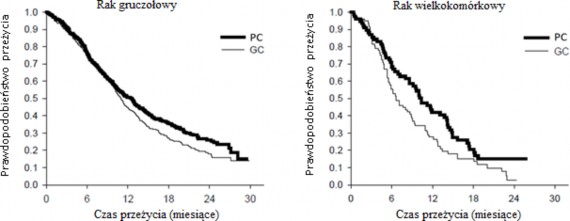
PC: pemetreksed + cisplatyna
GC: gemcytabina+cisplatyna
W obrębie poszczególnych podgrup histologicznych nie obserwowano istotnych klinicznie różnic w profilu bezpieczeństwa skojarzonej terapii pemetreksedem z cisplatyną.
Pacjenci leczeni pemetreksedem w skojarzeniu z cisplatyną rzadziej wymagali transfuzji krwi (16,4% w porównaniu z 28,9%, p<0,001), krwinek czerwonych (16,1% w porównaniu z 27,3%, p<0,001) i płytek krwi (1,8% w porównaniu z 4,5%, p=0,002). Pacjenci wymagali podania mniejszej ilości erytropoetyny lub darbepoetyny (10,4% w porównaniu z 18,1%, p<0,001), G-CSF/GM-CSF (3,1% w porównaniu z 6,1%, p=0,004), i produktów zawierających żelazo (4,3% w porównaniu
z 7,0%, p=0,021).
Niedrobnokomórkowy rak płuca, leczenie podtrzymujące JMEN
W wieloośrodkowym, randomizowanym, kontrolowanym placebo badaniu III fazy, z podwójnie ślepą
próbą (JMEN) porównywano skuteczność i bezpieczeństwo leczenia podtrzymującego pemetreksedem stosowanym łącznie z najlepszym leczeniem wspomagającym (BSC, ang. best supportive care)
(n = 441) z terapią polegającą na podawaniu placebo łącznie z najlepszym leczeniem wspomagającym (n = 222) u pacjentów z miejscowo zaawansowanym (stadium zaawansowania IIIB) lub z przerzutami (stadium zaawansowania IV) niedrobnokomórkowym rakiem płuca, u których nie stwierdzono progresji choroby po 4 cyklach terapii dwulekowej pierwszego rzutu, zawierającej cisplatynę lub karboplatynę w skojarzeniu z gemcytabiną, paklitakselem lub docetakselem. W dwulekowym schemacie leczenia pierwszego rzutu nie stosowano pemetreksedu. Stopień sprawności wszystkich pacjentów biorących udział w badaniu oceniono na 0 lub 1 w skali ECOG. Pacjenci otrzymywali leczenie podtrzymujące do czasu stwierdzenia progresji choroby. Skuteczność i bezpieczeństwo leczenia oceniano od momentu randomizacji po ukończeniu leczenia pierwszego rzutu. Mediana cykli leczenia wyniosła odpowiednio 5 dla leczenia podtrzymującego pemetreksedem oraz 3,5 dla placebo. Łącznie 213 pacjentów (48,3%) ukończyło ≥6 cykli leczenia, a 103 pacjentów ogółem (23,4%) ukończyło ≥10 cykli leczenia pemetreksedem.
Uzyskano pierwszorzędowy punkt końcowy badania i wykazano statystycznie istotne wydłużenie PFS w grupie leczonej pemetreksedem, w porównaniu z grupą placebo (n = 581, populacja analizowana niezależnie; mediana wyniosła odpowiednio 4 miesiące i 2 miesiące) (współczynnik ryzyka = 0,60; 95% CI = 0,49-0,73; p < 0,00001). Niezależna analiza wyników badań obrazowych pacjentów potwierdziła wyniki PFS uzyskane na podstawie oceny dokonanej przez badaczy. Mediana OS w całej populacji (n = 663) wyniosła 13,4 miesiąca w grupie leczonej pemetreksedem i 10,6 miesiąca
w grupie placebo, współczynnik ryzyka = 0,79 (95% CI = 0,65-0,95; p = 0,01192).
Podobnie jak w przypadku innych badań z zastosowaniem pemetreksedu, w badaniu JMEN obserwowano różnice skuteczności leczenia zależne od typu histologicznego niedrobnokomórkowego raka płuca. W przypadku pacjentów z niedrobnokomórkowym rakiem płuca o histologii innej niż
w przeważającym stopniu płaskonabłonkowa (n= 430, populacja analizowana niezależnie) mediana PFS wyniosła 4,4 miesiąca w grupie leczonej pemetreksedem i 1,8 miesiąca w grupie placebo, współczynnik ryzyka = 0,47; 95% CI = 0,37-0,60; p = 0,00001. Mediana OS u pacjentów
z niedrobnokomórkowym rakiem płuca o histologii innej niż w przeważającym stopniu płaskonabłonkowa (n = 481) wyniosła 15,5 miesiąca w grupie leczonej pemetreksedem
i 10,3 miesiąca w grupie placebo (współczynnik ryzyka = 0,70; 95% CI = 0,56-0,88; p = 0,002). Mediana OS łącznie z okresem leczenia pierwszego rzutu u pacjentów z niedrobnokomórkowym rakiem płuca o histologii innej niż w przeważającym stopniu płaskonabłonkowa wyniosła
18,6 miesiąca w grupie leczonej pemetreksedem i 13,6 miesiąca w grupie placebo (współczynnik ryzyka = 0,71; 95% CI = 0,56-0,88; p = 0,002).
Wyniki oceny PFS i OS u pacjentów z niedrobnokomórkowym rakiem płuca o histologii płaskonabłonkowej wskazują na brak przewagi leczenia pemetreksedem w porównaniu z placebo.
W obrębie poszczególnych podgrup histologicznych nie obserwowano istotnych klinicznie różnic w profilu bezpieczeństwa pemetreksedu.
JMEN: Krzywe Kaplana Meiera czasu przeżycia wolnego od progresji choroby nowotworowej i czasu przeżycia całkowitego pacjentów z niedrobnokomórkowym rakiem płuca o histologii innej niż w przeważającym stopniu płaskonabłonkowa, leczonych pemetreksedem oraz pacjentów otrzymujących placebo:
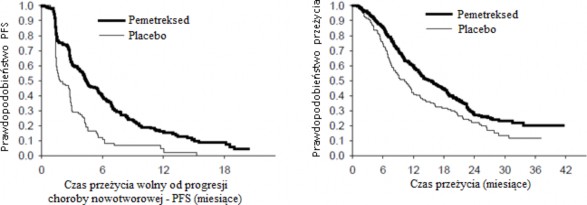
PARAMOUNT
W wieloośrodkowym, randomizowanym, kontrolowanym placebo badaniu III fazy, z podwójnie ślepą próbą (PARAMOUNT) porównywano skuteczność i bezpieczeństwo leczenia podtrzymującego pemetreksedem w ramach kontynuacji leczenia tym produktem stosowanym łącznie z najlepszą terapią wspomagającą (BSC, ang. best supportive care) (n = 359), z terapią polegającą na podawaniu placebo łącznie z najlepszą terapią wspomagającą (n = 180) u pacjentów z miejscowo zaawansowanym (stadium zaawansowania IIIB) lub uogólnionym (stadium zaawansowania IV) niedrobnokomórkowym rakiem płuca o histologii innej niż w przeważającym stopniu płaskonabłonkowa, u których nie stwierdzono progresji choroby po 4 cyklach terapii pierwszego rzutu pemetreksedem w skojarzeniu z cisplatyną. Spośród 939 pacjentów u których zastosowano jako lecznie pierwszego rzutu pemetreksed w skojarzeniu z cisplatyną, 539 losowo przydzielono losowo do grupy otrzymującej leczenie podtrzymujące polegające na podawaniu pemetreksedu lub placebo.
Wśród losowo przydzielonych pacjentów, u 44,9% obserwowano całkowitą lub częściową odpowiedź na leczenie pierwszego rzutu z zastosowaniem pemetreksedu w skojarzeniu z cisplatyną, natomiast
u 51,9% stwierdzono stabilizację choroby. Wymagano, aby stopień sprawności losowo dobranych pacjentów wynosił 0 lub 1 w skali ECOG. Mediana czasu od rozpoczęcia leczenia pierwszego rzutu pemetreksedem w skojarzeniu z cisplatyną do rozpoczęcia leczenia podtrzymującego wynosiła
2,96 miesiąca w grupie leczonej pemetreksedem i w grupie placebo. Losowo przydzieleni pacjenci otrzymywali leczenie podtrzymujące do czasu progresji choroby. Skuteczność i bezpieczeństwo oceniano od czasu randomizacji po zakończeniu leczenia pierwszego rzutu. Mediana cykli leczenia, które otrzymali pacjenci w ramach leczenia podtrzymującego pemetreksedem wyniosła odpowiednio 4 dla grupy otrzymującej pemetreksed oraz 4 dla grupy otrzymującej placebo. Łącznie 169 pacjentów (47,1%) otrzymało ≥6 cykli leczenia podtrzymującego produktem Pemetrexed Zentiva, co po uwzględnieniu liczby cykli leczenia pierwszego rzutu odpowiada łącznie co najmniej 10 cyklom leczenia pemetreksedem.
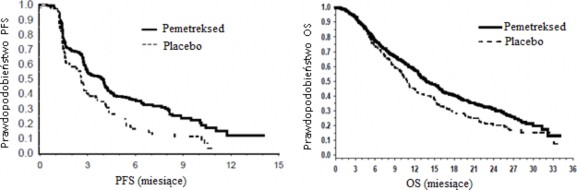
Osiągnięto pierwszorzędowy punkt końcowy badania i wykazano statystycznie istotne wydłużenie PFS w grupie leczonej pemetreksedem, w porównaniu z grupą placebo (n = 472, niezależna analiza populacji; mediana wyniosła odpowiednio 3,9 miesiąca i 2,6 miesiąca) (współczynnik ryzyka = 0,64; 95% CI = 0,51-0,81; p = 0,0002). Niezależna analiza wyników badań obrazowych wykonanych
u pacjentów potwierdziła dokonaną przez badaczy ocenę PFS. Mediana PFS pacjentów przydzielonych losowo do leczenia podtrzymującego oceniona przez badaczy od rozpoczęcia leczenia pierwszego rzutu pemetreksedem w skojarzeniu z cisplatyną wyniosła 6,9 miesiąca w grupie leczonej pemetreksedem i 5,6 miesiąca w grupie placebo (współczynnik ryzyka = 0,59 95% CI = 0,47-0,74).
Podczas kontynuacji terapii pemetreksedem po zastosowaniu pemetreksedu w skojarzeniu z cisplatyną jako leczenia pierwszego rzutu (4 cykle) wykazano istotne statystycznie wydłużenie czasu całkowitego przeżycia (ang. overall survival – OS) w porównaniu z placebo (mediana 13,9 miesiąca vs 11 miesięcy, współczynnik ryzyka = 0,78; 95% CI=0,64-0,96; p=0,0195). W momencie przeprowadzania końcowej analizy całkowitego przeżycia, 28,7% pacjentów z grupy otrzymującej pemetreksed pozostawało przy życiu lub nie było dalej obserwowanych pod kątem przeżycia (ang. lost to follow-up) w porównaniu do 21,7% pacjentów z grupy otrzymującej placebo. Obiektywne wyniki
leczenia pemetreksedem były zgodne wśród badanych podgrup (również w podgrupach uwzględniających stopień zaawansowania choroby, odpowiedź na leczenie pierwszego rzutu, stopień sprawności w skali ECOG, fakt palenia lub niepalenia tytoniu, płeć, typ histologiczny nowotworu oraz wiek) i podobne do uzyskanych podczas analizy nieskorygowanych wartości OS i PFS. Wskaźnik przeżyć rocznych i dwuletnich w grupie pacjentów otrzymujących pemetreksed wyniósł odpowiednio 58% i 32%, a w grupie placebo 45% i 21%. Mediana OS mierzonego od rozpoczęcia leczenia pierwszego rzutu z zastosowaniem pemetreksedu w skojarzeniu z cisplatyną u pacjentów otrzymujących pemetreksed wyniosła 16,9 miesięcy a w grupie otrzymującej placebo 14 miesięcy (współczynnik ryzyka = 0,78; 95% CI= 0,64-0,96). Odsetek pacjentów, którzy otrzymali dalsze leczenie po zakończeniu udziału w badaniu wyniósł 64,3% w grupie otrzymującej pemetreksed
i 71,7% w grupie placebo.
PARAMOUNT: Krzywe Kaplana Meiera czasu przeżycia wolnego od progresji choroby nowotworowej (PFS) i czasu całkowitego przeżycia (OS) w przypadku leczenia podtrzymującego pemetreksedem w ramach kontynuacji leczenia tym lekiem, w porównaniu z placebo, u chorych na niedrobnokomórkowego raka płuca o histologii innej niż w przeważającym stopniu płaskonabłonkowa (od czasu randomizacji)
Czas przeżycia wolny od progresji choroby nowotworowej | Czas całkowitego przeżycia |
Profil bezpieczeństwa pemetreksedu stosowanego w leczeniu podtrzymującym w badaniach JMEN i PARAMOUNT był podobny.
Właściwości farmakokinetyczne pemetreksedu oceniano po leczeniu monoterapią u 426 pacjentów chorych na różne odmiany złośliwych guzów litych. Wielkość dawki leku wahała się od 0,2 do 838 mg/m2 pc. Lek podawano we wlewie dożylnym przez 10 minut. Objętość dystrybucji pemetreksedu w stanie równowagi dynamicznej wynosi 9 l/m2. Z badań in vitro wynika, że stopień
wiązania pemetreksedu z białkami osocza wynosi około 81%. Nie stwierdzono znaczącego wpływu stopnia zaburzeń czynności nerek na wiązanie się leku z białkami osocza. Pemetreksed
w ograniczonym stopniu jest metabolizowany w wątrobie. Lek jest wydalany głównie w moczu: w ciągu pierwszej doby po podaniu leku w moczu znajduje się 70% - 90% dawki w postaci niezmienionej. Badania in vitro wskazują, że pemetreksed jest aktywnie wydzielany przez OAT3 (ang. organic anion transporter - transporter anionów organicznych). Całkowity klirens układowy
pemetreksedu wynosi 91,8 ml/min, a końcowy okres półtrwania u pacjentów z prawidłową czynnością nerek (klirens kreatyniny 90 ml/min) jest równy 3,5 godziny. Zmienność wartości klirensu oznaczanych u różnych pacjentów jest niewielka i wynosi 19,3%. Całkowite narażenie organizmu na pemetreksed (AUC) i największe stężenie w osoczu zmieniają się proporcjonalnie do dawki leku.
Właściwości farmakokinetyczne pemetreksedu u pacjentów poddawanych wielokrotnym cyklom leczenia pozostają takie same.
Podawana równocześnie cisplatyna nie zmienia właściwości farmakokinetycznych pemetreksedu, podobnie jak suplementacja kwasem foliowym (doustnie) i witaminą B12 (domięśniowo).
Po podaniu pemetreksedu ciężarnym samicom myszy obserwowano zmniejszoną zdolność płodów do życia, zmniejszenie masy ciała płodów, niepełne kostnienie niektórych struktur kostnych i rozszczep podniebienia.
Po podaniu pemetreksedu samcom myszy obserwowano szkodliwy wpływ na reprodukcję, objawiający się zmniejszoną płodnością i zanikiem jąder. W badaniu, w którym psom rasy beagle przez 9 miesięcy podawano lek w bolusie, obserwowano szkodliwy wpływ na jądra (zwyrodnienie lub martwicę nabłonka plemnikotwórczego). Wskazuje to, że pemetreksed może zaburzać płodność osobników męskich. Nie badano płodności samic.
Pemetreksed nie wykazywał działania mutagennego ani w teście aberracji chromosomalnych w komórkach jajnika chomika chińskiego in vitro, ani w teście Amesa. In vivo w teście mikrojądrowym u myszy wykazano klastogenność pemetreksedu.
Nie badano potencjalnego działania rakotwórczego pemetreksedu.
L-Arginina L-Cysteina
Glikol propylenowy Kwas cytrynowy Woda do wstrzykiwań
Pemetreksed powoduje fizyczną niezgodność z rozcieńczalnikami zawierającymi wapń, w tym
z roztworem Ringera do wstrzykiwań z mleczanami i roztworem Ringera do wstrzykiwań. Nie wolno mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności.
Produkt Pemetrexed Zentiva zawiera L-Argininę jako substancję pomocniczą. L-Arginina jest niezgodna z cisplatyną, powodując rozkład cisplatyny. Nie mieszać produktu leczniczego z innymi produktami leczniczymi.
Zestaw do infuzji dożylnej powinien zostać przepłukany po podaniu produktu Pemetrexed Zentiva.
Zamknięta fiolka 2 lata.
Roztwór rozcieńczony
Wykazano trwałość fizyczną i chemiczną sporządzonych roztworów i roztworów do wlewu, które były przechowywane w lodówce (2°C do 8°C) przez okres 24 godzin. Z mikrobiologicznego punktu widzenia produkt powinien być wykorzystany natychmiast po rozcieńczeniu. Jeżeli produkt nie zostanie natychmiast zużyty, odpowiedzialność za okres przechowywania i warunki przechowywania przed użyciem ponosi użytkownik: roztwór należy przechowywać w temperaturze 2°C do 8ºC przez okres nie dłuższy niż 24 godziny.
Przechowywać w miejscu chronionym przed światłem.
Zamknięta fiolka
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego. Nie zamrażać.
Warunki przechowywania produktu leczniczego po rozcieńczeniu, patrz punkt 6.3.
Produkt Pemetrexed Zentiva znajduje się w fiolce ze szkła typu I zawierającej 4 ml, 20 ml lub 40 ml koncentratu. Fiolki zamknięte są gumowym korkiem (wykonanym z bromobutylu), wyposażone
w wieczko typu flip-top.
Jedna fiolka w 4 ml koncentratu (kremowe wieczko typu flip-top) zawiera 100 mg pemetreksedu (w postaci pemetreksedu diargininy).
Jedna fiolka w 20 ml koncentratu (niebieskie wieczko typu flip-top) zawiera 500 mg pemetreksedu (w postaci pemetreksedu diargininy).
Jedna fiolka w 40 ml koncentratu (zielone wieczko typu flip-top) zawiera 1000 mg pemetreksedu (w postaci pemetreksedu diargininy).
Opakowanie zawiera jedną fiolkę.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Zentiva, k.s.
U kabelovny 130 Dolní Mĕcholupy 102 37 Praga 10 Republika Czeska
24658
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 30 marca 2018
09/2019











