Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
jest umieszczona w szczelinie znajdującej się w górnej części inhalatora Penthrox.
Ręcznie usunąć zakrętkę butelki.
Ewentualnie: użyć podstawy inhalatora Penthrox do
poluzowania zakrętki butelki – należy wsunąć ją do podstawy inhalatora i obrócić o 180º(pół obrotu). Oddzielić inhalator od butelki i ręcznie zdjąć zakrętkę.
Trzymać inhalator Penthrox pod kątem 45°
i wlać do jego podstawy całą zawartość jednej butelki produktu leczniczego Penthrox, jednocześnie
kilkakrotnie obracając inhalator wokół jego osi.
Założyć pacjentowi taśmę zabezpieczającą na nadgarstek.
 Pacjent oddycha poprzez ustnik inhalatora
Pacjent oddycha poprzez ustnik inhalatoraPenthrox w celu uśmierzenia bólu. Należy poinstruować pacjenta, że pierwsze wdechy przez inhalator powinien wykonywać ostrożnie, a następnie powinien zacząć oddychać normalnie.

Pacjent także wydycha do inhalatora Penthrox.
Wydychane opary przechodzą przez komorę
z węglem aktywnym w celu wychwycenia wszelkich pozostałości metoksyfluranu.

Jeśli zachodzi potrzeba uzyskania silniejszego
działania przeciwbólowego, pacjent (w czasie inhalacji)
może zakryć palcem otwór umieszczony w górnej części komory z węglem aktywnym.
W przypadku konieczności dalszego utrzymania
efektu przeciwbólowego po zużyciu pierwszej butelki, można zastosować drugą butelkę leku, jeśli jest dostępna.
Ewentualnie można użyć butelki z nowego pakietu. Przygotować do stosowania tak samo, jak w przypadku poprzedniej dawki (kroki 2 i 3).
Nie ma potrzeby wymiany komory z węglem aktywnym. Zużytą butelkę umieścić w dołączonej plastikowej torbie.

Pacjenta należy poinformować, że w celu uzyskania
odpowiedniego efektu przeciwbólowego powinien on wykonywać inhalacje z przerwami. Ciągła inhalacja skraca czas działania przeciwbólowego. Pacjent powinien stosować minimalną dawkę pozwalającą na uzyskanie skutecznej kontroli bólu.

Zakręcić pustą butelkę produktu leczniczego Penthrox.
Umieścić zużyty inhalator Penthrox i pustą butelkę w zamykanej torbie plastikowej i odpowiednio zutylizować (patrz punkt 6.6).
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Stosować najniższą dawkę zapewniającą skuteczną kontrolę dolegliwości bólowych.
Ostrożnie stosować u pacjentów w podeszłym wieku oraz u chorych ze znanymi czynnikami ryzyka chorób nerek.
Ostrożnie stosować u pacjentów z rozpoznanymi stanami klinicznymi, które mogą prowadzić do uszkodzenia nerek.
Metoksyfluran w wysokich dawkach wykazuje silne działanie nefrotoksyczne. Uważa się, że nefrotoksyczność wiąże się ze wzrostem stężenia nieorganicznych jonów fluorkowych, produktu przemian metabolicznych metoksyfluranu. W przypadku podawania metoksyfluranu w dawkach
przeciwbólowych pojedyncza dawka 3 ml metoksyfluranu skutkuje stężeniem nieorganicznych jonów fluorkowych w osoczu wynoszącym poniżej 10 mikromol/l. W przeszłości, kiedy metoksyfluran w wysokich dawkach był stosowany jako anestetyk, wykazywał on silne działanie nefrotoksyczne, które
‒ jak ustalono ‒ występuje, gdy poziom nieorganicznych jonów fluorkowych przekracza poziom 40 mikromol/l. Nefrotoksyczność związana jest również z tempem metabolizmu. Dlatego czynniki wpływające na przyspieszenie metabolizmu, takie jak leki pobudzające enzymy wątrobowe, mogą zwiększać ryzyko toksyczności metoksyfluranu, podobnie jak jest to obserwowane w przypadku
subpopulacji osób z uwarunkowaniami genetycznymi, które mogą prowadzić do szybkiej przemiany materii (patrz punkt 4.5).
Zaburzenia czynności wątroby
Metoksyfluran jest metabolizowany w wątrobie, dlatego u osób z zaburzeniami czynności wątroby zwiększona ekspozycja na ten lek może skutkować działaniem toksycznym. Produktu leczniczego Penthrox nie wolno stosować u pacjentów z oznakami niewydolności wątroby spowodowanej
wcześniejszym użyciem metoksyfluranu lub środków znieczulających z grupy halogenowanych
węglowodorów (patrz punkt 4.3). Produkt leczniczy Penthrox należy ostrożnie stosować u pacjentów z chorobą wątroby lub z ryzykiem wystąpienia zaburzeń czynności wątroby (np. u osób
przyjmujących substancje zwiększające aktywność enzymów ‒ patrz także punkt 4.5).
Istnieją doniesienia wskazujące, że uprzednia ekspozycja na środki znieczulające z grupy
halogenowanych węglowodorów (w tym na metoksyfluran, gdy był on w przeszłości stosowany jako anestetyk), zwłaszcza w okresie ostatnich trzech miesięcy, może zwiększać ryzyko uszkodzenia
wątroby.
Należy zachować ostrożność w ocenie klinicznej, w przypadku gdy produkt leczniczy Penthrox jest stosowany częściej niż w jednym przypadku w okresie trzech miesięcy.
Depresyjny wpływ na układ krążenia/stosowanie w populacji pacjentów w podeszłym wieku
Metoksyfluran w dawkach anestetycznych, podobnie jak inne środki znieczulające, może powodować obniżenie ciśnienia krwi oraz spowolnienie rytmu serca. W przypadku dawek przeciwbólowych wpływ metoksyfluranu na układ krążenia nie wydaje się znaczący. Nie ma określonego wzorca w
zakresie skurczowego ciśnienia tętniczego po podaniu metoksyfluranu w dawkach przeciwbólowych, w podziale na grupy wiekowe. Jednakże w związku ze zwiększonym ryzykiem w przypadku starszych pacjentów z niedociśnieniem i bradykardią, należy zachować ostrożność u chorych w podeszłym
wieku w związku z ryzykiem spadku ciśnienia krwi. Wpływ na ośrodkowy układ nerwowy
Działanie farmakodynamiczne metoksyfluranu obejmuje potencjalny wpływ na ośrodkowy układ nerwowy (OUN), skutkujący takimi objawami, jak sedacja, euforia, utrata pamięci, zaburzenia koncentracji, zaburzenia koordynacji czuciowo-ruchowej oraz zmiany nastroju, które są
charakterystyczne dla całej grupy farmakologicznej. Samodzielnie stosowanie metoksyfluranu w dawkach przeciwbólowych powinno być ograniczone w przypadku stwierdzenia objawów niepożądanych ze strony OUN, takich jak sedacja. Chociaż potencjalny wpływ metoksyfluranu na OUN może być postrzegany jako czynnik ryzyka jego nadużywania, doniesienia dotyczące takich przypadków po wprowadzeniu produktu na rynek są bardzo nieliczne.
Depresja oddechowa
Depresję oddechową notowano również po podaniu w dawkach przeciwbólowych (punkt 4.8). Należy monitorować oddech ze względu na ryzyko depresji oddechowej i hipoksji.
Wielokrotne stosowanie
Ze względu na ograniczenie wielkości dawki produktu leczniczego Penthrox (patrz punkt 4.2) oraz czasu trwania działania przeciwbólowego produkt leczniczy Penthrox nie jest wskazany do stosowania w leczeniu bólu przebijającego lub zaostrzenia bólu w przebiegu schorzeń przewlekłych, w kontrolowaniu bólu w chorobach przewlekłych ani w terapii pacjentów z bólem pourazowym, wymagających częstego podawania leku przeciwbólowego.
Butylohydroksytoluen
Produkt leczniczy Penthrox zawiera substancję pomocniczą ‒ środek stabilizujący ‒ butylohydroksytoluen (E321). Butylohydroksytoluen może powodować miejscową reakcją skórną (np. kontaktowe zapalenie skóry) lub podrażnienie oczu i błon śluzowych (patrz punkt 6.1).
Narażenie zawodowe
Fachowi pracownicy służby zdrowia regularnie wystawieni na ekspozycję na produkt leczniczy Penthrox powinni znać i stosować odpowiednie zasady bezpieczeństwa i higieny pracy dotyczące
leków wziewnych. W celu zmniejszenia narażenia zawodowego produkt leczniczy Penthrox powinien być zawsze stosowany z komorą z węglem aktywnym, który adsorbuje wydychany metoksyfluran.
Wielokrotne stosowanie inhalatora Penthrox bez komory z węglem aktywnym stanowi dodatkowe ryzyko ekspozycji na lek.
W przeszłości u personelu na oddziałach położniczych, gdzie metoksyfluran był stosowany u pacjentek w czasie porodu, zgłaszano przypadki zwiększonej aktywności enzymów wątrobowych, wzrostu stężenia azotu mocznika we krwi oraz podwyższonego poziomu kwasu moczowego
w surowicy.
Zgłaszano przypadki nieciężkich i przemijających działań, takich jak zawroty głowy, ból głowy, nudności lub złe samopoczucie, oraz przypadki reakcji nadwrażliwości na metoksyfluran lub inne składniki, u fachowego personelu medycznego narażonego na działanie produktu leczniczego Penthrox. Pomiary poziomu ekspozycji na metoksyfluran u pracowników szpitalnych wykazywały poziomy o wiele niższe od tych związanych z nefrotoksycznością.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
interakcji leku z induktorami enzymów wątrobowych (np. barbiturany) zwiększającymi metabolizm metoksyfluranu, co skutkowało zgłoszeniami kilku przypadków wystąpienia toksycznego uszkodzenia nerek. Dostępne są niewystarczające informacje, aby móc stwierdzić, czy indukcja enzymów wątrobowych po podaniu metoksyfluranu w dawkach przeciwbólowych ma niekorzystny wpływ na czynność wątroby.
zmniejszenia przepływu krwi w nerkach, a co za tym idzie spodziewanego nasilenia
niekorzystnego wpływu na nerki, gdy metoksyfluran był stosowany jednocześnie z lekami zmniejszającymi rzut minutowy serca (np. barbiturany).
depresyjnego wpływu na układ krążenia charakterystycznego dla całej grupy farmakologicznej, który może ulec nasileniu przy jednoczesnym stosowaniu innych leków wykazujących depresyjny wpływ na układ krążenia np. praktololu podawanego dożylnie w trakcie operacji kardiochirurgicznych.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
związane z produktem leczniczym Penthrox zgłaszane w badaniach klinicznych dotyczących kontrolowania bólu;
zgłaszane w odniesieniu do metoksyfluranu stosowanego jako środka przeciwbólowego odnotowane po wprowadzeniu produktu do obrotu;
związane z metoksyfluranem stosowanym jako środek przeciwbólowy zgłaszane po wprowadzeniu produktu do obrotu oraz odnotowane w publikacjach naukowych.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
woda/gaz ‒ 4,5,
krew/gaz – 13,
tłuszcz/gaz – 825.
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
10 butelek po 3 ml, w tekturowym pudełku.
1 lub 10 zestawów. W zestawie: jedna butelka zawierająca 3 ml metoksyfluranu 99,9% z zabezpieczeniem gwarancyjnym, jeden inhalator Penthrox oraz jedna komora zawierająca węgiel aktywny, w tekturowym pudełku
Szczególne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER(-Y) POZWOLENIA(Ń) NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Penthrox, 99,9%, płyn do sporządzania inhalacji parowej.
Jedna butelka zawiera 3 ml metoksyfluranu 99,9% (Methoxyfluranum).
Substancja pomocnicza o znanym działaniu: butylohydroksytoluen (E 321) (0,01% w/w).
Płyn do sporządzania inhalacji parowej.
Przezroczysta, niemal bezbarwna, lotna ciecz o charakterystycznym owocowym zapachu.
Doraźne uśmierzanie bólu od umiarkowanego do silnego, w przypadku urazu u przytomnych, dorosłych pacjentów.
Produkt leczniczy Penthrox przyjmowany jest samodzielnie przez pacjenta za pomocą inhalatora Penthrox, zabezpieczonego taśmą na nadgarstek, pod nadzorem osoby przeszkolonej w zakresie jego stosowania (lekarza i/lub personelu pielęgniarskiego i/lub ratownika medycznego). Produkt leczniczy jest wdychany przez pacjenta za pośrednictwem inhalatora Penthrox, przeznaczonego do
jednorazowego użytku. Dawkowanie
Dorośli
Zalecaną dawkę pojedynczą stanowi jedna butelka zawierająca 3 ml leku, podawana za pomocą dołączonego inhalatora. W razie potrzeby można zastosować drugą butelkę zawierającą 3 ml leku.
Częstość podawania produktu leczniczego Penthrox, zapewniająca bezpieczne stosowanie leku, nie została ustalona (patrz punkt 4.4). Zaleca się następujące stosowanie produktu leczniczego Penthrox: maksymalna dawka dobowa wynosi 6 ml, nie należy podawać leku w następujących po sobie dniach; maksymalna całkowita dawka tygodniowa dla pacjenta nie powinna przekraczać 15 ml.
Początek działania przeciwbólowego po zastosowaniu produktu leczniczego Penthrox jest szybki i występuje po pierwszych 6‒10 wdechach. Pacjenta należy poinstruować, aby w celu uzyskania odpowiedniej kontroli bólu, wykonywał inhalacje w sposób przerywany. Pacjenci sami są w stanie ocenić poziomu odczuwanego przez nich bólu i dostosowywać ilości wdychanego produktu leczniczego Penthrox w celu zapewnienia odpowiedniej kontroli bólu (złagodzenia dolegliwości bólowych). Ciągła inhalacja zawartością jednej 3ml butelki skutkuje działaniem przeciwbólowym utrzymującym się przez 25‒30 minut. Czas ten może zostać wydłużony poprzez przerywane stosowanie leku. Pacjenta należy poinformować, że produkt leczniczy Penthrox powinien być stosowany w możliwie najniższej skutecznej dawce (patrz punkt 4.4).
Zaburzenia czynności nerek
Metoksyfluran może powodować niewydolność nerek w przypadku przekroczenia zalecanej dawki. Należy zachować ostrożność w przypadku pacjentów z rozpoznaniem stanów klinicznych, które mogą prowadzić do uszkodzenia nerek (patrz punkt 4.4).
Zaburzenia czynności wątroby
Należy przeprowadzić baczną ocenę kliniczną, w przypadku gdy produkt leczniczy Penthrox jest stosowany częściej niż raz w okresie trzech miesięcy (patrz punkt 4.4).
Dzieci i młodzież
Produkt leczniczy Penthrox nie powinien być stosowany u dzieci i młodzieży w wieku poniżej 18 lat. Sposób podawania
Podanie wziewne.
Poniżej przedstawiono instrukcje dotyczące odpowiedniego przygotowania inhalatora Penthrox do użytku i właściwego sposobu jego używania.

Należy upewnić się, że komora z węglem aktywnym


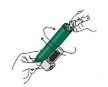
Lekarz, personel pielęgniarski lub ratownik medyczny lub osoba przeszkolona w zakresie stosowania produktu leczniczego Penthrox muszą dostarczyć pacjentowi ulotkę dla pacjenta i zapoznać go z jej treścią.
Stosowanie jako środek znieczulający.
Nadwrażliwość na metoksyfluran, którykolwiek fluorowany środek znieczulający lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Hipertermia złośliwa – zarówno u pacjentów ze stwierdzoną chorobą, jak i u osób genetycznie podatnych na to schorzenie.
U pacjentów z ciężką reakcją niepożądaną lub pacjentów ze stwierdzoną ciężką reakcją niepożądaną w wywiadzie rodzinnym, po podaniu wziewnych środków znieczulających.
U pacjentów, u których w przeszłości lub obecnie stwierdzono uszkodzenie wątroby w wyniku uprzedniego stosowania metoksyfluranu lub środków znieczulających z grupy halogenowanych węglowodorów.
Klinicznie znaczące zaburzenia czynności nerek.
Zaburzone stany świadomości z jakiegokolwiek powodu, w tym wskutek urazu głowy, przyjmowania substancji psychoaktywnych lub spożywania alkoholu.
Klinicznie występująca niestabilność sercowo-naczyniowa. Klinicznie występująca depresja oddechowa.
Zaburzenia czynności nerek
W celu zapewnienia bezpieczeństwa stosowania produktu leczniczego Penthrox jako środka przeciwbólowego należy przestrzegać następujących środków ostrożności:
Metoksyfluran jest metabolizowany przy udziale enzymów CYP 450, głównie przez CYP 2E1, CYP 2B6 i do pewnego stopnia przez CYP 2A6. Jest możliwe, że induktory tego enzymu (takie jak alkohol i izoniazyd w przypadku CYP 2E1 oraz fenobarbital i ryfampicyma w przypadku CYP 2A6 oraz karbamazepina, efawirenz, ryfampicyna lub newirapina w przypadku CYP 2B6), powodują
wzrost wskaźnika metabolizmu metoksyfluranu i mogą zwiększać ryzyko toksyczności, dlatego należy unikać jednoczesnego stosowania tych substancji z metoksyfluranem.
Należy unikać jednoczesnego stosowania metoksyfluranu i produktów leczniczych (np. środków kontrastowych lub niektórych antybiotyków), które wykazują działanie nefrotoksyczne, ponieważ może to skutkować addytywnym działaniem w zakresie toksycznego uszkodzenia nerek. Do grupy
antybiotyków o znanym potencjale nefrotoksycznym zalicza się tetracyklinę, gentamycynę, kolistynę, polimyksynę B i amfoterycynę B. Zaleca się unikanie stosowania środka znieczulającego – sewofluranu ‒ po podaniu metoksyfluranu jako środka przeciwbólowego, ponieważ sewofluran
zwiększa poziom jonów fluorkowych w osoczu, a nefrotoksyczne działanie metoksyfluranu jest także związane ze wzrostem stężenia jonów fluorkowych w osoczu.
Jednoczesne stosowanie produktu leczniczego Penthrox z substancjami o działaniu depresyjnym na OUN, takimi jak opioidy, leki o działaniu sedatywnym, nasennym, środki do znieczulenia ogólnego, fenotiazyna, trankwilizatory, leki zwiotczające mięśnie, leki przeciwhistaminowe o działaniu uspokajającym oraz alkohol, może nasilać działanie depresyjne metoksyfluranu. W przypadku jednoczesnego stosowania opioidów z produktem leczniczym Penthrox pacjenci powinni być
szczególnie obserwowani, zgodnie z obowiązującą praktyką kliniczną dotyczącą terapii lekami opioidowymi.
W przeszłości, gdy metoksyfluran był stosowany w wyższych dawkach (40‒60 ml) jako środek znieczulający, odnotowywano przypadki:
Płodność
Nie są dostępne dane kliniczne dotyczące wpływu metoksyfluranu na płodność. Nieliczne dane z badań na zwierzętach wykazują brak wpływu na morfologię nasienia.
Ciąża
Badania na zwierzętach wykazały toksyczny wpływ na płodność (patrz punkt 5.3).
W przypadku stosowania metoksyfluranu w łagodzeniu bólu porodowego u kobiet w ciąży odnotowano pojedyncze zgłoszenie dotyczące wystąpienia depresji oddechowej noworodków związanej z wysokim stężeniem metoksyfluranu u płodu. Jednakże w przypadku zastosowania niższego stężenia lub krótszej ekspozycji na wyższe stężenie, zgodnie z zaleceniami dotyczącymi dawkowania, metoksyfluran miał nieznaczny wpływ na płód. Wyniki wszystkich badań z zakresu
łagodzenia bólu porodowego nie wykazały żadnych powikłań u płodów po zastosowaniu u ich matek metoksyfluranu jako środka przeciwbólowego.
Podobnie jak w przypadku wszystkich produktów leczniczych należy zachować ostrożność podczas stosowania metoksyfluranu u kobiet w ciąży, zwłaszcza podczas pierwszego trymestru ciąży.
Karmienie piersią
Brak jest wystarczających informacji na temat przenikania metoksyfluranu do mleka matki. Należy zachować ostrożność podczas stosowania metoksyfluranu u kobiet karmiących piersią.
Metoksyfluran może mieć niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Po podaniu metoksyfluranu mogą wystąpić zawroty głowy i senność (patrz punkt 4.8).
Należy ostrzec pacjentów, aby powstrzymali się od prowadzenia pojazdów i obsługiwania maszyn w przypadku odczuwania senności lub zawrotów głowy.
Podsumowanie profilu bezpieczeństwa
Często obserwowane inne niż ciężkie działania niepożądane to reakcje ze strony OUN ‒ zawroty głowy i senność; działania te ogólnie są łatwo odwracalne.
Tabelaryczne zestawienie działań niepożądanych
Ryzyko wystąpienia ciężkiego zależnego od dawki toksycznego uszkodzenia nerek związane jest wyłącznie z podawaniem wysokich dawek metoksyfluranu przez dłuższy czas podczas znieczulenia ogólnego. Dlatego metoksyfluran przestał być stosowany jako środek znieczulający (patrz punkt 4.4 ‒ Zaburzenia czynności nerek). Nie należy przekraczać zalecanej maksymalnej dawki produktu leczniczego Penthrox.
W poniższej tabeli przedstawiono działania niepożądane:
Częstość występowania działań niepożądanych została zdefiniowana w następujący sposób: Bardzo często (≥1/10)
Często (od ≥1/100 do <1/10)
Niezbyt często (od ≥1/1000 do <1/100) Rzadko (od ≥1/10 000 do <1/1000) Bardzo rzadko (<1/10 000)
Nieznana (częstość nie może być określona na podstawie dostępnych danych)
Klasyfikacja układów i narządów MedDRA | Bardzo często ≥1/10 | Często od ≥1/100 do <1/10 | Niezbyt często od ≥1/1000 do <1/100 | Częstość nieznana |
Zaburzenia układu immunologicznego | Nadwrażliwość^ | |||
Zaburzenia metabolizmu i odżywiania | Wzmożone łaknienie | |||
Zaburzenia psychiczne | Euforia | Niepokój, depresja, zaburzenia uwagi, afekt niedostosowany, werbigeracje | Niestabilność emocjonalna^, pobudzenie^, stany splątania^, dysocjacja^, niepokój (zwłaszcza ruchowy)^ | |
Zaburzenia układu nerwowego | Zawroty głowy | Ból głowy, senność, zaburzenia smaku | Niepamięć dyzartria, parestezja, obwodowa neuropatia czuciowa | Odmienne stany świadomości^, oczopląs^ |
Zaburzenia oka | Zaburzenie widzenia | |||
Zaburzenia naczyniowe | Zaczerwienienie skóry, nadciśnienie, niedociśnienie | |||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Kaszel | Zadławienie^, hipoksja^ Depresja oddechowa^ | ||
Zaburzenia żołądka i jelit | Nudności | Suchość w ustach, dyskomfort w jamie ustnej, świąd jamy ustnej, nadmierne wydzielanie śliny, wymioty | ||
Zaburzenia wątroby i dróg żółciowych | Niewydolność wątroby*, zapalenie wątroby*, żółtaczka^, |
uszkodzenie wątroby^ | ||||
Zaburzenia skóry i tkanki podskórnej | Nadmierna potliwość | |||
Zaburzenia nerek i dróg moczowych | Niewydolność nerek^ | |||
Zaburzenia ogólne i stany w miejscu podania | Odczuwanie upojenia alkoholowego | Osłabienie, nieprawidłowe samopoczucie, dreszcze, odczuwanie odprężenia | ||
Badania diagnostyczne | Zwiększenie aktywności enzymów wątrobowych^, zwiększenie stężenia mocznika we krwi, zwiększenie stężenia kwasu moczowego we krwi^, zwiększenie poziomu kreatyniny we krwi^ |
*Odosobnione zgłoszenia po wprowadzeniu produktu dotyczące metoksyfluranu stosowanego jako środek przeciwbólowy.
^Inne zdarzenia związane z metoksyfluranem stosowanym jako środek przeciwbólowy zgłaszane po wprowadzeniu produktu do obrotu oraz odnotowane w publikacjach naukowych.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa,
tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również bezpośrednio podmiotowi odpowiedzialnemu.
W przypadku przedawkowania może wystąpić działanie anestetyczne z objawami takimi jak
nadmierna senność (włącznie z utratą przytomności), obniżenie ciśnienia krwi, depresja oddechowa, bladość i rozluźnienie mięśni. Po zaprzestaniu podawania produktu leczniczego Penthrox takie
działania zwykle szybko ustępują, często samoistnie, ale w razie potrzeby można zastosować środki wspomagające układ krążeniowo-naczyniowy. Metoksyfluran w wysokich dawkach powoduje dawkozależną nefrotoksyczność. Kilka godzin lub dni po podaniu metoksyfluranu w powtarzanych, wysokich dawkach znieczulających lub przeciwbólowych stwierdzono nieoliguryczną niewydolność nerek.
Grupa farmakoterapeutyczna: leki przeciwbólowe, inne leki przeciwbólowe i przeciwgorączkowe, kod ATC: N02BG09.
Mechanizm działania
Mechanizm działania przeciwbólowego metoksyfluranu nie został w pełni wyjaśniony. Działanie farmakodynamiczne
Metoksyfluran należy do lotnych środków znieczulających z grupy halogenowanych węglowodorów i wykazuje działanie przeciwbólowe, gdy jest wdychany w niskich dawkach przez przytomnych pacjentów. W dawkach przeciwbólowych stosowanych w celu kontroli bólu metoksyfluran może skutkować obniżeniem ciśnienia krwi, któremu może towarzyszyć bradykardia; rytm pracy serca
zazwyczaj jest regularny, chociaż u pacjenta może wystąpić uczucie senności. Metoksyfluran jedynie w nieznacznym stopniu uczula mięsień sercowy na adrenalinę.
Skuteczność kliniczna i bezpieczeństwo
Skuteczność i bezpieczeństwo produktu leczniczego Penthrox były analizowane w wieloośrodkowym, randomizowanym, podwójnie ślepym badaniu kontrolowanym placebo oceniającym kontrolę bólu ostrego u pacjentów z lekkimi urazami w warunkach oddziału ratunkowego. W badaniu uczestniczyło 300 pacjentów (151 badanych otrzymywało metoksyfluran, 149 pacjentów ‒ placebo [randomizacja w stosunku 1:1]). Do badania zakwalifikowano pacjentów z bólem o nasileniu od ≥4 do ≤7, mierzonym z użyciem skali numerycznej (NRS). Średni wynik natężenia dolegliwości bólowych w momencie wyjściowym (oceniany za pomocą skali wzrokowo-analogowej [VAS]) był zbliżony w grupie z metoksyfluranem (64,8) i w grupie z placebo (64,0). Dane w zakresie skuteczności przeciwbólowej stanowiące pierwszorzędowy punkt końcowy, tj. średnia zmiana w porównaniu z momentem wyjściowym wyniku w skali VAS w 5., 10., 15. i 20. minucie od rozpoczęcia wdychania badanego
leku, wykazały większą skuteczność przeciwbólową w grupie z metoksyfluranem (odpowiednio -23,1,
-28,9, -34,0 i -35,0) niż w grupie z placebo (odpowiednio -11,3, -14,8, -15,5 i -19,0). Ogółem
stwierdzono wysoce istotną różnicę pomiędzy grupą z metoksyfluranem a grupą kontrolną (oceniany efekt terapeutyczny: -15.1; 95% CI [zakres od -19,2 do -11,0]; p<0,0001). Najlepszy wynik odnotowano w 15. minucie (oceniany efekt terapeutyczny: -18,5). Analizę przeprowadzono u
pacjentów, którzy uzyskali klinicznie znaczącą odpowiedź terapeutyczną, zdefiniowaną jako 30-proc. redukcja nasilenia bólu w porównaniu z momentem wyjściowym, ocenianą za pomocą skali VAS.
Wyniki tej analizy wykazały, że odsetek odpowiedzi terapeutycznej w 5., 10., 15. i 20. minucie był znacząco wyższy w grupie z metoksyfluranem (51,0, 57,7, 63,8 i 63,8 proc.) vs grupa z placebo (23,5, 30,9, 33,6 i 37,6 proc.); p < 0,0001 w każdym punkcie czasowym. Ogółem 126 badanych (84,6 proc.) w grupie z metoksyfluranem doświadczyło ulgi w bólu w ciągu pierwszych 10 wdechów w porównaniu z 76 pacjentami (51 proc.) w grupie z placebo.
Wchłanianie
Metoksyfluran charakteryzuje się następującymi współczynnikami podziału:
Metoksyfluran dostaje się do płuc w postaci oparów, a następnie natychmiast wchłania się z płuc do krwiobiegu, co skutkuje bardzo szybkim początkiem działania przeciwbólowego. W badaniu
farmakokinetycznym z udziałem zdrowych ochotników krzywe średnich stężeń w osoczu względem czasu wykazywały bardzo szybki wzrost stężenia metoksyfluranu w osoczu. Po podaniu jednej dawki 3 ml metoksyfluranu wdychanego z przerwami w ciągu godziny, profil tętniczy charakteryzuje się następującymi wartościami: tmax wynosi 0,25 godziny (zakres 0,08 - 0,75 godziny), Cmax wynosi 32,39 ug/ml (SD 13,546 ug/ml, CV 41,8%), a AUC wynosi 28,95 h.ug/ml (zakres 12,3-52,6 h.ug/ml).
Dystrybucja
Metoksyfluran cechuje się wysokim współczynnikiem podziału tłuszcz/gaz, w związku z czym jest to związek wysoce lipofilowy. Metoksyfluran jest łatwo dystrybuowany do tkanki tłuszczowej, skąd następnie jest powoli uwalniany przez wiele dni.
Metabolizm
Metoksyfluran jest metabolizowany w ustroju. Metoksyfluran jest metabolizowany na drodze dechloracji i O-demetylacji w wątrobie przez enzymy CYP 450, głównie przez CYP 2E1, CYP 2B6 i CYP 2A6. Metoksyfluran jest metabolizowany do wolnego fluoru, kwasu szczawiowego, kwasu metoksydifluorooctowego oraz kwasu dichlorooctowego. Wolny fluor i kwas szczawiowy to związki o działaniu nefrotoksycznym w stężeniach wyższych niż te stosowane w pojedynczych dawkach
przeciwbólowych. Metoksyfluran wykazuje większą podatność na metabolizm niż inne halogenowane etery metylo-etylowe i charakteryzuje się łatwą dystrybucją do tkanki tłuszczowej, skąd następnie jest powoli uwalniany przez wiele dni.
Wydalanie
W badaniu farmakokinetycznym z udziałem zdrowych ochotników, który przyjmowali 3 ml metoksyfluranu w drodze inhalacji przez 1 godzinę, obserwowano wczesny szczyt krzywych
średniego stężenia w osoczu w tętnicach i żyłach względem czasu, po którym następowało szybkie wydalanie z osocza, przy czym stężenia metoksyfluranu w naczyniach żylnych powracały do wartości początkowych w ciągu 24 godzin po podaniu. Tętnicze i żylne stężenia metabolitu, nieorganicznego związku fluoru, wzrastały wolniej niż w przypadku metoksyfluranu (mediana tmax wynosząca
1,5 godziny) i były wydalane z osocza stopniowo – znaczne stężenia w osoczu żylnym stwierdzano po 48 godzinach od podania metoksyfluranu. Po podaniu jednej dawki 3 ml metoksyfluranu wdychanego z przerwami w ciągu godziny, mediana okresu półtrwania w krwi żylnej wynosi 3,16 godziny (zakres 1,06-7,89 godziny), a w przypadku nieorganicznego związku fluoru 33,30 godziny (zakres 23,50- 51,20 godziny). Profile farmakokinetyczne metoksyfluranu i nieorganicznego związku charakteryzują się dużą zmiennością międzyosobniczą. Około 60 % metoksyfluranu jest wydalane z moczem w postaci organicznych związków fluoru, fluoru wolnego i kwasu szczawiowego; pozostała ilość jest wydychana w postaci niezmienionej lub jako dwutlenek węgla. Można obserwować krótszy czas do osiągnięcia maksymalnego stężenia fluoru we krwi u osób otyłych niż u osób bez otyłości oraz u pacjentów w podeszłym wieku..
Genotoksyczność i rakotwórczość
Na podstawie wyników in vitro testu Amesa oraz in vivo testu mikrojądrowego u szczurów metoksyfluran nie został uznany za substancję o właściwościach mutagennych.
Brak wyraźnych dowodów wskazujących na właściwości rakotwórcze metoksyfluranu. Ponadto ryzyko jest ograniczone przez fakt, że produkt leczniczy Penthrox jest wskazany do stosowania w pojedynczym podaniu lub w krótkotrwałym podaniu przerywanym.
Toksyczność rozrodcza i rozwojowa
Metoksyfluran nie ma wpływu na plemniki u myszy. Wyniki badań na myszach i szczurach wykazały, że metoksyfluran przenikał przez łożysko, lecz nie wykazywał działania embriotoksycznego ani teratogennego. Jednakże po 9 dniach wielokrotnego dawkowania odnotowano opóźnienie rozwoju płodu (zmniejszona masa płodu oraz osłabione kostnienie). Najwyższy poziom narażenia, przy którym nie obserwuje się szkodliwych objawów (NOAEL) w zakresie rozwoju zarodka i płodu wynosił u myszy 0,006 proc. (104 mg/kg) ‒ 4 godziny/dobę u myszy i blisko 0,01 proc.(245 mg/kg) ‒ 8 godzin/dobę u szczurów. Wartość NOAEL u myszy i szczurów wykazała 1- do 2-krotnego margines w przeliczeniu na mg/kg i 0,1- do 0,3-krotnego margines w przeliczeniu na mg/m2 versus proponowana maksymalna dawka kliniczna. Ponieważ produkt leczniczy Penthrox nie jest wskazany do
codziennego stosowania, ryzyko opóźnienia rozwoju płodu zostało uznane za bardzo niskie.
Opublikowane badania przeprowadzone na zwierzętach (w tym naczelnych) przy podawaniu dawek skutkujących lekkim lub umiarkowanym znieczuleniem pokazują, że stosowanie środków
znieczulających w okresie szybkiego wzrostu mózgu lub synaptogenezy powoduje utratę komórek w rozwijającym się mózgu, co może wiązać się z długotrwałymi zaburzeniami funkcji poznawczych. Kliniczne znaczenie tych nieklinicznych obserwacji nie jest znane.
Wpływ na nerki i wątrobę
Ciągłe podawanie szczurom większych dawek znieczulających metoksyfluranu wiązało się z wystąpieniem martwicy kanalików nerkowych i obrzęku mitochondriów. W wielu modelach zwierzęcych powtarzane przerywane lub ciągłe podawanie subanestetycznego stężenia
metoksyfluranu wiązało się z ograniczonymi i zazwyczaj odwracalnymi zmianami w obrębie wątroby (tłuszczowe zwyrodnienie wątroby, zwiększona aktywność ALT/AST).
Po 6 godzinach ciągłej inhalacji metoksyfluranem przez 14 kolejnych dni zaobserwowano zmiany w nerkach szczurów, które ograniczały się do minimalnej wakuolacji kanalików korowych, a w wątrobie wystąpiła minimalna/łagodna wakuolacja środkowo-zrazikowa ekspansji cytoplazmy (hepatocytów środkowo-zrazikowych), co nadało cytoplazmie spieniony wygląd.
Po 90 minutach ciągłej inhalacji metoksyfluranem przez 14 kolejnych dni u psów nie stwierdzono żadnych istotnych zmian w nerkach, a w wątrobie stwierdzono minimalną/łagodną kumulację glikogenu w środkowej części zrazika.
W powyższych badaniach na szczurach i psach zgłoszono odpowiednio wartości NOAEL 396 mg/kg i 153 mg/kg. Wartości NOAEL u szczurów i psów stanowią 0,3-krotny margines ekspozycji na
podstawie danych dotyczących AUC i 0,2-krotny margines na podstawie wartości Cmax w porównaniu z proponowaną maksymalną dawką kliniczną 6ml na dobę. Ten wpływ na nerki i wątrobę był jednak obserwowany przy przedłużonym i powtarzanym podawaniu leku przez 14 dni, dlatego całkowity poziom narażenia przekracza wartości przewidywane w standardowej praktyce klinicznej.
Butylohydroksytoluen E 321 (0,01% w/w) (środek stabilizujący).
Nie dotyczy.
3 lata.
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Produkt leczniczy Penthrox jest dostępny w następujących opakowaniach:
Butelka o pojemności 5 ml ze szkła oranżowego typu I z wkładką z PET, z zakrętką z POM (polioksymetylen), z zabezpieczeniem gwarancyjnym.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Po napełnieniu inhalatora Penthrox zakręcić butelkę po produkcie leczniczym Penthrox. Po zakończeniu stosowania umieścić zużyty inhalator Penthrox oraz pustą butelkę w dołączonej
zamykanej torbie na odpadki i usunąć zgodnie z lokalnymi przepisami obowiązującymi w tym zakresie.
Medical Developments NED B.V. Strawinskylaan 411, WTC Tower A 1077 XX Amsterdam
Holandia
24604
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 08 marca 2018 Data ostatniego przedłużenia pozwolenia: 28 lutego 2023
03/2023











