Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA /DATA CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
atopowe zapalenie skóry;
wyprysk kontaktowy alergiczny, pokrzywka;
reakcje występujące po użądleniu lub ukąszeniu przez owady (jak swędzenie i podrażnienie).
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na hydrokortyzonu octan lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Zakażenia bakteryjne, wirusowe lub grzybicze.
Trądzik zwykły.
Trądzik różowaty.
Atrofia (zanik) skóry.
Nowotwory i stany przednowotworowe skóry.
Dermatitis perioralis.
Zmiany gruźlicze skóry.
Otwarte rany i uszkodzona skóra.
Współistniejąca grzybica układowa.
Skóra twarzy.
Dzieci w wieku poniżej 12 lat bez zalecenia lekarza.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
W przypadku zakażenia skóry w leczonym miejscu, należy zastosować dodatkowe leczenie przeciwbakteryjne lub przeciwgrzybicze. Jeżeli objawy zakażenia nie ustąpią, należy przerwać stosowanie produktu leczniczego do czasu wyleczenia zakażenia.
Unikać stosowania produktu leczniczego na powieki lub na skórę w okolicy powiek, ze względu na ryzyko jaskry lub zaćmy. U osób z jaskrą lub zaćmą może wystąpić nasilenie objawów choroby.
Unikać kontaktu produktu z oczami i błonami śluzowymi.
Na skórę pach i pachwin stosować tylko w przypadkach bezwzględnie koniecznych, ze względu na zwiększone wchłanianie kortykosteroidu przez delikatną skórę i związane z tym zwiększone ryzyko teleangiektazji, dermatitis perioralis, zaników skóry, nawet po krótkim stosowaniu.
Unikać stosowania produktu leczniczego pod opatrunkiem okluzyjnym (ceratką, pieluchą), ponieważ opatrunek nasila wchłanianie kortykosteroidu do organizmu.
Szczególnie ostrożnie stosować u pacjentów z łuszczycą, gdyż miejscowe stosowanie kortykosteroidów w łuszczycy może być niebezpieczne z wielu powodów, w tym ze względu na nawrót choroby spowodowany rozwojem tolerancji, ryzyko wystąpienia uogólnionej łuszczycy krostkowej i ogólne działania toksyczne spowodowane zaburzeniem ciągłości skóry.
Ostrożnie stosować i unikać długotrwałego stosowania u dzieci.
U dzieci, ze względu na większy niż u dorosłych stosunek powierzchni ciała do masy ciała, łatwiej niż u dorosłych może dojść do zahamowania czynności osi podwzgórze-przysadka-nadnercza
i wystąpienia objawów niepożądanych charakterystycznych dla kortykosteroidów, w tym zaburzeń wzrostu i rozwoju.
Specjalne ostrzeżenia dotyczące substancji pomocniczych
Produkt leczniczy zawiera alkohol cetylowy, alkohol stearylowy, i może powodować miejscowe reakcje skórne (np. kontaktowe zapalenie skóry).
Produkt leczniczy zawiera 30 mg glikolu propylenowego w każdym g kremu. Glikol propylenowy może powodować podrażnienie skóry.
Produkt leczniczy zawiera parahydroksybenzoesan metylu, parahydroksybenzoesan propylu i może powodować reakcje alergiczne (możliwe reakcje typu późnego).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
w przypadku zastosowania opatrunku okluzyjnego;
po nałożeniu produktu na delikatną skórę, np. twarzy i miejsca chorobowo zmienione, np. odparzenia;
w stanach zapalnych;
podczas długotrwałego stosowania.
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowywania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA /DATA CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Maxicortan, 10 mg/g, krem
1 g kremu zawiera 10 mg hydrokortyzonu octanu (Hydrocortisoni acetas).
Substancje pomocnicze o znanym działaniu: alkohol cetylowy, alkohol stearylowy, glikol propylenowy, metylu parahydroksybenzoesan, propylu parahydroksybenzoesan.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Krem
Biały krem
Produkt leczniczy Maxicortan stosuje się miejscowo w stanach zapalnych skóry różnego pochodzenia, przede wszystkim o podłożu alergicznym, o średnim nasileniu, które reagują na glikokortykosteroidy.
Produkt leczniczy stosuje się miejscowo w następujących wskazaniach:
Dawkowanie
Nakładać niewielką ilość kremu na miejsce zmienione chorobowo 1 lub 2 razy na dobę.
Nie należy stosować produktu leczniczego na duże powierzchnie skóry bez zalecenia lekarza. Nie stosować dłużej niż 7 dni bez zalecenia lekarza.
Dzieci
Produkt leczniczy Maxicortan nie jest przeznaczony do stosowania u dzieci w wieku poniżej 12 lat.
Sposób podawania
Podanie miejscowe na skórę.
Produkt leczniczy należy stosować zgodnie z miarą jednostki FTU (Jednostki opuszki palca).
1 FTU określa ilość kremu wyciśniętą z tuby w linii od czubka do fałdu pierwszego stawu palca wskazującego osoby dorosłej (~ 2,5 cm) co odpowiada 0,5 g kremu.
Mniejsze obszary będą wymagały odpowiednio mniejszych ilości kremu.
Jedna jednostka FTU leku przeznaczona jest do pokrycia powierzchni całych dwóch dłoni osoby dorosłej.
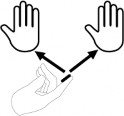
Jednostka FTU odpowiada zawsze ilości mierzonej na palcu osoby dorosłej.
Jeśli nie ma poprawy po 7 dniach stosowania produktu leczniczego, pacjent powinien skontaktować się z lekarzem.
Nie stosować na zdrową skórę.
Nie stosować na rozległą powierzchnię skóry bez uprzedniego porozumienia z lekarzem.
Kortykosteroidy wchłaniają się przez skórę, dlatego podczas stosowania produktu leczniczego istnieje ryzyko wystąpienia ogólnoustrojowych objawów niepożądanych octanu hydrokortyzonu,
charakterystycznych dla kortykosteroidów, w tym zahamowanie czynności kory nadnerczy. Z tego względu należy unikać stosowania produktu leczniczego na dużą powierzchnię skóry, stosowania w dużych dawkach, a także długotrwałego leczenia.
Nie stosować długotrwale u chorych z cukrzycą.
Nie opisywano dotychczas interakcji z zewnętrznie podawanym octanem hydrokortyzonu.
Kobiety ciężarne, planujące zajście w ciążę lub karmiące piersią nie powinny stosować produktu bez porozumienia z lekarzem.
Ciąża
Produkt leczniczy może być stosowany w ciąży jedynie w przypadku zdecydowanej konieczności, gdy korzyść dla matki przeważa nad potencjalnym zagrożeniem dla płodu.
Zaleca się stosowanie hydrokortyzonu krótkotrwale i na małe powierzchnie oraz szczególnie ostrożnie w pierwszych 3 miesiącach ciąży.
Karmienie piersią
Nie wiadomo, czy stosowane miejscowo kortykosteroidy przenikają do mleka kobiecego. W okresie karmienia piersią produkt leczniczy należy stosować ostrożnie, krótkotrwale i na małą powierzchnię skóry.
Produkt leczniczy nie powoduje upośledzenia sprawności psychofizycznej, zdolności prowadzenia pojazdów i obsługiwania maszyn.
W razie długotrwałego stosowania produktu leczniczego (przez okres dłuższy niż 14 dni), mogą wystąpić działania niepożądane.
Poniżej wymieniono możliwe działania niepożądane zgodnie z klasyfikacją układów i narządów.
Zaburzenia skóry i tkanki podskórnej:
zanikowe zapalenie skóry, zapalenie mieszków włosowych, alergia kontaktowa, zapalenie okołooczne (dermatitis periorbicularis), nadmierne owłosienie, opóźnienie gojenia ran i owrzodzeń, wybroczyny, rozstępy, plamica posteroidowa (przebarwienia i odbarwienia skóry), trądzik posteroidowy, dermatitis perioralis, pieczenie, zaczerwienienie, nadmierna suchość.
Zakażenia i zarażenia pasożytnicze:
nadkażenia bakteryjne, grzybicze i wirusowe, wtórne zakażenia.
Zaburzenia naczyniowe:
powierzchowne rozszerzenie naczyń krwionośnych, wybroczyny.
Zaburzenia oka:
jaskra lub zaćma.
Możliwe jest wystąpienie ogólnoustrojowych działań niepożądanych octanu hydrokortyzonu charakterystycznych dla glikokortykosteroidów.
Występują one przede wszystkim w przypadku długotrwałego stosowania produktu leczniczego, stosowania go na dużą powierzchnię skóry, pod opatrunkiem okluzyjnym lub w przypadku stosowania u dzieci.
Ogólnoustrojowe objawy niepożądane octanu hydrokortyzonu charakterystyczne dla
kortykosteroidów, to m.in. zahamowanie czynności osi podwzgórze–przysadka–nadnercza, zespół Cushinga, hamowanie wzrostu i rozwoju u dzieci, hiperglikemia, cukromocz.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem:
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301
faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Długotrwałe lub nieprawidłowe miejscowe stosowanie produktu leczniczego lub stosowanie go na duże powierzchnie skóry, może doprowadzić do zahamowania czynności osi podwzgórze-przysadka- nadnercza, hamowanie wzrostu i rozwoju u dzieci. Mogą wystąpić objawy przedawkowania w postaci m.in. hiperglikemii, cukromoczu i zespołu Cushinga.
W przypadku wystąpienia objawów przedawkowania wynikającego z długotrwałego stosowania miejscowego, należy zastosować postępowanie objawowe i przerwać stosowanie produktu leczniczego.
Grupa farmakoterapeutyczna: kortykosteroidy, preparaty dermatologiczne, jednoskładnikowe, o słabym działaniu.
Kod ATC: D 07 AA 02
Octan hydrokortyzonu jest syntetycznym kortykosteroidem o słabym działaniu przeciwzapalnym. Stosowany miejscowo wykazuje działanie przeciwzapalne, przeciwświądowe i obkurczające naczynia krwionośne.
Octan hydrokortyzonu po podaniu na skórę łatwo przenika do warstwy rogowej skóry. W niewielkim stopniu może przenikać do układu krążenia i wykazuje wówczas działanie ogólne. Po wchłonięciu kortyzon jest metabolizowany głównie w wątrobie.
Wchłanianie
Glikokortykosteroidy przenikają przez skórę do krwi.
Zwiększone wchłanianie hydrokortyzonu octanu występuje:
Octan hydrokortyzonu zastosowany na skórę w postaci kremu przenika do krążenia w minimalnym stopniu.
Dystrybucja
Po podaniu na skórę octan hydrokortyzonu rozmieszcza się w skórze w okolicy miejsca aplikacji. Większość wchłoniętego hydrokortyzonu wiąże się z białkami krwi.
Metabolizm
Po przeniknięciu do krwi hydrokortyzon jest metabolizowany w wątrobie.
Eliminacja
Metabolity i niezmieniony hydrokortyzon są wydalane z moczem (dotyczy to hydrokortyzonu znajdującego się w krążeniu ogólnym). Biologiczny okres półtrwania wynosi 8-12 godzin.
Nie wykazano mutagennego działania hydrokortyzonu.
Nie przeprowadzono odpowiednio liczebnych, dobrze kontrolowanych badań u ciężarnych kobiet, natomiast w badaniach na zwierzętach wykazano szkodliwe działanie glikokortykosteroidów na płód (deformacje) podczas stosowania w dużych ilościach przez długi czas pod opatrunkami okluzyjnymi. Dotyczyło to w szczególności związków z grupy o dużej aktywności.
Alkohol cetylowy Alkohol stearylowy Glikol propylenowy
Metylu parahydroksybenzoesan Propylu parahydroksybenzoesan Makrogolu eter cetostearylowy Parafina ciekła
Sorbitanu stearynian Wazelina biała Woda oczyszczona
Nie dotyczy.
3 lata
Okres ważności po pierwszym otwarciu: 28 dni.
Przechowywać w temperaturze poniżej 25˚C. Nie zamrażać.
Tuba aluminiowa z membraną zabezpieczającą i polietylenową zakrętką w tekturowym pudełku. 1 tuba po 15 g.
Bez specjalnych wymagań.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Aflofarm Farmacja Polska Sp. z o.o. ul. Partyzancka 133/151
95-200 Pabianice
tel. (42) 22-53-100
Pozwolenie nr 24551
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 13.02.2018 r. Data ostatniego przedłużenia pozwolenia: 21.09.2022 r.
20.10.2022











