Spis treści:
- Wskazania do stosowania
- Właściwości farmakodynamiczne
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
Klabax EC, 250 mg/5 ml, granulat do sporządzania zawiesiny doustnej
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Każde 5 ml sporządzonej zawiesiny zawiera 250 mg klarytromycyny. Substancje pomocnicze o znanym działaniu:
Każde 5 ml sporządzonej zawiesiny zawiera 2889 mg sacharozy oraz 1 mg aspartamu.
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na każde 5 ml zawiesiny. Ten produkt leczniczy zawiera 10 mg sodu benzoesanu na każde 5 ml zawiesiny.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
3. POSTAĆ FARMACEUTYCZNA
Granulat do sporządzania zawiesiny doustnej. Granulat w kolorze białym do białawego.
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
bakteryjne zapalenie gardła
ostre zapalenie ucha środkowego
ostre bakteryjne zapalenie zatok
ostre bakteryjne zaostrzenie przewlekłego zapalenia oskrzeli
łagodne lub umiarkowane pozaszpitalne zapalenie płuc
zakażenia skóry i tkanek miękkich o łagodnym lub umiarkowanym stopniu ciężkości np. zapalenie mieszków włosowych, zapalenie tkanki łącznej czy róża.
Należy wziąć pod uwagę oficjalne wytyczne dotyczące właściwego stosowania produktów przeciwbakteryjnych.
Produkt leczniczy Klabax EC jest wskazany do stosowania u dzieci w wieku od 6 miesięcy do 12 lat.
Produkt leczniczy Klabax EC jest wskazany do leczenia zakażeń wywoływanych przez wrażliwe organizmy. Wskazania obejmują:
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
z chorobą tętnic wieńcowych, ciężką niewydolnością serca, zaburzeniami przewodzenia serca lub klinicznie istotną bradykardią.
przyjmujących równocześnie inne produkty lecznicze wydłużające odstęp QT, inne niż te, które są przeciwwskazane
Dzieci w wieku poniżej 12 lat
Prowadzono badania kliniczne u dzieci w wieku od 6 miesięcy do 12 lat z zastosowaniem klarytromycyny w postaci zawiesiny doustnej. Dlatego dzieci w wieku poniżej 12 lat powinny otrzymywać klarytromycynę w tej postaci.
Zalecane dawki oraz schematy dawkowania:
Zwykle czas leczenia wynosi od 5 do 10 dni w zależności od patogenu i ciężkości zakażenia.
Zalecana dawka dobowa produktu leczniczego Klabax EC, 250 mg/5 ml, granulatu do
sporządzania zawiesiny doustnej u dzieci jest podana w poniższej tabeli i opiera się na dawce 7,5 mg/kg mc. dwa razy na dobę, do maksymalnie 500 mg dwa razy na dobę.
DAWKOWANIE U DZIECI
Dawkowanie w zależności od masy ciała (w kg) | ||
Masa ciała* (w kg) | Przybliżony wiek (w latach) | Dawka (w ml) 2 razy na dobę |
8 - 11 | 1 - 2 | 1,25 |
12 - 19 | 3 - 6 | 2,5 |
20 - 29 | 7 - 9 | 3,75 |
30 - 40 | 10 - 12 | 5 |
*Dzieciom o masie ciała < 8 kg dawkę leku należy podawać na podstawie masy ciała w kg: 0,15 ml/kg mc. dwa razy na dobę (około 7,5 mg/kg mc. dwa razy na dobę)
Niewydolność nerek
U dzieci z klirensem kreatyniny poniżej 30 ml/min/1,73 m2 pc. dawkę klarytromycyny należy zmniejszyć o połowę, do 7,5 mg/kg mc. na dobę.
U tych pacjentów leczenie nie powinno trwać dłużej niż 14 dni. Sposób podawania
Przed podaniem granulat należy wymieszać z wodą, co spowoduje powstanie białej do białawej zawiesiny.
Gotową zawiesinę podaje się za pomocą doustnej strzykawki. Zawiesinę należy dokładnie wstrząsnąć przed każdym użyciem.
Klabax EC można stosować niezależnie od posiłków, gdyż pokarm nie wpływa na jego dostępność biologiczną.
Klabax EC należy podawać dwa razy na dobę, co 12 godzin zgodnie z zaleceniami w powyższej tabeli.
Instrukcja dotycząca sporządzenia zawiesiny produktu leczniczego przed podaniem, patrz punkt 6.6.
Nadwrażliwość na substancję czynną, inne antybiotyki makrolidowe lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Przeciwwskazane jest jednoczesne stosowanie klarytromycyny i alkaloidów sporyszu (np. ergotaminy lub dihydroergotaminy) , gdyż może to prowadzić do wystąpienia objawów toksyczności sporyszu (patrz punkt 4.5).
Jednoczesne stosowanie klarytromycyny i doustnych postaci midazolamu jest przeciwwskazane (patrz punkt 4.5).
Przeciwwskazane jest jednoczesne stosowanie klarytromycyny z następującymi substancjami czynnymi: astemizolem, cyzaprydem, domperidonem, pimozydem i terfenadyną, ponieważ może to spowodować wydłużenie odstępu QT oraz wystąpienie arytmii serca, w tym
częstoskurczu komorowego, migotania komór oraz zaburzeń typu torsade de pointes (patrz punkt 4.4 i 4.5).
Klarytromycyny nie należy podawać pacjentom, u których występowało wydłużenie odstępu QT (wrodzone lub nabyte potwierdzone wydłużenie odstępu QT) lub arytmia komorowa, w tym torsade de pointes (patrz punkty 4.4 i 4.5).
Przeciwwskazane jest jednoczesne stosowanie klarytromycyny z tikagrelorem lub ranolazyną.
Podawanie klarytromycyny równocześnie z lomitapidem jest przeciwwskazane (patrz punkt 4.5).
Klarytromycyny nie należy stosować jednocześnie z inhibitorami reduktazy HMG-CoA (statynami), które są w dużym stopniu metabolizowane przez CYP3A4 (lowastatyną lub symwastatyną), ze względu na zwiększone ryzyko miopatii, w tym rabdomiolizy (patrz punkt 4.5).
Tak jak w przypadku innych silnych inhibitorów CYP3A4, klarytromycyny nie należy stosować u pacjentów przyjmujących kolchicynę (patrz punkty 4.4 i 4.5).
Klarytromycyny nie należy stosować u pacjentów z zaburzeniami elektrolitowymi (hipokaliemią lub hipomagnezemią, ze względu na ryzyko wydłużenia odstępu QT).
Klarytromycyny nie należy stosować u pacjentów z ciężką niewydolnością wątroby i występującymi jednocześnie zaburzeniami czynności nerek.
Lekarz nie powinien przepisywać klarytromycyny kobietom w ciąży bez dokładnego rozważenia korzyści w stosunku do ryzyka stosowania, co w szczególności dotyczy pierwszych trzech miesięcy ciąży (patrz punkt 4.6).
Klarytromycyna jest metabolizowana głównie przez wątrobę. Dlatego należy zachować ostrożność w przypadku stosowania klarytromycyny u pacjentów z zaburzeniami czynności
wątroby. Należy również zachować ostrożność podczas podawania klarytromycyny u pacjentów z umiarkowaną do ciężkiej niewydolności nerek (patrz punkt 4.2).
Podczas stosowania klarytromycyny notowano zaburzenia czynności wątroby, w tym
zwiększenie aktywności enzymów wątrobowych oraz wątrobokomórkowe i (lub) cholestatyczne zapalenie wątroby z żółtaczką lub bez. Takie zaburzenie czynności wątroby może być ciężkie i jest na ogół przemijające. Zanotowano przypadki niewydolności wątroby zakończone zgonem (patrz punkt 4.8). Niektórzy pacjenci mogli mieć chorobę wątroby przed rozpoczęciem leczenia lub mogli przyjmować inne produkty lecznicze mające toksyczny wpływ na wątrobę. Jeśli u pacjenta wystąpią przedmiotowe i podmiotowe objawy choroby wątroby, jak jadłowstręt,
żółtaczka, ciemne zabarwienie moczu, świąd lub tkliwość brzucha, należy go poinstruować, aby zaprzestał terapii i skontaktował się z lekarzem.
W czasie stosowania prawie wszystkich produktów przeciwbakteryjnych, w tym makrolidów, notowano przypadki rzekomobłoniastego zapalenia okrężnicy o nasileniu od łagodnego do
zagrażającego życiu. Podczas stosowania prawie wszystkich produktów przeciwbakteryjnych, w tym klarytromycyny, odnotowano przypadki biegunki wywołanej przez Clostridioides difficile
(ang. Clostridioides difficile-associated diarrhea, CDAD) o nasileniu od lekkiej biegunki do zapalenia okrężnicy zakończonego zgonem. Stosowanie leków przeciwbakteryjnych zmienia prawidłową florę okrężnicy, co może spowodować nadmierny wzrost C. difficile. Wystąpienie CDAD należy rozważać u wszystkich pacjentów, u których po zastosowaniu antybiotyku wystąpiła biegunka. Konieczne jest przeprowadzenie starannego wywiadu, ponieważ
występowanie CDAD notowano po ponad dwóch miesiącach od podania antybiotyków. Dlatego należy rozważyć odstawienie klarytromycyny bez względu na wskazania do jej podania. Należy przeprowadzić badanie obecności drobnoustrojów oraz rozpocząć odpowiednie leczenie. Należy unikać podawania leków spowalniających perystaltykę.
Po wprowadzeniu klarytromycyny do obrotu notowano przypadki toksyczności kolchicyny stosowanej w skojarzeniu z klarytromycyną, w szczególności u pacjentów w podeszłym wieku, przy czym niektóre z nich wystąpiły u pacjentów z niewydolnością nerek. U
niektórych z tych pacjentów odnotowano zgon (patrz punkt 4.5). Jednoczesne podawanie klarytromycyny i kolchicyny jest przeciwwskazane (patrz punkt 4.3).
Należy zachować ostrożność przy jednoczesnym stosowaniu klarytromycyny i triazolobenzodiazepin, w tym triazolamu, oraz midazolamu w podaniu dożylnym lub na śluzówkę jamy ustnej (patrz punkt 4.5).
Zdarzenia sercowo-naczyniowe
U pacjentów leczonych makrolidami, w tym klarytromycyną, obserwowano wydłużenie odstępu QT, mające wpływ na repolaryzację serca, niosące ze sobą ryzyko wystąpienia zaburzeń rytmu serca i zaburzeń typu torsade de pointes (patrz punkt 4.8). W związku ze zwiększeniem ryzyka wydłużenia odstępu QT i ryzyka arytmii komorowych (w tym zaburzeń typu torsade de pointes) stosowanie klarytromycyny jest przeciwwskazane u pacjentów przyjmujących astemizol,
cyzapryd, domperydon, pimozyd i terfenadynę, u pacjentów z hipokaliemią, u pacjentów z wydłużeniem odstępu QT lub arytmią komorową w wywiadzie (patrz punkt 4.3).
Ponadto należy zachować ostrożność stosując klarytromycynę w niżej opisanych grupach pacjentów:
Badania epidemiologiczne oceniające ryzyko działania niepożądanego makrolidów na układ sercowo-naczyniowy są zmienne. W niektórych badaniach obserwacyjnych stwierdzono
rzadkie, krótkoterminowe ryzyko zaburzeń rytmu serca, zawału mięśnia sercowego lub zgonu z przyczyn sercowo-naczyniowych, związane ze stosowaniem makrolidów, w tym
klarytromycyny. Przepisując klarytromycynę, należy brać pod uwagę zarówno te obserwacje, jak i korzyści terapeutyczne z zastosowania leku.
Zapalenie płuc: z uwagi na wzrastającą oporność Streptococcus pneumoniae na antybiotyki makrolidowe, ważne jest, aby przed przepisaniem klarytromycyny do leczenia pozaszpitalnego zapalenia płuc przeprowadzić badanie antybiotykowrażliwości. U pacjentów ze szpitalnym zapaleniem płuc, klarytromycynę należy stosować w skojarzeniu z dodatkowymi, odpowiednimi antybiotykami.
Zakażenia skóry i tkanek miękkich o nasileniu łagodnym lub umiarkowanym: Zakażenia te powodują najczęściej bakterie Staphylococcus aureus i Streptococcus pyogenes, oba gatunki mogą być oporne na antybiotyki makrolidowe. Dlatego też ważne jest, aby przed leczeniem przeprowadzić badanie antybiotykowrażliwości. Gdy nie można zastosować antybiotyków
beta-laktamowych (np. z powodu alergii), lekami pierwszego wyboru mogą być inne antybiotyki, takie jak klindamycyna. Obecnie uważa się, że antybiotyki makrolidowe mają znaczenie jedynie w leczeniu w niektórych zakażeń skóry i tkanek miękkich, w tym w
zakażeniach wywołanych przez Corynebacterium minutissimum, w trądziku pospolitym i róży oraz w sytuacjach, w których nie można zastosować leczenia penicyliną.
W przypadkach, w których wystąpią ciężkie, ostre reakcje nadwrażliwości, np. anafilaksja,
ciężkie skórne działania niepożądane (ang. Severe Cutaneous Adverse Reactions, SCAR) [np. ostra uogólniona osutka krostkowa (ang. Acute Generalised Exanthematous Pustulosis,
AGEP), zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka i wysypka polekowa z eozynofilią i objawami ogólnymi (ang. Drug Rash With Eosinophilia And Systemic Symptoms, DRESS)], należy niezwłocznie przerwać podawanie klarytromycyny i natychmiast wdrożyć odpowiednie leczenie.
Należy zachować ostrożność podczas skojarzonego podawania klarytromycyny z lekami indukującymi aktywność enzymu cytochromowego CYP3A4 (patrz punkt 4.5).
Inhibitory reduktazy HMG-CoA (statyny): Jednoczesne stosowanie klarytromycyny z lowastatyną lub symwastatyną jest przeciwwskazane (patrz punkt 4.3). Należy zachować
ostrożność przy przepisywaniu klarytromycyny z innymi statynami. U pacjentów przyjmujących jednocześnie klarytromycynę i statyny odnotowano przypadki rabdomiolizy. Pacjentów należy obserwować pod kątem występowania podmiotowych i przedmiotowych objawów miopatii.
Jeśli nie można uniknąć jednoczesnego stosowania klarytromycyny i statyn, zaleca się przepisywanie najmniejszej zarejestrowanej dawki statyny. Można także rozważyć zastosowanie statyny niezależnej od metabolizmu CYP3A (np. fluwastatyny) (patrz punkt 4.5).
Doustne leki przeciwcukrzycowe / insulina: Jednoczesne stosowanie klarytromycyny i doustnych leków przeciwcukrzycowych (takich jak sulfonylomoczniki) i (lub) insuliny może prowadzić do ciężkiej hipoglikemii. Zaleca się staranną kontrolę stężenia glukozy (patrz punkt 4.5).
Doustne leki przeciwzakrzepowe: Istnieje ryzyko ciężkiego krwotoku i znacznego zwiększenia wartości międzynarodowego współczynnika znormalizowanego (ang. International Normalized Ratio, INR) i wydłużenia czasu protrombinowego, gdy klarytromycyna jest podawana w skojarzeniu z warfaryną (patrz punkt 4.5). Należy często kontrolować wartość INR i czas protrombinowy u pacjentów, którzy otrzymują jednocześnie klarytromycynę i doustne leki przeciwzakrzepowe.
Należy zachować ostrożność podczas jednoczesnego stosowania klarytromycyny i doustnych leków przeciwzakrzepowych o działaniu bezpośrednim, takich jak dabigatran, rywaroksaban i apiksaban, szczególnie u pacjentów z grupy wysokiego ryzyka wystąpienia krwawienia (patrz punkt 4.5).
Podobnie jak w przypadku innych antybiotyków długoterminowe stosowanie klarytromycyny może prowadzić do kolonizacji organizmu przez oporne bakterie i grzyby. W przypadku wystąpienia nadkażenia należy przedsięwziąć odpowiednie leczenie.
Również należy mieć na uwadze możliwość oporności krzyżowej pomiędzy klarytromycyną i innymi makrolidami, a także linkomycyną i klindamycyną.
Sacharoza
ml zawiesiny zawiera 2889 mg sacharozy.
Należy to wziąć pod uwagę u pacjentów z cukrzycą.
Pacjenci z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy,
zespołem złego wchłaniania glukozy-galaktozy lub niedoborem sacharazy-izomaltazy, nie powinni przyjmować tego produktu leczniczego.
Aspartam
Ten produkt leczniczy zawiera 1 mg aspartamu w 5 ml produktu, co odpowiada stężeniu
0,2 mg/ml. Z tego względu może być szkodliwy dla osób z fenyloketonurią. Brak klinicznych i nieklinicznych danych dotyczących stosowania aspartamu u niemowląt poniżej 12. tygodnia życia.
Sód
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na 5 ml zawiesiny, to znaczy uznaje się go za „wolny od sodu”.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Podsumowanie profilu bezpieczeństwa
Najczęstsze i najbardziej powszechne działania niepożądane związane z leczeniem
klarytromycyną, zarówno u pacjentów dorosłych, jak i u dzieci i młodzieży, to ból brzucha, biegunka, nudności, wymioty oraz zaburzenia smaku. Te działania niepożądane są zazwyczaj lekkie i pokrywają się ze znanym profilem bezpieczeństwa antybiotyków makrolidowych (patrz podpunkt b w punkcie 4.8).
W badaniach klinicznych nie stwierdzono istotnej różnicy w częstości występowania działań niepożądanych ze strony układu pokarmowego pomiędzy grupami pacjentów z wcześniejszym zakażeniem mykobakteryjnym lub bez zakażenia.
Tabelaryczne podsumowanie działań niepożądanych
Poniższa tabela przedstawia działania niepożądane odnotowane w badaniach klinicznych oraz po wprowadzeniu do obrotu klarytromycyny w postaci tabletek o natychmiastowym
uwalnianiu, granulatu do sporządzania zawiesiny doustnej, proszku do sporządzania roztworu do wstrzykiwań, tabletek o przedłużonym uwalnianiu oraz tabletek o zmodyfikowanym uwalnianiu.
Działania niepożądane, które mogą być związane ze stosowaniem klarytromycyny zostały przedstawione według klasyfikacji układów i narządów oraz częstości występowania w następujący sposób: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100) i częstość nieznana (działania niepożądane występujące po
wprowadzeniu leku do obrotu; częstości nie można określić na podstawie dostępnych danych).
W każdej grupie o określonej częstości występowania objawy niepożądane wymieniono zgodnie ze zmniejszającym się nasileniem (gdy istniała możliwość oceny).
Klasyfikacja układów i narządów
Bardzo
często ≥1/10
Często ≥ 1/100 do < 1/10
Niezbyt często ≥1/1000 do < 1/100
Częstość nieznana* (nie może być określona na podstawie
dostępnych danych)
Zakażenia i zarażenia pasożytnicze
Zapalenie tkanki
łącznej1, kandydoza, zapalenie żołądka i jelit2, zakażenie3, zakażenie pochwy
Rzekomobłoniaste zapalenie okrężnicy, róża
Zaburzenia
krwi i układu
Leukopenia,
neutropenia4,
Agranulocytoza,
trombocytopenia
chłonnego
trombocytemia3, eozynofilia4
Zaburzenia układu immunologi- cznego
Reakcje rzekomoanafilaktyczne1, nadwrażliwość
Reakcje anafilaktyczne, obrzęk naczynioruchowy
Zaburzenia metabolizmu
i odżywiania
Jadłowstręt, zmniejszenie łaknienia
Zaburzenia psychiczne
Bezsenność
Niepokój, nerwowość3
Zaburzenia psychotyczne, stany splątania5, depersonalizacja, depresja, dezorientacja,
omamy, nietypowe sny, mania
Zaburzenia układu nerwowego
Zaburzenia smaku, ból głowy,
Utrata przytomności1, dyskineza1, zawroty głowy, senność5, drżenie
Drgawki, utrata odczuwania smaku, omamy węchowe, utrata odczuwania
zapachów, parestezje
Zaburzenia ucha i błędnika
Zawroty głowy pochodzenia błędnikowego,
zaburzenia słuchu, szumy uszne
Głuchota
Zaburzenia kardiologiczne
Zatrzymanie akcji serca1, migotanie przedsionków1,
wydłużenie odstępu QT w EKG, skurcze przedwczesne serca1, kołatanie serca
Zaburzenia typu torsade de pointes, częstoskurcz komorowy, migotanie komór
Zaburzenia naczyniowe
Rozszerzenie naczyń krwionośnych1
Krwotok
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Astma1, krwawienie z nosa2, zator płucny1
Zaburzenia żołądka i jelit
Biegunka, wymioty,
niestrawność, nudności, ból brzucha
Zapalenie przełyku1, choroba refluksowa przełyku2, zapalenie błony śluzowej żołądka, ból odbytu2, zapalenie błony śluzowej jamy
ustnej, zapalenie języka,
Ostre zapalenie trzustki, przebarwienia języka,
przebarwienia zębów
wzdęcia brzucha4, zaparcia, suchość w
jamie ustnej, odbijanie się, wzdęcia z oddawaniem gazów
Zaburzenia wątroby i dróg żółciowych
Nieprawidłowe wyniki badań
czynności wątroby
Cholestaza4, zapalenie wątroby4, zwiększenie aktywności aminotransferazy
alaninowej, zwiększenie aktywności aminotransferazy asparaginianowej,
zwiększenie aktywności gamma- glutamylotransferazy4
Niewydolność
wątroby, żółtaczka miąższowa
Zaburzenia skóry i tkanki podskórnej
Wysypka, nadmierne pocenie się
Pęcherzowe zapalenie skóry1, świąd, pokrzywka, wysypka plamisto-grudkowa3
Ciężkie skórne działania
niepożądane (ang. severe cutaneous adverse reactions SCAR) [(np. ostra uogólniona osutka krostkowa (ang. acute generalised exanthematous pustulosis AGEP)], zespół Stevensa- Johnsona, martwica toksyczno-rozpływna naskórka, wysypka polekowa z eozynofilią i objawami
układowymi (ang. Drug Reaction with Eosinophilia and
Systemic Symptoms, DRESS), trądzik
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej
Skurcze mięśni3, sztywność mięśniowo- szkieletowa1, bóle
mięśniowe2
Rabdomioliza2,6, miopatia
Zaburzenia nerek i dróg moczowych
Zwiększenie stężenia kreatyniny we krwi1,
zwiększenie stężenia mocznika we krwi1
Niewydolność nerek, śródmiąższowe zapalenie nerek
Zaburzenia ogólne i stany w miejscu podania
Zapalenie żyły w miejscu
wstrzyknięcia1
Ból w miejscu wstrzyknięcia1, stan zapalny w miejscu
wstrzyknięcia1
Złe samopoczucie4,
gorączka3, astenia, ból w klatce piersiowej4, dreszcze4, zmęczenie4
Badania diagnostyczne
Nieprawidłowa wartość stosunku albumin do globulin1, zwiększenie aktywności fosfatazy alkalicznej we krwi4, zwiększenie aktywności dehydrogenazy mleczanowej we krwi4
Wzrost wartości międzynarodowego współczynnika znormalizowanego, wydłużenie czasu protrombinowego, nieprawidłowe zabarwienie moczu
1 Działania niepożądane odnotowane wyłącznie w przypadku stosowania proszku do sporządzania koncentratu roztworu do infuzji
2 Działania niepożądane odnotowane wyłącznie w przypadku stosowania tabletek o przedłużonym działaniu
3 Działania niepożądane odnotowane wyłącznie w przypadku stosowania granulatu do sporządzania zawiesiny doustnej
4 Działania niepożądane odnotowane wyłącznie w przypadku stosowania tabletek o natychmiastowym uwalnianiu
5, 6 Patrz punkt c)
* Ze względu na to, że działania niepożądane są zgłaszane przez ochotników należących do populacji o nieustalonej wielkości, nie zawsze można rzetelnie ocenić ich częstości lub ocenić związek przyczynowy z ekspozycją na produkt leczniczy. Oszacowano, że ekspozycja na klarytromycynę wynosiła powyżej jednego miliarda osobodni.
Opis wybranych działań niepożądanych
Zapalenie żyły w miejscu wstrzyknięcia, ból w miejscu wstrzyknięcia oraz stan zapalny w miejscu wstrzyknięcia są charakterystyczne dla klarytromycyny w postaci dożylnej.
W niektórych zgłoszeniach dotyczących rabdomiolizy klarytromycynę podawano w skojarzeniu ze statynami, fibratami, kolchicyną lub allopurynolem (patrz punkty 4.3 i 4.4).
Po wprowadzeniu leku do obrotu, kiedy klarytromycynę i triazolam podawano łącznie, odnotowano interakcje między lekami oraz wpływ na ośrodkowy układ nerwowy (OUN) (np. senność i splątanie). Zaleca się obserwację pacjenta pod kątem zwiększonego oddziaływania farmakologicznego na OUN (patrz punkt 4.5).
Znane są rzadkie doniesienia o wydalaniu klarytromycyny w postaci tabletek o przedłużonym uwalnianiu ze stolcem. Wiele z tych przypadków miało miejsce u pacjentów z zaburzeniami
anatomicznymi (w tym ileostomią lub koleostomią) bądź funkcjonalnymi żołądka i jelit lub ze skróceniem pasażu żołądkowo-jelitowego. W kilku przypadkach pozostałości tabletek
wystąpiły podczas biegunki. Zaleca się, by pacjentom, u których pozostałości tabletek pojawiają się w stolcu oraz nie ma poprawy w stanie klinicznym, podać klarytromycynę w innej postaci (np. w zawiesinie) lub zastosować inny antybiotyk.
Szczególna grupa pacjentów: działania niepożądane u pacjentów z obniżoną odpornością (patrz punkt e).
Dzieci i młodzież
Przeprowadzono badania kliniczne z zastosowaniem klarytromycyny w postaci zawiesiny u pacjentów w wieku od 6 miesięcy do 12 lat. Z tego powodu u dzieci w wieku poniżej 12 lat należy stosować klarytromycynę w postaci zawiesiny.
U dzieci należy się spodziewać, że częstość, rodzaj oraz nasilenie działań niepożądanych będą takie same jak u dorosłych.
Inne szczególne grupy pacjentów
Pacjenci z obniżoną odpornością
U pacjentów z AIDS oraz u innych pacjentów z obniżoną odpornością leczonych większymi dawkami klarytromycyny przez dłuższy czas z powodu zakażeń mykobakteryjnych, często trudno było rozróżnić działania niepożądane prawdopodobnie związane ze stosowaniem klarytromycyny od objawów zakażenia ludzkim wirusem upośledzenia odporności (ang.
Human Immunodeficiency Virus, HIV) lub inną współistniejącą chorobą.
U dorosłych pacjentów otrzymujących 1000 mg i 2000 mg klarytromycyny na dobę,
najczęstszymi zgłaszanymi działaniami niepożądanymi były: nudności, wymioty, zaburzenia smaku, ból brzucha, biegunka, wysypka, wzdęcia z oddawaniem gazów, ból głowy, zaparcia,
zaburzenia słuchu, wzrost aktywności aminotransferazy asparaginianowej (ang. Serum Glutamic Oxaloacetic Transaminase, SGOT) i aminotransferazy alaninowej w surowicy (ang. Serum Glutamic Pyruvate Transaminase, SGPT). Ponadto rzadko występowały duszność, bezsenność i suchość w jamie ustnej. Częstość występowania tych przypadków była porównywalna u
pacjentów otrzymujących dawkę dobową klarytromycyny 1000 mg lub 2000 mg, lecz u pacjentów otrzymujących dobową dawkę klarytromycyny 4000 mg działania niepożądane występowały około 3 do 4 razy częściej.
U pacjentów z immunosupresją, ocenę określonych badań laboratoryjnych prowadzono poprzez analizę wyników testów, których wartości były znacznie odchylone (tj. ekstremalnie wysokie lub niskie) dla określonego testu. Na podstawie tych kryteriów u około 2% do 3% pacjentów, którzy otrzymywali 1000 mg lub 2000 mg klarytromycyny na dobę wystąpiła znacznie zwiększona
aktywność SGOT i SGPT, oraz nietypowo niska liczba białych krwinek i płytek krwi. U niższego odsetka pacjentów z tych dwóch grup również wystąpiło zwiększenie stężenia azotu mocznikowego we krwi. Nieznacznie częstsze występowanie nietypowych wartości wszystkich parametrów, oprócz liczby białych krwinek, odnotowano u pacjentów przyjmujących
klarytromycynę w dawce 4000 mg na dobę.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49-21-301
Fax: +48 22 49-21-309,
Strona internetowa: https://smz.ezdrowie.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
Stosowanie następujących substancji czynnych jest bezwzględnie przeciwwskazane ze względu na możliwość wystąpienia ciężkich interakcji między lekami:
Astemizol, cyzapryd, domperidon, pimozyd i terfenadyna
U pacjentów otrzymujących jednocześnie klarytromycynę i cyzapryd odnotowano podwyższone stężenia cyzaprydu. Może to prowadzić do wydłużenia odstępu QT oraz arytmii serca, w tym
częstoskurczu komorowego, migotania komór oraz zaburzeń typu torsade de pointes. Podobne skutki obserwowano u pacjentów przyjmujących klarytromycynę jednocześnie z pimozydem (patrz punkt 4.3).
Odnotowano, że makrolidy zmieniają metabolizm terfenadyny prowadząc do zwiększenia
stężenia terfenadyny, co w rzadkich przypadkach wiązało się z występowaniem arytmii serca, w tym wydłużenia odstępu QT, częstoskurczu komorowego, migotania komór oraz zaburzeń typu torsade de pointes (patrz punkt 4.3). W pojedynczym badaniu z zastosowaniem klarytromycyny i terfenadyny u 14 zdrowych ochotników, stężenie w surowicy kwasowego metabolitu
terfenadyny zwiększyło się dwa do trzech razy oraz wydłużył się odstęp QT, jednak nie wywołało to klinicznie istotnych skutków. Podobny wpływ obserwowano przy jednoczesnym stosowaniu astemizolu i innych antybiotyków makrolidowych.
Lomitapid
Podawanie klarytromycyny równocześnie z lomitapidem jest przeciwwskazane ze względu na ryzyko znacznego zwiększenia aktywności aminotransferaz (patrz punkt 4.3).
Alkaloidy sporyszu
Badania po wprowadzeniu klarytromycyny do obrotu wykazują, że skojarzone stosowanie klarytromycyny z ergotaminą lub dihydroergotaminą wiązało się z występowaniem ostrej
toksyczności sporyszu charakteryzującej się skurczem naczyń oraz niedokrwieniem kończyn i innych tkanek, w tym ośrodkowego układu nerwowego. Jednoczesne stosowanie
klarytromycyny i alkaloidów sporyszu jest przeciwwskazane (patrz punkt 4.3). Midazolam w postaci doustnej
Podczas doustnego stosowania midazolamu równocześnie z klarytromycyną w postaci tabletek (500 mg dwa razy na dobę), AUC midazolamu zwiększyło się 7-krotnie. Jednoczesne podawanie midazolamu w postaci doustnej i klarytromycyny jest przeciwwskazane (patrz
punkt 4.3).
Inhibitory reduktazy HMG-CoA (statyny)
Łączne podawanie klarytromycyny z lowastatyną lub symwastatyną jest przeciwwskazane (patrz punkt 4.3), ponieważ statyny te są w największym stopniu metabolizowane przez CYP3A4.
Jednoczesne stosowanie z klarytromycyną zwiększa ich stężenie w osoczu, co prowadzi do zwiększenia ryzyka miopatii, w tym rabdomiolizy. Zgłaszano przypadki rabdomiolizy u pacjentów przyjmujących klarytromycynę równocześnie z tymi statynami. Jeśli nie można uniknąć leczenia klarytromycyną, należy w tym czasie zaprzestać stosowania lowastatyny lub symwastatyny.
Należy zachować ostrożność przy przepisywaniu klarytromycyny ze statynami. Jeśli nie można uniknąć równoczesnego stosowania klarytromycyny ze statynami, zaleca się przepisanie najmniejszej zarejestrowanej dawki statyn. Można rozważyć zastosowanie statyny, której metabolizm nie zależy od CYP3A (np. fluwastatyny). Wówczas pacjentów należy obserwować w kierunku przedmiotowych i podmiotowych objawów miopatii.
Wpływ innych produktów leczniczych na klarytromycynę
Produkty lecznicze będące induktorami enzymu CYP3A (np. ryfampicyna, fenytoina,
karbamazepina, fenobarbital, ziele dziurawca) mogą pobudzać metabolizm klarytromycyny. Może to spowodować obniżenie stężenia klarytromycyny i doprowadzić do zmniejszenia jej skuteczności. Ponadto konieczne może być kontrolowanie stężenia induktora CYP3A w osoczu, ponieważ może ono być zwiększone z powodu hamującego wpływu klarytromycyny na CYP3A (patrz również odpowiednie informacje o produkcie, dotyczące podawanego inhibitora CYP3A4). Jednoczesne stosowanie ryfabutyny i klarytromycyny spowodowało odpowiednio zwiększenie i zmniejszenie stężenia w surowicy, a w efekcie zwiększenie ryzyka zapalenia błony naczyniowej oka.
Dowiedziono lub podejrzewa się wpływ wymienionych poniżej substancji czynnych na stężenia klarytromycyny we krwi; z tego powodu może być konieczne dostosowanie dawki klarytromycyny lub rozważenie alternatywnych terapii.
Efawirenz, newirapina, ryfampicyna, ryfabutyna i ryfapentyna
Silne induktory metabolizmu układu cytochromu P450, takie jak efawirenz, newirapina,
ryfampicyna, ryfabutyna i ryfapentyna mogą przyspieszać metabolizm klarytromycyny, przez co zmniejszać jej stężenie w osoczu, a jednocześnie zwiększać stężenie 14-OH-klarytromycyny – metabolitu, który jest również aktywny mikrobiologicznie. Ponieważ aktywność klarytromycyny i 14-OH-klarytromycyny jest różna w odniesieniu do różnych bakterii, zamierzony efekt terapeutyczny może być zaburzony w czasie jednoczesnego podawania klarytromycyny i induktorów enzymu.
Etrawiryna
Etrawiryna zmniejszała wpływ klarytromycyny na organizm, jednak stężenie czynnego metabolitu, 14-OH-klarytromycyny było zwiększone. Ponieważ 14-OH-klarytromycyna działa słabiej na kompleks Mycobacterium avium (MAC), całkowita aktywność produktu leczniczego w stosunku do tego patogenu może się zmienić. Z tego powodu w leczeniu zakażenia
wywołanego przez MAC należy rozważyć zastosowanie innego produktu leczniczego. Flukonazol
Jednoczesne podawanie flukonazolu w dawce 200 mg na dobę oraz klarytromycyny w dawce 500 mg dwa razy na dobę 21 zdrowym ochotnikom prowadziło do zwiększenia średniego minimalnego stężenia klarytromycyny w stanie stacjonarnym (Cmin) i pola pod krzywą (AUC) odpowiednio o 33% i 18%. Stężenie aktywnego metabolitu 14-OH-klarytromycyny w stanie stacjonarnym nie uległo znaczącej zmianie w czasie jednoczesnego stosowania flukonazolu. Nie ma konieczności dostosowania dawki klarytromycyny.
Rytonawir
Badanie farmakokinetyczne wykazało, że jednoczesne stosowanie rytonawiru w dawce 200 mg co osiem godzin i klarytromycyny w dawce 500 mg co 12 godzin prowadziło do znacznego zahamowania metabolizmu klarytromycyny. Przy jednoczesnym stosowaniu rytonawiru Cmax klarytromycyny wzrosło o 31%, Cmin wzrosło o 182% a AUC wzrosło o 77%. Natomiast odnotowano niemalże całkowite zahamowanie tworzenia czynnego metabolitu 14-OH- klarytromycyny. Z uwagi na duże okno terapeutyczne klarytromycyny nie jest konieczne zmniejszanie dawki u pacjentów z prawidłową czynnością nerek. U pacjentów z zaburzeniami
czynności nerek należy jednak rozważyć zastosowanie zmiany dawkowania. I tak u pacjentów z klirensem kreatyniny od 30 do 60 ml/min dawkę klarytromycyny należy zmniejszyć o 50%, a u pacjentów z klirensem kreatyniny < 30 ml/min dawkę należy zmniejszyć o 75%. Nie należy podawać więcej niż 1 g klarytromycyny na dobę w skojarzeniu z rytonawirem.
Podobne dostosowanie dawki należy wziąć pod uwagę u pacjentów z osłabioną czynnością nerek, kiedy rytonawir jest stosowany jako środek nasilający właściwości farmakokinetyczne z innymi inhibitorami proteazy HIV, w tym z atazanwirem i sakwinawirem (patrz punkt poniżej „Dwukierunkowe interakcje lekowe”).
Wpływ klarytromycyny na inne produkty lecznicze
Interakcje związane z CYP3A
Jednoczesne podawanie klarytromycyny, o której wiadomo, że hamuje CYP3A, z lekiem
metabolizowanym głównie przez CYP3A może wiązać się ze zwiększeniem stężenia takiego leku, co może zwiększyć lub wydłużyć zarówno jego działanie terapeutyczne, jak i
występowanie działań niepożądanych z nim związanych.
Stosowanie klarytromycyny jest przeciwwskazane u pacjentów przyjmujących substraty izoenzymu CYP3A - astemizol, cyzapryd, domperydon, pimozyd i terfenadynę, z powodu ryzyka wydłużenia odstępu QT i zaburzeń rytmu serca, w tym częstoskurczu komorowego, migotania komór i zaburzeń typu torsade de pointes (patrz punkt 4.3 i 4.4).
Również przeciwwskazane jest jednoczesne stosowanie klarytromycyny z alkaloidami sporyszu, midazolem podawanym doustnie, inhibitorami reduktazy HMG CoA
metabolizowanymi głównie przez CYP3A4 (lowastatyna i symwastatyna), kolichicyną, tikagrelorem i ranolazyną (patrz punkt 4.3).
Należy zachować ostrożność podczas stosowania klarytromycyny u pacjentów otrzymujących inne leki będące substratami enzymu CYP3A, w szczególności jeżeli substrat CYP3A ma
wąski przedział terapeutyczny (np. karbamazepina) i (lub) jeżeli substrat jest w dużym stopniu metabolizowany przez ten enzym. Należy rozważyć dostosowanie dawki klarytromycyny oraz gdy jest to możliwe ściśle kontrolować stężenia w surowicy leków metabolizowanych głównie przez CYP3A u pacjentów otrzymujących jednocześnie klarytromycynę.
Następujące leki i grupy leków, które wiadomo lub podejrzewa się, że są metabolizowane przez izoenzym CYP3A (choć nie jest to pełna lista) to alprazolam, karbamazepina, cylostazol,
cyklosporyna, dyzopiramid, ibrutynib, metyloprednizolon, midazolam (podawany dożylnie), omeprazol, doustne leki przeciwzakrzepowe (np. warfaryna, rywaroksaban, apiksaban), atypowe leki przeciwpsychotyczne (np. kwetiapina), chinidyna, ryfabutyna, syldenafil, syrolimus, takrolimus, triazolam i winblastyna.
Do leków podobnie metabolizowanych lecz przy udziale innych izoenzymów, niż układ cytochromu P450, zalicza się fenytoinę, teofilinę i walproinian.
Leki przeciwarytmiczne
Donoszono o przypadkach zaburzeń typu torsade de pointes występujących przy jednoczesnym stosowaniu klarytromycyny i chinidyny lub dyzopiramidu. W trakcie jednoczesnego podawania klarytromycyny z tymi produktami leczniczymi należy monitorować zapis EKG w kierunku wydłużenia odstępu QT. Podczas leczenia klarytromycyną należy kontrolować stężenia chinidyny i dyzopiramidu w surowicy.
Po wprowadzeniu leku do obrotu zgłaszano przypadki hipoglikemii podczas jednoczesnego podawania klarytromycyny i dyzopiramidu. Z tego powodu, w czasie skojarzonego podawania tych leków należy kontrolować stężenia glukozy we krwi.
Doustne leki przeciwcukrzycowe, insulina
Podczas jednoczesnego stosowania leków przeciwcukrzycowych, takich jak nateglinid i repaglinid, może dojść do zahamowania enzymu CYP3A przez klarytromycynę, co może powodować hipoglikemię. Zaleca się staranne kontrolowanie stężeń glukozy.
Doustne leki przeciwzakrzepowe o działaniu bezpośrednim (DOAC)
Dabigatran, lek z grupy DOAC, jest substratem białka transportującego pompy lekowej, P-gp (glikoproteina P). Rywaroksaban i apiksaban są metabolizowane przez cytochrom CYP3A4 i
także stanowią substraty P-gp. Należy zachować ostrożność podczas jednoczesnego stosowania klarytromycyny i tych leków, szczególnie u pacjentów z grupy wysokiego ryzyka wystąpienia krwawienia (patrz punkt 4.4).
Omeprazol
Klarytromycynę (500 mg co 8 godzin) podawano w skojarzeniu z omeprazolem (40 mg na dobę) zdrowym dorosłym ochotnikom. Przy jednoczesnym stosowaniu klarytromycyny stężenia omeprazolu w osoczu w stanie stacjonarnym wzrosły (Cmax, AUC0-24 i t1/2 wzrosły
odpowiednio o 30%, 89% i 34%). Średnia wartość pH w żołądku w ciągu 24 godzin wynosiła 5,2 przy podawaniu samego omeprazolu i 5,7, gdy omeprazol podawany był w skojarzeniu z klarytromycyną.
Syldenafil, tadalafil i wardenafil
Każdy z tych inhibitorów fosfodiesterazy jest co najmniej częściowo metabolizowany przez CYP3A, a CYP3A może być hamowany przy jednoczesnym stosowaniu klarytromycyny. Skojarzone podawanie klarytromycyny z syldenafilem, tadalafilem lub wardenafilem może prowadzić do zwiększenia ekspozycji na inhibitor fosfodiesterazy. Należy wziąć pod uwagę zmniejszenie dawki tych leków, gdy są podawane w skojarzeniu z klarytromycyną.
Teofilina, karbamazepina
Wyniki badań klinicznych wykazują umiarkowany, ale znaczący statystycznie (p ≤ 0,05) wzrost stężenia teofiliny lub karbamazepiny we krwi, gdy którykolwiek z tych leków podawany był jednocześnie z klarytromycyną. Należy rozważyć potrzebę zmniejszenie dawki.
Tolterodyna
Podstawowy szlak metaboliczny tolterodyny zachodzi głównie przy udziale izoenzymu 2D6 cytochromu P450 (CYP2D6). Jednak w części populacji pozbawionej CYP2D6, metabolizm ten przebiega przy udziale CYP3A. W tej podgrupie zahamowanie CYP3A prowadzi do znacząco wyższego stężenia tolterodyny w surowicy. Konieczne może być zmniejszenie dawki tolterodyny w obecności inhibitorów CYP3A, takich jak klarytromycyna, w populacji, w której metabolizm z udziałem CYP2D6 jest zmniejszony.
Triazolobenzodiazepiny (np. alprazolam, midazolam, triazolam)
Jednoczesne podawanie midazolamu dożylnie z tabletkami klarytromycyny (tabletki 500 mg dwa razy na dobę), zwiększyło AUC midazolamu 2,7-krotnie. Jeśli midazolam podaje się dożylnie w skojarzeniu z klarytromycyną, należy dokładnie kontrolować pacjenta w celu dostosowania dawki. Podawanie midazolamu na błonę śluzową jamy ustnej, które może spowodować ominięcie metabolizmu pierwszego przejścia, będzie prawdopodobnie prowadziło do podobnych interakcji jak po podaniu dożylnym midazolamu, niż jak po podaniu doustnym.
Te same środki ostrożności należy zastosować w stosunku do innych benzodiazepin metabolizowanych przez CYP3A, w tym do triazolamu i alprazolamu. Istnieje małe
prawdopodobieństwo wystąpienia interakcji o znaczeniu klinicznym z klarytromycyną w przypadku benzodiazepin nie metabolizowanych przez CYP3A (temazepam, nitrazepam, lorazepam).
Po wprowadzeniu leku do obrotu odnotowano przypadki interakcji leków i wpływu na ośrodkowy układ nerwowy (OUN) (np. senność i splątanie) podczas jednoczesnego stosowania klarytromycyny i triazolamu. Zaleca się kontrolowanie pacjenta, czy nie występują u niego nasilone działania farmakologiczne na OUN.
Inne interakcje lekowe
Hydroksychlorochina i chlorochina
Należy zachować ostrożność podczas stosowania klarytromycyny u pacjentów przyjmujących leki, o których wiadomo, że wydłużają odstęp QT mogący powodować zaburzenia rytmu serca np. hydroksychlorochina i chlorochina.
Kolchicyna
Kolchicyna jest substratem zarówno dla CYP3A, jak i dla glikoproteiny P (P-gp), która bierze udział w transporcie zewnątrzkomórkowym. Klarytromycyna i inne antybiotyki makrolidowe są znanymi inhibitorami CYP3A i P-gp. Podczas jednoczesnego podawania klarytromycyny i kolchicyny, hamowanie P-gp i (lub) CYP3A przez klarytromycynę może powodować
zwiększenie narażenia na kolchicynę (patrz punkty 4.3 i 4.4). Digoksyna
Uważa się, że digoksyna jest substratem dla glikoproteiny P (P-gp), która bierze udział w transporcie zewnątrzkomórkowym. Klarytromycyna hamuje P-gp. Jeśli klarytromycyna i digoksyna podawane są jednocześnie, zahamowanie P-gp przez klarytromycynę może
prowadzić do zwiększonego narażenia na digoksynę. W czasie nadzoru nad bezpieczeństwem stosowania, po wprowadzeniu leku do obrotu, stwierdzono również zwiększone stężenia digoksyny w surowicy u pacjentów otrzymujących jednocześnie klarytromycynę i digoksynę.
U niektórych pacjentów obserwowano kliniczne objawy pokrywające się z objawami
toksyczności digoksyny, w tym arytmie mogące prowadzić do zgonu. Podczas jednoczesnego stosowania tych leków należy kontrolować stężenie digoksyny w surowicy.
Zydowudyna
Jednoczesne doustne stosowanie klarytromycyny w tabletkach i zydowudyny u dorosłych pacjentów zakażonych wirusem HIV może doprowadzić do zmniejszenia stężenia
zydowudyny w stanie stacjonarnym. Ponieważ klarytromycyna zaburza wchłanianie jednocześnie podawanej doustnie zydowudyny, interakcji tej można w dużym stopniu
zapobiec ustalając dawki tak, aby pomiędzy przyjmowaniem leków następowała 4-godzinna przerwa. Nie odnotowano takiej interakcji u dzieci i młodzieży zakażonych wirusem HIV, otrzymujących klarytromycynę w postaci zawiesiny razem z zydowudyną lub dideoksyinozyną. Prawdopodobieństwo wystąpienia tej reakcji jest małe, gdy klarytromycyna jest podawana w postaci infuzji dożylnej.
Fenytoina i walproinian
Istnieją spontaniczne lub opublikowane doniesienia dotyczące interakcji inhibitorów CYP3A, w tym klarytromycyny, z lekami najprawdopodobniej nie metabolizowanymi przez CYP3A (np. fenytoina i walproinian). Zaleca się kontrolowanie stężeń tych leków w surowicy, jeżeli są podawane jednocześnie z klarytromycyną. Notowano przypadki ich zwiększonego stężenia w surowicy.
Dwukierunkowe interakcje lekowe
Atazanawir
Zarówno klarytromycyna jak i atazanawir są substratami i inhibitorami CYP3A, i istnieją dowody na dwukierunkowe interakcje między tymi lekami. Jednoczesne stosowanie
klarytromycyny (500 mg dwa razy na dobę) z atazanawirem (400 mg raz na dobę) prowadziło do 2-krotnego wzrostu narażenia na klarytromycynę oraz 70% spadku narażenia na 14-OH- klarytromycynę, przy 28% wzroście AUC atazanawiru. Z uwagi na duże okno terapeutyczne klarytromycyny, u pacjentów z prawidłową czynnością nerek nie ma potrzeby zmniejszenia dawki. U pacjentów z umiarkowanymi zaburzeniami czynności nerek (klirens kreatyniny od 30 do 60 ml/min), dawkę klarytromycyny należy zmniejszyć o 50%. U pacjentów z klirensem kreatyniny <30 ml/min, dawkę klarytromycyny należy zmniejszyć o 75%, stosując
odpowiednią postać klarytromycyny. Dawek klarytromycyny przekraczających 1000 mg na dobę nie należy podawać w skojarzeniu z inhibitorami proteazy.
Antagoniści kanału wapniowego
Zaleca się zachować ostrożność podczas skojarzonego podawania klarytromycyny i antagonistów kanału wapniowego metabolizowanych przez CYP3A4 (np. werapamilu, amlodypiny,
diltiazemu) ze względu na ryzyko hipotensji. Stężenia klarytromycyny i antagonistów kanału wapniowego w osoczu mogą zwiększać się ze względu na tę interakcję. U pacjentów
przyjmujących jednocześnie klarytromycynę i werapamil obserwowano hipotensję, bradyarytmię i kwasicę mleczanową.
Itrakonazol
Zarówno klarytromycyna jak i itrakonazol są substratami i inhibitorami CYP3A, co prowadzi do dwukierunkowych interakcji między tymi lekami. Klarytromycyna może zwiększać stężenie
itrakonazolu w osoczu, jak i itrakonazol może zwiększać stężenie klarytromycyny w osoczu.
Pacjentów przyjmujących jednocześnie itrakonazol i klarytromycynę należy ściśle obserwować w kierunku występowania objawów podmiotowych i przedmiotowych zwiększonego lub wydłużonego działania farmakologicznego.
Sakwinawir
Zarówno klarytromycyna, jak i sakwinawir są substratami oraz inhibitorami CYP3A i istnieją dowody na dwukierunkową interakcję między tymi lekami. Podczas podawania 12 zdrowym ochotnikom jednocześnie klarytromycyny (500 mg dwa razy na dobę) i sakwinawiru
(żelatynowe kapsułki miękkie, 1200 mg trzy razy na dobę) w stanie stacjonarnym wartości AUC i Cmax sakwinawiru były o 177% i 187% większe niż wtedy, gdy podawano wyłącznie sakwinawir. Wartości AUC i Cmax klarytromycyny były w przybliżeniu o 40% większe od obserwowanych, gdy podawano wyłącznie klarytromycynę. Nie jest konieczne dostosowanie dawki, gdy obydwa leki są podawane w badanych dawkach oraz postaciach farmaceutycznych przez ograniczony czas. Z badań wynika, że interakcje występujące podczas stosowania
żelatynowych kapsułek miękkich i twardych mogą się różnić. Interakcje lekowe obserwowane podczas badań, w których stosowano wyłącznie sakwinawir mogą różnić się od interakcji występujących podczas leczenia sakwinawirem z rytonawirem. Gdy sakwinawir podawany jest w skojarzeniu z rytonawirem, należy brać pod uwagę możliwy wpływ rytonawiru na
klarytromycynę (patrz punkt powyżej „Rytonawir”).
Pacjentki, które przyjmują doustne środki antykoncepcyjne należy ostrzec, że jeżeli wystąpi biegunka, wymioty lub krwawienie międzymiesiączkowe, to antykoncepcja może być nieskuteczna.
Ciąża
Nie określono bezpieczeństwa stosowania klarytromycyny w okresie ciąży. Zmienne dane z badań na zwierzętach oraz doświadczenie ze stosowania u ludzi wskazują, że nie można wykluczyć niepożądanego wpływu klarytromycyny na rozwój zarodka i płodu. W niektórych badaniach obserwacyjnych oceniających narażenie na klarytromycynę podczas pierwszego i drugiego trymestru stwierdzono zwiększone ryzyko poronienia w porównaniu do
niestosowania antybiotyków lub stosowania innych antybiotyków w tym samym okresie. Dostępne badania epidemiologiczne dotyczące ryzyka poważnych wad wrodzonych podczas stosowania makrolidów, w tym klarytromycyny, w okresie ciąży dają sprzeczne wyniki.
Dlatego nie zaleca się jej stosowania w okresie ciąży bez wnikliwej oceny stosunku korzyści do ryzyka.
Karmienie piersią
Klarytromycyna przenika w małych ilościach do mleka ludzkiego. Szacuje się, że niemowlę karmione wyłącznie piersią otrzymałoby około 1,7% dawki klarytromycyny dostosowanej do masy ciała matki.
Z tego względu u niemowlęcia karmionego piersią może wystąpić biegunka oraz zakażenie grzybicze błon śluzowych. W tej sytuacji może być konieczne przerwanie karmienia piersią. Należy również rozważyć możliwość wystąpienia nadwrażliwości. Należy oceniać korzyści z leczenia dla matki w stosunku do ryzyka dla niemowlęcia.
Płodność
Nie ma informacji na temat wpływu klarytromycyny na płodność u ludzi. Ograniczone dane z badań na szczurach nie wskazują na wpływ na płodność.
Nie ma danych dotyczących wpływu klarytromycyny na zdolność prowadzenia pojazdów lub obsługiwania maszyn. Przed prowadzeniem pojazdów lub obsługą maszyn należy wziąć pod uwagę możliwość wystąpienia związanych ze stosowaniem leku zawrotów głowy, w tym pochodzenia błędnikowego, splątania i dezorientacji.
Doniesienia wskazują, że zastosowanie dużych dawek klarytromycyny może prowadzić do
zaburzeń żołądkowo- jelitowych. Opisano przypadek pacjenta z zaburzeniami dwubiegunowymi w wywiadzie, który przyjął 8 g klarytromycyny . Obserwowano u niego zmiany w stanie
psychicznym, zachowania paranoidalne, hipokaliemię i hipoksemię.
Działania niepożądane występujące po przedawkowaniu należy leczyć poprzez
natychmiastowe usunięcie niewchłoniętego leku i zastosowanie ogólnego postępowania objawowego. Podobnie, jak w przypadku innych antybiotyków makrolidowych nie należy
oczekiwać, że hemodializa ani dializa otrzewnowa mogą wpłynąć korzystnie ani znacząco na stężenie klarytromycyny w surowicy.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: leki przeciwbakteryjne do stosowania ogólnego, makrolidy Kod ATC: J01FA09
Mechanizm działania
Klarytromycyna jest antybiotykiem należącym do grupy makrolidów. Przejawia działanie
przeciwbakteryjne poprzez wybiórcze wiązanie się z podjednostką 50S rybosomów wrażliwych drobnoustrojów, zapobiegając przemieszczaniu się aktywowanych aminokwasów. Hamuje to wewnątrzkomórkową syntezę białka w komórkach wrażliwych bakterii.
Metabolit klarytromycyny, 14-hydroksy-klarytromycyna - produkt metabolizmu związku
macierzystego, również wykazuje działanie przeciwbakteryjne. Jego działanie jest słabsze niż związku macierzystego w stosunku do większości baterii, w tym Mycobacterium spp. Wyjątkiem są bakterie Haemophilus influenzae, w przypadku których metabolit klarytomycyny 14-hydroksy działa dwa razy silniej niż związek macierzysty.
Klarytromycyna działa bakteriobójczo na wiele szczepów bakterii. Stężenia graniczne
Zgodnie z wytycznymi Europejskiego Komitetu ds. Oznaczania Lekowrażliwości Drobnoustrojów (EUCAST, ang. European Committee for Antimicrobial Susceptibility Testing) zdefiniowano następujące stężenia graniczne dla klarytromycyny:
Stężenia graniczne (minimalne stężenie hamujące – MIC, mg/l)
Mikroorganizmy
Wrażliwe (≤)
Oporne (>)
Staphylococcus spp. 1)
1
2
Streptococcus spp. (grupy A, B, C
oraz G) 1)
0,25
0,5
Streptococcus pneumonia 1)
0,25
0,5
Moraxella catarrhalis 1)
0,25
0,5
1) Wrażliwość bakterii na klarytromycynę można określać używając erytromycyny.
Wrażliwość
In vitro klarytromycyna zazwyczaj wykazuje aktywność względem następujących organizmów:
Gatunki powszechnie wrażliwe
Bakterie Gram-dodatnie
Staphylococcus aureus (wrażliwe na metycylinę);
Streptococcus pyogenes (paciorkowce beta-hemolizujące z grupy A);
paciorkowce alfa-hemolizujące (grupa viridans)
Streptococcus (Diplococcus) pneumoniae
Streptococcus agalactiae
Listeria monocytogenes
Bakterie Gram-ujemne
Haemophilus influenzae
Haemophilus parainfluenzae
Moraxella (Branhamella) catarrhalis
Neisseria gonorrhoeae
Legionella pneumophila
Bordetella pertussis
Helicobacter pylori
Campylobacter jejuni
Mykoplazma
Mycoplasma pneumoniae
Ureaplasma urealyticum
Inne organizmy
Chlamydia trachomatis
Mycobacterium avium
Mycobacterium leprae
Chlamydia pneumoniae
Beztlenowce
Bacteroides fragilis wrażliwe na makrolidy
Clostridium perfringens
gatunki z rodzaju Peptococcus
Peptostreptococcus species
Propionibacterium acnes
Klarytromycyna również działa bakteriobójczo na kilka szczepów bakterii. Obejmują one Haemophilus influenzae, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae, Moraxella catarrhalis, Neisseria gonorrhoeae, Helicobacter pylori oraz gatunki z rodzaju Campylobacter.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Wchłanianie
Klarytromycyna szybko i dobrze wchłania się z przewodu pokarmowego po podaniu doustnym. Aktywny mikrobiologicznie metabolit, 14-(R)-hydroksy-klarytromycyna, powstaje wskutek efektu pierwszego przejścia. Klarytromycynę można podawać niezależnie od posiłków, ponieważ pokarm nie ma wpływu na jej dostępność biologiczną. Pokarm
nieznacznie opóźnia wchłanianie klarytromycyny oraz tworzenie się metabolitu 14- hydroksylowego.
Dystrybucja
Klarytromycyna w niektórych tkankach osiąga stężenia, które są wielokrotnie wyższe niż stężenia we krwi krążącej. Zwiększone stężenia odnotowano zarówno w migdałkach, jak i w miąższu płuc. Klarytromycyna przenika również do płynu w uchu środkowym w stężeniach przewyższających stężenia w surowicy. W zakresie stężeń terapeutycznych klarytromycyna wiąże się z białkami osocza w 80%.
Biotransformacja
Głównym metabolitem występującym w moczu jest 14-hydroksyklarytromycyna, stanowiąca 10-15% dawki.
Wydalanie
Największa część podanego produktu jest wydalana z kałem, pierwotnie z żółcią. 5-10% dawki leku wydala się z kałem w postaci niezmienionej.
Liniowość
Chociaż farmakokinetyka klarytromycyny nie jest liniowa, stan stacjonarny zostaje osiągnięty po 2 dniach podawania.
W trwających 4 tygodnie badaniach na zwierzętach zaobserwowano, iż toksyczność
klarytromycyny jest zależna od dawki oraz czasu trwania terapii. U wszystkich badanych
gatunków pierwsze objawy toksyczności dotyczyły wątroby, przy czym zmiany u małp i psów dostrzeżono w ciągu 2 tygodni od rozpoczęcia eksperymentu. Układowe stężenia leku,
związane z toksycznością, nie są znane, lecz dawki toksyczne (300 mg/kg mc./dobę) były ewidentnie wyższe od zalecanych dawek terapeutycznych u ludzi. Toksyczny wpływ na
tkanki dotyczył takich organów, jak: żołądek, grasica wraz z innymi tkankami limfoidalnymi oraz nerki. Klarytromycyna podawana w dawkach zbliżonych do terapeutycznych jedynie u psów wywoływała przekrwienie spojówki oraz łzawienie. Przy zastosowaniu dawki dobowej 400 mg/kg mc. u niektórych psów i małp rozwinęły się zmętnienie rogówki i (lub) obrzęk.
Klarytromycyna w badaniach in vitro oraz in vivo nie wykazywała wpływu genetoksycznego.
Badania toksycznego wpływu na rozrodczość dowiodły, iż dożylne podawanie królikom klarytromycyny w dawkach dwukrotnie większych od dawek klinicznych oraz podawanie doustne małpom – w dawkach dziesięciokrotnie większych od dawek klinicznych prowadziło do zwiększenia częstości występowania samoistnych poronień. Dawki te miały związek z toksycznością względem matki. W badaniach na szczurach zasadniczo nie stwierdzono
embriotoksycznego bądź teratogennego wpływu klarytromycyny. Jednakże patologiczne
zmiany w układzie krążenia zauważono w dwóch badaniach na szczurach. którym podawano dawki 150 mg/kg mc. na dobę. U myszy otrzymujących dawki klarytromycyny 70 razy większe od dawki klinicznej dochodziło do rozszczepu podniebienia ze zmienną częstością (3- 30% przypadków). Klarytromycynę znaleziono w mleku samic w okresie laktacji.
U trzydniowych myszy i szczurów wartości stężeń LD50 wynosiły w przybliżeniu połowę wartości ustalonych dla zwierząt dorosłych. Profil toksyczności u młodocianych zwierząt był podobny, jak u zwierząt dojrzałych, niemniej jednak wyniki niektórych badań wskazują na wzrost nefrotoksyczności u szczurzych noworodków. U młodocianych zwierząt stwierdzono ponadto niewielkie zmniejszenie liczby erytrocytów, trombocytów i leukocytów. Nie badano działania rakotwórczego klarytromycyny.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Kwasu metakrylowego i etylu akrylanu kopolimer (1:1), dyspersja 30% Makrogol 1500
Talk Karbomer
Krzemionka koloidalna bezwodna Sacharoza
Aspartam (E 951) Guma ksantan (E 415)
Cytrynian sodu
Sodu benzoesan (E 211) Tytanu dwutlenek (E 171)
Aromat mięty pieprzowej (zawierający substancje smakowe, skrobię zmodyfikowaną) Aromat tutti frutti (zawierający maltodekstrynę kukurydzianą, aromaty identyczne z naturalnymi, glikol propylenowy (E 1520), zmodyfikowaną skrobię kukurydzianą (E 1450), składniki nadające smak i zapach pochodzenia syntetycznego).
Nie dotyczy.
2 lata (granulat)
14 dni (przygotowana zawiesina)
Przechowywać w temperaturze poniżej 30C. Przygotowanej zawiesiny nie przechowywać w lodówce, ani nie zamrażać.
Przezroczysta butelka z HDPE z zaznaczonym pierścieniem służącym do wypełnienia odpowiednią objętością z wieczkiem posiadającym zabezpieczenie przed dziećmi z PP oraz polipropylenową nakrętką.
Każde opakowanie zawiera również półprzezroczystą strzykawkę doustną z PP o pojemności 5 ml (z oznakowaniem CE i podziałką 1,25; 2,5; 3,75 i 5 ml) z tłokiem HDPE i adapterem LDPE do butelki.
Wielkość opakowań:
1 butelka zawierająca 34,72 – 38,37 g granulatu do przygotowania 50 ml zawiesiny doustnej lub
1 butelka zawierająca 41,66 – 46,04 g granulatu do przygotowania 60 ml zawiesiny doustnej lub
1 butelka zawierająca 48,61 – 53,72 g granulatu do przygotowania 70 ml zawiesiny doustnej lub
1 butelka zawierająca 69,44 – 76,75 g granulatu do przygotowania 100 ml zawiesiny doustnej lub
1 butelka zawierająca 97,21 – 107,44 g granulatu do przygotowania 140 ml zawiesiny doustnej Nie wszystkie wielkości opakowań mogą znajdować się w obrocie.
Instrukcja sporządzenia zawiesiny
Krok A
Wyjąć butelkę z pudełka

Krok B
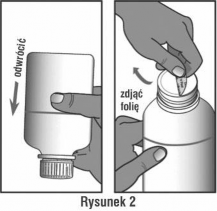
Odwrócić butelkę i wstrząsnąć, aby proszek w butelce nie przylegał do dna. Należy sprawdzić to spoglądając na odwróconą butelkę pod światło. Otworzyć nakrętkę zgodnie z poniższą instrukcją, podważyć i usunąć folię zabezpieczającą (patrz rysunek 2).
Krok C
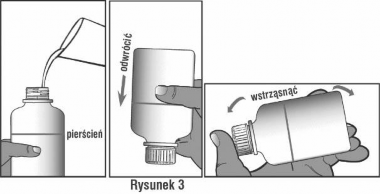
Powoli dodać wodę do poziomu pierścienia na butelce. Patrząc pod światło można sprawdzić, czy butelka jest napełniona do właściwego poziomu. Zamknąć butelkę, odwrócić i silnie wstrząsać przez około 1 minutę, aż proszek nie będzie przylegał do dna butelki (patrz rysunek 3). Należy spojrzeć na odwróconą butelkę pod światło, aby to sprawdzić.
Należy poczekać chwilę i jeżeli jest to potrzebne dodać więcej wody, aż do poziomu pierścienia, jak opisano w kroku D.
Krok D
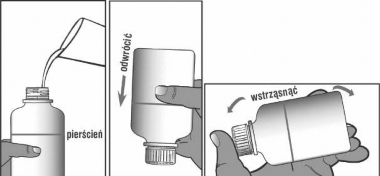
W razie potrzeby, ponownie dodać wody do poziomu pierścienia na butelce. Jeżeli jest to potrzebne trzymać butelkę pod światło, aby sprawdzić, czy butelka jest napełniona do właściwego poziomu. Zamknąć butelkę. Odwrócić i silnie wstrząsać do czasu, aż proszek nie będzie przylegał do dna butelki (patrz rysunek 4). Należy to sprawdzić trzymając odwróconą butelkę pod światło.
Rysunek 4
Instrukcja użycia
Podawanie dawki zawiesiny
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Lek Klabax EC może powodować gorzki posmak. Można temu zapobiec przez zjedzenie czegoś, wypicie soku lub wody tuż po przyjęciu zawiesiny.

Podanie wody lub soku po podaniu leku.
Można również jednorazowo dodać do butelki następujące ilości wody dla odpowiednich wielkości opakowań:
Wielkość opakowania | Objętość wody, jaką należy dodać |
Butelka 50 ml | 27 ml |
Butelka 60 ml | 33 ml |
Butelka 70 ml | 38 ml |
Butelka 100 ml | 54 ml |
Butelka 140 ml | 76 ml |
Zakręcić butelkę i energicznie wstrząsnąć.
Ranbaxy (Poland) Sp. z o.o. ul. Kubickiego 11
02 – 954 Warszawa
Pozwolenie nr 25813
25.03.2020
14.02.2023 r.











