CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
BioThrax zawiesina do wstrzykiwań.
Szczepionka przeciwko wąglikowi, adsorbowana (oczyszczony przesącz bezkomórkowy).
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
Jedna dawka (0,5 ml) zawiera:
Antygen wąglika z przesączu: 50 mikrogramów (50 µg) a, b
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
a Wytwarzany z bezkomórkowych przesączy niewirulentnego szczepu Bacillus anthracis
b Adsorbowany na wodorotlenku glinu uwodnionym (0,6 mg Al3+)
POSTAĆ FARMACEUTYCZNA
Zawiesina do wstrzykiwań.
Jałowa, po zmieszaniu mlecznobiała, płynna zawiesina
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Szczepionka BioThrax jest wskazana w celu zapobiegania chorobom wywołanym przez
Bacillus anthracis u osób dorosłych narażonych na ekspozycję.
Jeśli tylko jest to możliwe szczepionkę BioThrax należy stosować zgodnie z oficjalnymi zaleceniami.
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
Dawkowanie
Szczepienie pierwotne: 3 dawki po 0,5 ml każda, podawane w miesiącu 0, 1 i 6.
Dawka przypominająca: 0,5 ml w odstępach trzyletnich LUB według oficjalnych zaleceń.
Sposób podawania
Szczepionkę podaje się we wstrzyknięciach, głęboko domięśniowo (im.) w okolicy mięśnia naramiennego.
Strona 1 z 13
Szczepionkę można podawać we wstrzyknięciach podskórnych (sc.) (patrz punkt 5.1), gdy istnieją wskazania medyczne (np. u osób z zaburzeniami krzepnięcia), zachowując takie samo dawkowanie.
W przypadku podawania więcej niż jednej szczepionki w tym samym czasie należy stosować oddzielne miejsca wstrzyknięcia.
Szczepionki nie wolno mieszać z innymi szczepionkami w tej samej strzykawce.
Instrukcje dotyczące postępowania ze szczepionką przed podaniem znajdują się w punkcie 6.6.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
podczas radioterapii może nie zapewnić optymalnej odpowiedzi. Po zakończeniu takiego leczenia można rozważyć odroczenie szczepienia na 3 miesiące.
Podobnie jak w przypadku innych szczepionek, ochronna odpowiedź immunologiczna może
nie zostać uzyskana u wszystkich osób.
Bezpieczeństwo i skuteczność produktu BioThrax u dzieci nie zostały ustalone.
Bezpieczeństwo i skuteczność produktu BioThrax u pacjentów w wieku >65 lat nie zostały ustalone.
Stosowanie z innymi szczepionkami:
BioThrax można podawać jednocześnie z dowolną z następujących monowalentnych lub skojarzonych szczepionek przeciw: cholerze, błonicy, zapaleniu wątroby typu A i B, grypie, japońskiemu zapaleniu mózgu, odrze, zapaleniu opon mózgowo-rdzeniowych, śwince, krztuścowi, dżumie, polio, wściekliźnie, różyczce, ospie prawdziwej, tężcowi, ospie wietrznej i żółtej gorączce.
Brak danych dotyczących wpływu jednoczesnego podawania produktu BioThrax z innymi szczepionkami na odpowiedź immunologiczną.
W przypadku jednoczesnego podawania z innymi szczepionkam, produkt BioThrax należy podawać w oddzielne miejsce wstrzyknięcia (patrz punkt 5.3).
Stosowanie z antybiotykami:
Produkt BioThrax można podawać jednocześnie z ciprofloksacyną.
Inne produkty lecznicze:
Odpowiedź immunologiczna może być zmniejszona, jeśli pacjent poddawany jest leczeniu immunosupresyjnemu (patrz punkt 4.4).
Ciąża
Produktu BioThrax nie należy stosować w okresie ciąży, chyba że potencjalne korzyści z zastosowania szczepionki wyraźnie przewyższają potencjalne ryzyko dla płodu.
W retrospektywnym badaniu z grupą kontrolną odnotowano występowanie wad wrodzonych (np. otwór owalny), gdy matki zostały nieumyślnie zaszczepione podczas pierwszego trymestru ciąży.
W badaniach na zwierzętach (królikach) nie zaobserwowano wpływu na ciążę, zachowanie matki, płodność samic ani rozwój pourodzeniowy (patrz punkt 5.3).
Karmienie piersią:
Nie badano wpływu podania produktu BioTrax matkom na karmione piersią niemowlęta. Nie wiadomo, czy BioThrax przenika do mleka kobiecego.
Płodność:
Istnieją ograniczone dane dotyczące płodności u ludzi.
W retrospektywnym badaniu z grupą kontrolną oceniającym wcześniejsze podanie produktu BioThrax u partnerów płci męskiej zgłaszających się do poradni zapłodnienia in vitro nie wykazano żadnego wpływu na parametry nasienia, odsetek zapłodnienia, jakość zarodka ani częstość występowania ciąży.
Badania na królikach nie wykazały wpływu szczepionki na reprodukcję (patrz punkt 5.3).
Produkt BioThrax nie wywiera lub wywiera niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednak niektóre działania wymienione w punkcie 4.8 mogą tymczasowo wpływać na zdolność prowadzenia pojazdów lub obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa:
Bezpieczeństwo stosowania produktu BioThrax oceniono w jednym kontrolowanym badaniu klinicznym u 1 563 osób dorosłych; 1 044 osoby zostały przypisane do leczenia obejmującego od 1 do 8 wstrzyknięć domięśniowych (im.). Badanie kliniczne wykazało, że działania niepożądane występowały rzadziej po każdej kolejnej dawce podawanej domięśniowo. Dalsze dane dotyczące bezpieczeństwa stosowania oceniano na podstawie doświadczeń po wprowadzeniu do obrotu, gdzie ponad 14 milionów dawek produktu
BioThrax podano ponad 3 milionom osób dorosłych. Najczęściej obserwowanymi działaniami niepożądanymi są reakcje w miejscu wstrzyknięcia, ból głowy, bóle mięśni i zmęczenie.
Tabelaryczny wykaz działań niepożądanych
Działania niepożądane (po szczepieniu pierwotnym lub dawce przypominającej) uważane za przynajmniej potencjalnie związane ze szczepieniem, zostały sklasyfikowane według częstości występowania. Częstotliwości zostały zdefiniowane następująco:
Bardzo często: (≥1/10) Często: (≥1/100 do <1/10)
Niezbyt często: (≥1/1 000 do <1/100)
Rzadko: (≥1/10 000 do <1/1 000)
Bardzo rzadko: (< 1/10 000, łącznie ze sporadycznymi doniesieniami) Nieznana: (częstość nie może być określona na podstawie dostępnych danych)
W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem. Oprócz raportów z badań klinicznych, na liście znajdują się dobrowolne zgłoszenia reakcji niepożądanych dla produktu BioThrax otrzymane z całego świata. Ponieważ reakcje te są zgłaszane dobrowolnie dla populacji o nieznanej liczebności, trudno jest wiarygodnie ustalić częstość zdarzeń, dlatego będą one klasyfikowane jako „nieznane”.
Tabela 1 Działania niepożądane z badań klinicznych i doświadczeń po wprowadzeniu produktu leczniczego do obrotu (osoby dorosłe)
Klasyfikacja układów i narządów | Częstość występowania | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Często | Nieżyt nosa, zapalenie zatok, zakażenie dróg oddechowych |
Niezbyt często | Półpasiec | |
Nowotwory łagodne, złośliwe i nieokreślone (w tym torbiele i polipy) | Rzadko | Rak przewodowy piersi |
Zaburzenia krwi i układu chłonnego | Częstość nieznana | Powiększony węzeł chłonny pachowy |
Zaburzenia układu immunologicznego | Rzadko | Reakcje nadwrażliwości (obejmujące trudności w oddychaniu, osłabienie, chrypkę lub świszczący oddech, szybkie bicie serca, pokrzywkę, zawroty głowy, bladość lub obrzęk gardła, warg lub twarzy). |
Bardzo rzadko | Reakcja anafilaktyczna | |
Zaburzenia psychiczne | Często | Bezsenność |
Zaburzenia układu nerwowego | Bardzo często | Ból głowy |
Często | Zawroty głowy |
Klasyfikacja układów i narządów | Częstość występowania | Działania niepożądane |
Niezbyt często | Omdlenie | |
Rzadko | Guz rzekomy mózgu z obustronnym obrzękiem tarczy nerwu wzrokowego, zwężenie wodociągu mózgu z uogólnionymi napadami padaczkowymi | |
Częstość nieznana | Zespół Guillaina-Barrégo, drgawki, zapalenie korzeni splotu ramiennego, senność | |
Zaburzenia oka | Niezbyt często | Alergia w obrębie oczu |
Zaburzenia serca | Niezbyt często | Przyspieszona częstotliwość rytmu serca |
Częstość nieznana | Kołatanie serca, zwolniona częstotliwość rytmu serca | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Często | Kaszel |
Niezbyt często | Przekrwienie dróg oddechowych, duszność, kichanie | |
Częstość nieznana | Dysfonia | |
Zaburzenia żołądka i jelit | Często | Nudności (niestrawność) |
Niezbyt często | Ból w nadbrzuszu, wymioty | |
Częstość nieznana | Biegunka, dysfagia | |
Zaburzenia skóry i tkanki podskórnej | Często | Wysypka, świąd |
Rzadko | Zimne poty | |
Częstość nieznana | Obrzęk naczynioruchowy, łysienie, wyprysk, suchość skóry | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Bardzo często | Bóle mięśni |
Często | Bóle stawów, ból pleców, ból szyi | |
Niezbyt często | Sztywność stawów, sztywność mięśniowo-szkieletowa | |
Rzadko | Zespół pierścienia rotatorów | |
Częstość nieznana | Rabdomioliza | |
Zaburzenia układu rozrodczego i piersi | Niezbyt często | Bolesne miesiączkowanie |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Ból w miejscu wstrzyknięcia (odczuwanie pieczenia bezpośrednio po wstrzyknięciu; ból powodujący zmniejszoną ruchliwość ostrzykniętego ramienia), obrzęk w miejscu wstrzyknięcia, stwardnienie w miejscu wstrzyknięcia, rumień w miejscu wstrzyknięcia, siniak w miejscu wstrzyknięcia, świąd w miejscu wstrzyknięcia, uczucie ciepła w miejscu wstrzyknięcia, zmęczenie |
Często | Gorączka, dreszcze, ból pachy | |
Niezbyt często | Choroba grypopodobna, złe samopoczucie, drętwienie/mrowienie w miejscu wstrzyknięcia | |
Częstość nieznana | Pokrzywka w miejscu wstrzyknięcia |
Niemowlęta i dzieci (do 10 roku życia)
Bezpieczeństwo i skuteczność produktu BioThrax u dzieci nie zostały ustalone.
Młodzież (od 11 lat)
Bezpieczeństwo i skuteczność produktu BioThrax u młodzieży nie zostały ustalone.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Doświadczenie związane z przedawkowaniem jest ograniczone. W przypadku przedawkowania zaleca się monitorowanie czynności życiowych i ewentualnie leczenie objawowe.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: szczepionki przeciw wąglikowi, kod ATC: J07AC Mechanizm działania
Bacillus anthracis zawiera trzy białka określane jako antygen ochronny (ang. protective antigen, PA), czynnik letalny (ang. lethal factor, LF) i czynnik obrzękowy (ang. edema factor, EF). Pojedynczo białka te nie są cytotoksyczne, ale skojarzenie PA z LF lub EF skutkuje wytworzeniem toksyn. BioThrax działa poprzez stymulowanie układu odpornościowego do produkcji przeciwciał ochronnych przeciwko PA. Po zablokowaniu PA, LF i EF nie mogą wchodzić z nim w interakcje i tym samym toksyny ulegają neutralizacji.
Skuteczność kliniczna i bezpieczeństwo stosowania
Skuteczność produktu BioThrax nie została oceniona w badaniach klinicznych. Skuteczność szczepionki została określona na podstawie danych dotyczących immunogenności, w tym mian przeciwciał anty-PA klasy IgG i neutralizujących toksyny.
Wcześniejsza wersja adsorbowanej szczepionki przeciw wąglikowi (podawana sc. w tygodniach 0, 2 i 4 oraz miesiącach 6, 12 i 18) została oceniona pod kątem skuteczności klinicznej w poddanej ekspozycji, wrażliwej, nadzorowanej populacji 1 249 pracowników młyna w latach 1955-1959. Stwierdzono 26 przypadków, 4 u osób, które miały niepełne szczepienia, 21 u niezaszczepionych pracowników i jeden u zaszczepionego pracownika. Dane wykazały skuteczność szczepionki na poziomie 92,5% (dolna granica 95% CI = 65%).
Dane z nadzoru zebrane przez amerykańskie ośrodki ds. kontroli i zapobiegania chorobom (U.S. Disease Control and Prevention, CDC) w latach 1962-1974 wskazują na 27 przypadków zachorowania na wąglika: 24 u osób nieszczepionych i 3 u osób, u których cykl szczepień był niepełny. Nie zgłoszono udokumentowanych przypadków wąglika u osób, które otrzymały co najmniej trzy z zalecanych sześciu dawek szczepionki przeciw wąglikowi (dotyczy to zarówno poprzedniej szczepionki jak i produktu BioThrax).
Immunogenność:
Immunogenność produktu BioThrax została oceniona u szczepionych uczestników i zwierząt przez ilościowe oznaczenie odpowiedzi immunologicznej z udziałem przeciwciał przeciw antygenowi ochronnemu (protective antigen, PA) w klasie IgG oraz na podstawie zdolności tych przeciwciał do neutralizowania toksyny letalnej wąglika. Stwierdzono dużą korelację pomiędzy poziomem przeciwciał anty-PA klasy IgG a poziomem przeciwciał neutralizujących toksynę wąglika (Toxin Neutralizing Antibody, TNA). Poziom przeciwciał anty-PA klasy IgG i przeciwciał TNA koreluje z przeżyciem i ochroną przed chorobą wywołaną przez wąglika.
Badania z udziałem ssaków naczelnych innych niż ludzie (non-human primates, NHP) pokazują, że szczepienie przeciwko chorobie wywoływanej przez wąglika chroni przed śmiertelnym działaniem przetrwalników wąglika i jest związane z ochronną odpowiedzią immunologiczną mierzoną na podstawie poziomu przeciwciał anty-PA IgG lub TNA. Ze względów etycznych nie jest możliwe przeprowadzenie podobnych badań u zdrowych ochotników, zatem skuteczność produktu leczniczego BioThrax opiera się na ekstrapolacji współczynników przeżycia i poziomu przeciwciał ochronnych uzyskanych w badaniach NHP. Badania NHP są zatem stosowane do oszacowania przypuszczalnego poziomu przeciwciał ochronnych u ludzi. Poziom przeciwciał u ludzi mierzono podczas cyklu szczepienia pierwotnego i śledzono w miarę upływu czasu w celu uwzględnienia odpowiedzi na dawkę przypominającą szczepionki. Dane uzyskane z badań NHP umożliwiają ekstrapolację w celu oszacowania przeżywalności szczepionych ludzi w różnych punktach czasowych podczas cyklu szczepień. Szacuje się, że osoby, które otrzymały cykl szczepienia pierwotnego w ciągu 6 miesięcy mają 86,8-procentowe prawdopodobieństwa przeżycia w przypadku ekspozycji na przetrwalniki wąglika do 3 lat później, a prawdopodobieństwo przeżycia zwiększa się do 99,7% w przypadku ekspozycji po upływie miesiąca (tj. po upływie 43 miesięcy) po podaniu pojedynczej dawki przypominającej podanej 3 lata po zakończeniu cyklu szczepienia pierwotnego (tj. dawka przypominająca po upływie 42 miesięcy).
W poniższej Tabeli 2 podsumowano odpowiedź z udziałem przeciwciał u ludzi przed i po zakończeniu cyklu szczepienia pierwotnego (0, 1, 6 miesięcy) przy użyciu różnych schematów dawkowania i szacowane wskaźniki przeżywalności u ludzi w oparciu o badania NHP. W Tabeli 3 podsumowano odpowiedź z udziałem przeciwciał u ludzi przed i po szczepieniu przypominającym (3 lata po zakończeniu cyklu szczepienia pierwotnego) przy użyciu różnych schematów dawkowania i szacowane wskaźniki przeżywalności u ludzi w oparciu o badania NHP.
Tabela 2 Wyniki oznaczenia przeciwciał anty-PA klasy IgG GMC i TNA ED50 według schematu szczepień Schemat szczepienia pierwotnego z zastosowaniem przedziału ufności 95%
Schemat | Miesiąc 1 | Miesiąc 2 | Miesiąc 6 | 1 miesiąc po zakończeniu podstawowego schematu szczepień (miesiąc 7.) | |||||
Anty-PA (µg/ml) | TNA | Anty-PA (µg/ml) | TNA | Anty- PA (µg/ml) | TNA | Anty- PA (µg/ml) | TNA | % szacowana przeżywalność | |
7-5-4 im. (n=782) | 2,6 (2,4; 2,9) | 20,2 (19,2; 21,3) | 46,4 (42,2; 51,0) | 165,5 (146,2; 187,4) | 3,9 (3,6; 4,3) | 22,2 (20,8; 23,6) | 206,9 (187,1; 227,0) | 1423,9 (1253,1; 1617,9) | 99,4% (98,0; 99,9%) |
Anty-PA klasy IgG = immunoglobuliny klasy G przeciw antygenowi ochronnemu (średnia geometryczna stężenia) TNA ED50 = przeciwciała neutralizujące toksynę wąglika (średnia geometryczna miana) | |||||||||
Tabela 3 Wyniki oznaczenia przeciwciał anty-PA klasy IgG GMC i TNA ED50 według schematu szczepień Dawka przypominająca z zastosowaniem przedziału ufności 95%
Schemat | Miesiąc 42 .(przed podaniem dawki przypominającej) | Miesiąc 43. (1 miesiąc po podaniu dawki przypominającej) | ||||
Anty-PA (µg/ml) | TNA | % szacowana przeżywalność | Anty-PA (µg/ml) | TNA | % szacowana przeżywalność | |
4-im.1 | 6,0 | 42,7 | 86,8% | 433,2 | 2825,9 | 99,7% |
(5,3; 6,9) | (33,8; 54,0) | (80,8; 92,1) | (379,6; 494,4) | (2175,2; | (98,7; 100,0) | |
(n=161) | (n=70) | (n=157) | 3671,3) | |||
(n=66) | ||||||
5-im. | 21,6 | 174,1 | 95,8% | 310,0 | 1876,2 | 99,7% |
(18,9; 24,7) | (139,3; 217,6) | (91,6; 98,5) | (270,5; 355,3) | (1603,1; | (98,5; 100,0) | |
(n=145) | (n=72) | (n=141) | 2195,9) | |||
(n=67) | ||||||
7-im. | 35,7 | 215,2 | 98,1% | 254,8 | 1451,0 | 99,7% |
(31,2; 40,9) | (166,4; 278,4) | (94,9; 99,5) | (222,0; 292,4) | (1139,5;1847,7) | (98,5;100,0) | |
(n=147) | (n=67) | (n=139) | (n=56) | |||
1 – Jest to zarejestrowany sposób podania produktu leczniczego BioThrax zgodnie z Punktem 4.2 | ||||||
Anty-PA IgG = immunoglobuliny klasy G przeciw antygenowi ochronnemu (średnia geometryczna stężenia)
TNA ED50 = przeciwciała neutralizujące toksynę wąglika (średnia geometryczna miana)
Rycina 1 przedstawia stężenie przeciwciał anty-PA klasy IgG, a Rycina 2 - miano TNA wraz z upływem czasu dla różnych schematów szczepień. Punkty czasowe 0, 1 i 6 miesięcy odpowiadają podstawowemu schematowi szczepień, a dawka przypominająca podawana jest po 42 miesiącach (3 lata po zakończeniu podstawowego schematu szczepień). Punkt czasowy 7 miesięcy oznacza miesiąc po zakończeniu cyklu szcepienia pierwotnego, a 43 miesięcy – miesiąc po podaniu dawki przypominającej.
Rycina 1 Stężenie przeciwciał anty-PA klasy IgG wraz z upływem czasu
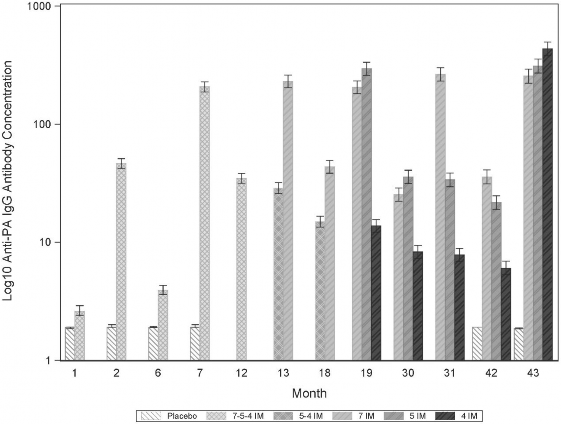
Uwaga: Dolna granica oznaczalności (lower limit of quantification, LLOQ) dla testu wynosi 1,8 µg/ml
Rycina 2 Miano TNA ED50 wraz z upływem czasu
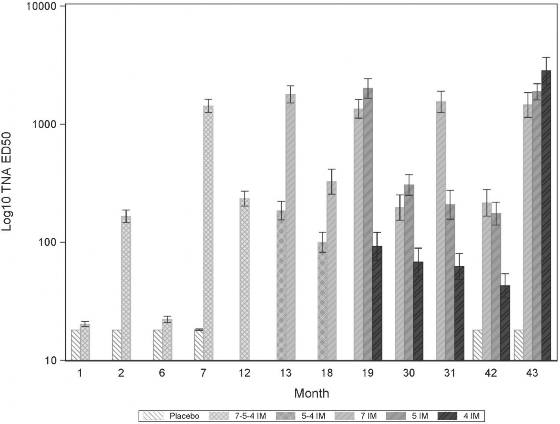
Uwaga: Dolna granica oznaczalności (lower limit of quantification, LLOQ) dla testu wynosi TNA ED50 = 18
Właściwości farmakokinetyczne
Nie dotyczy.
Przedkliniczne dane o bezpieczeństwie
Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych, badań toksyczności po podaniu pojedynczym i wielokrotnym nie ujawniają szczególnego zagrożenia dla człowieka.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Chlorek benzetoniowy
Formaldehyd Sodu chlorek
Woda do wstrzykiwań
Informacje na temat adsorbantu, patrz punkt 2.
Niezgodności farmaceutyczne
Nie mieszać produktu tego leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności, patrz punkt 4.5.
Okres ważności
lata
Po pierwszym otwarciu zawartość fiolki należy zużyć w ciągu 28 dni i przechowywać zgodnie z zaleceniami w punkcie 6.4.
Specjalne środki ostrożności podczas przechowywania
Przechowywać w lodówce (2ºC – 8ºC). Nie zamrażać.
Przechowywać w oryginalnym opakowaniu, w celu ochrony przed światłem.
Rodzaj i zawartość opakowania
ml (10 x dawka 0,5 ml) zawiesiny w fiolce wielodawkowej (szkło typu I) z korkiem (guma chlorobutylowa) w opakowaniu zawierającym 1 sztukę.
Specjalne środki ostrożności dotyczące usuwania <i innych czynności>
Przed użyciem fiolkę należy dobrze wstrząsnąć, aby uzyskać jednorodną zawiesinę.
Szczepionkę należy obejrzeć przed użyciem. Jeśli produkt wydaje się odbarwiony lub zawiera widoczne cząstki, fiolkę należy wyrzucić.
Na fiolce należy zapisać datę i godzinę otwarcia.
Użyć osobnej sterylnej igły i strzykawki dla każdej osoby, aby uniknąć przeniesienia
wirusowego zapalenia wątroby i innych czynników zakaźnych.
Fiolkę wielodawkową należy przechowywać z dala od najbliższego otoczenia pacjenta zgodnie z warunkami przechowywania opisanymi w punkcie 6.4. Nigdy nie należy gromadzić ani łączyć pozostałości w celu późniejszego użycia.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
Emergent Sales and Marketing Germany GmbH Vichystraße 14
76646 Bruchsal
Niemcy
Tel.: 0049 7251 32197031
Faks: 0049 7251 32197010
NUMER/-Y POZWOLENIA/-EŃ NA DOPUSZCZENIE DO OBROTU
25002
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 30 listopada 2018 Data przedłużenia pozwolenia:
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO











