Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
OZW
Pacjenci przyjmujący produkt Xanirva 2,5 mg dwa razy na dobę powinni również przyjmować dawkę dobową 75 do 100 mg ASA lub dawkę dobową 75 do 100 mg ASA oprócz dawki dobowej
75 mg klopidogrelu lub standardowej dawki dobowej tyklopidyny.
Leczenie należy regularnie oceniać, indywidualnie dla pacjenta, wyważając ryzyko zdarzeń niedokrwiennych w stosunku do ryzyka krwawień. Wydłużenie leczenia wykraczające poza
12 miesięcy powinno zostać wprowadzone na podstawie indywidualnej oceny pacjenta, ponieważ doświadczenie w stosowaniu do 24 miesięcy jest ograniczone (patrz punkt 5.1).
Leczenie produktem Xanirva należy rozpocząć jak najszybciej po stabilizacji zdarzenia OZW (w tym po zabiegach rewaskularyzacji); najwcześniej 24 godziny po przyjęciu do szpitala i w momencie, gdy normalnie przerwa się pozajelitowe leczenie przeciwzakrzepowe.
CAD/PAD
Pacjenci przyjmujący produkt Xanirva 2,5 mg dwa razy na dobę powinni również przyjmować dawkę dobową 75 do 100 mg ASA.
U pacjentów po udanym zabiegu rewaskularyzacji kończyny dolnej (chirurgicznym lub śródnaczyniowym, w tym zabiegi hybrydowe) z powodu objawowej PAD nie należy rozpoczynać leczenia do momentu osiągnięcia hemostazy (patrz punkt 5.1).
Czas trwania leczenia należy określić indywidualnie dla każdego pacjenta w oparciu o regularne dokonywanie oceny oraz biorąc pod uwagę ryzyko zdarzeń zakrzepowych w porównaniu z ryzykiem krwawienia.
OZW, CAD/PAD
Jednoczesne podawanie z terapią przeciwpłytkową
U pacjentów z ostrym zdarzeniem zakrzepowym lub poddawanych procedurze naczyniowej, u których istnieje potrzeba stosowania podwójnej terapii przeciwpłytkowej, należy przeanalizować, czy należy kontynuować stosowanie produktu Xanirva 2,5 mg dwa razy na dobę, w zależności od rodzaju zdarzenia lub procedury oraz schematu leczenia przeciwpłytkowego.
Bezpieczeństwo stosowania i skuteczność rywaroksabanu 2,5 mg dwa razy na dobę w skojarzeniu z podwójną terapią przeciwpłytkową badano u pacjentów:
po niedawno przebytym OZW w skojarzeniu z ASA plus klopidogrelem/tyklopidyną (patrz punkt 4.1) oraz
po niedawno przebytym zabiegu rewaskularyzacji kończyny dolnej z powodu objawowej PAD w skojarzeniu z ASA i, w razie potrzeby, krótkotrwałym stosowaniem klopidogrelu (patrz punkty 4.4 i 5.1).
Pominięcie dawki
W przypadku pominięcia dawki pacjent powinien kontynuować przyjmowanie zwykłej dawki zgodnie z zaleceniem w następnym zaplanowanym terminie. Nie należy stosować dawki podwójnej w celu uzupełnienia pominiętej dawki.
Zmiana leczenia z antagonistów witaminy K (ang.Vitamin K Antagonists, VKA) na produkt Xanirva W przypadku przejścia pacjentów z VKA na produkt Xanirva wartości Międzynarodowego Współczynnika Znormalizowanego (ang. International Normalized Ratio, INR ) mogą być nieprawdziwie podwyższone po przyjęciu produktu Xanirva. INR nie jest właściwy do pomiaru działania przeciwzakrzepowego produktu Xanirva i z tego powodu nie należy go stosować (patrz punkt 4.5).
Zmiana leczenia z produktu Xanirva na antagonistów witaminy K (VKA)
Istnieje możliwość niewłaściwej antykoagulacji w czasie zmiany leczenia produktem Xanirva na VKA. W czasie jakiejkolwiek zmiany na alternatywny lek przeciwzakrzepowy należy zapewnić ciągłą właściwą antykoagulację. Należy zauważyć, że produkt Xanirva może się przyczynić do
podwyższonego INR.
Pacjentom zmieniającym leczenie produktem Xanirva na VKA należy równocześnie podawać VKA, aż INR będzie ≥ 2,0. Przez pierwsze dwa dni okresu zmiany należy stosować standardowe dawkowanie początkowe VKA, a następnie dawkowanie VKA według testów INR.
Jeśli pacjenci są leczeni zarówno produktem Xanirva, jak i VKA, nie należy badać INR wcześniej niż 24 godziny po poprzedniej dawce, ale przed następną dawką produktu Xanirva. Po przerwaniu stosowania produktu Xanirva wiarygodne badania INR można wykonać co najmniej 24 godziny po ostatniej dawce (patrz punkty 4.5 i 5.2).
Zmiana leczenia z pozajelitowych leków przeciwzakrzepowych na produkt Xanirva
U pacjentów aktualnie otrzymujących pozajelitowy lek przeciwzakrzepowy należy przerwać jego przyjmowanie i rozpocząć stosowanie produktu Xanirva od 0 do 2 godzin przed czasem następnego zaplanowanego podania pozajelitowego produktu leczniczego (np. heparyny drobnocząsteczkowej) lub w momencie przerwania ciągle podawanego pozajelitowego produktu leczniczego (np. dożylnej heparyny niefrakcjonowanej).
Zmiana leczenia z produktu Xanirva na pozajelitowe leki przeciwzakrzepowe
Pierwszą dawkę pozajelitowego leku przeciwzakrzepowego należy podać w czasie, gdy powinna być przyjęta następna dawka produktu Xanirva.
Szczególne grupy pacjentów
Zaburzenia czynności nerek
Ograniczone dane kliniczne wskazują, że u pacjentów z ciężkim zaburzeniem czynności nerek (klirens kreatyniny 15-29 ml/min) znacznie zwiększa się stężenie rywaroksabanu w osoczu krwi. Zatem należy zachować ostrożność stosując Xanirva w tej grupie pacjentów. Nie zaleca się stosowania produktu Xanirva u pacjentów z klirensem kreatyniny <15 ml/min (patrz punkty 4.4 i 5.2).
U pacjentów z łagodnym (klirens kreatyniny 50 - 80 ml/min) lub umiarkowanym (klirens kreatyniny 30 - 49 ml/min) zaburzeniem czynności nerek nie ma potrzeby zmiany dawki (patrz punkt 5.2).
Zaburzenia czynności wątroby
Stosowanie produktu Xanirva jest przeciwwskazane u pacjentów z chorobą wątroby, która wiąże się z koagulopatią i ryzykiem krwawienia o znaczeniu klinicznym, w tym u pacjentów z marskością wątroby stopnia B i C wg klasyfikacji Child Pugh (patrz punkty 4.3 i 5.2).
Pacjenci w podeszłym wieku
Nie ma potrzeby zmiany dawkowania (patrz punkty 4.4 oraz 5.2). Ryzyko krwawienia zwiększa się wraz z wiekiem (patrz punkt 4.4).
Masa ciała
Nie ma potrzeby zmiany dawkowania (patrz punkty 4.4 oraz 5.2)
Płeć
Nie ma potrzeby zmiany dawkowania (patrz punkt 5.2)
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania i skuteczności kapsułek rywaroksabanu 2,5 mg u dzieci w wieku od 0 do 18 lat. Nie są dostępne dane, dlatego produkt Xanirva, kapsułki 2,5 mg nie jest zalecany do stosowania u dzieci w wieku poniżej 18 lat.
Sposób podawania
Produkt Xanirva przyjmuje się doustne.
Kapsułki można przyjmować z jedzeniem lub bez jedzenia (patrz punkty 4.5 i 5.2).
Wysypywanie zawartości kapsułki
Dla pacjentów, którzy nie mogą połykać całych kapsułek, zawartość kapsułki Xanirva można wymieszać z wodą lub przecierem jabłkowym, bezpośrednio przed zastosowaniem i podać doustnie. Zawartość kapsułki Xanirva można również wysypać i podawać przez zgłębnik żołądkowy. (patrz punkt 5.2 i 6.6).
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
wrodzone lub nabyte zaburzenia krzepnięcia;
niekontrolowalne ciężkie nadciśnienie tętnicze;
inne schorzeniami przewodu pokarmowego bez czynnego owrzodzenia, które mogą być przyczyną krwawienia (np. choroba zapalna jelit, zapalenie przełyku, zapalenie błony śluzowej żołądka i choroba refluksowa przełyku);
retinopatia naczyniowa;
rozstrzenie oskrzelowe lub krwawienie płucne w wywiadzie.
Produkt należy stosować z zachowaniem ostrożności u pacjentów z OZW oraz CAD/PAD:
w wieku ≥75 lat, jeśli podawany jest jednocześnie z samym ASA lub z ASA oraz klopidogrelem lub tyklopidyną. Należy indywidualnie, regularnie oceniać stosunek korzyści do ryzyka leczenia;
o mniejszej masie ciała (<60 kg), jeśli podawany jest jednocześnie z samym ASA lub z ASA oraz klopidogrelem lub tyklopidyną;
z CAD z objawami ciężkiej niewydolności serca. Dane z badań wskazują, że tacy pacjenci mogą odnosić mniejsze korzyści z leczenia rywaroksabanem (patrz punkt 5.1).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
zastosowano z góry zdefiniowane selektywne podejście do zbierania zdarzeń niepożądanych w wybranych badaniach fazy III. Częstość występowania działań niepożądanych nie zwiększyła się i nie zidentyfikowano nowych działań niepożądanych po przeprowadzeniu analizy tych badań.
Opis wybranych działań niepożądanych
Ze względu na farmakologiczny mechanizm działania, stosowanie Xanirva może wiązać się ze zwiększonym ryzykiem utajonego lub jawnego krwawienia z dowolnej tkanki lub organu, które może prowadzić do niedokrwistości pokrwotocznej. Jej objawy podmiotowe, przedmiotowe oraz nasilenie (w tym możliwość zgonu) będą różnić się w zależności od miejsca oraz nasilenia lub rozległości krwawienia i (lub) niedokrwistości (patrz punkt 4.9 Postępowanie w przypadku krwawienia).
W badaniach klinicznych w trakcie długotrwałego leczenia rywaroksabanem w porównaniu z leczeniem VKA częściej obserwowano krwawienia z błon śluzowych (np. krwawienie z nosa, dziąseł, przewodu pokarmowego, moczowo-płciowego, w tym nieprawidłowe krwawienie z pochwy lub
nadmierne krwawienie miesiączkowe) i niedokrwistość. Tak więc, oprócz odpowiedniego nadzoru klinicznego, badania laboratoryjne hemoglobiny/hematokrytu może być przydatne do wykrywania utajonego krwawienia i określania ilościowego znaczenia klinicznego jawnego krwawienia, jeśli uzna się to za stosowne. Dla niektórych grup pacjentów ryzyko krwawienia może być większe, np. u pacjentów z niekontrolowalnym ciężkim nadciśnieniem tętniczym krwi i (lub) u pacjentów, którzy jednocześnie stosują inne produkty wpływające na hemostazę (patrz punkt 4.4
„Ryzyko krwotoku”). Krwawienie menstruacyjne może mieć większe nasilenie i (lub) być dłuższe. Objawami powikłań krwotocznych mogą być: osłabienie, bladość, zawroty głowy, ból głowy lub obrzęk niewiadomego pochodzenia, duszność i wstrząs niewiadomego pochodzenia. W niektórych przypadkach, jako następstwo niedokrwistości obserwowano objawy niedokrwienia mięśnia sercowego, takie jak ból w klatce piersiowej lub dławica piersiowa.
Dla produktu Xanirva zgłaszano znane wtórne powikłania ciężkiego krwawienia, takie jak zespół ciasnoty przedziałów powięziowych i niewydolność nerek z powodu obniżonej perfuzji. Oceniając stan każdego pacjenta, u którego stosowano leki przeciwzakrzepowe, należy uwzględnić możliwość wystąpienia krwotoku
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa,
tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego w Polsce.
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
zmodyfikowana analiza wyników w grupach wyodrębnionych zgodnie z zaplanowanym leczeniem (analiza wyników w grupach wyodrębnionych zgodnie z zaplanowanym leczeniem dla zakrzepicy w stencie)
w porównaniu z placebo; wartość p w teście Log-Rank
statystycznie lepszy
** nominalnie istotne
Tabela 5: Wyniki skuteczności badania fazy III ATLAS ACS 2 TIMI 51 u pacjentów po PCI
Populacja badana
Pacjenci z przebytym niedawno ostrym zespołem wieńcowym po PCI a)
Dawka terapeutyczna
Rywaroksaban 2,5 mg, dwa razy na dobę, N=3114 n(%)
Współczynnik ryzyka (95%
CI) wartość p b)
Placebo N=3096 n(%)
Zgon z przyczyn sercowo-
153 (4,9%)
165 (5,3%)
naczyniowych, zawał mięśnia
0,94 (0,75, 1,17)
sercowego lub udar mózgu
p = 0,572
Zgon z przyczyn sercowo-
24 (0,8%)
45 (1,5%)
naczyniowych
0,54 (0,33, 0,89) p = 0,013**
Zgon z wszystkich przyczyn
31 (1,0%)
0,64 (0,41, 1,01) p = 0,053
49 (1,6%)
Zawał mięśnia sercowego
115 (3,7%)
1,03 (0,79, 1,33) p = 0,829
113 (3,6%)
Udar mózgu
27 (0,9%)
1,30 (0,74, 2,31) p = 0,360
21 (0,7%)
Zakrzepica w stencie
47 (1,5%)
0,66 (0,46, 0,95) p = 0,026**
71 (2,3%)
zmodyfikowana analiza wyników w grupach wyodrębnionych zgodnie z zaplanowany leczeniem (analiza wyników w grupach wyodrębnionych zgodnie z zaplanowanym leczeniem dla zakrzepicy w stencie)
w porównaniu z placebo; wartość p w teście Log-Rank
** Nominalnie istotne
Tabela 6: Wyniki bezpieczeństwa badania fazy III ATLAS ACS 2 TIMI 51
Populacja badana
Pacjenci z przebytym niedawno ostrym zespołem wieńcowyma)
Dawka terapeutyczna
Rywaroksaban 2,5 mg, dwa razy na dobę,
N = 5115, n (%)
Współczynnik ryzyka (95% CI) wartość p b)
Placebo
N = 5125 n (%)
Poważne krwawienie TIMI
niezwiązane z zabiegiem
pomostowania aortalno- wieńcowego
65 (1,3%)
3,46 (2,08, 5,77) p = <0,001*
19 (0,4%)
Śmiertelne krwawienie
6 (0,1%)
0,67 (0,24, 1,89) p = 0,450
9 (0,2%)
Objawowy krwotok śródczaszkowy
14 (0,3%)
2,83 (1,02, 7,86) p = 0,037
5 (0,1%)
Niedociśnienie wymagające leczenia dożylnymi lekami inotropowymi
3 (0,1%)
3 (0,1%)
Zabieg chirurgiczny z powodu trwającego krwawienia
7 (0,1%)
9 (0,2%)
Transfuzja 4 lub więcej jednostek krwi przez okres 48
godzin
19 (0,4%)
6 (0,1%)
populacja badana pod względem bezpieczeństwa stosowania, poddawana leczeniu
w porównaniu z placebo; wartość p w teście Log-Rank
statystycznie istotny
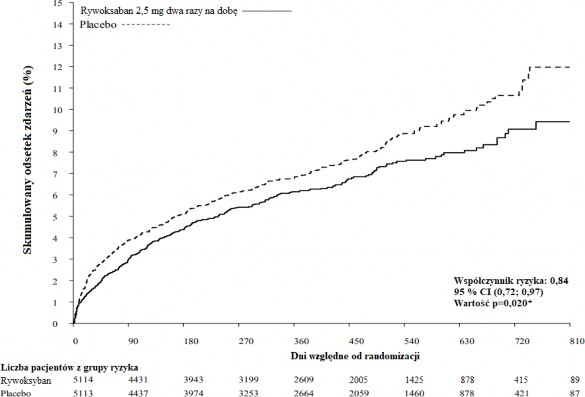
Wykres 1: Czas do wystąpienia pierwszorzędowego punktu końcowego skuteczności (zgonu
z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego lub udaru mózgu)
CAD/PAD
W badaniu fazy III COMPASS (27 395 pacjentów, 78,0% mężczyzn, 22,0% kobiet) wykazano skuteczność i bezpieczeństwo stosowania rywaksobanu w profilaktyce punktu końcowego złożonego ze zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego i udaru mózgu u pacjentów z CAD lub objawową PAD obciążonych dużym ryzykiem zdarzeń niedokrwiennych. Pacjenci byli objęci kontrolą przez okres czasu, którego mediana wynosiła 23 miesiące, i maksymalnie przez 3,9 lat.
Pacjentów, u których nie istniała stała potrzeba leczenia inhibitorami pompy protonowej, zrandomizowano do otrzymywania pantoprazolu lub placebo. Następnie wszystkich pacjentów zrandomizowano w stosunku 1:1:1 do otrzymywania rywaroksabanu 2,5 mg dwa razy na dobę/ASA 100 mg raz na dobę, do rywaksobanu 5 mg dwa razy na dobę lub samego ASA 100 mg raz na dobę oraz odpowiadających im placebo.
Pacjenci z CAD mieli wielonaczyniową CAD i (lub) zawał mięśnia sercowego w wywiadzie.
W przypadku pacjentów w wieku < 65 lat wymagano obecności miażdżycy z zajęciem co najmniej dwóch łożysk naczyniowych lub występowania co najmniej dwóch dodatkowych czynników ryzyka sercowo-naczyniowego.
Pacjenci z PAD przebyli uprzednio interwencje, takie jak pomostowanie aortalno-wieńcowe, przezskórną śródnaczyniową angioplastykę lub amputację kończyny albo stopy w wyniku choroby naczyń tętniczych, lub występowało u nich chromanie przestankowe ze wskaźnikiem kostka-ramię wynoszącym < 0,90 i (lub) istotne zwężenie tętnicy obwodowej albo przebyli uprzednio rewaskularyzację tętnicy szyjnej, lub występowało u nich bezobjawowe zwężenie tętnicy szyjnej
o ≥ 50%.
Kryteria wykluczenia obejmowały potrzebę stosowania podwójnej terapii przeciwpłytkowej lub terapii przeciwpłytkowej innej niż ASA, lub stosowanie doustnego leczenia przeciwkrzepliwego oraz pacjentów z dużym ryzykiem krwawienia lub niewydolnością serca z frakcją wyrzutową < 30% lub
klasą czynnościową III lub IV wg Nowojorskiego Towarzystwa Kardiologicznego (NYHA) lub jakimkolwiek udarem niedokrwiennym niezatokowym w ciągu ostatniego miesiąca, lub z udarem krwotocznym albo zatokowym w wywiadzie.
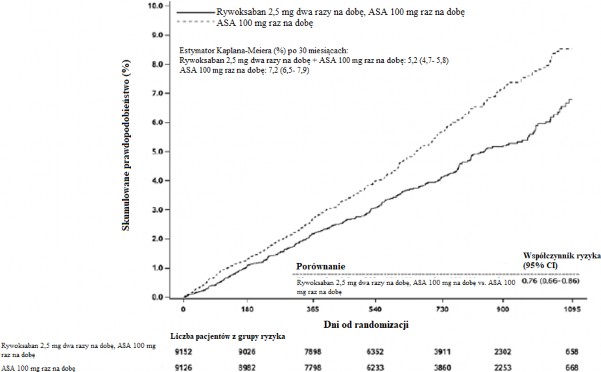
Rywaroksaban 2,5 mg dwa razy na dobę w skojarzeniu z ASA 100 mg raz na dobę był lepszy od ASA 100 mg w zmniejszaniu pierwszorzędowego punktu końcowego złożonego ze zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego i udaru mózgu (patrz Tabela 7 i Wykres 2).
Występowało istotne zwiększenie w zakresie pierwszorzędowego kryterium bezpieczeństwa (poważne krwawienia wg zmodyfikowanych wytycznych ISTH) u pacjentów leczonych rywaroksabanem 2,5 mg dwa razy na dobę w skojarzeniu z ASA 100 mg raz na dobę w porównaniu z pacjentami, którzy otrzymywali ASA 100 mg (patrz Tabela 8).
W zakresie pierwszorzędowego punktu końcowego skuteczności obserwowana korzyść ze stosowania rywaroksabanu 2,5 mg dwa razy na dobę plus ASA 100 mg raz na dobę w porównaniu z ASA 100 mg raz na dobę wynosiła HR 0,89 (95% CI 0,7-1,1) u pacjentów w wieku ≥75 lat (zakres: 6.3% w porównaniu do 7.0%) oraz HR=0,70 (95% CI 0,6-0,8) u pacjentów w wieku <75 lat (3.6% w porównaniu do 5.0%). Dla poważnego krwawienia wg zmodyfikowanych wytycznych ISTH obserwowane zwiększenie ryzyka wynosiło HR 2,12 (95% CI 1,5-3,0) u pacjentów w wieku ≥75 lat (5.2% w porównaniu do 2.5%) i HR=1,53 (95% CI 1,2-1,9) u pacjentów w wieku <75 lat (2.6% w
porównaniu do 1.7%).
Stosowanie pantoprazolu w dawce 40 mg raz na dobę w skojarzeniu z lekami przeciwzakrzepowymi u pacjentów bez klinicznej potrzeby stosowania inhibitora pompy protonowej, nie przyniosło żadnych korzyści w zapobieganiu zdarzeniom w górnym odcinku przewodu pokarmowego (tj. zdarzeniom złożonym z krwawienia z górnego odcinka przewodu pokarmowego, owrzodzenia górnego odcinka przewodu pokarmowego i niedrożności lub perforacji górnego odcinka przewodu pokarmowego); częstość występowania zdarzeń w górnym odcinku przewodu pokarmowego wynosiła 0,39/100 pacjentolat w grupie pantoprazolu 40 mg raz na dobę i 0,40/100 pacjentolat w grupie placebo raz na dobę.
Tabela 7: Wyniki dotyczące skuteczności z badania fazy III COMPASS
Populacja badana
Pacjenci z CAD/PAD a)
Dawka
terapeutyczna
Rywaroksaban 2,5 mg dwa razy na dobę
w skojarzeniu z ASA 100 mg raz na dobę N=9152
ASA 100 mg
raz na dobę
N=9126
Pacjenci, u których wystąpiły
zdarzenia
KM %
Pacjenci, u których wystąpiły
zdarzenia
KM %
HR (95% CI)
Wartość p b)
Udar mózgu, zawał
mięśnia sercowego
lub zgon z
379 (4,1%)
5,20%
496 (5,4%)
7,17%
0,76
p = 0,00004*
przyczyn sercowo-
(0,66;0,86)
naczyniowych
- Udaru mózgu
83 (0,9%)
1,17%
142 (1,6%)
2,23%
0,58
(0,44;0,76)
p = 0,00006
Populacja badana
Pacjenci z CAD/PAD a)
Dawka
terapeutyczna
Rywaroksaban 2,5 mg dwa razy na dobę
w skojarzeniu z ASA 100 mg raz na dobę N=9152
ASA 100 mg
raz na dobę
N=9126
Pacjenci, u których wystąpiły
zdarzenia
KM %
Pacjenci, u których wystąpiły
zdarzenia
KM %
HR (95% CI)
Wartość p b)
- Zawał mięśnia sercowego
178 (1,9%)
2,46%
205 (2,2%)
2,94%
0,86
(0,70;1,05)
p = 0,14458
- Zgon z
przyczyn
0,78
sercowo-
160 (1,7%)
2,19%
203 (2,2%)
2,88%
(0,64;0,96)
p = 0,02053
naczyniowych
Śmiertelność ze wszystkich
przyczyn
313 (3,4%)
4,50%
378 (4,1%)
5,57%
0,82
(0,71;0,96)
Ostre
22 (0, 2%)
0,27%
40 (0,4%)
0,60%
0,55
niedokrwienie kończyny dolnej
(0,32;0,92)
grupy wyodrębnione zgodnie z zaplanowanym leczeniem, analizy główne
w porównaniu z ASA 100 mg; wartość p w teście Log-Rank
Zmniejszenie w pierwszorzędowym punkcie końcowym skuteczności było statystycznie lepsze.
CI: przedział ufności; KM %: estymator Kaplana-Meiera łącznego ryzyka częstości występowania obliczanego po 900 dniach.
Tabela 8: Wyniki bezpieczeństwa stosowania z badania fazy III COMPASS
Populacja badana
Pacjenci z CAD/PAD a)
Dawka terapeutyczna
Rywaroksaban 2,5 mg dwa razy na dobę w skojarzeniu z
100 mg raz na dobę,
N=9152
n (łączne ryzyko %)
ASA 100 mg raz
na dobę
N=9126
n (łączne ryzyko %)
Współczynnik ryzyka (95 % CI)
wartość p b)
Poważne krwawienia wg zmodyfikowanych
wytycznych ISTH
288 (3,9%)
170 (2,5%)
1,70 (1,40;2,05)
p < 0,00001
- Śmiertelne krwawienie
15 (0,2%)
10 (0,2%)
1,49 (0,67;3,33)
p = 0,32164
- Krwawienie objawowe w ważnym narządzie
(nieprowadzące do zgonu)
63 (0,9%)
49 (0,7%)
1,28 (0,88;1,86)
p = 0,19679
- Krwawienie w polu operacyjnym wymagające ponownego zabiegu chirurgicznego (nieprowadzące do zgonu,
nie w ważnym narządzie)
10 (0,1%)
8 (0,1%)
1,24 (0,49;3,14)
p = 0,65119
- Krwawienie prowadzące do hospitalizacji (nieprowadzące do zgonu, nie w ważnym narządzie, niewymagające ponownego zabiegu
chirurgicznego)
208 (2,9%)
109 (1,6%)
1,91 (1,51;2,41)
p < 0,00001
- Z pozostaniem na noc
172 (2,3%)
90 (1,3%)
1,91 (1,48;2,46)
p < 0,00001
- Bez pozostania na noc
36 (0,5%)
21 (0,3%)
1,70 (0,99;2,92)
p = 0,04983
Poważne krwawienie
z przewodu pokarmowego
140 (2,0%)
65 (1,1%)
2,15 (1,60;2,89)
p < 0,00001
Poważne krwawienie śródczaszkowe
28 (0,4%)
24 (0,3%)
1,16 (0,67;2,00)
p = 0,59858
grupy wyodrębnione zgodnie z zaplanowanym leczeniem, analizy główne
w porównaniu z ASA 100 mg; wartość p w teście Log-Rank
CI: przedział ufności; Łączne ryzyko: łączne ryzyko częstości występowania (estymator Kaplana- Meiera) po 30 miesiącach; ISTH: Międzynarodowe Towarzystwo Zakrzepicy i Hemostazy.
Wykres 2: Czas do wystąpienia pierwszorzędowego punktu końcowego skuteczności (udaru mózgu, zawału mięśnia sercowego, zgonu z przyczyn sercowo-naczyniowych) w badaniu COMPASS
CI – przedział ufności.
Pacjenci po niedawno przebytym zabiegu rewaskularyzacji kończyny dolnej z powodu objawowej PAD
W kluczowym, przeprowadzanym metodą podwójnie ślepej próby badaniu fazy III VOYAGER PAD 6 564 pacjentów po niedawno przebytym udanym zabiegu rewaskularyzacji kończyny dolnej (chirurgicznym lub śródnaczyniowym, w tym zabiegi hybrydowe) z powodu objawowej PAD zostało losowo przydzielonych w stosunku 1:1 do jednej z dwóch grup otrzymujących leczenie przeciwzakrzepowe: rywaroksaban 2,5 mg dwa razy na dobę w skojarzeniu z ASA 100 mg raz na dobę lub ASA 100 mg raz na dobę. Pacjentom wolno było dodatkowo otrzymywać standardową dawkę klopidogrelu raz na dobę przez okres do 6 miesięcy. Celem badania było wykazanie skuteczności i bezpieczeństwa stosowania rywaroksabanu plus ASA w zapobieganiu zawałowi mięśnia sercowego, udarowi niedokrwiennemu, zgonowi z przyczyn sercowo-naczyniowych, ostremu niedokrwieniu kończyn lub dużej amputacji z przyczyn naczyniowych u pacjentów po niedawno przebytym udanym zabiegu rewaskularyzacji kończyn dolnych z powodu objawowej PAD. Włączono pacjentów w wieku ≥50 lat z udokumentowaną umiarkowaną do ciężkiej objawową miażdżycową PAD kończyny dolnej, za pomocą wszystkich następujących kryteriów: klinicznych (tj. ograniczenia czynnościowe), anatomicznych (tj. wynik badania obrazowego potwierdzający PAD dystalnie od tętnicy biodrowej zewnętrznej) i hemodynamicznych (wskaźnik kostka-ramię [ang. ankle-brachial- index, ABI] ≤0,80 lub wskaźnik paluch-ramię [ang. toe-brachial-index, TBI] ≤0,60 w przypadku pacjentów z ujemnym wywiadem w kierunku wcześniejszej rewaskularyzacji kończyn lub ABI ≤0,85 lub TBI ≤0,65 w przypadku pacjentów z dodatnim wywiadem w kierunku wcześniejszej rewaskularyzacji kończyn). Pacjenci, u których konieczne było stosowanie podwójnej terapii przeciwpłytkowej przez >6 miesięcy lub jakiejkolwiek dodatkowej terapii przeciwpłytkowej innej
niż ASA i klopidogrel, lub doustnej terapii przeciwzakrzepowej, oraz pacjenci z krwotokiem śródczaszkowym, udarem mózgu lub przemijającym napadem niedokrwiennym w wywiadzie, lub pacjenci z eGFR <15 ml/min zostali wykluczeni.
Średnia czasu trwania obserwacji wynosiła 24 miesiące, a maksymalny czas trwania obserwacji wynosił 4,1 roku. Średnia wieku pacjentów włączonych do badania wynosiła 67 lat, a 17% populacji pacjentów była w wieku >75 lat. Mediana czasu od wskaźnikowego zabiegu rewaskularyzacji do rozpoczęcia leczenia wynosiła 5 dni w populacji ogólnej (6 dni po rewaskularyzacji chirurgicznej i 4 dni po rewaskularyzacji śródnaczyniowej, w tym zabiegach hybrydowych). Ogółem 53,0% pacjentów otrzymało krótkotrwałą terapię podstawową klopidogrelem, przy czym mediana czasu trwania wynosiła 31 dni. Zgodnie z protokołem badania leczenie można było rozpocząć możliwie jak najszybciej, ale nie później niż 10 dni od udanego zabiegu rewaskularyzacji i po osiągnięciu hemostazy.
Rywaroksaban 2,5 mg dwa razy na dobę w skojarzeniu z ASA 100 mg raz na dobę wykazywał nadrzędność w zmniejszaniu pierwszorzędowego punktu końcowego złożonego z zawału mięśnia sercowego, udaru niedokrwiennego, zgonu z przyczyn sercowo-naczyniowych, ostrego niedokrwienia kończyn i dużej amputacji z przyczyn naczyniowych w porównaniu z samym ASA (patrz tabela 9).
Częstość występowania pierwszorzędowego punktu końcowego dotyczącego bezpieczeństwa stosowania obejmującego zdarzenia dużego krwawienia TIMI zwiększyła się u pacjentów leczonych rywaroksabanem i ASA, przy czym nie obserwowano wzrostu krwawień prowadzących do zgonu lub krwotoków wewnątrzczaszkowych (patrz tabela 10).
Drugorzędowe punkty końcowe dotyczące skuteczności badano w z góry zdefiniowanej kolejności hierarchicznej (patrz tabela 9).
Tabela 9: Wyniki dotyczące skuteczności z badania fazy III VOYAGER PAD
Populacja badana
Pacjenci po niedawno przebytym zabiegu rewaskularyzacji kończyny dolnej z powodu
objawowej PAD a
)
Dawka
terapeutyczna
Rywaroksaban 2,5 mg dwa razy na dobę w skojarzeniu z ASA 100 mg raz na dobę
N=3286
ASA 100 mg raz na dobę
N=3278
n (łączne ryzyko %)c)
Współczynnik ryzyka
(95% CI) d
)
n (łączne ryzyko %)c)
Pierwszorzędowy punkt końcowy dotyczący
skutecznościb)
508 (15,5%)
584 (17,8%)
0,85 (0,76;0,96) p=0,0043 e)*
- Zawał mięśnia sercowego
131 (4,0%)
148 (4,5%)
0,88 (0,70;1,12)
- Udar niedokrwienny
71 (2,2%)
82 (2,5%)
0,87 (0,63;1,19)
- Zgon z przyczyn sercowo-
naczyniowych
199 (6,1%)
174 (5,3%)
1,14 (0,93;1,40)
- Ostre niedokrwienie kończyn f)
155 (4,7%)
227 (6,9%)
0,67 (0,55;0,82)
- Duża amputacja z
przyczyn naczyniowych
103 (3,1%)
115 (3,5%)
0,89 (0,68;1,16)
Drugorzędowy punkt końcowy dotyczący skuteczności
Nieplanowany zabieg rewaskularyzacji kończyny indeksowanej z powodu nawracającego
niedokrwienia kończyn
584 (17,8%)
655 (20,0%)
0,88 (0,79;0,99) p=0,0140 e)*
Hospitalizacja z powodu choroby tętnic wieńcowych lub obwodowych (dowolna kończyna dolna) o charakterze
zakrzepowym
262 (8,0%)
356 (10,9%)
0,72 (0,62;0,85) p<0,0001 e)*
Śmiertelność z wszystkich przyczyn
321 (9,8%)
297 (9,1%)
1,08 (0,92;1,27)
Zdarzenia ŻChZZ
25 (0,8%)
41 (1,3%)
0,61 (0,37;1,00)
a) grupy wyodrębnione zgodnie z zaplanowanym leczeniem, analizy główne; oceniane przez niezależną komisję rozstrzygającą
b) punkt końcowy złożony z zawału mięśnia sercowego, udaru niedokrwiennego, zgonu z przyczyn sercowo-naczyniowych (zgon z przyczyn sercowo-naczyniowych i nieznana przyczyna zgonu), ostrego niedokrwienia kończyny i dużej amputacji z przyczyn naczyniowych
c) uwzględniane jest tylko pierwsze wystąpienie zdarzenia objętego złożonym punktem końcowym podlegającego analizie w zakresie danych pochodzących od uczestnika
d) Współczynnik ryzyka (95% CI) określano na podstawie modelu proporcjonalnego hazardu Coxa stratyfikowanego według rodzaju zabiegu i stosowania klopidogrelu, z leczeniem jako jedyną współzmienną.
e) Jednostronną wartość p oceniano w logarytmicznym teście rang ze stratyfikacją na podstawie rodzaju zabiegu i stosowania klopidogrelu z leczeniem jako czynnikiem.
f) ostre niedokrwienie kończyny jest definiowane jako nagłe istotne zmniejszenie perfuzji krwi w kończynie, z nowym deficytem tętna lub wymagające interwencji leczniczej (np. leczenie trombolityczne lub trombektomia, lub pilna rewaskularyzacja) i prowadzące do hospitalizacji
Zmniejszenie w punkcie końcowym skuteczności było statystycznie lepsze. CI: przedział ufności
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Xanirva, 2,5 mg, kapsułki, twarde
Każda kapsułka twarda zawiera 2,5 mg rywaroksabanu. Substancje pomocnicze o znanym działaniu:
każda kapsułka twarda zawiera 28,5 mg laktozy jednowodnej i żółcień pomarańczową S (E 110).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Kapsułka, twarda
Żółta, nieprzezroczysta, twarda kapsułka wypełniona białym lub prawie białym proszkiem, rozmiar „5” (o długości 11,1 ± 0,4 mm), z czarnym nadrukiem „2.5” na wieczku.
Produkt Xanirva, podawany w skojarzeniu z samym kwasem acetylosalicylowym (ASA) lub z ASA oraz klopidogrelem lub tyklopidyną, jest wskazany do profilaktyki zdarzeń zakrzepowych na podłożu miażdżycowym u dorosłych pacjentów po ostrym zespole wieńcowym (OZW) z podwyższonymi biomarkerami sercowymi (patrz punkty 4.3, 4.4 oraz 5.1).
Produkt Xanirva, podawany w skojarzeniu z kwasem acetylosalicylowym (ASA), jest wskazany do profilaktyki zdarzeń zakrzepowych o podłożu miażdżycowym u dorosłych pacjentów, u których występuje choroba wieńcowa (ang. coronary artery disease, CAD) lub objawowa choroba tętnic obwodowych (ang. peripheral artery disease, PAD) obciążonych wysokim ryzykiem zdarzeń niedokrwiennych.
Dawkowanie
Zalecana dawka to 2,5 mg dwa razy na dobę.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Czynne krwawienie o znaczeniu klinicznym.
Nieprawidłowości i stany stanowiące znaczące ryzyko wystąpienia poważnych krwawień. Obejmują one czynne lub ostatnio przebyte owrzodzenia w obrębie przewodu pokarmowego, nowotwór złośliwy z wysokim ryzykiem krwawienia, świeżo przebyty uraz mózgu lub kręgosłupa, przebyty ostatnio zabieg chirurgiczny mózgu, kręgosłupa lub okulistyczny, świeżo przebyty krwotok wewnątrzczaszkowy, stwierdzona lub podejrzewana obecność żylaków przełyku, żylno-tętnicze wady rozwojowe, tętniak naczyniowy lub poważne nieprawidłowości w obrębie naczyń wewnątrzrdzeniowych lub śródmózgowych.
Jednoczesne leczenie innymi produktami przeciwzakrzepowymi np. heparyną niefrakcjonowaną, heparynami drobnocząsteczkowymi (enoksaparyna, dalteparyna itp.), pochodnymi heparyny (fondaparynuks itp.), doustnymi lekami przeciwzakrzepowymi (warfaryna, eteksylan dabigatranu, apiksaban, itp.) z wyjątkiem szczególnego przypadku zmiany leczenia przeciwzakrzepowego (patrz punkt 4.2) lub jeżeli heparyna niefrakcjonowana podawana jest w dawkach koniecznych do utrzymania drożności cewnika żył głównych lub tętnic (patrz punkt 4.5).
Jednoczesne leczenie OZW terapią przeciwpłytkową u pacjentów z wcześniejszym udarem lub przemijającym napadem niedokrwiennym (TIA) (patrz punkt 4.4).
Jednoczesne leczenie CAD/PAD za pomocą ASA u pacjentów po przebytym udarze krwotocznym lub zatokowym, lub jakimkolwiek udarze w ciągu ostatniego miesiąca (patrz punkt 4.4).
Choroba wątroby, która wiąże się z koagulopatią i ryzykiem krwawienia o znaczeniu klinicznym, w tym pacjenci z marskością wątroby stopnia B i C wg klasyfikacji Child Pugh (patrz punkt 5.2).
Ciąża i karmienie piersią (patrz punkt 4.6).
U pacjentów z OZW skuteczność i bezpieczeństwo stosowania rywaroksabanu 2,5 mg dwa razy na dobę zostały zbadane w skojarzeniu ze środkami przeciwpłytkowymi, tj. sam ASA lub ASA plus klopidogrel/tyklopidyna.
U pacjentów obciążonych dużym ryzykiem zdarzeń niedokrwiennych z CAD/PAD skuteczność i bezpieczeństwo stosowania rywaroksabanu 2,5 mg dwa razy na dobę badano w skojarzeniu z ASA.
U pacjentów po niedawno przebytym zabiegu rewaskularyzacji kończyny dolnej z powodu objawowej PAD skuteczność i bezpieczeństwo stosowania rywaroksabanu 2,5 mg dwa razy na dobę badano w skojarzeniu z samą substancją przeciwpłytkową ASA lub z ASA plus krótkotrwałym stosowaniem klopidogrelu. Jeśli konieczne jest stosowanie podwójnej terapii przeciwpłytkowej z klopidogrelem, powinno być ono krótkotrwałe; należy unikać stosowania długotrwałego stosowania podwójnej terapii przeciwpłytkowej (patrz punkt 5.1).
Jednoczesne leczenie z innymi środkami przeciwpłytkowymi takimi jak prasugrel lub tikagrelor nie było badane i nie jest zalecane.
W czasie leczenia zalecany jest nadzór kliniczny zgodnie z praktyką leczenia przeciwzakrzepowego. Ryzyko krwotoku
Podobnie jak w przypadku innych środków przeciwzakrzepowych, pacjentów otrzymujących produkt
Xanirva należy ściśle monitorować w celu wykrycia objawów krwawienia. W przypadku zwiększonego ryzyka krwotoków zaleca się ostrożność podczas stosowania. Należy przerwać stosowanie produktu Xanirva jeśli wystąpi poważny krwotok (patrz punkt 4.9).
W badaniach klinicznych, krwawienia z błon śluzowych (np. krwawienie z nosa, dziąseł, przewodu pokarmowego, moczowo-płciowego, w tym nieprawidłowe krwawienie z pochwy lub nadmierne krwawienie miesiączkowe) i niedokrwistość obserwowano częściej w trakcie długotrwałego leczenia rywaroksabanem dodanym do pojedynczej lub podwójnej terapii przeciwpłytkowej. Tak więc, oprócz odpowiedniego nadzoru klinicznego, do wykrywania utajonego krwawienia i określania ilościowego znaczenia klinicznego jawnego krwawienia przydatne mogą być badania laboratoryjne hemoglobiny/hematokrytu, jeśli uzna się je za stosowne.
U pacjentów z wymienionych poniżej podgrup istnieje zwiększone ryzyko wystąpienia krwawienia. Z tego powodu, stosowanie produktu Xanirva w skojarzeniu z podwójną terapią przeciwpłytkową u pacjentów ze stwierdzonym zwiększonym ryzykiem wystąpienia krwawienia powinno być zrównoważone korzyściami w postaci zapobiegania zdarzeniom zakrzepowym na podłożu miażdżycowym. Ponadto po rozpoczęciu leczenia należy uważnie obserwować tych pacjentów w celu wykrycia objawów przedmiotowych i podmiotowych powikłań krwawienia i niedokrwistości (patrz punkt 4.8).
W każdym przypadku zmniejszenia stężenia hemoglobiny lub obniżenia ciśnienia tętniczego krwi o niewyjaśnionej przyczynie należy szukać źródła krwawienia.
Pomimo, że leczenie rywaroksabanem nie wymaga rutynowego monitorowania ekspozycji na lek, to stężenie rywaroksabanu mierzone skalibrowanym ilościowym testem anty-Xa może być pomocne
w wyjątkowych sytuacjach, kiedy informacja na temat stężenia rywaroksabanu może ułatwić decyzję kliniczną, np. przedawkowanie i ratujący życie zabieg chirurgiczny (patrz punkty 5.1 i 5.2).
Zaburzenia czynności nerek
U pacjentów z ciężkim zaburzeniem czynności nerek (klirens kreatyniny <30 ml/min) stężenie rywaroksabanu w osoczu krwi może się znacznie zwiększać (średnio 1,6-krotnie), co może prowadzić do zwiększonego ryzyka krwawienia. Należy zachować ostrożność stosując produkt Xanirva u pacjentów z klirensem kreatyniny 15-29 ml/min. Nie zaleca się stosowania produktu Xanirva u pacjentów z klirensem kreatyniny < 15 ml/min (patrz punkty 4.2 i 5.2).
U pacjentów z umiarkowanym zaburzeniem czynności nerek (klirens kreatyniny 30 - 49 ml/min), stosujących jednocześnie inne produkty lecznicze, które zwiększają stężenia stężenie rywaroksabanu w osoczu, produkt Xanirva należy stosować z zachowaniem ostrożności (patrz punkt 4.5).
Interakcje z innymi produktami leczniczymi
Nie zaleca się stosowania produktu Xanirva u pacjentów otrzymujących jednocześnie systemowe leczenie przeciwgrzybiczymi pochodnymi azolowymi (takimi jak ketokonazol, itrakonazol, worykonazol i pozakonazol), lub inhibitorami proteazy HIV (np. rytonawir). Wymienione substancje czynne są silnymi inhibitorami zarówno CYP3A4, jak i glikoproteiny P, i w związku z tym mogą zwiększać stężenie rywaroksabanu w osoczu krwi do wartości o znaczeniu klinicznym (średnio 2,6- krotnie), co może prowadzić do zwiększonego ryzyka krwawienia (patrz punkt 4.5).
Należy zachować ostrożność u pacjentów stosujących jednocześnie produkty lecznicze wpływające na proces hemostazy, takie jak niesteroidowe przeciwzapalne produkty lecznicze (NLPZ), kwas acetylosalicylowy (ASA) i inhibitory agregacji płytek lub selektywne inhibitory zwrotnego wychwytu
serotoniny (SSRI) i inhibitory zwrotnego wychwytu serotoniny i noradrenaliny (SNRI). W przypadku pacjentów zagrożonych chorobą wrzodową przewodu pokarmowego można rozważyć odpowiednie leczenie profilaktyczne (patrz punkty 4.5 i 5.1).
Pacjenci leczeni produktem Xanirva i substancjami przeciwpłytkowymi powinni otrzymywać jednoczesne leczenie NLPZ tylko wtedy, gdy korzyści przewyższają ryzyko krwawienia.
Inne czynniki ryzyka krwotoku
Podobnie jak i inne środki przeciwzakrzepowe, rywaroksaban nie jest zalecany u pacjentów z nasilonymi czynnikami ryzyka krwawienia takimi jak:
Pacjenci z chorobą nowotworową
Pacjenci z chorobą nowotworową mogą być jednocześnie narażeni na większe ryzyko krwawienia i zakrzepicy. Należy rozważyć indywidualne korzyści z leczenia przeciwzakrzepowego w stosunku do ryzyka krwawienia u pacjentów z aktywną chorobą nowotworową, w zależności od lokalizacji guza, leczenia przeciwnowotworowego i stadium choroby. Nowotwory zlokalizowane w przewodzie pokarmowym lub układzie moczowo-płciowym były związane ze zwiększonym ryzykiem krwawienia podczas leczenia rywaroksabanem.
U pacjentów z nowotworami złośliwymi, u których występuje duże ryzyko krwawienia, stosowanie rywaroksabanu jest przeciwwskazane (patrz punkt 4.3).
Pacjenci z protezami zastawek
Rywaroksaban nie powinien być stosowany w celu tromboprofilaktyki u pacjentów którzy przeszli zabieg przezcewnikowej wymiany zastawki aortalnej (ang. transcatheter aortic valve replacement, TAVR). Nie badano bezpieczeństwa stosowania i skuteczności rywaroksabanu u pacjentów z protezami zastawek serca; z tego powodu brak jest danych uzasadniających, że rywaroksaban zapewnia właściwe działanie przeciwzakrzepowe w tej grupie pacjentów. Leczenie produktem Xanirva nie jest zalecane u tych pacjentów.
Pacjenci z zespołem antyfosfolipidowym
Bezpośrednie doustne antykoagulanty (ang. direct acting oral anticoagulants, DOACs) takie jak rywaroksaban nie są zalecane dla pacjentów z zakrzepicą w wywiadzie, u których zdiagnozowano zespół antyfosfolipidowy. Leczenie DOACs u pacjentów potrójnie pozytywnych (tj. z obecnymi antykoagulantem toczniowym, przeciwciałami antykardiolipinowymi oraz przeciwciałami anty beta-2- glikoproteiny I) może być powiązane z zwiększonym ryzykiem nawracających zdarzeń zakrzepowych, w porównaniu z terapią antagonistami witaminy K.
Pacjenci z wcześniejszym udarem i (lub) przemijającym napadem niedokrwiennym
Pacjenci z OZW
Produkt Xanirva 2,5 mg jest przeciwwskazany do leczenia OZW u pacjentów z wcześniejszym udarem lub przemijającym napadem niedokrwiennym (patrz punkt 4.3). Przeprowadzono badanie kilku pacjentów z OZW z wcześniejszym udarem lub przemijającym napadem niedokrwiennym, ale dostępne ograniczone dane dotyczące skuteczności wskazują, że pacjenci ci nie odnoszą korzyści
z leczenia.
Pacjenci z CAD/PAD
Nie badano pacjentów z CAD/PAD po przebytym udarze krwotocznym lub zatokowym,
lub przebytym w ciągu ostatniego miesiąca udarze niedokrwiennym, niezatokowym (patrz punkt 4.3). Nie badano pacjentów po niedawnym zabiegu rewaskularyzacji kończyny dolnej z powodu objawowej PAD z wcześniejszym udarem lub przemijającym napadem niedokrwiennym. W przypadku stosowania podwójnej terapii przeciwpłytkowej u tych pacjentów należy unikać leczenia produktem Xanirva 2,5 mg.
Znieczulenie lub nakłucie podpajęczynówkowe/zewnątrzoponowe
Podczas stosowania znieczulenia przewodowego (znieczulenie podpajęczynówkowe
/zewnątrzoponowe) lub nakłucia podpajęczynówkowego/zewnątrzoponowego u pacjentów otrzymujących leki przeciwzakrzepowe w celu zapobiegania powikłaniom zakrzepowo-zatorowym, występuje ryzyko powstania krwiaka zewnątrzoponowego lub podpajęczynówkowego, który może powodować długotrwałe lub trwałe porażenie. Pooperacyjne zastosowanie stałego cewnika zewnątrzoponowego lub jednoczesne stosowanie produktów wpływających na hemostazę może zwiększać ryzyko wystąpienia takich zdarzeń. Ryzyko może być również zwiększone podczas wykonywania nakłucia zewnątrzoponowego lub podpajęczynówkowego w sposób urazowy lub wielokrotny. Pacjentów należy często kontrolować w celu wykrycia podmiotowych i przedmiotowych objawów zaburzeń neurologicznych (np. drętwienie lub osłabienie nóg, zaburzenia czynnościowe jelit lub pęcherza moczowego). W przypadku stwierdzenia zaburzenia neurologicznego konieczna jest natychmiastowa diagnostyka i leczenie. Przed wykonaniem zabiegu w obrębie ośrodkowego układu nerwowego u pacjentów otrzymujących lub mających otrzymać leki przeciwzakrzepowe w celu profilaktyki przeciwzakrzepowej lekarz powinien dokładnie rozważyć stosunek potencjalnych korzyści do ryzyka. Nie ma doświadczenia klinicznego w stosowaniu rywaroksabanu w dawce 2,5 mg i substancji przeciwpłytkowych w takich sytuacjach. Jak wskazano w „Wytycznych dla przepisujących lek Xanirva”, należy zaprzestać stosowania inhibitorów agregacji płytek krwi.
Aby zmniejszyć możliwe ryzyko krwawień związane z jednoczesnym stosowaniem rywaroksabanu i znieczulenia przewodowego (zewnątrzoponowego/podpajęczynówkowego) należy wziąć pod uwagę profil farmakokinetyczny rywaroksabanu. Założenie lub usunięcie cewnika zewnątrzoponowego lub nakłucie lędźwiowe najlepiej wykonywać, kiedy działanie przeciwzakrzepowe rywaroksabanu jest szacowane jako słabe (patrz punkt 5.2). Dokładny czas, kiedy wystąpi odpowiednio słabe działanie przeciwzakrzepowe u poszczególnych pacjentów nie jest jednak znany.
Zalecenia dotyczące dawkowania przed i po zabiegach inwazyjnych i interwencji chirurgicznej
Jeśli wymagany jest zabieg inwazyjny lub interwencja chirurgiczna, należy w miarę możliwości i na podstawie oceny klinicznej lekarza przerwać stosowanie produktu Xanirva, 2,5 mg co najmniej 12 godzin przed interwencją. Jeśli pacjent ma być poddany planowej operacji, a efekt przeciwpłytkowy nie jest pożądany, należy przerwać podawanie inhibitorów agregacji płytek zgodnie z informacjami o leku podanymi przez wytwórcę. Jeśli nie jest możliwe przełożenie zabiegu, należy ocenić zwiększone ryzyko wystąpienia krwawienia wobec konieczności interwencji.
Stosowanie produktu Xanirva należy jak najszybciej rozpocząć ponownie po zabiegu inwazyjnym lub interwencji chirurgicznej, pod warunkiem, że pozwala na to sytuacja kliniczna i zgodnie z ustaleniami lekarza prowadzącego osiągnięta jest właściwa hemostaza (patrz punkt 5.2).
Pacjenci w podeszłym wieku
Wraz z wiekiem wzrastać może ryzyko wystąpienia krwotoku (patrz punkty 5.1 i 5.2).
Reakcje skórne
Po wprowadzeniu do obrotu zgłaszano poważne reakcje skórne związane ze stosowaniem rywaroksabanu, w tym zespół Stevensa-Johnsona lub toksyczne martwicze oddzielanie się naskórka i zespół DRESS (patrz punkt 4.8). Ryzyko wystąpienia tych działań jest prawdopodobnie największe na początku terapii; większość powikłań notowano w ciągu pierwszych tygodni leczenia. Stosowanie rywaroksabanu należy przerwać po wystąpieniu pierwszych poważnych reakcji skórnych [np. rozległych, ostrych i (lub) z towarzyszącym powstawaniem pęcherzy], albo jakichkolwiek innych objawów nadwrażliwości w połączeniu ze zmianami na błonach śluzowych.
Substancje pomocnicze
Produkt leczniczy zawiera laktozę jednowodną, sód oraz żółcień pomarańczową S (E 110).
Ten produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, całkowitym niedoborem laktazy lub zespołem złego wchłaniania glukozy- galaktozy.
Ten produkt zawiera mniej niż 1 mmol sodu (23 mg) na jedną kapsułkę, co oznacza, że jest praktycznie „wolny od sodu”.
Substancja pomocnicza żółcień pomarańczowa S (E 110) może powodować reakcje alergiczne.
Inhibitory CYP3A4 oraz glikoproteiny P
Podanie rywaroksabanu jednocześnie z ketokonazolem (400 mg raz na dobę) lub rytonawirem (600 mg 2 razy na dobę) prowadziło odpowiednio do 2,6- / 2,5-krotnego zwiększenia średniego AUC rywaroksabanu oraz do 1,7-/1,6-krotnego zwiększenia średniego stężenia maksymalnego (Cmax) rywaroksabanu, ze znacznym nasileniem działania farmakodynamicznego, które może prowadzić do zwiększonego ryzyka krwawienia. Z tego powodu nie zaleca się stosowania produktu Xanirva u pacjentów, którzy w tym samym czasie przyjmują ogólnoustrojowo azolowe leki przeciwgrzybicze takie jak ketokonazol, itrakonazol, worykonazol i pozakonazol, lub inhibitory proteazy HIV. Wymienione substancje czynne są silnymi inhibitorami zarówno CYP3A4, jak i glikoproteiny P (patrz punkt 4.4).
Oczekuje się, że substancje czynne silnie hamujące tylko jeden ze szlaków eliminacji rywaroksabanu, albo CYP3A4 albo glikoproteinę P, mniej wpłyną na wzrost stężenia rywaroksabanu w osoczu krwi. Dla przykładu, klarytromycyna (500 mg 2 razy na dobę), uważana za silny inhibitor CYP3A4 oraz umiarkowany inhibitor glikoproteiny P, prowadzi do 1,5-krotnego zwiększenia średniego AUC rywaroksabanu oraz 1,4-krotnego zwiększenia Cmax rywaroksabanu. Interakcja z klarytromycyną nie jest prawdopodobnie istotna klinicznie u większości pacjentów, ale może być potencjalnie istotna u pacjentów wysokiego ryzyka. (Informacja dotycząca pacjentów z zaburzeniami czynności nerek: patrz punkt 4.4).
Erytromycyna (500 mg 3 razy na dobę), która umiarkowanie hamuje CYP3A4 oraz glikoproteinę P, prowadziła do 1,3-krotnego zwiększenia średniego AUC oraz Cmax rywaroksabanu. Interakcja z erytromycyną nie jest prawdopodobnie istotna klinicznie u większości pacjentów, ale może być potencjalnie istotna u pacjentów wysokiego ryzyka. U pacjentów z łagodnymi zaburzeniami czynności nerek erytromycyna (500 mg trzy razy na dobę) prowadziła do 1,8-krotnego zwiększenia średniego AUC rywaroksabanu i 1,6-krotnego zwiększenia Cmax w porównaniu z pacjentami z prawidłową czynnością nerek. U pacjentów z umiarkowanymi zaburzeniami czynności nerek erytromycyna prowadziła do 2,0-krotnego zwiększenia średniego AUC rywaroksabanu i 1,6-krotnego zwiększenia Cmax w porównaniu z pacjentami z prawidłową czynnością nerek. Skutki działania erytromycyny sumują się ze skutkami zaburzeń czynności nerek (patrz punkt 4.4).
Flukonazol (400 mg raz na dobę), uznawany za umiarkowany inhibitor CYP3A4, prowadził do 1,4- krotnego zwiększenia średniego AUC oraz 1,3-krotnego zwiększenia średniego Cmax rywaroksabanu.
Interakcja z flukonazolem nie jest prawdopodobnie istotna klinicznie u większości pacjentów, ale może być potencjalnie istotna u pacjentów wysokiego ryzyka. (Pacjenci z zaburzeniami czynności nerek, patrz punkt 4.4).
Biorąc pod uwagę ograniczone dostępne dane kliniczne dotyczące dronedaronu, należy unikać jednoczesnego stosowania z rywaroksabanem.
Leki przeciwzakrzepowe
Po jednoczesnym podaniu enoksaparyny (pojedyncza dawka 40 mg) oraz rywaroksabanu (pojedyncza dawka 10 mg) obserwowano addytywne działanie hamujące aktywność czynnika Xa, bez jakiegokolwiek dodatkowego wpływu na czasy krzepnięcia (PT, APTT). Enoksaparyna nie wpływała na farmakokinetykę rywaroksabanu.
Z powodu zwiększonego ryzyka krwawienia należy zachować ostrożność, jeśli pacjenci są jednocześnie leczeni jakimkolwiek innym środkiem przeciwzakrzepowym (patrz punkty 4.3 i 4.4).
Niesteroidowe leki przeciwzapalne (NLPZ)/inhibitory agregacji płytek krwi
Po jednoczesnym podaniu rywaroksabanu (15 mg) oraz 500 mg naproksenu nie obserwowano wydłużenia czasu krwawienia istotnego klinicznie. Tym niemniej, u niektórych pacjentów może dojść do bardziej nasilonych działań farmakodynamicznych.
Po jednoczesnym podaniu rywaroksabanu oraz 500 mg kwasu acetylosalicylowego nie obserwowano istotnych klinicznie interakcji farmakokinetycznych ani farmakodynamicznych.
Klopidogrel (300 mg w dawce nasycającej, a następnie 75 mg w dawce podtrzymującej) nie wykazywał interakcji farmakokinetycznej z rywaroksabanem (15 mg), ale w podgrupie pacjentów stwierdzono znaczne wydłużenie czasu krwawienia, które nie było skorelowane z agregacją płytek krwi, stężeniem P-selektyny ani aktywnością receptora GPIIb/IIIa.
Należy zachować ostrożność u pacjentów, którzy stosują jednocześnie niesteroidowe leki przeciwzapalne - NLPZ (w tym kwas acetylosalicylowy) oraz inhibitory agregacji płytek krwi, ponieważ zwykle zwiększają one ryzyko krwawienia (patrz punkt 4.4).
SSRI/SNRI
Tak jak w przypadku innych leków przeciwzakrzepowych, istnieje możliwość występowania podwyższonego ryzyka krwawienia podczas jednoczesnego stosowania SSRI lub SNRI ze względu na ich zgłaszane działanie na płytki krwi. W badaniach klinicznych podczas jednoczesnego stosowania z rywaroksabanem we wszystkich grupach leczenia obserwowano liczbowo większe częstości poważnych i innych niż poważne klinicznie istotnych krwawień.
Warfaryna
Zmiany leczenia pacjentów z antagonisty witaminy K warfaryny (INR 2,0 do 3,0) na rywaroksaban (20 mg) lub z rywaroksabanu (20 mg) na warfarynę (INR 2,0 do 3,0) zwiększały czas protrombinowy/INR (neoplastyna) więcej niż addytywnie (można zaobserwować pojedyncze wartości INR do 12), podczas gdy wpływ na APTT, hamowanie aktywności czynnika Xa i endogenny potencjał trombiny był addytywny.
Jeśli pożądane jest badanie skutków farmakodynamicznych rywaroksabanu w okresie zmiany leczenia, można wykorzystać aktywność czynnika anty-Xa, PiCT i HepTest, ponieważ warfaryna nie wpływa na te badania. Czwartego dnia po ostatniej dawce warfaryny wszystkie badania (w tym PT, APTT, hamowanie aktywności czynnika Xa i ETP) odzwierciedlały tylko działanie rywaroksabanu. Jeśli pożądane jest badanie skutków farmakodynamicznych warfaryny w okresie zmiany leczenia, można wykorzystać pomiar INR przy Cmin rywaroksabanu (24 godziny po uprzednim przyjęciu rywaroksabanu), ponieważ rywaroksaban ma minimalny wpływ na to badanie w tym punkcie czasowym.
Nie obserwowano interakcji farmakokinetycznej między warfaryną a rywaroksabanem.
Induktory CYP3A4
Zastosowanie rywaroksabanu jednocześnie z silnym induktorem CYP3A4, ryfampicyną, prowadziło
do około 50% zmniejszenia średniego AUC rywaroksabanu, czemu towarzyszyło zmniejszenie jego działań farmakodynamicznych. Jednoczesne stosowanie rywaroksabanu z innymi silnymi induktorami CYP3A4 [np. fenytoiną, karbamazepiną, fenobarbitalem lub zielem dziurawca (Hypericum perforatum)] może także prowadzić do zmniejszenia stężeń rywaroksabanu w osoczu. Dlatego też należy unikać jednoczesnego stosowania silnych induktorów CYP3A4, chyba że pacjent jest ściśle obserwowany w kierunku objawów przedmiotowych i podmiotowych zakrzepicy.
Inne leczenie skojarzone
Nie stwierdzono żadnych farmakokinetycznych ani farmakodynamicznych interakcji o znaczeniu klinicznym po jednoczesnym podaniu rywaroksabanu oraz midazolamu (substrat CYP3A4), digoksyny (substrat glikoproteiny P), atorwastatyny (substrat CYP3A4 i glikoproteiny P) lub omeprazolu (inhibitor pompy protonowej). Rywaroksaban ani nie hamuje, ani nie indukuje żadnej z głównych izoform CYP, takich jak CYP3A4.
Nie stwierdzono interakcji z pokarmem o znaczeniu klinicznym (patrz punkt 4.2).
Wyniki badań laboratoryjnych
Wyniki badań układu krzepnięcia (np. PT, aPTT, HepTest) zmieniają się zgodnie z oczekiwaniami, ze względu na mechanizm działania rywaroksabanu (patrz punkt 5.1).
Ciąża
Nie ustalono bezpieczeństwa stosowania i skuteczności produktu Xanirva u kobiet w okresie ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). W związku z możliwym szkodliwym wpływem na reprodukcję, ryzykiem wewnętrznego krwawienia
i potwierdzeniem, że rywaroksaban przenika przez łożysko, stosowanie Xanirva jest przeciwwskazane w okresie ciąży (patrz punkt 4.3).
Kobiety w wieku rozrodczym powinny unikać zajścia w ciążę podczas leczenia rywaroksabanem.
Karmienie piersią
Nie ustalono bezpieczeństwa stosowania i skuteczności produktu Xanirva u kobiet karmiących piersią. Badania na zwierzętach wskazują, że rywaroksaban przenika do mleka. Z tego względu stosowanie Xanirva jest przeciwwskazane podczas karmienia piersią (patrz punkt 4.3). Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać podawanie produktu.
Płodność
Nie przeprowadzono specyficznych badań rywaroksabanu u ludzi, w celu oceny wpływu na płodność. W badaniu dotyczącym płodności samców i samic szczurów nie obserwowano takiego wpływu (patrz punkt 5.3).
Xanirva ma niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Stwierdzano działania niepożądane takie jak omdlenia (częstość nieznana) i zawroty głowy (często) (patrz punkt 4.8). Pacjenci, u których wystąpią takie działania niepożądane nie powinni prowadzić pojazdów ani obsługiwać maszyn.
Podsumowanie profilu bezpieczeństwa
Bezpieczeństwo stosowania rywaroksabanu oceniano w trzynastu kluczowych badaniach fazy III (patrz Tabela 1).
Rywaroksaban podawano łącznie 69 608 dorosłym pacjentom w dziewiętnastu badaniach fazy III i
412 pacjentom pediatrycznym w dwóch badaniach fazy II i jednym badaniu fazy III.
Tabela 1: Liczba badanych pacjentów, łączna dawka dobowa i maksymalny czas trwania leczenia w badaniach dorosłych i pediatrycznych fazy III
Wskazanie | Liczba pacjentów* | Łączna dawka dobowa | Maksymalny czas trwania leczenia |
Profilaktyka żylnej choroby zakrzepowo-zatorowej (ŻChZZ) u dorosłych pacjentów po przebytej planowej aloplastyce stawu biodrowego lub kolanowego | 6 097 | 10 mg | 39 dni |
Profilaktyka ŻChZZ u pacjentów hospitalizowanych z powodów niechirurgicznych | 3 997 | 10 mg | 39 dni |
Leczenie zakrzepicy żył głębokich (ZŻG), zatorowości płucnej (ZP) i profilaktyka nawrotów | 6 790 | Dzień 1-21: 30 mg Dzień 22 i następne: 20 mg Po co najmniej 6 miesiącach: 10 mg lub 20 mg | 21 miesięcy |
Leczenie ŻChZZ i profilaktyka nawrotów ŻChZZ u donoszonych noworodków i dzieci w wieku poniżej18 lat po rozpoczęciu standardowego leczenia przeciwzakrzepowego | 329 | Dawka dostosowana do masy ciała w celu uzyskania podobnej ekspozycji jak tej obserwowanej u dorosłych leczonych dawką 20 mg rywaroksabanu raz na dobę z powodu ZŻG | 12 miesięcy |
Profilaktyka udaru i zatorowości obwodowej u pacjentów z migotaniem przedsionków niezwiązanym z wadą zastawkową | 7 750 | 20 mg | 41 miesięcy |
Profilaktyka zdarzeń zakrzepowych o podłożu miażdżycowym u pacjentów po ostrym zespole wieńcowym (OZW) | 10 225 | Odpowiednio 5 mg lub 10 mg podawane jednocześnie z kwasem acetylosalicylowym lub kwasem acetylosalicylowym z klopidogrelem lub tyklopidyną | 31 miesięcy |
Profilaktyka zdarzeń zakrzepowych o podłożu miażdżycowym u pacjentów z CAD/PAD | 18 244 | 5 mg w skojarzeniu z ASA lub 10 mg w monoterapii | 47 miesięcy |
3 256** | 5 mg w skojarzeniu z ASA | 42 miesiące |
*Pacjenci, którym podano co najmniej jedną dawkę rywaroksabanu.
** Dane z badania VOYAGER PAD
Najczęściej zgłaszanymi działaniami niepożądanymi u pacjentów otrzymujących rywaroksaban były krwawienia (patrz punkt 4.4 i "Opis wybranych działań niepożądanych" poniżej) (Tabela 2).
Tabela 2: Odsetek krwawień* i niedokrwistości u pacjentów, którym podawano rywaroksaban
w zakończonych badaniach dorosłych i pediatrycznych fazy III
Wskazanie | Jakiekolwiek krwawienie | Niedokrwistość |
Profilaktyka ŻChZZ u dorosłych pacjentów po przebytej planowej aloplastyce stawu biodrowego lub kolanowego | 6,8% pacjentów | 5,9% pacjentów |
Profilaktyka ŻChZZ u pacjentów hospitalizowanych z powodów niechirurgicznych | 12,6% pacjentów | 2,1% pacjentów |
Leczenie ZŻG, ZP i profilaktyka nawrotów | 23% pacjentów | 1,6% pacjentów |
Leczenie ŻChZZ i profilaktyka nawrotów ŻChZZ u donoszonych noworodków i dzieci w wieku poniżej 18 lat po rozpoczęciu standardowego leczenia przeciwzakrzepowego | 39,5% pacjentów | 4,6% pacjentów |
Profilaktyka udaru i zatorowości obwodowej u pacjentów z migotaniem przedsionków niezwiązanym z wadą zastawkową | 28 na 100 pacjentolat | 2,5 na 100 pacjentolat |
Profilaktyka zdarzeń zakrzepowych o podłożu miażdżycowym u pacjentów po ostrym zespole wieńcowym (OZW) | 22 na 100 pacjentolat | 1,4 na 100 pacjentolat |
Profilaktyka zdarzeń zakrzepowych o podłożu miażdżycowym u pacjentów z CAD/PAD | 6,7 na 100 pacjentolat | 0,15 na 100 pacjentolat** |
8,38 na 100 pacjentolat# | 0,74 na 100 pacjentolat***# |
* W ramach wszystkich badań rywaroksabanu gromadzono, zgłaszano i oceniano wszystkie krwawienia.
** W badaniu COMPASS odnotowano niewielką częstość występowania anemii, ponieważ zastosowano selektywne podejście do zbierania zdarzeń niepożądanych.
*** Zastosowano selektywne podejście do zbierania zdarzeń niepożądanych.
# Dane z badania VOYAGER PAD
Tabelaryczne podsumowanie działań niepożądanych
Częstość występowania działań niepożądanych zgłaszanych podczas stosowania rywaroksabanu u dorosłych oraz dzieci i młodzieży jest przedstawiona w Tabeli 3 według klasyfikacji układów i narządów (w MedDRA) i częstości występowania.
Częstości zdefiniowano jako:
bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10),
niezbyt często (≥ 1/1 000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1 000), bardzo rzadko (< 1/10 000),
częstość nieznana (nie może być określona na podstawie dostępnych danych).
Tabela 3: Wszystkie działania niepożądane zgłaszane u dorosłych pacjentów w badaniach fazy III lub po wprowadzeniu produktu do obrotu* i w dwóch badaniach fazy II i jednym fazy III z udziałem dzieci i młodzieży.
Często | Niezbyt często | Rzadko | Bardzo rzadko | Częstość nieznana |
Zaburzenia krwi i układu chłonnego | ||||
Niedokrwistość | Nadpłytkowość | |||
(w tym wynik | (w tym zwiększenie | |||
odpowiedniego | liczby płytek krwi)A, | |||
parametru laboratoryjnego) | małopłytkowość | |||
Zaburzenia układu immunologicznego | ||||
Reakcja alergiczna, | Reakcja | |||
alergiczne zapalenie | anafilaktyczna | |||
skóry, | w tym wstrząs | |||
obrzęk | anafilaktyczny | |||
naczynioruchowy | ||||
i obrzęk alergiczny | ||||
Zaburzenia układu nerwowego | ||||
Zawroty głowy, ból głowy | Krwotok mózgowy i śródczaszkowy, omdlenie | |||
Zaburzenia oka | ||||
Krwotok oczny (w tym krwotok podspojówkowy) | ||||
Zaburzenia serca | ||||
Tachykardia | ||||
Zaburzenia naczyniowe | ||||
Niedociśnienie tętnicze, krwiak | ||||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | ||||
Krwawienie z nosa, Krwioplucie | ||||
Często | Niezbyt często | Rzadko | Bardzo rzadko | Częstość nieznana |
Zaburzenia żołądka i jelit | ||||
Krwawienie z dziąseł, krwotok z przewodu pokarmowego (w tym krwotok z odbytnicy), bóle brzucha oraz żołądka i jelit, niestrawność, nudności, zaparciaA, biegunka, wymiotyA | Suchość błony śluzowej jamy ustnej | |||
Zaburzenia wątroby i dróg żółciowych | ||||
Zwiększenie aktywności aminotransferaz | Zaburzenia czynności wątroby, zwiększenie stężenia bilirubiny, zwiększenie aktywności fosfatazy alkalicznejA, zwiększenie aktywności GGTA | Żółtaczka, zwiększenie stężenia sprzężonej bilirubiny (z lub bez towarzyszącego zwiększenia aktywności AlAT), cholestaza, zapalenie wątroby (w tym uszkodzenie komórek wątroby) | ||
Zaburzenia skóry i tkanki podskórnej | ||||
Świąd (w tym niezbyt częste przypadki świądu uogólnionego), wysypka, siniaczenie, krwotok skórny i podskórny | Pokrzywka | Zespół Stevensa- Johnsona lub toksyczne martwicze oddzielanie się naskórka, zespół DRESS | ||
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | ||||
Ból kończynyA | Wylew krwi do stawu | Krwawienie domięśniowe | Zespół ciasnoty przedziałów powięziowych, wtórny do krwawienia | |
Często | Niezbyt często | Rzadko | Bardzo rzadko | Częstość nieznana |
Zaburzenia nerek i dróg moczowych | ||||
Krwotok z układu moczowo-płciowego (w tym krwiomocz i nadmierne krwawienie miesiączkoweB), zaburzenie czynności nerek (w tym zwiększenie stężenia kreatyniny we krwi, zwiększenie stężenia mocznika we krwi) | Niewydolność nerek/ostra niewydolność nerek, wtórna do krwawienia, wystarczająceg o do spowodowania hipoperfuzji | |||
Zaburzenia ogólne i stany w miejscu podania | ||||
GorączkaA, obrzęk obwodowy, ogólne obniżenie siły i energii (w tym zmęczenie i astenia) | Złe samopoczucie (w tym niemoc) | Obrzęk miejscowyA | ||
Badania diagnostyczne | ||||
Zwiększenie LDHA, zwiększenie lipazyA, zwiększenie amylazyA | ||||
Urazy, zatrucia i powikłania po zabiegach | ||||
Krwotok po zabiegu medycznym (w tym niedokrwistość pooperacyjna i krwotok z rany), stłuczenie, wydzielina z ranyA | Tętniak rzekomyC | |||
A: obserwowane w profilaktyce ŻChZZ u dorosłych pacjentów po przebytej planowej aloplastyce stawu biodrowego lub kolanowego.
B: obserwowane w leczeniu i profilaktyce nawrotów zakrzepicy żył głębokich (ZŻG) i zatorowości płucnej (ZP) jako bardzo częste u kobiet w wieku < 55 lat
C: obserwowane niezbyt często w profilaktyce zdarzeń zakrzepowych na podłożu miażdżycowym u pacjentów po ostrym zespole wieńcowym (OZW) (po zabiegu przezskórnej interwencji wieńcowej)
Zgłaszano rzadkie przypadki przedawkowania do 1,960 mg. W przypadku przedawkowania należy uważnie obserwować pacjenta pod kątem powikłań krwotocznych lub innych działań niepożądanych (patrz punkt „Postępowanie w przypadku krwawienia”). Ze względu na ograniczone wchłanianie oczekiwany jest efekt pułapowy bez dalszego zwiększania średniej ekspozycji osocza po dawkach supraterapeutycznych 50 mg rywaroksabanu lub powyżej.
Dostępny jest specyficzny środek odwracający działanie rywaroksabanu (andeksanet alfa), który znosi jego farmakodynamiczne działanie (patrz Charakterystyka Produktu Leczniczego andeksanetu alfa). W razie przedawkowania rywaroksabanu, aby zmniejszyć wchłanianie można rozważyć zastosowanie węgla aktywnego.
Postępowanie w przypadku krwawienia
W przypadku wystąpienia powikłania krwotocznego u pacjenta otrzymującego rywaroksaban, należy opóźnić podanie kolejnej dawki rywaroksabanu lub należy przerwać leczenie, w zależności od sytuacji klinicznej. Okres półtrwania rywaroksabanu wynosi około 5 do 13 godzin (patrz punkt 5.2).
Postępowanie należy dostosować indywidualnie według stopnia ciężkości i umiejscowienia krwotoku. W razie potrzeby można zastosować odpowiednie leczenie objawowe, takie jak ucisk mechaniczny (np. w ciężkim krwawieniu z nosa), hemostaza chirurgiczna z procedurami opanowania krwawienia, podawanie płynów i zastosowanie wsparcia hemodynamicznego, przetoczenie produktów krwiopochodnych (koncentrat krwinek czerwonych lub świeżo mrożone osocze, w zależności od powiązanej niedokrwistości lub koagulopatii) lub płytek krwi.
Jeśli pomimo zastosowania powyższych środków nie uda się powstrzymać krwawienia, należy rozważyć podanie specyficznego inhibitora czynnika Xa, odwracającego działanie rywaroksabanu (andeksanet alfa), który znosi jego działanie farmakodynamiczne, lub specjalnego prokoagulacyjnego środka odwracającego, takiego jak koncentrat czynników zespołu protrombiny (PCC), koncentrat aktywowanych czynników zespołu protrombiny (aPCC) lub rekombinowany czynnik VIIa (r-FVIIa).
Obecnie dostępne jest jednak bardzo ograniczone doświadczenie kliniczne w stosowaniu tych produktów leczniczych u pacjentów przyjmujących rywaroksaban. Zalecenie to oparte jest więc na ograniczonych danych nieklinicznych. W zależności od stopnia zmniejszania się krwawienia należy rozważyć ponowne podanie rekombinowanego czynnika VIIa i stopniowe zwiększanie jego dawki. W przypadku wystąpienia poważnych krwawień należy, w zależności od dostępności na szczeblu lokalnym, skonsultować się ze specjalistą ds. krzepnięcia krwi (patrz punkt 5.1).
Siarczan protaminy i witamina K nie powinny wpływać na przeciwzakrzepowe działanie rywaroksabanu. Istnieją ograniczone doświadczenia z kwasem traneksamowym i nie ma doświadczeń z kwasem aminokapronowym oraz aprotyniną u pacjentów przyjmujących rywaroksaban. Nie ma ani podstaw naukowych ani doświadczenia, które potwierdzałyby korzyści z zastosowania leku przeciwkrwotocznego o działaniu ogólnym, desmopresyny, u pacjentów przyjmujących rywaroksaban. Ze względu na wysoki stopień wiązania z białkami osocza krwi, rywaroksaban raczej nie będzie ulegał dializie.
5.1. Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: środki przeciwzakrzepowe, bezpośrednie inhibitory czynnika Xa, kod ATC: B01AF01
Mechanizm działania
Rywaroksaban jest wysoce wybiórczym, bezpośrednim inhibitorem czynnika Xa, biodostępnym po podaniu doustnym. Hamowanie aktywności czynnika Xa przerywa wewnątrz- oraz zewnątrzpochodną drogę kaskady krzepnięcia krwi, hamując zarówno wytwarzanie trombiny, jak i powstawanie zakrzepu. Rywaroksaban nie hamuje trombiny (aktywowany czynnik II) oraz nie wykazano, żeby wpływał na płytki krwi.
Działanie farmakodynamiczne
W związku z wykazaną biorównoważnością produktu Xanirva w postaci kapsułek względem produktu referencyjnego (Xarelto) w postaci tabletek, wyniki badań produktu referencyjnego mogą być ekstrapolowane na produkt Xanirva w postaci kapsułek.
U ludzi hamowanie aktywności czynnika Xa było zależne od dawki rywaroksabanu. Rywaroksaban wpływa na czas protrombinowy (PT) w sposób zależny od dawki. Dla oznaczenia z użyciem odczynnika Neoplastin występuje ścisła korelacja ze stężeniem substancji czynnej w osoczu krwi (wartość r wynosi 0,98). Po zastosowaniu innych odczynników uzyskane wyniki mogłyby się różnić. Odczyt wartości PT należy podać w sekundach, ponieważ Międzynarodowy Współczynnik Znormalizowany (ang. International Normalised Ratio, INR) jest kalibrowany i zwalidowany jedynie dla kumaryn, zatem nie można go użyć dla innych antykoagulantów.
W farmakologicznym badaniu klinicznym dotyczącym odwracania farmakodynamiki rywaroksabanu u zdrowych osób dorosłych (n=22) oceniano działanie jednokrotnych dawek (50 j.m./kg) dwóch różnych rodzajów PCC - trójczynnikowego PCC (czynniki II, IX i X) oraz 4-czynnikowego (czynniki II, VII, IX i X). 3-czynnikowy PCC skracał średnie wartości PT (neoplastyna) o ok. 1,0 sekundę na przestrzeni 30 minut, w porównaniu do 4-czynnikowego PCC, który powodował skracanie PT o ok. 3,5 sekundy. Natomiast w porównaniu z 4-czynnikowym PCC, 3-czynnikowy PCC wykazywał silniejsze i szybsze działanie w zakresie odwracania zmian w endogennym wytwarzaniu trombiny (patrz punkt 4.9).
Czas częściowej tromboplastyny po aktywacji (APTT) oraz HepTest są także wydłużone w sposób zależny od dawki, jednakże nie zaleca się stosowania tych badań w celu oceny działania farmakodynamicznego rywaroksabanu. Nie ma potrzeby monitorowania parametrów układ krzepnięcia w czasie leczenia rywaroksabanem w codziennej praktyce klinicznej. Jednak w przypadku
wskazania klinicznego stężenie rywaroksabanu może być zmierzone skalibrowanym ilościowym testem anty-Xa (patrz punkt 5.2).
Skuteczność kliniczna i bezpieczeństwo stosowania
OZW
Program badań klinicznych rywaroksabanu został opracowany w celu wykazania skuteczności produktu Xanirva w profilaktyce zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego lub udaru mózgu u pacjentów z przebytym niedawno OZW [zawał mięśnia sercowego z uniesieniem odcinka ST (STEMI), zawał mięśnia sercowego bez uniesienia odcinka ST (NSTEMI) lub niestabilna dławica piersiowa’. W kluczowym, przeprowadzanym metodą podwójnie ślepej próby badaniu ATLAS ACS 2 TIMI 51, 15 526 pacjentów przydzielono losowo w stosunku 1:1:1 do jednej z trzech grup: rywaroksaban 2,5 mg doustnie dwa razy na dobę, 5 mg doustnie dwa razy na dobę lub placebo dwa razy na dobę podawane równocześnie z samym ASA lub ASA oraz tienopirydyną (klopidogrel lub tyklopidyna). Pacjenci z OZW w wieku poniżej 55 lat musieli chorować na cukrzycę lub być po przebytym zawale mięśnia sercowego. Mediana czasu poddawania leczeniu wynosiła 12 miesięcy, a ogólny czas trwania leczenia wynosił prawie 3 lata. 93,2% pacjentów otrzymywało ASA jednocześnie z leczeniem tienopirydyną, a 6,8% tylko ASA. Spośród pacjentów otrzymujących podwójną terapię przeciwpłytkową 98,8% otrzymywało klopidogrel, 0,9% otrzymywało tyklopidynę, a 0,3% otrzymywało prasugrel. Pacjenci otrzymali pierwszą dawkę rywaroksabanu co najmniej 24 godziny i maksymalnie 7 dni (średnia 4,7 dni) po przyjęciu do szpitala, ale jak najszybciej po stabilizacji OZW, włącznie z zabiegami rewaskularyzacji, oraz gdy normalnie przerwa się pozajelitowe leczenie przeciwzakrzepowe.
Obydwa schematy leczenia – 2,5 mg dwa razy na dobę i 5 mg dwa razy na dobę – były skuteczne w dalszym zmniejszeniu częstości występowania zdarzeń sercowo-naczyniowych na tle standardowego leczenia przeciwpłytkowego. Schemat 2,5 mg dwa razy na dobę zmniejszał śmiertelność i dostępne są dowody, że mniejsza dawka była związana z mniejszym ryzykiem krwawienia. Dlatego rywaroksaban 2,5 mg dwa razy na dobę podawany jednocześnie z samym
kwasem acetylosalicylowym (ASA) lub z ASA oraz klopidogrelem lub tyklopidyną jest zalecany do profilaktyki zdarzeń zakrzepowych na podłożu miażdżycowym u dorosłych pacjentów po OZW z podwyższonymi biomarkerami sercowymi.
W porównaniu z placebo rywaroksaban istotnie zmniejszył pierwszorzędowy punkt końcowy złożony ze zgonu z przyczyn sercowo-naczyniowych, zawału mięśnia sercowego lub udaru mózgu. Korzyści w redukcji pierwszorzędowego punktu końcowego były powodowane zmniejszeniem liczby zgonów z przyczyn sercowo-naczyniowych i zawału mięśnia sercowego. Korzyści wystąpiły już we wczesnej fazie leczenia i utrzymywały się do jego zakończenia (patrz tabela 4 i wykres 1). Również pierwszy drugorzędowy punkt końcowy (zgon ze wszystkich przyczyn, zawał mięśnia sercowego lub udar mózgu) był istotnie zmniejszony. Dodatkowa retrospektywna analiza wykazała nominalnie istotne zmniejszenie wskaźników częstości występowania zakrzepicy w stencie, w porównaniu z placebo (patrz Tabela 4). Wskaźniki częstości występowania dla głównego kryterium bezpieczeństwa stosowania (poważne krwawienia TIMI niezwiązane z zabiegiem pomostowania aortalno- wieńcowego, ang. non-CABG TIMI major bleeding events) były wyższe u pacjentów leczonych rywaroksabanem niż u pacjentów otrzymujących placebo (patrz Tabela 6). Jednak wskaźniki częstości występowania były zrównoważone między rywaroksabanem i placebo dla takich składowych jak śmiertelne krwawienia, niedociśnienie wymagające leczenia dożylnymi lekami inotropowymi i zabieg chirurgiczny z powodu trwającego krwawienia.
W tabeli 5 przedstawiono skuteczność kliniczną u pacjentów po zabiegu przezskórnej interwencji wieńcowej (PCI). Bezpieczeństwo w podgrupie pacjentów po PCI było porównywalne do ogólnego bezpieczeństwa stosowania.
Pacjenci z podwyższonymi biomarkerami (troponina lub CK-MB) bez wcześniejszego udaru/
przemijającego napadu niedokrwiennego stanowili 80% badanej populacji. Uzyskane wyniki były zgodne z ogólnym profilem skuteczności i bezpieczeństwa stosowania.
Tabela 4: Wyniki skuteczności badania fazy III ATLAS ACS 2 TIMI 51
Populacja badana | Pacjenci z przebytym niedawno ostrym zespołem wieńcowym a) | |
Dawka terapeutyczna | Rywaroksaban 2,5 mg, dwa razy na dobę, N=5 114 n (%) Współczynnik ryzyka (95 % CI) wartość p b) | Placebo N=5 113 n (%) |
Zgon z przyczyn sercowo- | 313 (6,1%) | 376 (7,4%) |
naczyniowych, zawał mięśnia | 0,84 (0,72, 0,97) | |
sercowego lub udar mózgu | p = 0,020* | |
Zgon z wszystkich przyczyn, zawał | 320 (6,3%) | 386 (7,5%) |
mięśnia sercowego lub udar mózgu | 0,83 (0,72, 0,97) p = 0,016* | |
Zgon z przyczyn sercowo- | 94 (1,8%) | 143 (2,8%) |
naczyniowych | 0,66 (0,51, 0,86) | |
p = 0,002** | ||
Zgon z wszystkich przyczyn | 103 (2,0%) 0,68 (0,53, 0,87) p = 0,002** | 153 (3,0%) |
Zawał mięśnia sercowego | 205 (4,0%) | 229 (4,5%) |
0,90 (0,75, 1,09) | ||
p = 0,270 | ||
Udar mózgu | 46 (0,9%) | 41 (0,8%) |
1,13 (0,74, 1,73) | ||
p = 0,562 | ||
Zakrzepica w stencie | 61 (1,2%) 0,70 (0,51, 0,97) p = 0,033** | 87 (1,7%) |
Tabela 10: Wyniki dotyczące bezpieczeństwa stosowania z badania fazy III VOYAGER PAD
Populacja badana | Pacjenci po niedawno przebytym zabiegu rewaskularyzacji kończyny dolnej z powodu objawowej PAD a ) | ||
Dawka terapeutyczna | Rywaroksaban 2,5 mg dwa razy na dobę w skojarzeniu z ASA 100 mg raz na dobę N=3256 n (łączne ryzyko %)b) | ASA 100 mg raz na dobę N=3248 n (łączne ryzyko %)b ) | Współczynnik ryzyka (95% CI) c) wartość p d ) |
Poważne krwawienie TIMI (związane z zabiegiem pomostowania aortalno-wieńcowego / niezwiązane z zabiegiem pomostowania aortalno- wieńcowego) | 62 (1,9%) | 44 (1,4%) | 1,43 (0,97;2,10) p=0,0695 |
- Śmiertelne krwawienie | 6 (0,2%) | 6 (0,2%) | 1,02 (0,33;3,15) |
- Krwawienie śródczaszkowe | 13 (0,4%) | 17 (0,5%) | 0,78 (0,38;1,61) |
- Jawne krwawienie związane ze spadkiem Hb ≥5 g/dl / Hct ≥15% | 46 (1,4%) | 24 (0,7%) | 1,94 (1,18;3,17) |
Poważne krwawienie wg wytycznych ISTH | 140 (4,3%) | 100 (3,1%) | 1,42 (1,10;1,84) p=0,0068 |
- Śmiertelne krwawienie | 6 (0,2%) | 8 (0,2%) | 0,76 (0,26;2,19) |
- Krwawienie objawowe w ważnym narządzie, nieprowadzące do zgonu | 29 (0,9%) | 26 (0,8%) | 1,14 (0,67;1,93) |
Istotne klinicznie inne niż poważne krwawienie wg wytycznych ISTH | 246 (7,6%) | 139 (4,3%) | 1,81 (1,47;2,23) |
a) Populacja objęta analizą bezpieczeństwa stosowania (wszyscy uczestnicy, których poddano randomizacji i którzy otrzymali co najmniej jedną dawkę badanego leku)
b) n = liczba uczestników, u których wystąpiły zdarzenia, N = liczba uczestników obciążonych ryzykiem, % = 100 * n/N, n/100 pacjentolat = stosunek liczby uczestników, u których wystąpiły zdarzenia incydentalne / łączny czas obciążenia ryzykiem
c) Współczynnik ryzyka (95% CI) określano na podstawie modelu proporcjonalnego hazardu Coxa stratyfikowanego według rodzaju zabiegu i stosowania klopidogrelu, z leczeniem jako jedyną współzmienną.
d) Dwustronną wartość p oceniano w logarytmicznym teście rang ze stratyfikacją na podstawie rodzaju zabiegu i stosowania klopidogrelu, z leczeniem jako czynnikiem.
Pacjenci z CAD i niewydolnością serca
Badanie COMMANDER HF obejmowało 5 022 pacjentów z niewydolnością serca i znaczącą chorobą niedokrwienną serca (CAD), po hospitalizacji z powodu zdekompensowanej niewydolności serca (HF), którzy zostali losowo przydzieleni do jednej z dwóch grup przyjmujących: rywaroksaban w dawce 2,5 mg dwa razy na dobę (N=2 507) lub odpowiednie placebo (N=2 515). Mediana całkowitego czasu leczenia w badaniu wyniosła 504 dni. Pacjenci musieli mieć objawową HF przez co najmniej 3 miesiące i frakcję wyrzutową lewokomorową (LVEF) o wartości ≤40% przez co najmniej rok od włączenia do badania. Na początku badania, mediana frakcji wyrzutowej wynosiła 34% (IQR: 28% - 38%), a 53% uczestników miało klasę czynnościową III lub IV wg Nowojorskiego Towarzystwa Kardiologicznego (NYHA). Analizy pierwszorzędowych punktów skuteczności (np. śmiertelność ze wszystkich przyczyn, zawał serca lub udar) nie wykazały znaczącej statystycznie różnicy pomiędzy rywaroksabanem w dawce 2,5 mg dwa razy na dobę i placebo z HR = 0,94 (95% CI 0,84 – 1,05), p = 0,270. Dla śmiertelności ze wszystkich przyczyn nie było różnic w liczbie zdarzeń pomiędzy grupą pacjentów otrzymującą rywaroksaban i placebo (wskaźnik zdarzeń na 100 pacjentolat; 11,41 vs. 11,63, HR: 0,98; 95% CI: 0,87 do 1,10; p = 0,743). Wskaźnik zdarzeń dla
zawału serca na 100 pacjentolat (rywaroksaban vs placebo) wynosił 2,08 vs. 2,52 (HR 0,83; 95% CI:
0,63 DO 1,08; p = 0,165), a wskaźnik zdarzeń dla udaru na 100 pacjentolat wynosił 1,08 vs. 1,62 (HR:
0,66; 95% CI: 0,47 do 0,95; p = 0,023). Główne kryterium bezpieczeństwa stosowania (np. krwawienie śmiertelne lub krwawienie do przestrzeni krytycznej z możliwością trwałego inwalidztwa) wystąpiło u 18 (0,7%) pacjentów w grupie otrzymującej rywaroksaban w dawce 2,5 mg dwa razy na dobę i u 23 (0,9%) pacjentów w grupie placebo (HR = 0,80; 95% CI: 0,43 - 1,49; p = 0,484).
Stwierdzono statystycznie istotny wzrost częstości krwawień według Międzynarodowego Stowarzyszenia Zakrzepicy i Hemostazy (ISTH) w grupie otrzymującej rywaroksaban w porównaniu z grupą placebo (częstość występowania krwawień na 100 pacjentolat: 2,04 vs 1,21, HR 1,68; 95% CI:
1,18 do 2,39; p = 0,003).
U pacjentów z łagodną i umiarkowaną niewydolnością serca efekty leczenia w podgrupie badawczej COMPASS były podobne do efektów leczenia całej badanej populacji (patrz podpunkt CAD/PAD).
Pacjenci z wysokim ryzykiem potrójnie pozytywnego zespołu antyfosfolipidowego
W sponsorowanym przez badaczy, randomizowanym, otwartym wieloośrodkowym badaniu
z zaślepionym punktem końcowym, rywaroksaban był porównywany z warfaryną u pacjentów
z zakrzepicą w wywiadzie, zdiagnozowanym zespołem antyfosfolipidowym i z wysokim ryzykiem incydentów zakrzepowo-zatorowych (wynik pozytywny dla trzech parametrów antyfosfolipidowych: antykoagulant toczniowy, przeciwciała antykardiolipinowe oraz przeciwciała anty beta-2- glikoproteiny I). Badanie zostało zakończone przedwcześnie, po włączeniu do badania 120 pacjentów, w związku z nadmiarem incydentów wśród pacjentów otrzymujących rywaroksaban. Średni czas badania wyniósł 569 dni. 59 pacjentów zostało zrandomizowanych na rywaroksaban w dawce 20 mg (15 mg u pacjentów z klirensem kreatyniny (CL) < 50 ml/min), a 61 pacjentów zrandomizowano na warfarynę (INR od 2,0 do 3,0). Incydenty zakrzepowo-zatorowe wystąpiły u 12% pacjentów zrandomizowanych na rywaroksaban (4 udary niedokrwienne i 3 zawały tkanki mięśniowej serca).
Nie odnotowano incydentów u pacjentów przyjmujących warfarynę. Krwawienia wystąpiły u 4 pacjentów (7%) przyjmujących rywaroksaban i u 2 pacjentów (3%) przyjmujących warfarynę.
Dzieci i młodzież
Europejska Agencja Leków odstąpiła od obowiązku przedstawienia wyników badań dla produktu Xanirva we wszystkich podgrupach dzieci i młodzieży w profilaktyce powikłań zakrzepowo- zatorowych (patrz punkt 4.2, informacje na temat stosowania u dzieci i młodzieży).
Wchłanianie
Rywaroksaban wchłania się szybko i osiąga maksymalne stężenia w osoczu (Cmax) w czasie od 2 do 4 godzin po podaniu kapsułki.
Wchłanianie po podaniu doustnym jest prawie całkowite, a biodostępność po podaniu doustnym jest wysoka (80 - 100%) dla dawki 2,5 mg i 10 mg, niezależnie od przyjmowania na czczo lub
z posiłkiem. Przyjmowanie rywaroksabanu w dawce 2,5 mg i 10 mg z pokarmem nie wpływa na AUC ani na Cmax. Rywaroksaban, dla dawki 2,5 mg i 10 mg w postaci kapsułek może być przyjmowany w czasie jedzenia lub niezależnie od posiłku.
Farmakokinetyka rywaroksabanu jest prawie liniowa w zakresie dawek do około 15 mg raz na dobę. W większych dawkach obserwuje się wchłanianie ograniczane uwalnianiem rywaroksabanu, ze zmniejszoną biodostępnością i zmniejszonym współczynnikiem wchłaniania w miarę zwiększania dawki. Jest to bardziej widoczne w stanie na czczo niż po posiłku. Zmienność farmakokinetyki rywaroksabanu jest umiarkowana, ze zmiennością osobniczą (CV%) wynoszącą od 30% do 40%.
Wchłanianie rywaroksabanu zależy od miejsca jego uwalniania w przewodzie pokarmowym. Opisywano zmniejszenie AUC i Cmax odpowiednio o 29% i 56% w porównaniu z tabletką, w przypadku uwalniania granulatu rywaroksabanu w proksymalnym odcinku jelita cienkiego. Ekspozycja jest dalej zmniejszona w przypadku uwalniania rywaroksabanu w dystalnej części jelita cienkiego lub okrężnicy wstępującej. Z tego powodu należy unikać podawania rywaroksabanu dystalnie od żołądka, ponieważ może to prowadzić do zmniejszonego wchłaniania i powiązanej ekspozycji na rywaroksaban.
Dostępność biologiczna (AUC i Cmax) była porównywalna dla produktu Xanirva, 20 mg podawanego doustnie w postaci kapsułki, której zawartość wymieszano z przecierem jabłkowym z produktem referencyjnym Xarelto, 20 mg podawanym w postaci rozgniecionej tabletki, wymieszanej z przecierem jabłkowym. Biorąc pod uwagę przewidywalny, proporcjonalny do dawki profil farmakokinetyczny rywaroksabanu, wyniki dostępności biologicznej z tego badania mają prawdopodobnie zastosowanie dla mniejszych dawek rywaroksabanu.
Dystrybucja
U ludzi rywaroksaban w znacznym stopniu wiąże się z białkami osocza, w około 92% do 95%, głównie z albuminami. Objętość dystrybucji jest umiarkowana a Vss (objętość dystrybucji w stanie równowagi) wynosi około 50 litrów.
Metabolizm i eliminacja
Około 2/3 podanej dawki rywaroksabanu ulega przemianom metabolicznym, z czego połowa jest wydalana przez nerki, a druga połowa z kałem. Pozostała 1/3 podanej dawki rywaroksabanu,
w postaci niezmienionego związku, jest wydalana przez nerki z moczem, głównie poprzez aktywne wydzielanie nerkowe.
Rywaroksaban jest metabolizowany przez CYP3A4, CYP2J2 oraz w procesach niezależnych od CYP. Główne mechanizmy biotransformacji to oksydacyjny rozkład części morfolinonowej oraz hydroliza wiązań amidowych. Według badań przeprowadzonych in vitro, rywaroksaban jest substratem dla białek transportowych P-gp (glikoproteiny P) oraz białka Bcrp (ang. breast cancer resistance protein). Najważniejszym związkiem w ludzkim osoczu jest niezmieniony rywaroksaban; w krążeniu nie występują metabolity główne ani aktywne. Klirens ogólnoustrojowy wynosi około 10 l/h, więc rywaroksaban można uznać za substancję o małym klirensie. Po dożylnym podaniu dawki 1 mg okres półtrwania w fazie eliminacji wynosi około 4,5 godziny. Po doustnym podaniu eliminacja jest ograniczana szybkością wchłaniania. Eliminacja rywaroksabanu z osocza następuje z końcowym okresem półtrwania 5 do 9 godzin u młodych osób, a z końcowym okresem półtrwania 11 do13 godzin u osób w podeszłym wieku.
Szczególne populacje
Płeć
Nie stwierdzono żadnych istotnych klinicznie różnic we właściwościach farmakokinetycznych
i farmakodynamicznych pomiędzy mężczyznami i kobietami.
Pacjenci w podeszłym wieku
U pacjentów w podeszłym wieku stwierdzono większe stężenia leku w osoczu w porównaniu
z osobami młodszymi, a średnie wartości pola pod krzywą zależności stężenia od czasu (AUC) były około 1,5-krotnie większe, głównie z powodu zmniejszonego (pozornego) klirensu całkowitego i nerkowego. Nie ma potrzeby zmiany dawkowania.
Różnice w masie ciała
Dla skrajnych wartości masy ciała (< 50 kg lub > 120 kg) stwierdzano jedynie niewielki wpływ na stężenie rywaroksabanu w osoczu (mniej niż 25%). Nie ma potrzeby zmiany dawkowania.
Różnice między grupami etnicznymi
Nie obserwowano żadnych istotnych klinicznie różnic, w zakresie farmakokinetycznych
i farmakodynamicznych właściwości rywaroksabanu, pomiędzy pacjentami rasy kaukaskiej, afroamerykańskiej, latynoskiej, japońskiej lub chińskiej.
Zaburzenie czynności wątroby
U pacjentów z marskością przebiegającą z łagodnym zaburzeniem czynności wątroby (stopień A wg klasyfikacji Child Pugh), stwierdzono jedynie niewielkie zmiany farmakokinetyki rywaroksabanu (średnio 1,2-krotne zwiększenie AUC rywaroksabanu), prawie porównywalne do odpowiadającej zdrowej grupy kontrolnej.
U pacjentów z marskością i umiarkowanym zaburzeniem czynności wątroby (stopień B wg klasyfikacji Child Pugh) stwierdzono znaczące, 2,3-krotne zwiększenie średniego AUC rywaroksabanu w porównaniu do zdrowych ochotników. Wartość AUC dla niezwiązanego rywaroksabanu była 2,6-krotnie większa. U pacjentów z tej grupy, podobnie jak u pacjentów z umiarkowanym zaburzeniem czynności nerek stwierdzano zmniejszone wydalanie rywaroksabanu przez nerki. Brak jest danych dotyczących pacjentów z ciężkim zaburzeniem czynności wątroby.
W porównaniu do zdrowych ochotników, zahamowanie aktywności czynnika Xa było 2,6-krotnie silniejsze u pacjentów z umiarkowanym zaburzeniem czynności wątroby; podobnie PT był 2,1-krotnie wydłużony. Pacjenci z umiarkowanym zaburzeniem czynności wątroby byli bardziej podatni na działanie rywaroksabanu, co objawiało się bardziej stromym nachyleniem krzywej zależności PK/PD (farmakokinetyczno/farmakodynamicznej) pomiędzy stężeniem i PT.
Stosowanie produktu Xanirva jest przeciwwskazane u pacjentów z chorobą wątroby, która wiąże się z koagulopatią i ryzykiem krwawienia o znaczeniu klinicznym, w tym u pacjentów z marskością wątroby stopnia B i C wg klasyfikacji Child Pugh (patrz punkt 4.3).
Zaburzenie czynności nerek
Występowało zwiększenie ekspozycji na rywaroksaban skorelowane ze stopniem zaburzenia czynności nerek, co stwierdzono na podstawie oznaczeń klirensu kreatyniny. U pacjentów z łagodnym (klirens kreatyniny 50-80 ml/min), umiarkowanym (klirens kreatyniny 30-49 ml/min) oraz ciężkim (klirens kreatyniny 15-29 ml/min) zaburzeniem czynności nerek, stężenia rywaroksabanu w osoczu (AUC) były zwiększone 1,4-; 1,5- lub 1,6-krotnie. Odpowiednio, bardziej nasilone były efekty farmakodynamiczne. U pacjentów z łagodnym, umiarkowanym oraz ciężkim zaburzeniem czynności nerek, ogólne zahamowanie aktywności czynnika Xa było odpowiednio 1,5-, 1,9- i 2-krotnie silniejsze w porównaniu do zdrowych ochotników; podobnie jak 1,3; 2,2 i 2,4-krotnie bardziej wydłużony był PT. Brak jest danych pochodzących od pacjentów z klirensem kreatyniny <15 ml/min.
Ze względu na wysoki stopień wiązania z białkami osocza krwi nie należy spodziewać się, że rywaroksaban będzie ulegał dializie. Nie zaleca się stosowania produktu Xanirva u pacjentów z klirensem kreatyniny <15 ml/min. Należy zachować ostrożność stosując produkt Xanirva u pacjentów z klirensem kreatyniny 15-29 ml/min (patrz punkt 4.4).
Dane farmakokinetyczne u pacjentów
U pacjentów przyjmujących rywaroksaban 2,5 mg dwa razy na dobę w profilaktyce zdarzeń zakrzepowych na podłożu miażdżycowym u pacjentów z OZW, średnia geometryczna stężenia (przedział ufności 90%) w 2 do 4 godzin oraz około 12 godzin po podaniu (co w przybliżeniu odpowiada maksymalnemu i minimalnemu stężeniu w przerwie między dawkami) wynosiła odpowiednio 47 (13 - 123) i 9,2 (4,4 - 18) µg/l.
Zależność farmakokinetyczno-farmakodynamiczna
Zależność farmakokinetyczno-farmakodynamiczną (PK/PD) pomiędzy stężeniem rywaroksabanu
w osoczu i kilkoma farmakodynamicznymi (PD) punktami końcowymi (hamowanie czynnika Xa, PT, APTT, HepTest), oceniano w szerokim zakresie dawek (5-30 mg dwa razy na dobę). Zależność między stężeniem rywaroksabanu a aktywnością czynnika Xa najlepiej opisywał model Emax. Dla PT zwykle lepszy był model odcięcia liniowego. W zależności od tego, jaki odczynnik zastosowano do określenia PT, otrzymywano znaczące różnice w nachyleniu krzywej. Po zastosowaniu odczynnika Neoplastin, początkowy PT wynosił 13 s, a nachylenie krzywej około 3 do 4 s/(100 µg/l). Wyniki analiz PK/PD z badań II. i III. fazy były zgodne z wynikami uzyskanymi w badaniach z udziałem zdrowych ochotników.
Dzieci i młodzież
Nie ustalono bezpieczeństwa stosowania i skuteczności dla dzieci i młodzieży w wieku do 18 lat we wskazaniach OZW i CAD/PAD.
Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, toksyczności po podaniu jednokrotnym, fototoksyczności, genotoksyczności, potencjalnego działania rakotwórczego i toksyczności u młodych nie ujawniają żadnego szczególnego zagrożenia dla człowieka.
Skutki działania obserwowane w badaniach toksyczności po podaniu wielokrotnym wynikały głównie z nasilonej aktywności farmakodynamicznej rywaroksabanu. U szczurów, przy wartościach ekspozycji o znaczeniu klinicznym, obserwowano zwiększenie stężeń IgG i IgA w osoczu.
U szczurów nie obserwowano wpływu na płodność samców ani samic. W badaniach na zwierzętach stwierdzono toksyczny wpływ na reprodukcję, który wynikał z farmakologicznego mechanizmu działania rywaroksabanu (np. powikłania krwotoczne). Dla stężeń o znaczeniu klinicznym stwierdzano toksyczny wpływ na rozwój zarodka i płodu (poronienie, opóźnione lub przyspieszone kostnienie, mnogie, białawe plamki wątrobowe) i zwiększoną częstość występowania zwykłych wad rozwojowych, jak również zmiany w łożysku. W badaniach przed- i pourodzeniowych u szczurów, przy stosowaniu dawek toksycznych dla matek obserwowano obniżoną żywotność potomstwa.
Zawartość kapsułki: Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Hypromeloza
Sodu laurylosiarczan Magnezu stearynian
Osłonka kapsułki:
Żelatyna
Tytanu dwutlenek (E 171) Żółcień chinolinowa (E 104) Żółcień pomarańczowa S (E 110)
Tusz do nadruku, czarny Szelak
Żelaza tlenek czarny (E 172) Glikol propylenowy (E 1520) Amonowy wodorotlenek stężony Potasu wodorotlenek
Nie dotyczy.
2 lata
Blistry z folii PVC/PVDC/Aluminium: Przechowywać w temperaturze poniżej 30°C. Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią.
Blistry z folii OPA/Aluminium/PVC/Aluminium: Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Kapsułki twarde są pakowane w blistry z folii PVC/PVDC/Aluminium lub z folii OPA/Aluminium/PVC/Aluminium oraz tekturowe pudełko.
Wielkości opakowań: 28, 56 lub 100 kapsułek twardych.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie
z lokalnymi przepisami.
Wysypywanie zawartości kapsułek
Zawartość kapsułek rywaroksabanu można zawiesić w 50 ml wody i podawać przez zgłębnik nosowo- żołądkowy lub zgłębnik do żywienia dojelitowego po potwierdzeniu, że zgłębnik jest umieszczony w żołądku. Następnie zagłębnik należy przepłukać wodą. Ponieważ wchłanianie rywaroksabanu jest zależne od miejsca uwalniania substancji czynnej, należy unikać podawania rywaroksabanu dystalnie od żołądka, gdyż może to spowodować zmniejszone wchłanianie, a tym samym zmniejszoną ekspozycję na substancję czynną. Żywienie dojelitowe nie jest wymagane bezpośrednio po podaniu kapsułek 2,5 mg.
Zentiva, k.s.
U kabelovny 130, Dolní Měcholupy 102 37 Praga 10
Republika Czeska
Pozwolenie nr 25998
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 02.09.2020











