Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- Powoli wykonać wydech.
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania ASTMA
u pacjentów z niewystarczającą kontrolą objawów choroby za pomocą kortykosteroidów wziewnych oraz stosowanego doraźnie krótko działającego beta2-agonisty lub
u pacjentów, u których uzyskano odpowiednią kontrolę objawów choroby za pomocą zarówno kortykosteroidów wziewnych, jak i długo działających beta2-agonistów.
Produkt Fostex NEXThaler jest wskazany do stosowania u osób dorosłych.
POChP
Leczenie objawowe pacjentów z ciężką postacią przewlekłej obturacyjnej choroby płuc (POChP) (wartość FEV1 < 50% wartości należnej) oraz nawracającymi w przeszłości zaostrzeniami, u których występują wyraźne objawy choroby pomimo regularnego leczenia długo działającymi lekami rozszerzającymi oskrzela.
Dawkowanie i sposób podawania ASTMA
Zawartość opakowania
W celu sprawdzenia zawartości opakowania, patrz punkt 6.5.
Jeżeli zawartość opakowania różni się z opisem z punktu 6.5, inhalator należy zwrócić osobie, od której został nabyty i wymienić na nowy.
Ogólne ostrzeżenia i środki ostrożności
Nie należy wyjmować inhalatora z saszetki ochronnej, jeśli nie będzie od razu używany.
Inhalator należy stosować zgodnie ze wskazaniami.
Nie należy otwierać wieczka, jeśli nie jest konieczne zastosowanie kolejnej dawki z użyciem inhalatora.
Podczas gdy inhalator nie jest używany, należy go przechowywać w czystym i suchym miejscu.
Pod żadnym pozorem nie podejmować prób rozebrania inhalatora na części.
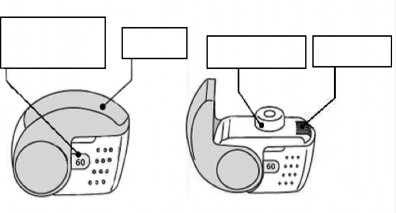
Główne cechy inhalatora
Ustnik
Otwór wlotu powietrza
Wieczko
Okienko licznika
W celu przyjęcia dawki za pomocą inhalatora należy wykonać trzy proste czynności: otworzyć, wykonać inhalację, zamknąć.
Przed użyciem nowego inhalatora
Otworzyć saszetkę i wyjąć inhalator.
Nie należy używać inhalatora, jeżeli saszetka nie jest szczelna lub jest uszkodzona
– inhalator należy zwrócić osobie, od której został nabyty i wymienić na nowy.
Na naklejce umiejscowionej na pudełku należy wpisać datę otwarcia saszetki.
Sprawdzić inhalator.
Jeżeli inhalator wygląda na zepsuty lub zniszczony, należy zwrócić go osobie, od której został nabyty i wymienić na nowy.
Sprawdzić okienko licznika dawek. Jeżeli inhalator jest nowy, licznik dawek będzie wskazywał „60”.
Nie należy używać nowego inhalatora, jeżeli w okienku licznika dawek widać liczbę mniejszą niż „60”. Należy zwrócić go osobie, od której został nabyty
Jak używać inhalator
Jeżeli pacjent nie jest pewien czy przyjął odpowiednią dawkę leku, należy skontaktować się z lekarzem lub farmaceutą.
Jeżeli pacjent nie ma pewności czy po wykonanej inhalacji licznik wskazuje liczbę inhalacji zmniejszoną o jeden, powinien poczekać do następnej planowanej inhalacji i przyjąć lek jak zwykle. Nie należy zażywać dodatkowej dawki.
Otwieranie
Uchwycić mocno inhalator w pozycji pionowej.
Należy sprawdzić liczbę pozostałych dawek: jakakolwiek liczba pomiędzy „1” a „60” wskazuje, że pozostały jeszcze w inhalatorze dawki leku.
Jeżeli licznik dawek wskazuje „0”, oznacza to, że nie pozostała już żadna dawka – należy usunąć inhalator i nabyć nowy.
Otworzyć całkowicie wieczko inhalatora.
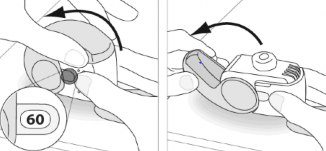
Przed wykonaniem inhalacji wykonać wydech na tyle głęboki, na ile jest to możliwe.
Nie wydychać powietrza przez inhalator.
Wykonanie inhalacji
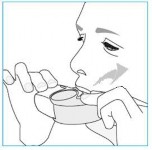
Jeśli to możliwe, w czasie inhalacji należy stać lub siedzieć w pozycji wyprostowanej.
Unieść inhalator, umieścić go w ustach i objąć ustnik wargami.
Trzymając inhalator nie wolno zatykać otworu wlotu powietrza.
Nie należy wykonywać inhalacji poprzez otwór wlotu powietrza.
Wykonać energiczny i głęboki wdech przez usta.
Podczas inhalowania dawki można poczuć charakterystyczny smak.
Podczas inhalowania dawki można usłyszeć i poczuć kliknięcie.
Nie należy wykonywać inhalacji przez nos.
Nie należy wyjmować inhalatora z ust podczas wykonywania inhalacji.
Wyjąć inhalator z ust.
Wstrzymać oddech na 5 do 10 sekund lub na tak długo, jak to możliwe.
Powoli wykonać wydech.
Nie należy wydychać powietrza przez inhalator.
Fostex NEXThaler, (200 mikrogramów + 12 mikrogramów)/dawkę inhalacyjną, proszek do inhalacji
Jedna dawka odmierzona zawiera:
200 mikrogramów beklometazonu dipropionianu oraz 12 mikrogramów formoterolu fumaranu dwuwodnego.
Odpowiada to dawce dostarczonej (dawka opuszczająca ustnik) zawierającej 173,9 mikrograma beklometazonu dipropionianu i 10,4 mikrogramów formoterolu fumaranu dwuwodnego.
Substancja pomocnicza o znanym działaniu:
Jedna dawka odmierzona zawiera 19,75 mg laktozy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek do inhalacji.
Biały lub prawie biały proszek.
Fostex NEXThaler jest wskazany w regularnym leczeniu astmy, wymagającym zastosowania produktu złożonego (wziewnego kortykosteroidu i długo działającego beta2-agonisty):
Fostex NEXThaler nie jest przeznaczony do stosowania w początkowym okresie leczenia astmy. Dawkowanie produktu Fostex NEXThaler należy ustalać indywidualne i należy dostosować je do stopnia ciężkości choroby. Należy wziąć to pod uwagę nie tylko w momencie rozpoczynania leczenia produktami złożonymi, ale także podczas ustalania dawki. Jeśli u pacjenta jest konieczne zastosowanie skojarzenia substancji czynnych w dawkach innych niż te dostępne w produkcie Fostex NEXThaler,
należy przepisać odpowiednie dawki beta2-agonistów i (lub) kortykosteroidów do podania za pomocą osobnych inhalatorów.
Z powodu rozmieszczenia w drogach oddechowych typowego dla cząsteczek o bardzo drobnych rozmiarach (ang. extrafine), konieczne jest dostosowanie dawkowania u pacjentów, u których zmieniono lek w postaci farmaceutycznej charakteryzującej się dużymi rozmiarami cząsteczek na Fostex NEXThaler w postaci proszku do inhalacji. U pacjentów zmieniających poprzednie leczenie należy brać pod uwagę, że całkowita dobowa dawka beklometazonu dipropionianu przy zastosowaniu produktu Fostex NEXThaler jest mniejsza niż w przypadku dotychczas stosowanych produktów zawierających beklometazonu dipropionian o większych rozmiarach cząsteczek i należy ją dostosować do indywidualnych potrzeb pacjenta. Jednak u pacjentów, u których zmieniono analogiczny lek
w postaci roztworu w ciśnieniowym aerozolu inhalacyjnym na Fostex NEXThaler w postaci proszku do inhalacji, nie jest konieczne dostosowywanie dawkowania.
Zalecane dawkowanie dla dorosłych w wieku 18 lat i starszych:
Jedna inhalacja dwa razy na dobę. Maksymalna dawka dobowa to 2 inhalacje.
Fostex NEXThaler (200 mikrogramów + 12 mikrogramów)/dawkę inhalacyjną należy stosować jedynie w terapii podtrzymującej. Inna moc produktu leczniczego Fostex NEXThaler
(100 mikrogramów + 6 mikrogramów)/dawkę inhalacyjną przeznaczona jest do terapii podtrzymującej i doraźnej.
Pacjenci powinni być regularnie poddawani kontroli lekarskiej, co pozwoli utrzymać optymalne dawkowanie produktu Fostex NEXThaler, o którego zmianie może zadecydować jedynie lekarz. Należy zalecić pacjentom, aby przyjmowali produkt Fostex NEXThaler codziennie, nawet w okresie bez objawów astmy.
POChP
Dawka zalecana u dorosłych w wieku 18 lat i powyżej:
Jedna inhalacja dwa razy na dobę. Maksymalna dawka dobowa to 2 inhalacje.
Szczególne grupy pacjentów
Nie ma konieczności dostosowywania dawkowania u pacjentów w podeszłym wieku.
Brak dostępnych danych dotyczących stosowania produktu Fostex NEXThaler u pacjentów z zaburzeniami czynności wątroby lub nerek (patrz punkt 5.2).
Dzieci i młodzież
Produkt leczniczy Fostex Nexthaler, (200 + 12) mikrogramów/dawkę inhalacyjną jest przeciwwskazany do stosowania u dzieci i młodzieży w wieku poniżej 18 lat.
Sposób podawania
Produkt leczniczy Fostex Nexthaler jest przeznaczony wyłącznie do podania wziewnego.
Inhalator w produkcie Fostex NEXThaler to inhalator aktywowany wdechem. Wykazano, że pacjenci z astmą o średnim i dużym nasileniu oraz pacjenci z POChP są w stanie wytworzyć na tyle silny przepływ wdechowy, aby uruchomić uwalnianie dawki leku z inhalatora (patrz punkt 5.1). Uwalnianie produktu Fostex NEXThaler nie zależy od natężenia przepływu powietrza, w zakresie przepływu wdechowego, jaki może być wygenerowany w inhalatorze przez tą populację pacjentów.
W celu zapewnienia skutecznego leczenia konieczne jest prawidłowe zastosowanie inhalatora. Należy zalecić pacjentowi, by dokładnie przeczytał ulotkę dla pacjenta oraz przestrzegał instrukcji stosowania w niej zawartej. Dla wygody lekarza prowadzącego, instrukcja ta zamieszczona została poniżej.
Jeżeli pacjent nie wykona inhalacji, liczba dawek widoczna w okienku na pojemniku nie powinna się zmienić po zamknięciu wieczka.
Należy poinstruować pacjenta, aby otwierał wieczko inhalatora jedynie w razie potrzeby.
W przypadku, gdy pacjent otworzył inhalator, lecz nie wykonał inhalacji, a następnie zamknął wieczko, dawka zostaje wycofana do pojemnika z proszkiem wewnątrz inhalatora i może być użyta bezpiecznie następna dawka.
Po inhalacji pacjenci powinni wypłukać jamę ustną i gardło wodą lub umyć zęby (patrz punkt 4.4).
INSTRUKCJA STOSOWANIA INHALATORA
i wymienić na nowy.
Zamykanie
Ponownie uchwycić inhalator w pozycji pionowej i zamknąć całkowicie wieczko.
Sprawdzić, czy licznik dawek wskazuje o jedną dawkę mniej.
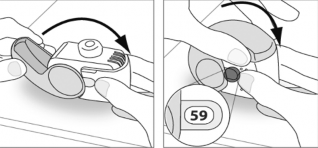
W przypadku konieczności zażycia kolejnej dawki, należy powtórzyć czynności od
E.1 do E.3
Czyszczenie
Zazwyczaj czyszczenie inhalatora nie jest konieczne.
Jeżeli to konieczne, po użyciu inhalator można wytrzeć suchą szmatką lub chusteczką.
o Nie należy czyścić inhalatora wodą lub innymi płynami. Przechowywać w suchym miejscu.
Przechowywanie i usuwanie
W celu uzyskania informacji na temat przechowywania i usuwania inhalatora, patrz punkt 6.4 i 6.6.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
Nadwrażliwość na substancje czynne, białka mleka lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
W celu zakończenia leczenia, zaleca się stopniowe zmniejszanie dawki. Nie należy nagle przerywać leczenia.
Leczenie astmy zazwyczaj powinno przebiegać z uwzględnieniem stopniowych zmian dawkowania, a monitorowanie reakcji pacjenta na leczenie powinno obejmować obserwację objawów klinicznych oraz badania czynnościowe płuc.
Jeśli pacjent uzna, że leczenie jest nieskuteczne, powinien zgłosić się do lekarza prowadzącego. Zwiększenie częstości stosowania doraźnych leków rozszerzających oskrzela wskazuje na zaostrzenie choroby podstawowej i wymaga ponownej oceny leczenia astmy. Nagłe i postępujące pogorszenie
kontroli objawów astmy może zagrażać życiu pacjenta, który powinien zostać poddany natychmiastowej kontroli lekarskiej. Należy rozważyć konieczność zwiększenia dawki kortykosteroidów w postaci wziewnej lub doustnej, lub zastosowania antybiotykoterapii w przypadku podejrzenia infekcji.
Nie należy rozpoczynać leczenia produktem Fostex NEXThaler podczas zaostrzenia objawów choroby lub w przypadku znacznego pogorszenia się lub zaostrzenia astmy. Podczas leczenia produktem Fostex NEXThaler mogą wystąpić ciężkie działania niepożądane związane z astmą oraz zaostrzenie astmy. Pacjentów należy pouczyć, aby kontynuowali leczenie, jednak w przypadku braku kontroli objawów astmy lub zaostrzenia objawów astmy po rozpoczęciu leczenia produktem Fostex NEXThaler powinni zgłosić się do lekarza prowadzącego.
Jak w przypadku innych leków podawanych wziewnie, może wystąpić paradoksalny skurcz oskrzeli z natychmiastowym nasileniem świszczącego oddechu, kaszlu i duszności po podaniu leku. Należy wówczas natychmiast zastosować szybko działający wziewny lek rozszerzający oskrzela. Należy natychmiast przerwać podawanie produktu Fostex NEXThaler, ocenić stan pacjenta i, w razie konieczności, zastosować leczenie alternatywne.
Produkt Fostex NEXThaler nie jest przeznaczony do rozpoczynania leczenia astmy.
Należy poradzić pacjentom, by w leczeniu ostrych napadów astmy stosowali doraźnie krótko działający lek rozszerzający oskrzela, który powinni mieć zawsze przy sobie.
Należy przypomnieć pacjentom o konieczności przyjmowania produktu Fostex NEXThaler codziennie, zgodnie z zaleceniami lekarza, nawet w okresie bez objawów choroby. Po opanowaniu objawów astmy, należy rozważyć stopniowe zmniejszanie dawki produktu Fostex NEXThaler. Ważna jest regularna obserwacja pacjentów w okresie zmniejszania dawki. Należy stosować najmniejszą skuteczną dawkę produktu (dostępna jest mniejsza moc produktu, Fostex NEXThaler
(100+6) mikrogramów/dawkę, proszek do inhalacji, patrz punkt 4.2).
Zapalenie płuc u pacjentów z POChP
U pacjentów z POChP otrzymujących wziewne kortykosteroidy zaobserwowano zwiększenie częstości występowania zapalenia płuc, w tym zapalenia płuc wymagającego hospitalizacji. Istnieją pewne dowody na zwiększone ryzyko wystąpienia zapalenia płuc wraz ze zwiększeniem dawki steroidów, ale nie zostało to jednoznacznie wykazane we wszystkich badaniach.
Nie ma jednoznacznych dowodów klinicznych na różnice między produktami zawierającymi wziewne kortykosteroidy, dotyczące stopnia ryzyka występowania zapalenia płuc.
Lekarze powinni szczególnie wnikliwie obserwować pacjentów z POChP, czy nie rozwija się u nich zapalenie płuc, ponieważ kliniczne objawy takich zakażeń oraz zaostrzenia POChP często się nakładają.
Do czynników ryzyka zapalenia płuc u pacjentów z POChP należą aktualne palenie tytoniu, starszy wiek, niski wskaźnik masy ciała (BMI) i ciężka postać POChP.
Kortykosteroidy wziewne mogą spowodować wystąpienie działań ogólnoustrojowych, szczególnie, jeśli są one stosowane w dużych dawkach przez długi okres. Wystąpienie tych działań jest znacznie mniej prawdopodobne niż w przypadku stosowania doustnych kortykosteroidów. Możliwe działania ogólnoustrojowe obejmują: zespół Cushinga, wystąpienie cech typowych dla zespołu Cushinga, zahamowanie czynności nadnerczy, opóźnienie wzrostu u dzieci i młodzieży, zmniejszenie gęstości mineralnej kości, zaćmę, jaskrę, oraz rzadziej zespół zaburzeń psychicznych lub zmian zachowania, w tym nadmierną aktywność psychoruchową, zaburzenia snu, niepokój, depresję lub zachowanie agresywne (szczególnie u dzieci). Z tego względu, ważne jest, by zmniejszyć dawkę kortykosteroidu wziewnego do najmniejszej dawki zapewniającej skuteczną kontrolę objawów astmy.
Długotrwałe leczenie dużymi dawkami kortykosteroidów wziewnych może spowodować zahamowanie czynności nadnerczy i ostry przełom nadnerczowy. Dzieci i młodzież w wieku poniżej 16 lat przyjmujące większe niż zalecane dawki beklometazonu dipropionianu mogą być szczególnie narażone na wystąpienie takiego działania. Ostry przełom nadnerczowy może być potencjalnie spowodowany przez: urazy, zabiegi chirurgiczne, infekcje i gwałtowne zmniejszenie dawkowania.
Objawy są zazwyczaj nietypowe i mogą to być: brak łaknienia, ból brzucha, zmniejszenie masy ciała,
zmęczenie, ból głowy, nudności, wymioty, niedociśnienie, zaburzenie świadomości, hipoglikemia
i napady drgawkowe. W okresach nasilonego stresu lub przed planowanym zabiegiem chirurgicznym, należy rozważyć dodatkowe zastosowanie kortykosteroidów działających ogólnoustrojowo.
U pacjentów, u których leczenie kortykosteroidami doustnymi zmieniono na leczenie kortykosteroidami wziewnymi, ryzyko zaburzeń czynności nadnerczy może utrzymywać się przez dłuższy okres. Ryzyko to może również dotyczyć pacjentów, którzy w przeszłości wymagali doraźnego podawania dużych dawek kortykosteroidów lub byli długotrwale leczeni dużymi dawkami wziewnych kortykosteroidów. Możliwość wystąpienia zaburzeń czynności nadnerczy należy zawsze brać pod uwagę w przypadku nagłych sytuacji lub planowanych zabiegów wywołujących stres; należy wówczas rozważyć podanie odpowiednich kortykosteroidów. Przed przystąpieniem do planowanych zabiegów chirurgicznych może być konieczna konsultacja ze specjalistą, który oceni stopień zaburzeń czynności nadnerczy.
Należy zachować ostrożność podczas stosowania produktu Fostex NEXThaler u pacjentów z aktywną lub nieaktywną gruźlicą płuc oraz grzybiczymi i wirusowymi zakażeniami dróg oddechowych.
Produkt Fostex NEXThaler należy stosować z zachowaniem ostrożności (z uwzględnieniem możliwości monitorowania stanu pacjenta) u pacjentów z zaburzeniami rytmu serca, szczególnie blokiem przedsionkowo-komorowym trzeciego stopnia i tachyarytmiami, samoistnym podzastawkowym zwężeniem aorty, przerostową kardiomiopatią z zawężeniem drogi odpływu, niedokrwienną chorobą serca, ciężką niewydolnością serca, ciężkim nadciśnieniem tętniczym
i tętniakiem.
Należy także zachować ostrożność w trakcie leczenia pacjentów z rozpoznanym lub podejrzewanym wydłużeniem odstępu QTc, zarówno wrodzonym, jak i wywołanym lekami (QTc > 0,44 sekund).
Formoterol może powodować wydłużenie odstępu QTc.
Należy także zachować ostrożność podczas stosowania produktu Fostex NEXThaler u pacjentów z tyreotoksykozą, cukrzycą, guzem chromochłonnym i niewyrównaną hipokaliemią.
Leczenie beta2-agonistą może powodować potencjalnie ciężką hipokaliemię. Należy zachować szczególną ostrożność w leczeniu ciężkiej astmy, ponieważ ryzyko wystąpienia hipokaliemii może ulec zwiększeniu pod wpływem niedotlenienia. Hipokaliemia może także ulec nasileniu przez jednoczesne stosowanie innych leków, które mogą ją wywołać, takich jak pochodne ksantyny, steroidy i leki moczopędne (patrz punkt 4.5). Zaleca się także zachować ostrożność w przypadku niestabilnej astmy, kiedy to istnieje możliwość stosowania doraźnie wielu leków rozszerzających oskrzela. Zaleca się, by w takich sytuacjach kontrolować stężenie potasu w surowicy.
Inhalacja formoterolu może spowodować zwiększenie stężenia glukozy we krwi. Z tego względu należy ściśle kontrolować stężenie glukozy we krwi u pacjentów chorych na cukrzycę.
Jeśli planowane jest znieczulenie za pomocą halogenowych środków znieczulających, należy upewnić się, że pacjent nie przyjmował produktu Fostex NEXThaler przez co najmniej 12 godzin przed rozpoczęciem znieczulenia, ze względu na ryzyko zaburzeń rytmu serca.
W celu zmniejszenia ryzyka grzybiczego zakażenia jamy ustnej i gardła oraz dysfonii, należy zalecić pacjentom dokładne płukanie jamy ustnej i gardła wodą oraz mycie zębów po inhalacji przepisanej dawki.
Zaburzenia widzenia
Zaburzenie widzenia może wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
Ten produkt leczniczy zawiera laktozę. Laktoza zawiera niewielkie ilości białek mleka, które mogą powodować reakcje alergiczne.
Interakcje farmakokinetyczne
Beklometazonu dipropionian jest bardzo szybko metabolizowany z udziałem esteraz.
Metabolizm beklometazonu w mniejszym stopniu zależy od CYP3A niż w przypadku innych kortykosteroidów i interakcje są raczej mało prawdopodobne, jednak nie można wykluczyć wystąpienia działań ogólnoustrojowych po jednoczesnym stosowaniu silnie działających inhibitorów CYP3A (np. rytonawir, kobicystat). Z tego względu zaleca się ostrożność i właściwe monitorowanie podczas stosowania tych leków.
Interakcje farmakodynamiczne
U pacjentów z astmą należy unikać podawania leków beta-adrenolitycznych (w tym w postaci kropli do oczu). Jeśli z konieczności pacjenci z astmą otrzymują leki beta-adrenolityczne, działanie formoterolu będzie zmniejszone lub zahamowane.
Stosowanie innych leków beta-adrenergicznych może spowodować sumowanie się działania, dlatego też należy zachować ostrożność podczas stosowania formoterolu jednocześnie z teofiliną lub innymi lekami beta-adrenergicznymi.
Jednoczesne podawanie z chinidyną, dyzopiramidem, prokainamidem, fenotiazynami, niektórymi lekami przeciwhistaminowymi (np. terfenadyną), inhibitorami monoaminooksydazy
i trójpierścieniowymi lekami przeciwdepresyjnymi, może wydłużać odstęp QTc i zwiększać ryzyko komorowych zaburzeń rytmu.
Ponadto, L-dopa, L-tyroksyna, oksytocyna i alkohol mogą zaburzać tolerancję serca na leki beta2-sympatykomimetyczne.
Jednoczesne podawanie z inhibitorami monoaminooksydazy lub lekami o podobnych właściwościach, takimi jak furazolidon i prokarbazyna, może wywołać nadciśnienie tętnicze krwi.
Istnieje zwiększone ryzyko wystąpienia zaburzeń rytmu serca u pacjentów jednocześnie poddawanych znieczuleniu za pomocą halogenowych węglowodorów.
Jednoczesne podawanie z pochodnymi ksantyny, steroidami lub lekami moczopędnymi może nasilać działanie hipokaliemiczne beta2-agonistów (patrz punkt 4.4). Hipokaliemia może zwiększyć skłonność do występowania zaburzeń rytmu serca u pacjentów leczonych glikozydami naparstnicy.
Ciąża
Brak odpowiednich danych klinicznych dotyczących stosowania produktu Fostex NEXThaler u kobiet w ciąży. W badaniach na zwierzętach z zastosowaniem beklometazonu dipropionianu w skojarzeniu
z formoterolem wykazano szkodliwy wpływ na reprodukcję oraz płód po podaniu dużych dawek o działaniu ogólnoustrojowym (patrz punkt 5.3). Wiadomo, że podawanie ciężarnym zwierzętom
dużych dawek kortykosteroidów powoduje zaburzenia rozwoju płodu, w tym rozszczep podniebienia oraz opóźnienie rozwoju wewnątrzmacicznego. Ze względu na działanie tokolityczne beta2- sympatykomimetyków, należy zachować szczególną ostrożność w okresie od zajścia w ciążę aż do porodu. Nie należy zalecać stosowania formoterolu kobietom w ciąży, szczególnie w końcowym okresie ciąży, ani w czasie porodu, chyba że nie istnieje żadna inna (bezpieczniejsza) alternatywa.
Produkt Fostex NEXThaler należy podawać w okresie ciąży tylko wówczas, gdy spodziewane korzyści przewyższają możliwe ryzyko.
Karmienie piersią
Brak odpowiednich danych klinicznych dotyczących stosowania produktu Fostex NEXThaler u kobiet karmiących piersią.
Mimo braku danych z badań na zwierzętach, uzasadnione jest założenie, że podobnie jak inne kortykosteroidy, beklometazonu dipropionian przenika do mleka ludzkiego.
Nie wiadomo, czy formoterol przenika do mleka ludzkiego, jednak został on wykryty w mleku karmiących zwierząt.
Należy podjąć decyzję, czy przerwać karmienie piersią czy przerwać podawanie produktu Fostex NEXThaler, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla kobiety.
Płodność
Brak danych u ludzi. W badaniach na zwierzętach stosowanie dużych dawek beklometazonu dipropionianu było związane ze zmniejszoną płodnością samic szczurów oraz toksycznym działaniem na płód (patrz punkt 5.3).
Fostex NEXThaler nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Profil bezpieczeństwa produktu Fostex NEXThaler w postaci proszku do inhalacji został głównie określony na podstawie produktu o mocy 100 mikrogramów + 6 mikrogramów.
Najczęściej występującym działaniem niepożądanym jest drżenie. W trwającym 12 tygodni badaniu klinicznym produktu Fostex NEXThaler (100+6) mikrogramów/dawkę, drżenie obserwowano jedynie w schemacie z zastosowaniem największych dawek (400+24) mikrogramy/na dobę, częściej występowało na początku leczenia i było łagodne. Żaden pacjent nie został wyłączony z badania
z powodu drżenia.
Dane z badań klinicznych u pacjentów z astmą
Bezpieczeństwo stosowania produktu Fostex NEXThaler (100+6) mikrogramów/dawkę oceniano w badaniach klinicznych z aktywnym komparatorem i z placebo w grupie kontrolnej, w których
badany lek podawano 719 pacjentom w wieku od 12 lat, z astmą o różnym stopniu nasilenia. Częstość występowania działań niepożądanych, które przedstawiono w tabeli poniżej, dotyczy pacjentów
w wieku 12 lat i starszych, i została podana na podstawie oceny bezpieczeństwa stosowania leku w dwóch kluczowych badaniach klinicznych, w których produkt Fostex NEXThaler (100+6) mikrogramów/dawkę podawano zgodnie z dawkowaniem zalecanym w Charakterystyce Produktu Leczniczego, przez okres 8-12 tygodni. W badaniach klinicznych produktu Fostex NEXThaler (100+6) mikrogramów/dawkę nie obserwowano zaburzeń psychicznych, jednak zostały one wymienione w tabeli, jako potencjalnie możliwe działania niepożądane dotyczące całej grupy kortykosteroidów wziewnych.
Poniżej wymieniono działania niepożądane związane z beklometazonu dipropionianem
i formoterolem, podawanymi w skojarzeniu (w produkcie Fostex NEXThaler), z uwzględnieniem klasyfikacji układów i narządów. Częstość występowania działań niepożądanych określono następująco: bardzo często (≥1/10), często (1/100 do <1/10), niezbyt często (1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1000) i bardzo rzadko (<1/10 000), nieznana (nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Działanie niepożądane | Częstość występowania |
Zakażenia i zarażenia pasożytnicze | Zapalenie jamy nosowej i gardła | Niezbyt często |
Kandydoza jamy ustnej | Niezbyt często | |
Zapalenie płuc (u pacjentów z POChP) | Często | |
Zaburzenia metabolizmu i odżywiania | Hipertriglicerydemia | Niezbyt często |
Zaburzenia psychiczne | Nadmierna aktywność psychoruchowa, zaburzenia snu, niepokój, depresja, agresja, zmiany w zachowaniu (głównie u dzieci) | Częstość nieznana |
Zaburzenia oka | Nieostre widzenie (patrz także punkt 4.4.) | Częstość nieznana |
Zaburzenia układu nerwowego | Drżenie | Często |
Ból głowy | Niezbyt często | |
Zaburzenia serca | Częstoskurcz | Niezbyt często |
Bradykardia zatokowa | Niezbyt często | |
Dławica piersiowa | Niezbyt często | |
Niedokrwienie mięśnia sercowego | Niezbyt często | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Podrażnienie gardła, zaostrzenie astmy | Niezbyt często |
Duszność | Niezbyt często | |
Ból gardła | Niezbyt często | |
Dysfonia | Niezbyt często | |
Kaszel | Niezbyt często | |
Zaburzenia żołądka i jelit | Nudności | Niezbyt często |
Zaburzenia ogólne i stany w miejscu podania | Zmęczenie | Niezbyt często |
Drażliwość | Niezbyt często | |
Badania diagnostyczne | Wydłużenie odstępu QT w elektrokardiogramie | Niezbyt często |
Zmniejszone stężenie wolnego kortyzolu w moczu | Niezbyt często | |
Zmniejszone stężenie kortyzolu we krwi | Niezbyt często | |
Zwiększone stężenie potasu we krwi | Niezbyt często | |
Zwiększone stężenie glukozy we krwi | Niezbyt często | |
Słaba progresja załamka R w EKG | Niezbyt często |
Spośród obserwowanych działań niepożądanych, działania niepożądane zazwyczaj związane
z podawaniem formoterolu to: drżenie, ból głowy, częstoskurcz, bradykardia zatokowa, dławica piersiowa, niedokrwienie mięśnia sercowego, wydłużenie odstępu QT.
Spośród obserwowanych działań niepożądanych, działania niepożądane zazwyczaj związane
z podawaniem beklometazonu dipropionianu to: zapalenie jamy nosowej i gardła, kandydoza jamy
ustnej, dysfonia, podrażnienie gardła, drażliwość, zmniejszone stężenie wolnego kortyzolu w moczu, zmniejszone stężenie kortyzolu we krwi, zwiększone stężenie glukozy we krwi.
Do działań niepożądanych, których nie obserwowano w badaniach klinicznych produktu Fostex NEXThaler (100+6) mikrogramów/dawkę, ale które zwykle są związane z podawanym wziewnie beklometazonu dipropionianem, należą inne zakażenia grzybicze jamy ustnej i zapalenie płuc.
W trakcie leczenia kortykosteroidami wziewnymi, w pojedynczych przypadkach zgłaszano zaburzenia smaku.
W punkcie 4.4 podano, w jaki sposób można zmniejszyć ryzyko wystąpienia zakażeń grzybiczych jamy ustnej, kandydozy jamy ustnej oraz dysfonii.
Ogólnoustrojowe działania kortykosteroidów wziewnych (np. beklometazonu dipropionianu) mogą wystąpić, zwłaszcza podczas długotrwałego stosowania dużych dawek. Należą do nich: zespół Cushinga, wystąpienie cech typowych dla zespołu Cushinga, zahamowanie czynności nadnerczy, zmniejszenie gęstości mineralnej kości, opóźnienie wzrostu u dzieci i młodzieży, zaćma i jaskra (patrz również punkt 4.4).
Inne działania niepożądane, których nie obserwowano w badaniach klinicznych z zastosowaniem terapeutycznych dawek produktu Fostex NEXThaler (100+6) mikrogramów/dawkę, lecz które zwykle związane są z podawaniem beta2-agonistów, takich jak formoterol, to: kołatanie serca, migotanie przedsionków, dodatkowe skurcze komorowe, tachyarytmia, potencjalnie ciężka hipokaliemia
i zwiększenie lub zmniejszenie ciśnienia tętniczego krwi. W pojedynczych przypadkach podczas leczenia formoterolem w postaci wziewnej obserwowano bezsenność, zawroty głowy, niepokój oraz lęk. Formoterol może również powodować skurcze oraz ból mięśni.
Zgłaszano reakcje nadwrażliwości, w tym wysypki, pokrzywkę, świąd, rumień oraz obrzęk oczu, twarzy, warg i gardła (obrzęk naczynioruchowy).
Jak w przypadku innych leków podawanych wziewnie, może wystąpić paradoksalny skurcz oskrzeli z natychmiastowym nasileniem świszczącego oddechu, kaszlu i duszności po podaniu leku (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Największa zalecana dawka produktu Fostex NEXThaler, która może być podana jednorazowo to 1 inhalacja.
U pacjentów z astmą badano działanie produktu w postaci roztworu w ciśnieniowym aerozolu inhalacyjnym, podawanego wziewnie w ilości do 12 skumulowanych inhalacji, każda o mocy (100+6) mikrogramów/dawkę (łącznie 1200 mikrogramów beklometazonu dipropionianu
i 72 mikrogramy formoterolu podane w pojedynczej dawce). Leczenie skumulowanymi dawkami nie miało negatywnego, klinicznie znaczącego wpływu na parametry życiowe, nie obserwowano też poważnych lub ciężkich działań niepożądanych.
Zastosowanie zbyt dużych dawek formoterolu może prowadzić do wystąpienia działań typowych dla agonistów receptorów beta2-adrenergicznych: nudności, wymiotów, bólu głowy, drżenia, senności, kołatania serca, częstoskurczu, arytmii komorowych, wydłużenia odstępu QTc, kwasicy metabolicznej, hipokaliemii, hiperglikemii.
W razie przedawkowania formoterolu wskazane jest leczenie podtrzymujące i objawowe.
W ciężkich przypadkach pacjentów należy hospitalizować. Można rozważyć zastosowanie kardioselektywnych leków blokujących receptory beta-adrenergiczne, jednak wyłącznie zachowując szczególną ostrożność, ponieważ zastosowanie leku blokującego receptory beta-adrenergiczne może wywołać skurcz oskrzeli. Należy kontrolować stężenie potasu w surowicy.
W przypadku wziewnego zastosowania większych niż zalecane dawek beklometazonu dipropionianu może wystąpić okresowe zahamowanie czynności nadnerczy. Nie wymaga to działań doraźnych, ponieważ czynność nadnerczy powraca do normy po kilku dniach, co potwierdzają badania stężenia kortyzolu w osoczu. U tych pacjentów należy kontynuować leczenie dawkami zapewniającymi kontrolę objawów astmy.
W przypadku długotrwałego stosowania wziewnego zbyt dużych dawek beklometazonu dipropionianu istnieje ryzyko zahamowania czynności nadnerczy (patrz punkt 4.4). Może być konieczne monitorowanie czynności nadnerczy. Leczenie należy kontynuować stosując dawkę zapewniającą kontrolę objawów astmy.
Dipropionian beklometazonu i formoterol zawarte w produkcie leczniczym Fostex NEXThaler (100+6) mikrogramów/dawkę, stosowane u pacjentów z POChP, i przyjmowane w dawce pojedynczej większej niż terapeutyczna, wynoszącej odpowiednio do 800 mikrogramów oraz do 48 mikrogramów, są na ogół bezpieczne i dobrze tolerowane.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Grupa farmakoterapeutyczna: leki adrenergiczne, stosowane wziewnie: leki adrenergiczne w połączeniu z glikokortykosteroidami lub innymi lekami z wyjątkiem leków przeciwcholinergicznych
Kod ATC: R03AK08
Mechanizm działania i działanie farmakodynamiczne
Produkt Fostex NEXThaler zawiera beklometazonu dipropionian i formoterol w postaci suchego proszku, który podawany jest w postaci aerozolu cząsteczek o bardzo drobnych rozmiarach (ang. extrafine) ze średnią wartością mediany rozkładu cząsteczek ze względu na ich średnicę (MMAD – ang. Mass Median Aerodynamic Diameter) równą 1,4 – 1,7 mikrometra, i charakteryzujących się równomiernym osadzaniem w płucach obu składników. Rozpylane cząsteczki produktu Fostex NEXThaler są zwykle znacznie mniejsze niż cząsteczki rozpylane z innych postaci farmaceutycznych, w których nie zastosowano technologii extrafine.
Przeprowadzone u osób dorosłych z astmą badanie ze znakowanym radioaktywnie lekiem Fostex Nexthaler (100+6) mikrogramów/dawkę, dotyczące jego depozycji w płucach, wykazało, że duży odsetek leku (szacunkowo 42% dawki nominalnej) dostaje się do płuc z równomiernym osadzaniem w drogach oddechowych. Taka charakterystyka dystrybucji leku uzasadnia zastosowanie małej dawki kortykosteroidu przy jednoczesnym nasileniu miejscowego działania farmakodynamicznego, co wykazano, że jest równoważne z odpowiadającym mu lekiem w postaci ciśnieniowego aerozolu inhalacyjnego.
Dwie substancje czynne produktu Fostex NEXThaler wykazują różny mechanizm działania. Podobnie, jak w przypadku innych skojarzeń kortykosteroidów wziewnych z agonistami receptorów beta2-
adrenergicznych, łączne działanie tych składników prowadzi do zmniejszenia częstości zaostrzeń astmy.
Beklometazonu dipropionian
Beklometazonu dipropionian, stosowany wziewnie w zalecanych dawkach, wykazuje glikokortykosteroidowe działanie przeciwzapalne w obrębie płuc, co w rezultacie powoduje zmniejszenie nasilenia objawów oraz częstości występowania zaostrzeń astmy, przy jednocześnie mniejszej częstości występowania działań niepożądanych w porównaniu do kortykosteroidów podawanych ogólnoustrojowo.
Formoterol
Formoterol jest selektywnym agonistą receptorów beta2-adrenergicznych, powodującym rozkurcz mięśni gładkich oskrzeli u pacjentów z odwracalną obturacją dróg oddechowych. Działanie rozszerzające oskrzela występuje szybko, w ciągu 1 do 3 minut po inhalacji, i utrzymuje się przez 12 godzin po podaniu dawki.
Dane z badań klinicznych
ASTMA (terapia podtrzymująca)
Skuteczność obu składników produktu Fostex NEXThaler w postaci proszku do inhalacji oceniano na podstawie produktu o mocy (100+6) mikrogramów/dawkę, u pacjentów z przewlekłą astmą
o nasileniu od umiarkowanego do ciężkiego w trzech osobnych badaniach klinicznych, porównując go z produktem w postaci roztworu w ciśnieniowym aerozolu inhalacyjnym, zawierającym 100 mikrogramów beklametazonu dipropionianu i 6 mikrogramów formoterolu. W zasadzie oczekiwano, że skuteczność obydwu wziewnych produktów będzie równoważna w praktyce klinicznej, zarówno
z zastosowaniem 1 inhalacji dwa razy na dobę, jak i z zastosowaniem 2 inhalacji 2 razy na dobę.
Głównym celem jednego z badań była ocena skuteczności kortykosteroidu wziewnego, wchodzącego w skład leku, mierzona stopniem rozszerzania oskrzeli (natężona objętość wydechowa pierwszosekundowa mierzona przed podaniem leku - FEV1 [ang. Forced Expiratory Volume]).
Klinicznie istotne zwiększenie wartości FEV1 mierzonych przed podaniem leku, w porównaniu do wartości zmierzonych przed rozpoczęciem badania, obserwowano u 696 pacjentów z umiarkowaną lub ciężką astmą objawową, po 3 miesiącach terapii z zastosowaniem 1 inhalacji dwa razy na dobę oraz 2 inhalacji dwa razy na dobę, dla obydwu postaci farmaceutycznych. Obserwowano średnie zwiększenie o co najmniej 250 ml. Nie odnotowano klinicznie istotnych różnic w wartości FEV1 pomiędzy produktem Fostex NEXThaler (100+6) mikrogramów/dawkę w postaci proszku do inhalacji a produktem w postaci roztworu w ciśnieniowym aerozolu inhalacyjnym, w żadnym z zastosowanych schematów dawkowania. Zaobserwowano znaczącą zależność dawka-odpowiedź dla porannych pomiarów PEF (ang. Peak Expiratory Flow, szczytowy przepływ wydechowy). Nie odnotowano statystycznie istotnej zależności dawka-odpowiedź dla wartości FEV1 mierzonych przed podaniem leku. Wskaźniki stopnia kontroli astmy, takie jak punktowa ocena objawów astmy występujących rano i wieczorem lub odsetek dni bez objawów astmy, poprawiały się znacząco od chwili rozpoczęcia leczenia do jego zakończenia, szczególnie w przypadku dwóch dużych dawek obydwu produktów.
Podstawowym celem drugiego badania była ocena skuteczności długo działającego beta2-agonisty, wchodzącego w skład produktu Fostex NEXThaler (100+6) mikrogramów/dawkę. W badaniu tym mierzono rozszerzanie oskrzeli zaraz po podaniu pojedynczej dawki oraz do 12 godzin od podania pojedynczej dawki, za pomocą seryjnych pomiarów spirometrycznych FEV1 (wartość AUC FEV1 przez co najmniej 80% czasu trwania działania formoterolu). Jedna inhalacja, jak i cztery inhalacje obydwu substancji czynnych produktu Fostex NEXThaler (100+6) mikrogramów/dawkę, znacząco zwiększały wartość AUC0-12 FEV1, w porównaniu do placebo. Obydwie stosowane dawki produktu Fostex NEXThaler w postaci proszku do inhalacji były nie gorsze od odpowiadającym im dawkom produktu leczniczego w postaci roztworu w ciśnieniowym aerozolu inhalacyjnym. Dla obu postaci farmaceutycznych zaobserwowano statystycznie istotną zależność dawka-odpowiedź między małą a dużą dawką.
W trzecim badaniu, po 4-tygodniowym okresie wstępnym z zastosowaniem produktu złożonego zawierającego beklometazonu dipropionian oraz formoterol w postaci roztworu w ciśnieniowym aerozolu inhalacyjnym, w dawce 1 inhalacja 2 razy na dobę, 755 kontrolowanych pacjentów z astmą zostało losowo przydzielonych do 8-tygodniowego leczenia tym samym produktem złożonym, co
w okresie wstępnym, produktem Fostex NEXThaler (100+6) mikrogramów/dawkę w postaci proszku do inhalacji oraz beklometazonu dipropionianem w postaci proszku do inhalacji o mocy 100 mikrogramów/dawkę inhalacyjną, w dawce 1 inhalacja 2 razy na dobę w każdym z wymienionych przypadków. Głównym celem badania była zmiana średniego porannego szczytowego przepływu wydechowego (PEF) obserwowanego przez cały okres leczenia, w stosunku do wartości początkowej. Po 8 tygodniach leczenia nie zaobserwowano różnicy w zakresie pierwszorzędowego punktu końcowego pomiędzy złożonymi produktami wziewnymi. Wyniki dla każdego z nich były znacząco lepsze niż w przypadku monoterapii beklometazonem dipropionianu. Nie zaobserwowano różnic pomiędzy produktem zawierającym beklometazonu dipropionian oraz formoterol w postaci roztworu w ciśnieniowym aerozolu inhalacyjnym a produktem Fostex NEXThaler w postaci proszku do inhalacji w odniesieniu do objawów astmy ocenianych za pomocą punktacji w kwestionariuszu kontroli astmy, a także liczby dni wolnych od leczenia doraźnego (ratunkowego).
POChP
Przeprowadzono otwarte kontrolowane badanie kliniczne z zastosowaniem placebo w celu potwierdzenia, że na przepływ wdechowy, jaki może być wygenerowany w inhalatorze NEXThaler, nie wpływa wiek pacjenta oraz choroba i stopień jej nasilenia, a zatem aktywacja i uwolnienie leku z urządzenia są możliwe dla wszystkich pacjentów. Głównym punktem końcowym badania był odsetek pacjentów w obrębie każdej grupy wiekowej i rodzaju choroby, zdolnych aktywować inhalator. W badaniu uczestniczyło 89 pacjentów w wieku od 5 do 84 lat, w tym pacjenci z astmą
o umiarkowanym i ciężkim nasileniu (FEV1 odpowiednio > 60% i ≤ 60% wartości należnej) oraz pacjenci z umiarkowaną i ciężką POChP (FEV1 50% i < 50% wartości należnej). Wszyscy pacjenci, niezależnie od wieku, rodzaju oraz nasilenia choroby, byli w stanie wytworzyć wystarczający przepływ wdechowy do aktywowania inhalatora NEXThaler.
U pacjentów z łagodną do ciężkiej postacią POChP przeprowadzono dodatkowe badanie otwarte, kontrolowane placebo, w celu oceny profilu inhalacji z zastosowaniem produktu leczniczego Fostex NEXThaler (100+6) mikrogramów/dawkę.
Wszyscy pacjenci we wszystkich podgrupach, niezależnie od ich ograniczenia funkcjonalnego, byli w stanie skutecznie uruchomić i posługiwać się inhalatorem.
Beklometazonu dipropionian
Beklometazonu dipropionian jest prolekiem o słabym powinowactwie do receptorów glikokortykosteroidowych. Ulega hydrolizie z udziałem esteraz do aktywnego metabolitu beklometazonu 17-monopropionianu, który wykazuje silniejsze miejscowe działanie przeciwzapalne w porównaniu do proleku, beklometazonu dipropionianu.
Wchłanianie, dystrybucja i metabolizm
Beklometazonu dipropionian podany wziewnie jest szybko wchłaniany z płuc; przed wchłonięciem następuje jego intensywna przemiana do aktywnego metabolitu, beklometazonu 17-monopropionianu z udziałem esteraz, które są obecne w większości tkanek. Dostępność ogólnoustrojowa aktywnego metabolitu jest wynikiem wchłaniania z płuc i wchłaniania z przewodu pokarmowego połkniętej części dawki. Biodostępność połkniętej części dawki beklometazonu dipropionianu jest nieznaczna, jednak w wyniku przemiany do beklometazonu 17-monopropionianu, zachodzącej przed dostaniem się do krwioobiegu, część dawki jest wchłaniana jako aktywny metabolit.
Zwiększanie wziewnej dawki prowadzi do w przybliżeniu liniowego zwiększenia narażenia ogólnoustrojowego.
Bezwzględna biodostępność po podaniu wziewnym, za pomocą inhalatora ciśnieniowego, odmierzającego dawki, wynosi około 2% i 62% nominalnej dawki, odpowiednio dla niezmienionego beklometazonu dipropionianu i beklometazonu 17-monopropionianu.
Po podaniu dożylnym, rozmieszczenie beklometazonu dipropionianu i jego aktywnego metabolitu charakteryzuje duży klirens osoczowy (odpowiednio 150 i 120 l/h), przy niewielkiej objętości dystrybucji beklometazonu dipropionianu w stanie stacjonarnym (20 l) i większej dystrybucji do tkanek jego aktywnego metabolitu (424 l). Głównym produktem (82%) przemian metabolicznych beklometazonu dipropionianu jest aktywny metabolit, beklometazonu 17-monopropionian.
Stopień wiązania się z białkami osocza jest umiarkowanie duży (87%).
Eliminacja
Beklometazonu dipropionian jest wydalany w większości z kałem, głównie w postaci polarnych metabolitów. Wydalanie beklometazonu dipropionianu i jego metabolitów z moczem jest minimalne. Okres półtrwania w fazie eliminacji wynosi 0,5 h i 2,7 h, odpowiednio dla beklometazonu dipropionianu i beklometazonu 17-monopropionianu.
Szczególne grupy pacjentów
Nie badano farmakokinetyki beklometazonu dipropionianu u pacjentów z zaburzeniami czynności nerek lub wątroby; jednakże ze względu na to, że beklometazonu dipropionian jest bardzo szybko metabolizowany z udziałem esteraz obecnych w soku jelitowym, surowicy, płucach i wątrobie, do bardziej polarnych produktów: beklometazonu 21-monopropionianu, beklometazonu 17- monopropionianu i beklometazonu, nie oczekuje się, by zaburzenia czynności wątroby zmieniały farmakokinetykę i profil bezpieczeństwa beklometazonu dipropionianu.
Beklometazonu dipropionianu i jego metabolitów nie wykryto w moczu i dlatego nie należy spodziewać się zwiększenia ogólnoustrojowego narażenia na produkt u pacjentów z zaburzeniami czynności nerek.
Formoterol
Wchłanianie i dystrybucja
Po podaniu wziewnym, formoterol jest wchłaniany zarówno z płuc, jak i z przewodu pokarmowego. Część dawki połkniętej podczas inhalacji z użyciem inhalatora ciśnieniowego z dozownikiem (MDI: Metered Dose Inhaler), może wynosić od 60% do 90% dawki. Co najmniej 65% połkniętej dawki wchłania się z przewodu pokarmowego. Maksymalne stężenie w osoczu leku w postaci niezmienionej osiągane jest w ciągu 0,5 do 1 godziny po podaniu doustnym. Formoterol wiąże się z białkami osocza w 61 – 64%, z czego 34% wiąże się z albuminami. W zakresie stężeń osiąganych po podaniu dawek leczniczych nie dochodzi do wysycenia miejsc wiązania. Po podaniu doustnym okres półtrwania
w fazie eliminacji wynosi 2 do 3 godzin. Wchłanianie formoterolu przebiega liniowo po podaniu wziewnym dawek od 12 do 96 μg formoterolu fumaranu.
Metabolizm
Formoterol jest intensywnie metabolizowany, głównie poprzez bezpośrednie wiązanie z grupą hydroksylofenolową. Produkt wiązania z kwasem glukuronowym jest nieaktywny. Drugim
w kolejności procesem biotransformacji jest O-demetylacja, po której następuje sprzęganie z grupą 2’-hydroksylofenolową. W procesie O-demetylacji formoterolu uczestniczą izoenzymy cytochromu P450: CYP2D6, CYP2C19 i CYP2C9. Wydaje się, że głównym miejscem przemian metabolicznych
jest wątroba. Formoterol w stężeniach mających znaczenie lecznicze nie hamuje aktywności enzymów CYP450.
Eliminacja
Skumulowane wydalanie formoterolu z moczem po podaniu wziewnym pojedynczej dawki suchego proszku za pomocą inhalatora zwiększało się liniowo dla dawek od 12 do 96 μg. Średnio, wydalane było odpowiednio 8% i 25% dawki formoterolu niezmienionego i dawki całkowitej. Na podstawie pomiaru stężeń w osoczu, wykonanych u 12 zdrowych ochotników po podaniu wziewnym pojedynczej dawki wynoszącej 120 μg, ustalono, że średni okres półtrwania w fazie eliminacji wynosi 10 godzin. Enancjomery (R,R) i (S,S) stanowiły odpowiednio około 40% i 60% dawki leku w postaci niezmienionej wydalonego z moczem. Względny stosunek obu enancjomerów nie zmieniał się
w zakresie badanych dawek i nie stwierdzono dowodów na zwiększoną kumulację jednego enancjomeru względem drugiego po podaniu dawek wielokrotnych.
Po podaniu doustnym (40 do 80 g) leku zdrowym ochotnikom, 6% do 10% dawki jest wydalane w postaci niezmienionej z moczem; do 8% dawki wydalane było w postaci glukuronidu.
W sumie 67% doustnej dawki formoterolu jest wydalane z moczem (głównie w postaci metabolitów), a pozostała część dawki jest wydalana z kałem. Klirens nerkowy formoterolu wynosi 150 ml/min.
Szczególne grupy pacjentów
Zaburzenia czynności wątroby i (lub) nerek: nie badano farmakokinetyki formoterolu u pacjentów z zaburzeniami czynności wątroby lub nerek.
Dane z badań klinicznych
Ogólnoustrojowa ekspozycja na beklometazonu dipropionian i formoterol podawane w skojarzeniu, porównywano z ekspozycją na każdy ze składników podawany oddzielnie. Nie ma dowodów na występowanie interakcji farmakokinetycznych i farmakodynamicznych (ogólnoustrojowych) między beklometazonu dipropionianem a formoterolem.
W badaniu farmakokinetycznym, z zastosowaniem pojedynczej dawki, u zdrowych ochotników, oceniano dostępność płuc (przy użyciu techniki bloku węglowego) i całkowitą ekspozycję ogólnoustrojową (bez bloku węglowego) produktu Fostex NEXThaler (200+12) mikrogramów/dawkę w postaci proszku do inhalacji w porównaniu ze skojarzeniem beklometazonu dipropionianu
i formoterolu fumaranu dwuwodnego o mocy (100+6) mikrogramów/dawkę w postaci proszku do inhalacji (DPI).
Wyniki tego badania wskazują, że całkowita ekspozycja ogólnoustrojowa i dostępność płucna formoterolu, BDP i B17MP są zasadniczo takie same po podaniu CHF 1535 200/12 DPI (2 inhalacje) vs. CHF 1535 100/6 DPI (4 inhalacje): 90% CI współczynników leczenia (200/12 vs. 100/6) dla wszystkich pierwotnych zmiennych PK (AUC0-t i Cmax dla FF, BDP i B17MP z blokiem węglowym
i bez) były całkowicie zawarte w 80-125% zakresu akceptacji dla biorównoważności.
Badania toksyczność przeprowadzone na zwierzętach, z zastosowaniem beklometazonu dipropionianu z formoterolem w skojarzeniu lub osobno, pokazały głównie skutki związane z nadmierną aktywnością farmakologiczną. Były one związane z immunosupresyjną aktywnością beklometazonu dipropionianu i znanymi działaniami formoterolu na układ sercowo-naczyniowy widocznymi głównie u psów. Po podaniu obu substancji czynnych, w skojarzeniu lub osobno, nie zaobserwowano ani wzrostu toksyczności, ani wystąpienia nieoczekiwanych wyników.
Badania wpływu na reprodukcję, prowadzone na szczurach wykazały, że działanie zależy od dawki.
Podawanie dużych dawek beklometazonu dipropionianu wiązało się ze zmniejszeniem płodności
u samic oraz zmniejszeniem prawdopodobieństwa zagnieżdżenia zarodka oraz działaniem toksycznym na rozwój zarodka i płodu zwierząt. Wiadomo, że podawanie dużych dawek kortykosteroidów ciężarnym samicom zwierząt, powoduje nieprawidłowy rozwój płodu, w tym rozszczep podniebienia
i wewnątrzmaciczne zahamowanie wzrostu. Prawdopodobnie działania te, obserwowane po podaniu produktu złożonego zawierającego beklometazonu dipropionian oraz formoterol, są spowodowane przez beklometazonu dipropionian. Działania te stwierdzono jedynie w przypadku dużego ogólnoustrojowego narażenia na aktywny metabolit beklometazonu 17-monopropionian (200 razy większe od oczekiwanego stężenia w osoczu pacjentów). Ponadto, w badaniach na zwierzętach obserwowano wydłużenie czasu trwania ciąży oraz porodu, co jest związane z tokolitycznym działaniem leków beta2-sympatykomimetycznych. Działania te zaobserwowano przy wartościach stężeń formoterolu w osoczu samic, które były mniejsze niż stężenia spodziewane u pacjentów leczonych produktem Fostex NEXThaler.
W badaniach genotoksyczności, przeprowadzonych z zastosowaniem skojarzenia beklometazonu dipropionianu z formoterolem, nie stwierdzono mutagennego działania. Nie przeprowadzono badań dotyczących rakotwórczego działania proponowanego skojarzenia obu substancji czynnych. Jednakże, dane uzyskane z badań przeprowadzonych na zwierzętach dla każdej z tych substancji, nie wskazują na ryzyko wystąpienia działania rakotwórczego u ludzi.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Laktoza jednowodna Magnezu stearynian
Nie dotyczy.
2 lata.
Okres ważności po pierwszym otwarciu saszetki wynosi 6 miesięcy.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią. Inhalator należy wyjmować z saszetki tylko bezpośrednio przed użyciem.
Przed pierwszym otwarciem saszetki:
Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego.
Po pierwszym otwarciu saszetki:
Nie przechowywać w temperaturze powyżej 25°C.
Jedno opakowanie zawiera 1, 2 lub 3 inhalatory Nexthaler, z których każdy zapewnia dostarczenie 60 dawek leku. Każdy inhalator z ABS umieszczony jest w torebce PET/Aluminium/PE lub Poliamid/Aluminium/PE z zamknięciem z PP. Całość w tekturowym pudełku.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Fostex NEXThaler to wielodawkowe urządzenie do inhalacji. Obudowa inhalatora składa się z niżej znajdującego się pojemnika, na którym jest okienko, w którym wyświetla się ilość pozostałych dawek, oraz połączonego z nim wieczka. Podczas otwierania, wieczko, które również uruchamia mechanizm licznika dawek, odkrywa ustnik, przez który inhalowany jest lek. Dolna część inhalatora oraz ustnik wykonane są z kopolimeru akrylonitrylowo-butadienowo-styrenowego, natomiast górna część inhalatora (wieczko) wykonane jest z polipropylenu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
Chiesi Farmaceutici S.p.A., Via Palermo 26/A,
43122 Parma, Włochy
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
Pozwolenie nr
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











