Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
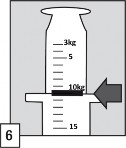
Mały znak podziałki odpowiada masie 1 kg, tzn: 0,25 mg midazolamu,
Średni znak podziałki odpowiada masie 5 kg, tzn: 1,25 mg midazolamu,
Duży znak podziałki odpowiada masie 10 kg, tzn: 2,5 mg midazolamu
Dla pacjentów o masie ciała powyżej 40 kg do uzyskania odpowiedniej dawki potrzebne są 2 ampułki. Minimalna dawka do pobrania z ampułki powinna odpowiadać dawce na 3 kg masy ciała. W przypadku pacjentów o masie ciała 41 i 42 kg, wymagających użycia więcej niż jednej ampułki, należy pobrać z pierwszej ampułki dawkę na mniej niż 40 kg i uzupełnić lekiem z drugiej ampułki do wymaganej dawki z drugiej ampułki, patrz przykłady poniżej:
W przypadku pacjenta o masie ciała 41 kg zaleca się pobranie dawki na 30 kg z pierwszej ampułki i dawki na 11 kg z drugiej ampułki
W przypadku pacjenta o masie ciała 42 kg zaleca się pobranie dawki na 30 kg z pierwszej ampułki i dawki na 12 kg z drugiej ampułki.
Przeciwwskazania
nadwrażliwością na substancję czynną, benzodiazepiny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1,
miastenią,
ciężką niewydolnością układu oddechowego,
nieprawidłowością anatomiczną układu oddechowego lub chorobą płuc,
zespołem bezdechu sennego,
ciężkimi zaburzeniami czynności wątroby.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Leki przeciwgrzybicze z grupy azoli: ketokonazol, itrakonazol, worykonazol, flukonazol, posakonazol.
Inhibitory proteazy HIV: sakwinawir i inne inhibitory proteazy, w tym leki złożone zawierające rytonawir.
Antybiotyki makrolidowe: klarytromycyna, erytromycyna, telitromycyna, roksytromycyna; roksytromycyna zwiększa o 30% okres półtrwania w fazie końcowej midazolamu podawanego doustnie w postaci tabletek.
Leki blokujące kanały wapniowe: diltiazem, werapamil; werapamil i diltiazem zwiększają stężenie midazolamu w osoczu odpowiednio trzy- i czterokrotnie oraz wydłużają okres półtrwania w fazie końcowej odpowiednio o 41% i 49%.
Antagoniści receptorów substancji P: aprepitant; aprepitant powoduje zależne od dawki zwiększenie stężenia w osoczu midazolamu podawanego doustnie, stężenie w osoczu jest zwiększane 3,3-krotnie po podaniu dawki 80 mg/dobę aprepitantu, a jego okres półtrwania w fazie końcowej zostaje wydłużony około 2-krotnie.
Antagoniści H2: cymetydyna, ranitydyna.
Selektywne inhibitory wychwytu zwrotnego serotoniny: fluwoksamina.
Leki przeciwcholinergiczne: propiweryna.
Inne leki (atorwastatyna, nefazodon, aprepitant, iwakaftor).
Produkty roślinne: sok grejpfrutowy, jeżówka purpurowa Echinacea purpurea, kurkuma.
Substancje indukujące aktywność CYP3A4:
Antybiotyki z grupy ryfamycyn: ryfampicyna; ryfampicyna zmniejsza stężenie doustnego midazolamu w osoczu o 96% u osób zdrowych, powodując niemal całkowite ustąpienie działania psychomotorycznego midazolamu.
Leki przeciwpadaczkowe: karbamazepina, fenytoina; wielokrotne podawanie karbamazepiny lub fenytoiny zmniejsza stężenie w osoczu midazolamu po podaniu doustnym nawet o 90% i skraca okres półtrwania w fazie końcowej eliminacji o 60%.
Inhibitory odwrotnej transkryptazy: efawirenz; stosunek α-hydroksymidazolamu (metabolit wytwarzany przez CYP3A4) zwiększa się pięciokrotnie w stosunku do midazolamu, potwierdzając działanie efawirenzu indukujące aktywność CYP3A4.
Ziele dziurawca zwyczajnego (Hypericum perforatum)
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
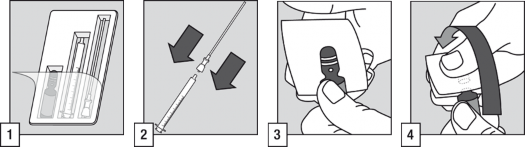
Podanie produktu leczniczego pacjentowi wymaga użycia ampułki, wężyka z filtrem i aplikatora doustnego.
Założyć wężyk z filtrem na końcówkę aplikatora doustnego.
Postukać górną części ampułki, aby cały płyn spłynął na dół. Okryć górną część ampułki bibułką i chwycić ją, umieszczając kciuk jednej ręki na białej kropce.
Mocno przytrzymać ampułkę skierowaną białą kropką do góry i w stronę użytkownika. Nacisnąć od siebie górę ampułki, która łatwo się odłamie.
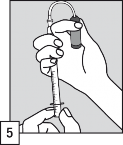
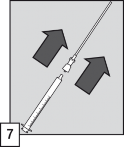
Umieścić wężyk z filtrem w ampułce. Przed pobraniem dawki i w celu wyeliminowania ewentualnego powietrza z wężyka z filtrem, zalecane jest krótkie pompowanie aplikatorem (napełnianie i opróżnianie) roztworu wewnątrz ampułki.
Trzymając ampułkę w pozycji pionowej, napełnić aplikator doustny do oznaczenia podziałki odpowiadającego masie ciała pacjenta w kilogramach (kg). Wyrównać znak linii z górną częścią kołnierza, aby pobrać właściwą dawkę.
Zdjąć wężyk z filtrem z końcówki aplikatora doustnego.
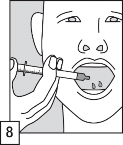
Opróżnić zawartość aplikatora doustnego do jamy ustnej pacjenta. Niezwłocznie połknąć roztwór.
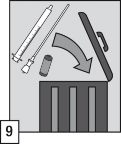
Po użyciu wyrzucić ampułkę, wężyk z filtrem, aplikator doustny i wszelkie niewykorzystane resztki produktu leczniczego do pojemnika przygotowanego do tego celu zgodnie z lokalnymi przepisami dotyczącymi substancji kontrolowanych i akcesoriów farmaceutycznych.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
OZASED, 2 mg/ml, roztwór doustny w pojemniku jednodawkowym
Każdy ml produktu leczniczego OZASED zawiera 2 mg midazolamu.
Każda ampułka 5 ml produktu leczniczego OZASED zawiera 10 mg midazolamu.
Substancje pomocnicze o znanym działaniu: etanol (mniej niż 100 mg na ampułkę), sód (mniej niż 1 mmol (23 mg) na ampułkę), gammadeks (400 mg na ampułkę i mniej niż dozwolone narażenie wynoszące 20 mg/kg mc/dobę w zalecanej dawce).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór doustny w pojemniku jednodawkowym.
Przejrzysty lub lekko opalizujący roztwór, jasnożółty lub lekko brązowy, o odczynie pH od 3,6 do 4,2.
Produkt leczniczy OZASED jest wskazany u niemowląt, dzieci i młodzieży w wieku od 6 miesięcy do 17 lat w umiarkowanej sedacji przed zabiegiem leczniczym lub diagnostycznym w celu złagodzenia lęku, niepokoju i pobudzenia związanego z zabiegiem lub jako premedykacja przed podaniem znieczulenia.
Produkt leczniczy OZASED roztwór doustny powinien być podawany wyłącznie przez fachowy personel medyczny.
Należy przestrzegać ogólnych wytycznych dotyczących pozostawania na czczo przez pacjenta przed sedacją.
Dawkowanie
Dawkę należy dostosować do masy ciała pacjenta.
Produkt leczniczy OZASED należy stosować doustnie w pojedynczej dawce 0,25 mg/kg mc. u dzieci i młodzież w wieku od sześciu miesięcy. Nie zaleca się natychmiastowego podania kolejnej dawki (patrz punkt 5.2).
.
Maksymalna dawka nie powinna przekraczać 20 mg midazolamu (co odpowiada 2 ampułkom) nawet u dzieci i młodzieży o masie ciała powyżej 80 kg.
Produkt leczniczy OZASED jest wskazany do podania w pojedynczej dawce i brak jest dostępnych danych dotyczących powtórzonego podania produktu leczniczego OZASED.
W przypadku otyłych dzieci i młodzieży dawkę należy podawać zgodnie z rzeczywistą masą ciała i nie przekraczać 20 mg.
Dawkę należy dostosować do masy ciała pacjenta. Aplikator doustny ma podziałkę w kilogramach, od 3 kg do 40 kg masy ciała (patrz punkt 6.6, nr 6), z trzema typami znaków podziałki:
Szczególne grupy pacjentów
Pacjenci z zaburzeniami czynności nerek
Produkt leczniczy OZASED należy stosować ostrożnie u pacjentów z przewlekłą niewydolnością nerek, ponieważ eliminacja midazolamu może być opóźniona i jego działanie może być przedłużone.
Pacjenci z zaburzeniami czynności wątroby
Zaburzenia czynności wątroby zmniejszają klirens midazolamu, co wydłuża jego okres półtrwania w fazie końcowej (do eliminacji) oraz zwiększa biodostępność. Konieczne jest uważne monitorowanie tych działań i parametrów czynności życiowych po podaniu midazolamu tym pacjentom (patrz punkt 4.4).
U pacjentów z ciężkim zaburzeniem czynności wątroby stosowanie produktu leczniczego OZASED jest przeciwwskazane (patrz punkt 4.3).
Dzieci i młodzież
Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego OZASED u dzieci w wieku poniżej sześciu miesięcy. Dane nie są dostępne
Sposób podawania
Produkt leczniczy OZASED jest przeznaczony do podawania doustnego i należy go podawać wyłącznie za pomocą specjalnego aplikatora doustnego z podziałką w kg.
Produkt leczniczy OZASED należy podawać około na 30 minut przed zabiegiem lub znieczuleniem. Aplikator doustny i wężyk z filtrem to sprzęt jednorazowego użytku służący do pobrania i podania dawki.
Po użyciu ampułkę, aplikator doustny i wężyk z filtrem należy wyrzucić. Pełne instrukcje podano w punkcie 6.6.
W przypadku pacjentów z:
Midazolam powinien być podawany wyłącznie przez fachowy personel medyczny, w miejscu w pełni wyposażonym w sprzęt do monitorowania i wspomagania czynności układu oddechowego i sercowo- naczyniowego oraz przez osoby przeszkolone w zakresie rozpoznawania i leczenia spodziewanych działań niepożądanych, w tym prowadzenia resuscytacji krążeniowo-oddechowej. Zgłaszano ciężkie działania niepożądane krążeniowo-oddechowe. Obejmowały one depresję oddechową, bezdech, zatrzymanie oddechu i (lub) zatrzymanie krążenia. Wystąpienie takich zagrażających życiu incydentów jest bardziej prawdopodobne po podaniu dużej dawki.
Podawanie produktu leczniczego pacjentom z grupy wysokiego ryzyka
Midazolam należy stosować ostrożnie u pacjentów z przewlekłą niewydolnością oddechową, ponieważ może on zaostrzać depresję oddechową.
Midazolam należy stosować ostrożnie u pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby, niewydolnością serca lub przewlekła niewydolnością nerek. Midazolam lub jego metabolit mogą kumulować się u pacjentów z przewlekłą niewydolnością nerek lub niewydolnością wątroby, a klirens midazolamu może być zmniejszony u pacjentów z niewydolnością krążenia.
Doustny midazolam należy stosować ostrożnie u pacjentów ze złym ogólnym stanem zdrowia, ponieważ są oni bardziej wrażliwi na działanie benzodiazepin na ośrodkowy układ nerwowy.
Modyfikacja eliminacji midazolamu
Doustny midazolam należy stosować ostrożnie u pacjentów leczonych produktami leczniczymi, o których wiadomo, że hamują lub indukują aktywność CYP3A4 (patrz punkt 4.5).
Jednoczesne stosowanie alkoholu/substancji o działaniu depresyjnym na ośrodkowy układ nerwowy Należy unikać jednoczesnego stosowania midazolamu i alkoholu lub substancji o działaniu depresyjnym na ośrodkowy układ nerwowy. Takie połączenie prawdopodobnie zwiększa efekty kliniczne działania midazolamu, co może spowodować głęboką sedację lub klinicznie istotną depresję oddechową (patrz punkt 4.5).
Alkoholizm lub uzależnienie od narkotyków w wywiadzie
Podobnie jak inne benzodiazepiny, należy unikać stosowania midazolamu u pacjentów z alkoholizmem lub uzależnieniem od narkotyków w wywiadzie.
Amnezja
Midazolam powoduje niepamięć następczą.
Warunki wypisania pacjenta ze szpitala
Pacjenci, którym podano midazolam, powinni przebywać w towarzystwie osoby dorosłej po wypisaniu ze szpitala i opuścić salę zabiegową i szpital dopiero po całkowitym ustąpieniu działania uspokajającego oraz wyłącznie po uzyskaniu zezwolenia od lekarza.
Substancje pomocnicze:
W zalecanej pojedynczej dawce wynoszącej 0,25 mg/kg mc. (przy maksymalnej pojedynczej dawce wynoszącej 20 mg), ilość podanego gammadeksu wynosi 10 mg/kg mc. (przy maksymalnej pojedynczej dawce wynoszącej 800 mg). Ta ilość gammadeksu jest mniejsza niż dopuszczalne narażenie (200 mg/kg mc./dobę i 20 mg/kg mc./dobę u dzieci poniżej 2 roku życia). Dlatego też, nawet jeśli produkt leczniczy OZASED zostanie nieumyślnie podany w dawce 0,5 mg/kg mc., dawka gammadeksu nie przekroczy dopuszczalnego dobowego narażenia.
Lek zawiera mniej niż 1 mmol (23 mg) sodu na ampułkę, to znaczy lek uznaje się za „wolny od sodu”.
Ten lek zawiera maksymalnie 17,4 mg alkoholu (etanolu, składnik o smaku pomarańczowym) w każdej jednostce dawkowania, ampułce o poj. 5 ml, co jest równoważne 3,5 mg/ml (etanol/roztwór) lub 0,32% w/v.
Ilość etanolu w 1 ampułce o poj. 5 ml tego leku (17,4 mg) jest równoważna 0,2 ml wina. Ilość etanolu w 2 ampułkach o poj. 5 ml tego leku (34,8 mg) jest równoważna 0,4 ml wina przy maksymalnej dawce 20 mg midazolamu.
Mała ilość alkoholu w tym leku nie będzie powodowała zauważalnych skutków..
Interakcje farmakokinetyczne z produktami leczniczymi
Ponieważ midazolam jest metabolizowany głównie przez izoenzym CYP3A4, inhibitory i leki indukujące aktywność CYP3A4 mogą odpowiednio zwiększać lub zmniejszać stężenia midazolamu w osoczu a co za tym idzie jego działanie kliniczne może być zwiększone lub zmniejszone, a okres działania może być wydłużony lub skrócony. Dlatego zaleca się uważne monitorowanie działania klinicznego i parametrów czynności życiowych pacjenta po podaniu midazolamu z inhibitorem izoenzymu CYP3A4, nawet po pojedynczej dawce.
W przypadku hamowania lub nieodwracalnego zahamowania aktywności izoenzymu CYP3A4, wpływ na farmakokinetykę midazolamu może utrzymywać się od kilku dni do kilku tygodni po podaniu leku modulującego aktywność CYP3A4 (np. klarytromycyny, erytromycyny, inhibitorów proteazy HIV, werapamilu, diltiazemu, atrowastatyny, aprepitantu).
Podczas jednoczesnego podawania z etynylestradiolem i norgestrelem stosowanymi jako doustne środki antykoncepcyjne, narażenie na midazolam nie ulega znaczącej zmianie.
Inhibitory aktywności CYP3A4:
Nie wiadomo, czy midazolam zmienia farmakokinetykę innych produktów leczniczych. Interakcje farmakodynamiczne z innymi produktami leczniczymi
Jednoczesne podawanie midazolamu z innymi środkami uspokajającymi/nasennymi i substancjami o
działaniu depresyjnym na ośrodkowy układ nerwowy może nasilać zwiększać sedację i depresję oddechową.
Do takich środków uspokajających/nasennych należą: alkohol (w tym produkty lecznicze zawierające alkohol), opiaty/opioidy (jeśli stosowane jako środki przeciwbólowe, leki przeciwkaszlowe lub leki zamienne), leki przeciwpsychotyczne, inne benzodiazepiny stosowane jako anksjolityki lub leki nasenne, barbiturany, propofol, ketamina, etomidat, leki przeciwdepresyjne o działaniu uspokajającym, leki przeciwhistaminowe, przeciwpadaczkowe i działające ośrodkowo leki przeciwnadciśnieniowe). Midazolam obniża minimalne stężenie wziewnych środków znieczulających w pęcherzykach płucnych (ang. minimum alveolar concentration, MAC).
Należy bezwzględnie unikać połączonego działania alkoholu i midazolamu oraz bezwzględnie unikać spożywania alkoholu podczas podawania midazolamu (patrz punkt 4.4 i punkt 4.9).
Ciąża
Brak wystarczających danych, które umożliwiałyby ocenę bezpieczeństwa stosowania midazolamu u kobiet w okresie ciąży. Badania na zwierzętach nie wskazują na działanie teratogenne, jednak podobnie jak w przypadku innych benzodiazepin obserwowano działanie toksyczne na płód. Brak dostępnych danych dotyczących ekspozycji na midazolam w pierwszych dwóch trymestrach ciąży.
Zgłaszano występowanie działań niepożądanych u matki i płodu w przypadku podania wysokich dawek midazolamu w ostatnim trymestrze ciąży, w trakcie porodu lub jako premedykacji przed znieczuleniem przed cesarskim cięciem (ryzyko dotyczące narażenia inhalacyjnego u matki, nieprawidłowości w tętnie płodu, hipotonia, słaby odruch ssania, hipotermia i depresja oddechowa u noworodka).
Co więcej, u niemowląt urodzonych przez matki, które otrzymywały benzodiazepiny przewlekle podczas ostatniego etapu ciąży, może rozwinąć się uzależnienie fizyczne i może się to wiązać z pewnym ryzykiem wystąpienia objawów odstawienia w okresie pourodzeniowym.
W rezultacie, midazolam może być stosowany w okresie ciąży, jeżeli jest to ewidentnie konieczne, zaleca się jednak unikania stosowania go przed wykonaniem cesarskiego cięcia.
Przy rozważaniu podania midazolamu z powodów chirurgicznych pod koniec ciąży należy wziąć pod uwagę ryzyko dla noworodka.
Karmienie piersią
Midazolam przenika w małych ilościach do mleka kobiet. Matkom karmiącym piersią należy zalecić przerwanie karmienia piersią na 24 godziny po podaniu midazolamu.
Płodność
Badania na zwierzętach nie wykazały szkodliwego wpływu na reprodukcję (patrz punkt 5.3).
Produkt leczniczy OZASED wywiera znaczny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Uspokojenie polekowe, amnezja następcza, zaburzona zdolność koncentracji i zaburzona funkcja mięśni mogą chwilowo niekorzystnie wpływać na zdolność prowadzenia pojazdów lub obsługiwania maszyn. Przed podaniem produktu leczniczego OZASED pacjenta należy ostrzec, aby nie prowadził pojazdów ani nie używał maszyn do czasu całkowitego ustąpienia działania produktu leczniczego. Lekarz musi zdecydować, kiedy pacjent może wznowić te czynności. Zaleca się, aby pacjent przebywał w towarzystwie osoby dorosłej podczas powrotu do domu po wypisaniu ze szpitala.
Podczas podawania midazolamu obserwowano następujące reakcje niepożądane o nieznanej częstości występowania, których częstość nie może być określona na podstawie dostępnych danych:
Klasyfikacja układów i narządów | Działanie niepożądane leku – częstość nieznana |
Zaburzenia serca | Tachykardia, bradykardia. |
Zaburzenia psychiczne | Reakcje paradoksalne (pobudzenie, ekscytacja, omamy, agresywność, odhamowanie, dysforia, zachowanie niepożądane, lęk), zaburzenia snu, mimowolne ruchy, akatyzja, niestabilność chodu, drżenie. |
Zaburzenia układu nerwowego | Długotrwałe/nadmierne uspokojenie, ospałość, senność, zawroty głowy, ataksja, zawroty głowy pochodzenia błędnikowego, dyzartria, suchość w jamie ustnej, nadmierne wydzielanie śliny, moczenie się, ból głowy, amnezja następcza. |
Zaburzenia oka | (Zazwyczaj niewielkie) Niewyraźne widzenie, diplopia |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Hipoksemia, przejściowe desaturacje, skurcz krtani, depresja oddechowa, niedrożność dróg oddechowych, rzężenia/głośne oddychanie, czkawka, duszność. |
Zaburzenia żołądka i jelit | Wymioty, nudności. |
Zaburzenia skóry i tkanki podskórnej | Świąd, pokrzywka, wysypka skórna. |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Zaburzona kontrola mięśniowa. |
Zaburzenia ogólne i stany w miejscu podania | Nietypowa męczliwość, uczucie osłabienia. |
Zaburzenia układu immunologicznego | Nadwrażliwość/obrzęk naczynioruchowy. |
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy
Jak wszystkie benzodiazepiny, midazolam często powoduje senność, ataksję, dyzartrię i oczopląs. Przedawkowanie midazolamu rzadko zagraża życiu, jeśli produkt jest przyjmowany w monoterapii, jednak przedawkowanie może powodować arefleksję, bezdech, hipotensję, depresję krążeniowo- oddechową i w rzadkich przypadkach śpiączkę. Działania depresyjne benzodiazepin na układ oddechowy są poważniejsze u pacjentów z chorobami układu oddechowego lub chorobami serca lub jeśli lek jest podawany w skojarzeniu z innymi lekami powodującymi depresję ośrodkowego układu nerwowego, w tym z alkoholem.
Postępowanie
W większości przypadków konieczne jest monitorowanie parametrów czynności życiowych.
W razie przedawkowania należy zwrócić szczególną uwagę na funkcje układu oddechowego i sercowo- naczyniowego na oddziale intensywnej opieki medycznej.
Po przedawkowaniu należy wywołać wymioty (jak najszybciej i w ciągu godziny od podania midazolamu), jeżeli pacjent jest przytomny, lub przeprowadzić płukanie żołądka z ochroną dróg oddechowych, jeśli pacjent jest nieprzytomny. Jeśli płukanie żołądka nie jest skuteczne, należy podać węgiel aktywny, aby zmniejszyć wchłanianie.
Flumazenil, antagonista benzodiazepin, jest wskazany w razie ciężkiego zatrucia, któremu towarzyszy depresja oddechowa lub śpiączka. Leczenie to powinno być przeprowadzane wyłącznie pod ścisłą obserwacją. Okres półtrwania flumazenilu jest krótki (około godziny), co oznacza, że monitorowanie jest wymagane po ustąpieniu jego działania. Należy zachować najwyższą ostrożność podczas stosowania flumazenilu w przypadku przedawkowania po jednoczesnym podaniu pacjentowi różnych leków oraz u
pacjentów z padaczką, którzy otrzymali już benzodiazepiny. Flumazenil należy stosować wyłącznie z zachowaniem najwyższej ostrożności u pacjentów otrzymujących trójpierścieniowe leki przeciwdepresyjne lub leki epileptogenne oraz u pacjentów z zaburzeniami EKG (wydłużenie odstępu QRS lub odstępu QT).
Grupa farmakoterapeutyczna: benzodiazepiny, kod ATC: N05CD08 Mechanizm działania
Midazolam jest pochodną leków z grupy imidazobenzodiazepin. Działania farmakologiczne
benzodiazepin wynikają z odwracalnych interakcji z receptorem kwasu gamma-aminomasłowego (GABA) benzodiazepin w ośrodkowym układzie nerwowym, głównym neuroprzekaźnikiem o działaniu hamującym w ośrodkowym układzie nerwowym.
Działania farmakodynamiczne
Właściwości farmakodynamiczne midazolamu i jego metabolitów, które są podobne do metabolitów innych benzodiazepin, obejmują działanie uspokajające, przeciwlękowe (anksjolityczne), amnestyczne ( niepamięć następcza), działanie nasenne, zwiotczające mięśnie i działanie przeciwdrgawkowe.
Działanie farmakologiczne midazolamu charakteryzuje się krótkim czasem działania, ponieważ ulega on szybkim przemianom metabolicznym. Działanie midazolamu jest łatwe do odwrócenia za pomocą antagonisty receptora benzodiazepin: flumazenilu.
Skuteczność kliniczna i bezpieczeństwo stosowania
Dane pochodzące z opublikowanych raportów z badań u dzieci i młodzieży wyraźnie pokazują, że midazolam podawany doustnie działa jako środek uspokajający i anksjolityczny przed zabiegiem chirurgicznym wymagającym podania znieczulenia, a także w innych zabiegach medycznych wymagających sedacji bez znieczulenia.
Przeprowadzono kilka badań obejmujących setki dzieci wymagających umiarkowanej sedacji przed znieczuleniem lub zabiegiem medycznym. Te dzieci otrzymały pojedynczą dawkę midazolamu doustnie (bez skojarzenia z innym lekiem o działaniu depresyjnym na ośrodkowy układ nerwowy). Maksymalną sedację uzyskano w ciągu od 30 do 45 minut po podaniu midazolamu w dawce od 0,25 do 1,0 mg/kg mc. Podobne dane uzyskano w zakresie działania anksjolitycznego. Działanie uspokajające uzyskano dla stężeń midazolamu w osoczu wynoszących od 30 do 160 ng/ml i EC50 (połowa maksymalnego stężenia efektywnego) od 18 do 171 ng/ml w zależności od metody stosowanej do oceny sedacji (dane dotyczące dzieci i dorosłych).
Badanie oceniające produkt leczniczy OZASED przeprowadzono u dzieci i młodzieży w wieku od 6 miesięcy do 17 lat wymagających zastosowania premedykacji przed podaniem znieczulenia i. Wyniki tego badania są zgodne z wynikami przedstawionymi w piśmiennictwie. Działanie uspokajające i anksjolityczne obserwowano w ciągu 30 minut po podaniu doustnym pojedynczej dawki produktu leczniczego OZASED wynoszącej średnio 0,269 mg/kg mc. oraz przy stężeniu midazolamu w osoczu w zakresie od 15 do 65 ng/ml. U zdrowych uczestników dorosłych, po podaniu doustnym produktu leczniczego OZASED w dawce 15 mg (średnio 0,245 mg/kg mc.), obserwowano stężenie EC50 wynoszące 53,82 ng/ml. Nie ma danych dotyczących dzieci i młodzieży niebędących na czczo w wieku od 6 miesięcy do 17 lat otrzymujących pojedynczą doustną dawkę produktu leczniczego OZASED.
Wchłanianie
Midazolam jest szybko i całkowicie wchłaniany po podaniu doustnym.
Dane z piśmiennictwa
Maksymalne stężenie w osoczu (Cmax) uzyskuje się w ciągu od 30 do 60 minut (Tmax) po doustnym podaniu midazolamu. U zdrowych dorosłych, po podaniu dawki 15 mg, obserwowano wartość Cmax od 70 do 154 ng/ml . Zgłaszano wartości Cmax wynoszące od 30 do 200 ng/ml zgłaszano w zależności od podanej dawki (od 0,25 do 1,0 mg/kg mc.) i wieku dziecka (od 6 miesięcy do 17 lat).
Biodostępność waha się od 30 do 50% w zależności od badania i zastosowanej postaci doustnej stosowanego leku.
Dane dotyczące produktu leczniczego OZASED
Po podaniu doustnym pojedynczej dawki produktu leczniczego OZASED, wartość Cmax osiągano w ciągu od 35 do 45 minut (mediana Tmax) u osób dorosłych i młodzieży. Na podstawie analizy farmakokinetyki populacyjnej (pop-PK), w tym danych dotyczących dorosłych oraz dzieci i młodzieży, stwierdzono, że większość midazolamu jest wchłaniana w ciągu 30 minut po podaniu produktu leczniczego OZASED.
Po podaniu doustnym dawki 15 mg (średnio 0,245 mg/kg mc.) produktu leczniczego OZASED, wartość Cmax wynosiła 113 ng/ml u zdrowych uczestników dorosłych. Po podaniu produktu leczniczego OZASED w dawce od 0,12 do 0,30 mg/kg, średnia wartość Cmax u dzieci wynosiła 40,8 ng/ml.
Bezwzględna biodostępność midazolamu podawanego doustnie wynosi 39,4% u dorosłych, którzy otrzymali jedną dawkę 15 mg produktu leczniczego OZASED.
Dystrybucja
Dystrybucja tkankowa midazolamu po podaniu doustnym jest bardzo szybka i w większości przypadków faza dystrybucji nie jest widoczna lub jest zakończona w ciągu od 1 do 2 godzin po podaniu doustnym. Midazolam jest bardzo dobrze rozpuszczalny w tłuszczach i w dużym stopniu podlega dystrybucji. Midazolam silnie wiąże się z białkami osocza (w zakresie 96-98%), głównie z albuminą.
Przenikanie midazolamu do płynu mózgowo-rdzeniowego jest powolne i niewielkie. U ludzi midazolam przenika barierę łożyskową i powoli przenika do krążenia płodu. Niewielkie ilości midazolamu są stwierdzane w mleku matki.
Dane z piśmiennictwa
Objętość dystrybucji w stanie stacjonarnym wynosi od 1,0 do 2,5 l/kg mc. i do 6,6 l/kg mc.
Dane dotyczące produktu leczniczego OZASED
Wielkość dystrybucji midazolamu wynosi 4,7 l/kg mc. u zdrowych osób dorosłych.
Na podstawie analizy pop-PK centralną objętość dystrybucji i objętość dystrybucji przedziału obwodowego oceniono odpowiednio jako wynoszącą 27,9 l i 413 l u przeciętnego dziecka o masie ciała 34 kg.
Metabolizm
Midazolam jest niemal całkowicie wydalany w procesach biotransformacji. Midazolam jest hydroksylowany przez izoenzym CYP3A4, a głównym metabolitem w moczu i osoczu jest α- hydroksymidazolam. Stężenie α-hydroksymidazolamu w osoczu wynosi od 30 do 50% związku macierzystego. α-hydroksymidazolam jest farmakologicznie czynny i znacznie przyczynia się (w około 34%) do działania podawanego doustnie midazolamu.
Dane z piśmiennictwa
Po podaniu doustnym metabolizm wątrobowy pierwszego przejścia szacuje się na około od 30 do 60%.
Po podaniu doustnym u dzieci stosunek wartości obszaru pod krzywą (AUC) α-hydroksymidazolamu do midazolamu waha się od 0,38 do 0,75.
Dane dotyczące produktu leczniczego OZASED
Około 40% narażenia na α-hydroksymidazolam wynika z efektu pierwszego przejścia wątrobowego. Współczynnik metaboliczny wynosi odpowiednio 0,504; 0,364 i 0,313 u dzieci, młodzieży i dorosłych.
Eliminacja
U zdrowych osób dorosłych klirens osoczowy wynosi od 300 do 500 ml/min (lub od 4 do 13 ml/min/kg mc.). Midazolam jest wydalany głównie przez nerki; od 60 do 80% podanej dawki jest wydalane w ciągu 24 godzin od podania i jest odzyskiwane w postaci glukuronianu α-hydroksymidazolamu. Mniej niż 1% podanej dawki odzyskano w postaci niezmienionej w moczu. Okres półtrwania w fazie eliminacji midazolamu wynosi około 3 godzin, a w przypadku α-hydroksymidazolamu około 2 godziny.
Dane z piśmiennictwa
U dzieci okres półtrwania może się znacznie różnić w zakresie od 0,5 do 7 godzin, w zależności od badania, niezależnie od wieku dziecka i podanej dawki midazolamu. Klirens osoczowy oszacowano pomiędzy od 1,5 do 3,6 l/godz./kg mc.
Dane dotyczące produktu leczniczego OZASED
Okres półtrwania oceniono na 3,6 godziny u młodzieży. Na podstawie analizy pop-PK klirens midazolamu oszacowano jako wynoszący 34,7 l/godz., a klirens α-hydroksymidazolamu jako wynoszący 40,6 l/godz. u typowego uczestnika o masie ciała 34 kg.
Farmakokinetyka w szczególnych grupach pacjentów
Noworodki i niemowlęta
Nie prowadzono badań produktu leczniczego OZASED u dzieci w wieku poniżej 6 miesięcy.
Pacjenci otyli
Średni okres półtrwania midazolamu jest wyższy u pacjentów otyłych niż u pacjentów o prawidłowej masie ciała (5,9 godziny w porównaniu do 2,3 godziny). Jest to spowodowane zwiększeniem o około 50% objętości dystrybucji skorygowanej dla całkowitej masy ciała. Nie ma istotnych różnic w klirensie osoczowym pomiędzy pacjentami otyłymi, a pacjentami o prawidłowej masie ciała. Konieczne może być dłuższe monitorowanie pacjentów otyłych po zabiegu.
Pacjenci z zaburzeniami czynności wątroby
U pacjentów z marskością wątroby okres półtrwania w fazie eliminacji może być dłuższy, a klirens mniejszy niż obserwowany u zdrowych osób, ze względu na ryzyko kumulacji α-hydroksymidazolamu (patrz punkty 4.2 i 4.3).
Pacjenci z zaburzeniami czynności nerek
Okres półtrwania w fazie eliminacji u pacjentów z przewlekłą niewydolnością nerek jest podobny do okresu półtrwania u zdrowych osób. Jednak u pacjentów z zaburzeniami czynności nerek należy zachować ostrożność w przypadku stosowania doustnego midazolamu.
Pacjenci z niewydolnością krążenia
Okres półtrwania w fazie eliminacji jest dłuższy u pacjentów z zastoinową niewydolnością serca w porównaniu do osób zdrowych (patrz punkt 4.4).
W badaniu dotyczącym płodności prowadzonym na szczurach, podczas którego zwierzęta otrzymały nawet dziesięciokrotnie większej dawki niż dawka kliniczna, nie obserwowano niekorzystnych działań na płodność.
Nie ma istotnych danych przedklinicznych dla osoby przepisującej lek oprócz danych już wymienionych w innych punktach ChPL.
Kwas cytrynowy jednowodny Gammadeks
Sukraloza
Aromat pomarańczowy (zawiera w szczególności 70-80% etanolu) Sodu wodorotlenek (do ustalenia pH)
Woda do wstrzykiwań.
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności.
Przed otwarciem: 3 lata.
Po otwarciu: produkt użyć natychmiast po otwarciu, a pozostałości wyrzucić.
Nie przechowywać w temperaturze powyżej 25°C. Nie przechowywać w lodówce ani nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Ampułka o pojemności 5 ml ze szkła oranżowego typu I, zestaw do podawania doustnego (aplikator, wężyk z filtrem ułatwiający pobranie roztworu z ampułki) w blistrze.
Pudełko zawierające 1 ampułkę, 1 zestaw do podawania doustnego. Pudełko zawierające 5 ampułek, 5 zestawów do podawania doustnego. Pudełko zawierające 10 ampułek, 10 zestawów do podawania doustnego.
Aplikator doustny i wężyk z filtrem są przeznaczone do jednorazowego użytku. Na aplikatorze doustnym znajduje się podziałka w kg masy ciała: od 3 kg do 40 kg, z przyrostem co jeden kg.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Stosowanie u dzieci i młodzieży
Produkt leczniczy OZASED jest przeznaczony wyłącznie do podania doustnego.
Instrukcja bezpiecznego stosowania ampułki, aplikatora doustnego i wężyka z filtrem produktu leczniczego OZASED znajduje się na blistrze. OZASED należy podawać wyłącznie za pomocą dedykowanego, specjalnego aplikatora doustnego z podziałką w kg:
Primex Pharmaceuticals Oy
Mannerheimintie 12 B
00100 Helsinki Finlandia
Pozwolenie nr: 26965
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 16.03.2022
08.07.2022











