Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU 27222
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
w leczeniu nowo rozpoznanego hormonowrażliwego raka gruczołu krokowego wysokiego ryzyka z przerzutami (ang. metastatic hormone sensitive prostate cancer, mHSPC) u dorosłych mężczyzn w skojarzeniu z terapią supresji androgenowej (ang. Androgen Deprivation Therapy, ADT) (patrz punkt 5.1)
w leczeniu opornego na kastrację raka gruczołu krokowego z przerzutami (ang. metastatic castration resistant prostate cancer, mCRPC) u dorosłych mężczyzn, bez objawów lub
z objawami o nieznacznym lub niewielkim nasileniu, po niepowodzeniu terapii supresji androgenowej, u których zastosowanie chemioterapii nie jest jeszcze wskazane klinicznie (patrz punkt 5.1)
w leczeniu mCRPC u dorosłych mężczyzn, u których choroba postępuje w trakcie lub po chemioterapii zawierającej docetaksel.
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Kobiety, które są lub mogą prawdopodobnie być w ciąży (patrz punkt 4.6).
Ciężkie zaburzenia czynności wątroby [klasa C wg Child-Pugh (patrz punkty 4.2, 4.4 i 5.2)].
Stosowanie abirateronu z prednizonem lub prednizolonem w skojarzeniu z Ra-223 jest przeciwwskazane.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
wartość p pochodzi z logarytmicznego testu rang stratyfikowanego wg punktacji skali sprawności ECOG (0 lub 1)
** Współczynnik ryzyka <1 na korzyść abirateronu.
Wykres 3: Krzywe Kaplana-Meiera przeżycia bez progresji radiograficznej u pacjentów otrzymujących abirateron lub placebo w skojarzeniu z prednizonem lub prednizolonem oraz analogami LHRH lub po wcześniejszej orchidektomii
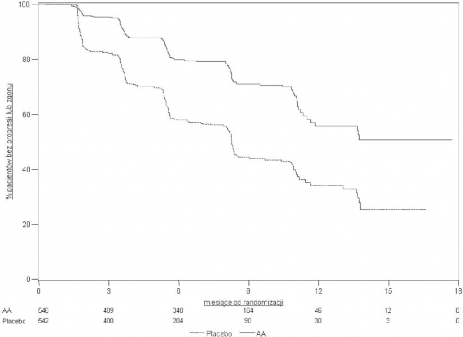
AA = abirateron
Kontynuowano zbieranie danych od osób badanych do daty drugiej analizy pośredniej całkowitego przeżycia (ang. Overall survival, OS). Radiograficzny przegląd rPFS, przeprowadzony przez badaczy jako kontynuacja analizy czułości, przedstawia Tabela 5 i Wykres 4.
607 badanych miało progresję radiograficzną lub zmarło: 271 (50%) w grupie abirateronu octanu i 336 (62%) w grupie placebo. Leczenie abirateronu octanem zmniejszyło ryzyko progresji radiograficznej lub zgonu o 47% w porównaniu z placebo (HR=0,530; 95% CI: [0,451; 0,623]; p < 0,0001). Mediana rPFS wyniosła 16,5 miesiąca w grupie abirateronu octanu i 8,3 miesiąca w grupie placebo.
Tabela 5: Badanie 302: Przeżycie bez progresji radiograficznej u pacjentów otrzymujących abirateron lub placebo w skojarzeniu z prednizonem lub prednizolonem oraz analogami LHRH lub po wcześniejszej orchidektomii (Podczas drugiej analizy pośredniej OS-Rewizja Badacza)
Abirateron
(N=546)
Placebo
(N=542)
Przeżycie bez radiograficznej progresji (rPFS)
Progresja lub zgon
271 (50%)
336 (62%)
Mediana rPFS w miesiącach
16,5
8,3
(95% CI)
(13,8; 16,79)
(8,05; 9,43)
Wartość p* <0,0001
Współczynnik ryzyka**(95% CI) 0,530 (0,451; 0,623)
wartość p pochodzi z logarytmicznego testu rang stratyfikowanego wg punktacji skali sprawności ECOG (0 lub 1)
** Współczynnik ryzyka <1 na korzyść abirateronu.
Wykres 4: Krzywe Kaplana-Meiera przeżycia bez progresji radiograficznej u pacjentów otrzymujących abirateron lub placebo w skojarzeniu z prednizonem lub prednizolonem oraz analogami LHRH lub po wcześniejszej orchidektomii (Podczas drugiej analizy pośredniej OS-Rewizja Badacza)
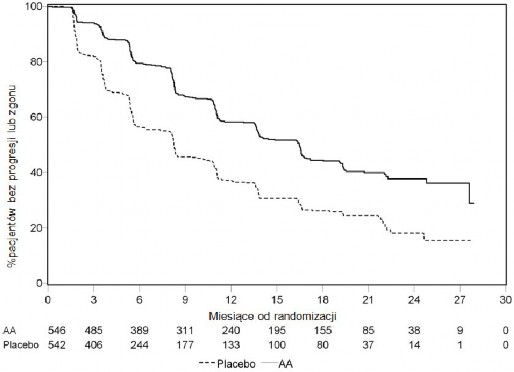
AA = abirateron
Planową analizę pośrednią (ang. interim analysis, IA) OS przeprowadzono po stwierdzeniu 333 zgonów. Badanie zostało odkodowane na podstawie ważności stwierdzonych korzyści
klinicznych, a pacjentom z grupy placebo zaproponowano leczenie abirateronem. Całkowity czas przeżycia był dłuższy dla abirateronu niż placebo, z 25% redukcją ryzyka zgonu (HR = 0,752; 95 % CI: [0,606; 0,934], p = 0,0097), lecz nie osiągnięto OS, a wyniki pośrednie nie osiągnęły zamierzonej wartości granicznej dla znamienności statystycznej (patrz Tabela 4). Przeżycie będzie nadal obserwowane po tej analizie pośredniej.
Planową analizę końcową OS przeprowadzono po stwierdzeniu 741 zgonów (mediana obserwacji – 49 miesięcy). Zmarło 65% (354 z 546) pacjentów leczonych abirateronem, w porównaniu z 71% (387 z 542) pacjentów otrzymujących placebo. Wykazano statystycznie znamienną różnicę w OS na korzyść grupy leczonej abirateronem z 19,4% zmniejszeniem ryzyka zgonu (HR = 0,806; 95% CI: [0,697; 0,931], p = 0,0033) oraz poprawą średniego OS o 4,4 miesiąca (abirateron 34,7 miesięcy, placebo 30,3 miesięcy), (patrz Tabela 6 i Wykres 5). Tę poprawę wykazano także u 44% pacjentów z grupy placebo, którzy następnie otrzymywali abirateron.
Tabela 6: Badanie 302: Całkowite przeżycie u pacjentów otrzymujących abirateron lub placebo w skojarzeniu z prednizonem lub prednizolonem oraz analogami LHRH lub po wcześniejszej orchidektomii
Abirateron
(N=546)
Placebo
(N=542)
Analiza pośrednia przeżycia
Zgony (%)
147 (27%)
186 (34%)
Mediana przeżycia w miesiącach
nie osiągnięto
27,2%
(95% CI)
(NE; NE)
(25,95; NE)
Wartość p* 0,0097
Współczynnik ryzyka**(95% CI) 0,752 (0,606; 0,934)
Analiza końcowa przeżycia
Zgony 354 (65%) 387 (71%)
Mediana całkowitego przeżycia w
miesiącach (95% CI) 34,7 (32,7; 36,8) 30,3 (28,7; 33,3)
wartość p* 0,0033
Współczynnik ryzyka **(95% CI) 0,806 (0,697; 0,931)
NE = nie oceniono
wartość p pochodzi z logarytmicznego testu rang stratyfikowanego wg punktacji skali sprawności ECOG (0 lub 1)
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU 27222
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Abirateron Aristo, 500 mg, tabletki powlekane
Każda tabletka zawiera 500 mg abirateronu octanu.
Substancje pomocnicze o znanym działaniu
Każda tabletka zawiera 232,2 mg laktozy (jednowodnej) i 11,5 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka powlekana.
Owalne, obustronnie wypukłe, tabletki powlekane w kolorze fioletowym (o długości 19 mm i szerokości 11 mm), z wytłoczeniem ‘500’ po jednej stronie i gładkie po drugiej stronie.
Produkt leczniczy Abirateron Aristo w skojarzeniu z prednizonem lub prednizolonem jest wskazany :
Ten produkt leczniczy powinien być zalecany przez lekarza z odpowiednią specjalizacją.
Dawkowanie
Zalecana dawka wynosi 1000 mg podawana jednorazowo raz na dobę i nie wolno produktu leczniczego przyjmować razem z jedzeniem (patrz poniżej „Sposób podawania”).
Przyjmowanie produktu leczniczego z jedzeniem zwiększa całkowite narażenie organizmu na abirateron (patrz punkty 4.5 i 5.2).
Dawkowanie prednizonu lub prednizolonu
W leczeniu mHSPC abirateron stosuje się jednocześnie z 5 mg prednizonu lub prednizolonu na dobę. W leczeniu mCRPC abirateron stosuje się jednocześnie z 10 mg prednizonu lub prednizolonu na dobę. U pacjentów niekastrowanych chirurgicznie należy w trakcie leczenia kontynuować farmakologiczną kastrację analogami gonadoliberyny (ang. luteinising hormone releasing hormone, LHRH).
Zalecana obserwacja
Należy oceniać aktywność aminotransferaz w surowicy przed rozpoczęciem leczenia, co dwa tygodnie przez pierwsze trzy miesiące leczenia, a następnie co miesiąc. Ciśnienie tętnicze krwi, stężenie potasu w surowicy i zastój płynów należy oceniać co miesiąc. Jednakże pacjentów z istotnym ryzykiem zastoinowej niewydolności serca należy badać co 2 tygodnie przez pierwsze 3 miesiące leczenia,
a następnie co miesiąc (patrz punkt 4.4).
U pacjentów z występującą wcześniej hipokaliemią lub z hipokaliemią, która rozwinęła się w trakcie leczenia abirateronem, należy utrzymywać stężenie potasu na poziomie ≥4,0 mM.
U pacjentów, u których wystąpią objawy toksyczności stopnia ≥3. w tym nadciśnienie, hipokaliemia, obrzęk i inne działania niezwiązane z mineralokortykosteroidami, należy wstrzymać leczenie
i wdrożyć odpowiednie postępowanie. Nie należy wznawiać leczenia abirateronem, aż nasilenie objawów zmniejszy się do stopnia 1. lub wartości wyjściowych.
W przypadku pominięcia dawki dobowej, zarówno abirateronu, jak i prednizonu lub prednizolonu, należy wznowić leczenie zwykle stosowaną dawką dobową następnego dnia.
Hepatotoksyczność
U pacjentów, u których wystąpi działanie hepatotoksyczne podczas leczenia (zwiększy się aktywność aminotransferazy alaninowej [AlAT] lub zwiększy się aktywność aminotransferazy asparaginianowej [AspAT] ponad pięciokrotnie powyżej górnej granicy normy [GGN] ), należy natychmiast wstrzymać leczenie (patrz punkt 4.4). Wznowienie leczenia po powrocie testów czynnościowych wątroby do wartości wyjściowych może być kontynuowane w zmniejszonej dawce 500 mg raz na dobę.
U pacjentów, u których wznowiono leczenie, należy badać aktywność aminotransferaz w surowicy przynajmniej co dwa tygodnie przez trzy miesiące, a następnie co miesiąc. W przypadku nawrotu hepatotoksyczności podczas stosowania zmniejszonej dawki 500 mg na dobę należy przerwać leczenie.
W przypadku wystąpienia ciężkiej hepatotoksyczności (aktywność AlAT lub AspAT zwiększona ponad 20 razy powyżej GGN) kiedykolwiek podczas terapii należy przerwać leczenie i nie rozpoczynać go ponownie.
Zaburzenia czynności wątroby
Nie jest konieczne dostosowanie dawki u pacjentów z występującymi wcześniej łagodnymi zaburzeniami czynności wątroby klasy A wg Child-Pugh.
U pacjentów z umiarkowanymi zaburzeniami czynności wątroby (klasa B wg Child-Pugh) wykazano około 4-krotne zwiększenie całkowitego wpływu abirateronu na organizm po podaniu jednorazowej dawki doustnej 1000 mg abirateronu octanu (patrz punkt 5.2). Brak danych dotyczących bezpieczeństwa klinicznego i skuteczności wielokrotnych dawek abirateronu octanu podawanych pacjentom z umiarkowanymi lub ciężkimi zaburzeniami czynności wątroby (klasa B lub C wg Child- Pugh). Nie można określić zaleceń dotyczących dostosowania dawki. Zastosowanie abirateronu należy rozważnie ocenić u pacjentów z umiarkowanymi zaburzeniami czynności wątroby, u których korzyści powinny jasno przeważać nad możliwym ryzykiem (patrz punkty 4.2 i 5.2). Nie należy stosować abirateronu u pacjentów z ciężkimi zaburzeniami czynności wątroby (patrz punkty 4.3, 4.4 i 5.2).
Zaburzenia czynności nerek
Nie jest konieczne dostosowanie dawki u pacjentów z zaburzeniami czynności nerek (patrz punkt 5.2). Niemniej jednak brak jest danych klinicznych u pacjentów z rakiem gruczołu krokowego i ciężkimi zaburzeniami czynności nerek. Należy zachować ostrożność u tych pacjentów (patrz punkt 4.4).
Dzieci i młodzież
Nie istnieje odpowiednie zastosowanie abirateronu w populacji dzieci i młodzieży.
Sposób podawania
Abirateron Aristo podaje się doustnie.
Tabletki należy przyjmować co najmniej dwie godziny po jedzeniu i nie należy spożywać pokarmu przez co najmniej jedną godzinę po przyjęciu tabletki. Tabletki należy połykać w całości, popijając wodą.
Nadciśnienie, hipokaliemia, zastój płynów i niewydolność serca wynikające z nadmiaru mineralokortykosteroidów
Abirateron może powodować nadciśnienie, hipokaliemię i zastój płynów (patrz punkt 4.8) jako następstwa zwiększenia stężeń mineralokortykosteroidów, wynikającego z hamowania CYP17 (patrz punkt 5.1). Jednoczesne podawanie kortykosteroidu hamuje wydzielanie hormonu adrenokortykotropowego (ACTH), co skutkuje zmniejszeniem częstości i nasilenia tych działań niepożądanych. Należy zachować ostrożność podczas leczenia pacjentów, u których stan schorzeń współistniejących może ulec pogorszeniu w wyniku zwiększenia ciśnienia tętniczego, hipokaliemii (np. u pacjentów stosujących glikozydy nasercowe) lub zastoju płynów (np. u pacjentów
z niewydolnością serca, ciężką lub niestabilną dławicą piersiową, niedawno przebytym zawałem serca lub arytmią komorową oraz u pacjentów z ciężkimi zaburzeniami czynności nerek).
Abirateron należy stosować z ostrożnością u pacjentów z chorobami sercowo-naczyniowymi
w wywiadzie. Badania fazy 3 prowadzone z abirateronem nie obejmowały pacjentów
z niepoddającym się leczeniu nadciśnieniem tętniczym, istotną klinicznie chorobą serca, potwierdzoną zawałem mięśnia sercowego lub tętniczymi zdarzeniami zakrzepowymi w okresie ostatnich
6 miesięcy, z ciężką lub niestabilną dusznicą bolesną lub niewydolnością serca klasy III lub IV
wg NYHA (ang. New York Heart Association) (badanie 301) lub niewydolnością serca klasy II do IV (badania 3011 i 302) lub pacjentów z frakcją wyrzutową serca <50%. Z badań 3011 i 302 wykluczono pacjentów z migotaniem przedsionków lub innymi arytmiami komorowymi, wymagającymi leczenia. Nie określono bezpieczeństwa u pacjentów z frakcją wyrzutową lewej komory (ang. Left Ventricular Ejection Fraction, LVEF) <50% lub z niewydolnością serca klasy III lub IV wg NYHA (w badaniu 301) lub niewydolnością serca klasy II do IV (w badaniach 3011 i 302) (patrz punkty 4.8 i 5.1).
Przed rozpoczęciem leczenia u pacjentów z istotnym ryzykiem zastoinowej niewydolności serca
(np. niewydolność serca w wywiadzie, niekontrolowane nadciśnienie tętnicze lub zdarzenia sercowe, takie jak choroba niedokrwienna serca) należy rozważyć wykonanie badań oceniających czynność serca (np. echokardiografię). Przed rozpoczęciem leczenia abirateronem należy leczyć niewydolność serca i zoptymalizować czynność serca. Należy wyrównać i kontrolować nadciśnienie tętnicze, hipokaliemię i zastój płynów. Podczas leczenia należy co 2 tygodnie przez 3 miesiące a następnie co miesiąc monitorować ciśnienie krwi, stężenie potasu w osoczu, zastój płynów (przyrost masy ciała, obrzęki obwodowe) oraz inne objawy przedmiotowe i podmiotowe zastoinowej niewydolności serca i korygować nieprawidłowości. U pacjentów z hipokaliemią, podczas leczenia abirateronem, stwierdzano wydłużenie odstępu QT. Należy oceniać czynność serca zgodnie ze wskazaniami klinicznymi, ustalić właściwe postępowanie i rozważyć odstawienie tego leczenia, gdy nastąpi znaczne pogorszenie czynności serca (patrz punkt 4.2).
Hepatotoksyczność i zaburzenia czynności wątroby
W kontrolowanych badaniach klinicznych stwierdzono znaczne zwiększenie aktywności enzymów wątrobowych, prowadzące do przerwania leczenia lub zmiany dawki (patrz punkt 4.8). Należy oceniać aktywność aminotransferaz w surowicy przed rozpoczęciem leczenia, co dwa tygodnie przez pierwsze trzy miesiące leczenia a następnie co miesiąc. Jeśli kliniczne objawy podmiotowe i przedmiotowe wskazują na hepatotoksyczność, należy natychmiast dokonać pomiaru aktywności aminotransferaz
w surowicy. Jeśli kiedykolwiek aktywność AlAT lub AspAT zwiększy się ponad 5-krotnie powyżej GGN, należy natychmiast przerwać leczenie i szczegółowo monitorować czynność wątroby. Leczenie można wznowić w zmniejszonej dawce tylko po powrocie testów czynnościowych wątroby do wartości wyjściowych (patrz punkt 4.2).
W przypadku wystąpienia ciężkiej hepatotoksyczności (aktywność AlAT lub AspAT zwiększona ponad 20 razy powyżej GGN) kiedykolwiek podczas terapii, należy przerwać leczenie i nie rozpoczynać go ponownie.
Pacjentów z czynnym lub objawowym wirusowym zapaleniem wątroby wykluczono z badań klinicznych; dlatego nie ma danych potwierdzających celowość zastosowania abirateronu w tej populacji.
Brak danych dotyczących bezpieczeństwa klinicznego i skuteczności wielokrotnych dawek abirateronu octanu stosowanego u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności wątroby (Klasa B lub C wg Child-Pugh). Zastosowanie abirateronu należy ostrożnie ocenić
u pacjentów z umiarkowanymi zaburzeniami czynności wątroby, u których korzyści powinny jasno przeważać nad możliwym ryzykiem (patrz punkty 4.2 i 5.2). Nie należy stosować abirateronu
u pacjentów z ciężkimi zaburzeniami czynności wątroby (patrz punkty 4.2, 4.3 i 5.2).
Po wprowadzeniu produktu do obrotu zgłaszano rzadkie przypadki ostrej niewydolności wątroby
i nadostrego zapalenia wątroby, niektóre zakończone zgonem (patrz punkt 4.8).
Odstawianie kortykosteroidów i zabezpieczenie sytuacji stresogennych
Zaleca się zachowanie ostrożności i obserwację w kierunku występowania objawów niewydolności nadnerczy, gdy pacjentom odstawia się prednizon lub prednizolon. Jeśli stosowanie abirateronu jest kontynuowane po odstawieniu kortykosteroidów, pacjentów należy obserwować w kierunku występowania objawów nadmiaru mineralokortykosteroidów (patrz informacja powyżej).
U pacjentów stosujących prednizon lub prednizolon, narażonych na wyjątkowy stres, może być wskazane zwiększenie dawki kortykosteroidów przed, w trakcie i po sytuacji stresogennej.
Gęstość kości
U mężczyzn z zaawansowanym rakiem gruczołu krokowego z przerzutami może wystąpić zmniejszenie gęstości kości. Stosowanie abirateronu w skojarzeniu z glikokortykosteroidami może nasilić to działanie.
Wcześniejsze stosowanie ketokonazolu
U pacjentów, którzy stosowali wcześniej ketokonazol w leczeniu raka gruczołu krokowego, można spodziewać się słabszej odpowiedzi na leczenie.
Hiperglikemia
Stosowanie glikokortykosteroidów może nasilać hiperglikemię, dlatego u pacjentów z cukrzycą należy często badać stężenie glukozy we krwi.
Hipoglikemia
Zgłaszano przypadki hipoglikemii po podaniu abirateronu z prednizonem i (lub) prednizolonem pacjentom z istniejącą wcześniej cukrzycą, otrzymującym pioglitazon lub repaglinid (patrz punkt 4.5); dlatego u pacjentów z cukrzycą należy monitorować stężenie cukru we krwi.
Stosowanie podczas chemioterapii
Nie określono bezpieczeństwa ani skuteczności abirateronu stosowanego jednocześnie z cytotoksyczną chemioterapią (patrz punkt 5.1).
Nietolerancja substancji pomocniczych
Produkt leczniczy zawiera laktozę. Lek nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy.
Produkt leczniczy zawiera również ponad 23 mg sodu w dawce dwóch tabletek 500 mg, co odpowiada 1,2% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
Ryzyko związane ze stosowaniem
U mężczyzn z rakiem gruczołu krokowego z przerzutami, w tym u pacjentów przyjmujących abirateron, mogą wystąpić niedokrwistość i zaburzenia czynności seksualnych.
Wpływ na mięśnie szkieletowe
U pacjentów leczonych abirateronem zgłaszano przypadki miopatii i rabdomiolizy. Większość przypadków wystąpiła w ciągu pierwszych 6 miesięcy leczenia, a po odstawieniu abirateronu rabdomioliza ustąpiła. Należy zachować ostrożność u pacjentów leczonych jednocześnie produktami leczniczymi związanymi z występowaniem miopatii i (lub) rabdomiolizy.
Interakcje z innymi produktami leczniczymi
Ze względu na ryzyko zmniejszenia ekspozycji na abirateron należy unikać jednoczesnego stosowania silnych induktorów CYP3A4, chyba że nie istnieje alternatywne leczenie (patrz punkt 4.5).
Skojarzenie abirateronu i prednizonu i (lub) prednizolonu z Ra-223
W badaniach klinicznych stwierdzono, że leczenie abirateronem i prednizonem i (lub) prednizolonem w skojarzeniu z Ra-223 jest przeciwwskazane (patrz punkt 4.3) ze względu na zwiększone ryzyko złamań i tendencję do zwiększonej śmiertelności u pacjentów bezobjawowych lub z łagodnymi objawami z rakiem gruczołu krokowego. Zaleca się, aby kolejna terapia Ra-223 nie była rozpoczynana przez co najmniej 5 dni po ostatnim podaniu abirateronu w skojarzeniu z prednizonem i (lub) prednizolonem.
Wpływ jedzenia na abirateronu octan
Podawanie leku z jedzeniem znacząco zwiększa wchłanianie abirateronu octanu. Nie ustalono skuteczności i bezpieczeństwa stosowania abirateronu podawanego razem z jedzeniem, dlatego nie wolno tego produktu leczniczego podawać razem z jedzeniem (patrz punkty 4.2 i 5.2).
Interakcje z innymi produktami leczniczymi
Możliwość wpływu innych produktów leczniczych na ekspozycję na abirateron
W badaniu klinicznym interakcji farmakokinetycznych, przeprowadzonym u zdrowych ochotników otrzymujących wcześniej ryfampicynę – silny induktor CYP3A4 w dawce 600 mg na dobę przez
6 dni, podanie pojedynczej dawki 1000 mg abirateronu octanu skutkowało zmniejszeniem średniego AUC∞ abirateronu w osoczu o 55%.
Podczas leczenia należy unikać stosowania silnych induktorów CYP3A4 (np.: fenytoiny, karbamazepiny, ryfampicyny, ryfabutyny, ryfapentyny, fenobarbitalu, ziela dziurawca zwyczajnego [Hypericum perforatum]), chyba że nie istnieje alternatywne leczenie.
W innym badaniu klinicznym interakcji farmakokinetycznych przeprowadzonym u zdrowych osób jednoczesne podawanie ketokonazolu, silnego inhibitora CYP3A4, nie miało istotnego klinicznego wpływu na farmakokinetykę abirateronu.
Możliwość wpływu na ekspozycję na inne produkty lecznicze
Abirateron jest inhibitorem metabolizmu wątrobowych enzymów CYP2D6 i CYP2C8.
W badaniu określającym wpływ abirateronu octanu (w skojarzeniu z prednizonem) na pojedynczą dawkę dekstrometorfanu będącego substratem CYP2D6 całkowite narażenie na dekstrometorfan (AUC) zwiększyło się około 2,9 razy. AUC24 dekstrorfanu, czynnego metabolitu dekstrometorfanu, zwiększyło się o około 33%.
Zaleca się zachowanie ostrożności podczas jednoczesnego podawania z produktami leczniczymi aktywowanymi lub metabolizowanymi przez CYP2D6, szczególnie z produktami leczniczymi
z wąskim indeksem terapeutycznym. Należy rozważyć zmniejszenie dawki produktów leczniczych z wąskim indeksem terapeutycznym metabolizowanych przez CYP2D6. Przykłady produktów
leczniczych metabolizowanych przez CYP2D6: metoprolol, propranolol, dezypramina, wenlafaksyna, haloperydol, rysperydon, propafenon, flekainid, kodeina, oksykodon i tramadol (ostatnie trzy produkty lecznicze wymagają CYP2D6 do wytworzenia metabolitów czynnych przeciwbólowo).
W badaniu interakcji lekowych dotyczących cytochromu CYP2C8, przeprowadzonym u zdrowych ochotników, AUC pioglitazonu zwiększyło się o 46%, a AUC czynnych metabolitów pioglitazonu M-III i M-IV zmniejszyły się o 10%, gdy pioglitazon podawano z pojedynczą dawką 1 000 mg abirateronu octanu. Należy obserwować pacjentów, czy nie występują u nich objawy toksyczności, związane z jednocześnie stosowanymi substratami CYP2C8 z wąskim indeksem terapeutycznym. Przykładami produktów leczniczych metabolizowanych przez CYP2C8 są pioglitazon i repaglinid (patrz punkt 4.4).
W warunkach in vitro, główne metabolity: siarczan abirateronu i siarczan N-tlenku abirateronu, hamowały wychwyt wątrobowy nośnikiem OATP1B1, co może skutkować zwiększeniem stężeń produktów leczniczych eliminowanych przez OATP1B1. Brak dostępnych danych klinicznych potwierdzających interakcje z tym nośnikiem.
Stosowanie z produktami leczniczymi, które mogą wydłużać odstęp QT
Ponieważ terapia supresji androgenowej może powodować wydłużenie odstępu QT, należy zachować ostrożność podczas stosowania produktu abirateron z produktami leczniczymi, które mogą wydłużać odstęp QT lub produktami leczniczymi, które mogą wywoływać częstoskurcz komorowy typu torsades de pointes, takimi jak: leki przeciwarytmiczne klasy IA (np. chinidyna, dyzopiramid) lub klasy III (np. amiodaron, sotalol, dofetylid, ibutylid), metadon, moksyfloksacyna, leki przeciwpsychotyczne, itp.
Stosowanie ze spironolaktonem
Spironolakton wiąże się z receptorem androgenowym i może zwiększać stężenie swoistego antygenu gruczołu krokowego (ang. prostate specific antygen, PSA). Nie zaleca się stosowania z abirateronem (patrz punkt 5.1).
Kobiety w wieku rozrodczym
Brak danych dotyczących stosowania abirateronu u kobiet w ciąży.
Abirateron nie jest przeznaczony do stosowania u kobiet w wieku rozrodczym.
Antykoncepcja mężczyzn i kobiet
Nie wiadomo, czy abirateron lub jego metabolity są wykrywalne w nasieniu. Konieczne jest stosowanie prezerwatywy w przypadku aktywności seksualnej pacjenta z kobietą będącą w ciąży. W przypadku aktywności seksualnej pacjenta z kobietą w okresie rozrodczym konieczne jest stosowanie prezerwatywy jednocześnie z inną skuteczną metodą antykoncepcyjną. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3).
Ciąża
Abirateron nie jest przeznaczony do stosowania u kobiet i jest przeciwwskazany u kobiet w ciąży lub mogących zajść w ciążę (patrz punkty 4.3 i 5.3).
Karmienie piersią
Abirateron nie jest przeznaczony do stosowania u kobiet.
Płodność
Abirateron wpływał na płodność u samców i samic szczurów, ale działania te były całkowicie przemijające (patrz punkt 5.3).
Abirateron nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów
i obsługiwania maszyn.
Charakterystyka profilu bezpieczeństwa
W analizie działań niepożądanych połączonych danych z badań fazy 3 dla abirateronu działania niepożądane, które stwierdzono u ≥10% pacjentów, to: obrzęk obwodowy, hipokaliemia, nadciśnienie tętnicze, zakażenia dróg moczowych i zwiększenie aktywności aminotransferazy alaninowej i (lub) zwiększenie aktywności aminotransferazy asparaginianowej.
Inne istotne działania niepożądane to: choroby serca, hepatotoksyczność, złamania i alergiczne zapalenie pęcherzyków płucnych.
W następstwie swojego mechanizmu działania abirateron może wywoływać nadciśnienie tętnicze krwi, hipokaliemię i zastój płynów. W badaniach fazy 3 oczekiwane działania niepożądane mineralokortykosteroidowe stwierdzano częściej u pacjentów leczonych abirateronu octanem niż
u pacjentów otrzymujących placebo, odpowiednio: hipokaliemia 18% vs. 8%, nadciśnienie tętnicze 22% vs. 16% i zastój płynów (obrzęk obwodowy) 23% vs. 17%. U pacjentów leczonych abirateronu octanem w porównaniu z pacjentami otrzymującymi placebo: stwierdzano hipokaliemię stopni 3. i 4. wg CTCAE (wersja 4.0) (ang. Common Terminology Criteria for Adverse Events) u odpowiednio 6% vs. 1%, nadciśnienie tętnicze stopni 3. i 4. wg CTCAE (wersja 4.0) u odpowiednio 7% i 5% oraz
zastój płynów (obrzęk obwodowy) stopni 3. i 4. u odpowiednio 1% vs. 1%.
Reakcje mineralokortykosteroidowe zwykle można było skutecznie leczyć. Jednoczesne zastosowanie kortykosteroidów zmniejsza częstość i nasilenie tych działań niepożądanych (patrz punkt 4.4).
Tabelaryczne zestawienie działań niepożądanych
W badaniach klinicznych pacjentom z zaawansowanym rakiem gruczołu krokowego z przerzutami, którzy stosowali analogi LHRH lub byli wcześniej leczeni za pomocą orchidektomii, podawano abirateron w dawce 1 000 mg na dobę w skojarzeniu z małą dawką prednizonu lub prednizolonu
(5 mg lub 10 mg na dobę, w zależności od wskazania).
Działania niepożądane stwierdzone podczas badań klinicznych oraz po wprowadzeniu produktu do obrotu przedstawiono poniżej wg kategorii częstości występowania. Kategorie częstości zdefiniowano następująco: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000) i częstość nieznana (nie można określić częstości na podstawie dostępnych danych).
W obrębie każdej kategorii o określonej częstości występowania, działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Tabela 1: Działania niepożądane stwierdzone podczas badań klinicznych oraz po wprowadzeniu produktu do obrotu
Klasyfikacja organów i narządów | Działania niepożądane i częstość występowania |
Zakażenia i zarażenia pasożytnicze | bardzo często: infekcja dróg moczowych często: posocznica |
Zaburzenia układu endokrynologicznego | niezbyt często: niewydolność nadnerczy |
Zaburzenia metabolizmu i odżywiania | bardzo często: hipokaliemia często: hipertriglicerydemia |
Zaburzenia serca | często: niewydolność serca*, dusznica bolesna, migotanie przedsionków, częstoskurcz niezbyt często: inne arytmie częstość nieznana: zawał mięśnia sercowego, wydłużenie odstępu QT (patrz punkty 4.4 i 4.5) |
Zaburzenia naczyniowe | bardzo często: nadciśnienie tętnicze krwi |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | rzadko: alergiczne zapalenie pęcherzyków płucnycha |
Zaburzenia żołądka i jelit | bardzo często: biegunka często: niestrawność |
Zaburzenia wątroby i dróg żółciowych | bardzo często: zwiększenie aktywności aminotransferazy alaninowej i (lub) zwiększenie aktywności aminotransferazy asparaginianowejb rzadko: nadostre zapalenie wątroby, ostra niewydolność wątroby |
Zaburzenia skóry i tkanki podskórnej | często: wysypka |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | niezbyt często: miopatia, rabdomioliza |
Zaburzenia nerek i dróg moczowych | często: krwiomocz |
Zaburzenia ogólne i stany w miejscu podania | bardzo często: obrzęk obwodowy |
Urazy, zatrucia i powikłania po zabiegach | często: złamania** |
Zaburzenia układu immunologicznego | częstość nieznana: wstrząs anafilaktyczny |
* Niewydolność serca obejmuje także: zastoinową niewydolność serca, dysfunkcję lewej komory i zmniejszenie frakcji wyrzutowej.
** Złamania obejmują osteoporozę i wszystkie złamania poza złamaniami patologicznymi.
a Zgłoszenia spontaniczne po wprowadzeniu produktu do obrotu.
b Zwiększenie aktywności aminotransferazy alaninowej i (lub) zwiększenie aktywności aminotransferazy asparaginianowej obejmuje zwiększenie aktywności AlAT, AspAT i nieprawidłową czynność wątroby.
Następujące działania niepożądane stopnia 3. wg CTCAE (wersja 4.0) wystąpiły u pacjentów leczonych abirateronu octanem: hipokaliemia u 5%; zakażenia dróg moczowych u 2%; zwiększenie aktywności AlAT i (lub) AspAT u 4%; nadciśnienie tętnicze u 6%; złamania u 2%; oraz następujące u 1% pacjentów: obrzęk obwodowy, niewydolność serca i migotanie przedsionków.
Hipertriglicerydemia stopnia 3. wg CTCAE (wersja 4.0) i dusznica bolesna wystąpiły u <1%
pacjentów. Zakażenia dróg moczowych stopnia 4. wg CTCAE (wersja 4.0), zwiększenie aktywności AlAT i (lub) AspAT, hipokaliemia, niewydolność serca, migotanie przedsionków i złamania wystąpiły u <1% pacjentów.
Większą częstość nadciśnienia tętniczego i hipokaliemii obserwowano w populacji wrażliwej na hormony (badanie 3011). Nadciśnienie tętnicze stwierdzono u 36,7% pacjentów w populacji wrażliwej na hormony (badanie 3011) w porównaniu do 11,8% i 20,2%, odpowiednio, w badaniach 301 i 302.
Hipokaliemię zaobserwowano u 20,4% pacjentów w populacji wrażliwej na hormony (badanie 3011), w porównaniu do 19,2% i 14,9%, odpowiednio w badaniach 301 i 302.
Częstość i nasilenie działań niepożądanych były większe w podgrupie pacjentów z wyjściowym statusem wydolności ECOG2, a także u pacjentów w podeszłym wieku (≥75 lat).
Opis wybranych działań niepożądanych
Sercowo-naczyniowe działania niepożądane
Trzy badania fazy 3 przeprowadzono z wyłączeniem pacjentów z niepoddającym się leczeniu nadciśnieniem tętniczym, istotną klinicznie chorobą serca, potwierdzoną zawałem mięśnia sercowego lub tętniczymi zdarzeniami zakrzepowymi w okresie ostatnich 6 miesięcy, z ciężką lub niestabilną dusznicą bolesną lub niewydolnością serca klasy III lub IV (badanie 301) lub niewydolnością serca klasy II do IV (badania 3011 i 302) wg NYHA lub frakcją wyrzutową serca wynoszącą <50%.
Wszyscy włączeni pacjenci (zarówno w grupie czynnie leczonej oraz w grupie placebo) otrzymywali jednocześnie supresję androgenową, głównie z zastosowaniem analogów LHRH, których stosowanie wiązało się z wystąpieniem cukrzycy, zawału mięśnia sercowego, incydentów
mózgowo-naczyniowych i nagłego zgonu z przyczyn kardiologicznych.
Częstość sercowo-naczyniowych działań niepożądanych w badaniach 3 fazy u pacjentów stosujących abirateronu octan, w porównaniu z pacjentami przyjmującymi placebo była następująca: migotanie przedsionków 2,6% vs. 2,0%, tachykardia 1,9% vs. 1%, dławica piersiowa 1,7% vs. 0,8%,
niewydolność serca 0,7% vs. 0,2% i arytmia 0,7% vs. 0,5%.
Hepatotoksyczność
U pacjentów stosujących abirateronu octan stwierdzano hepatotoksyczność ze zwiększoną aktywnością AlAT, AspAT i stężenia całkowitego bilirubiny. W badaniach klinicznych fazy 3 stwierdzano hepatotoksyczność stopni 3 i 4 (np. AlAT lub AspAT zwiększone o >5 x powyżej górnej granicy normy [GGN] lub bilirubina zwiększona o >1,5 x GGN) u około 6% pacjentów, którzy otrzymywali abirateronu octan, zwykle podczas pierwszych 3 miesięcy od rozpoczęcia terapii.
W badaniu 3011 stwierdzano hepatotoksyczność stopnia 3. lub 4. u 8,4% pacjentów leczonych abirateronem. Dziesięciu pacjentów przerwało stosowanie abirateronu z powodu hepatotoksyczności; dwóch miało hepatotoksyczność stopnia 2., sześciu hepatotoksyczność stopnia 3., a dwóch hepatotoksyczność stopnia 4. Nie było zgonu z powodu hepatotoksyczności w badaniu 3011.
W badaniach fazy 3 pacjenci, u których wyjściowe wartości AlAT lub AspAT były podwyższone, częściej doświadczali zwiększenia testów czynnościowych wątroby niż pacjenci rozpoczynający leczenie z prawidłowymi wartościami. Gdy stwierdzano zwiększenie AlAT lub AspAT o >5 x GGN lub zwiększenie bilirubiny o >3 x GGN, stosowanie abirateronu octanu było wstrzymywane lub przerywane. W dwóch przypadkach wystąpiło znaczne zwiększenie wyników testów czynnościowych wątroby (patrz punkt 4.4). Tych dwóch pacjentów z prawidłową wyjściową czynnością wątroby doświadczyło zwiększenia AlAT lub AspAT od 15 do 40 x GGN i zwiększenia bilirubiny od 2 do 6 x GGN. Po odstawieniu abirateronu octanu u obu pacjentów testy czynnościowe wątroby powróciły do normy a u jednego pacjenta wznowiono leczenie bez ponownego zwiększania się wyników testów.
W badaniu 302 stwierdzono zwiększenie AlAT lub AspAT stopnia 3. lub 4. u 35 (6,5%) pacjentów leczonych abirateronu octanem. Zwiększenie aktywności aminotransferaz ustąpiło u wszystkich
z wyjątkiem 3 pacjentów (u 2 z nowymi przerzutami do wątroby a u 1 ze zwiększeniem AspAT po około 3 tygodniach od podania ostatniej dawki abirateronu octanu). W badaniach fazy 3, rezygnacje z leczenia z powodu zwiększenia AlAT i AspAT lub nieprawidłowej czynności wątroby stwierdzono u 1,1% pacjentów leczonych abirateronu octanem i u 0,6% pacjentów otrzymujących placebo. Nie było przypadków zgonów z powodu hepatotoksyczności.
Ryzyko wystąpienia hepatotoksyczności było w badaniach klinicznych zmniejszone wskutek wyłączenia pacjentów z wyjściowym zapaleniem wątroby lub znaczącymi odstępstwami od normy testów czynnościowych wątroby. Z badania 3011 wykluczano pacjentów z wyjściowymi wartościami AlAT i AspaT ≥2,5 x GGN, bilirubiny >1,5 x GGN oraz pacjentów z czynnym lub objawowym wirusowym zapaleniem wątroby lub przewlekłą chorobą wątroby; wodobrzusze lub zaburzenia krwotoczne jako następstwa dysfunkcji wątroby były wykluczane z badania. Z badania 301 wykluczano pacjentów z wyjściowymi wartościami AlAT i AspaT ≥2,5 x GGN w przypadku braku przerzutów do wątroby i >5 x GGN w razie obecności przerzutów do wątroby. Z badania 302 wykluczano pacjentów z przerzutami do wątroby oraz z wyjściowymi wartościami AlAT i AspAT
≥2,5 x GGN. Ujawnienie się nieprawidłowych wyników testów czynnościowych wątroby u pacjentów uczestniczących w badaniach klinicznych skutkowało zdecydowanym postępowaniem, wymagającym przerwania leczenia i zezwoleniem na wznowienie terapii dopiero po powrocie wyników testów czynnościowych wątroby do wartości wyjściowych (patrz punkt 4.2). Pacjentów ze zwiększeniem AlAT lub AspAT o >20 x GGN nie leczono ponownie. Nieznane jest bezpieczeństwo ponownego rozpoczęcia terapii u tych pacjentów. Mechanizm hepatotoksyczności nie jest poznany.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, fax: + 48 22 49-21-309, strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dostępne są jedynie ograniczone dane dotyczące przedawkowania abirateronu u ludzi.
Nie ma swoistego antidotum. W razie przedawkowania leczenie należy przerwać i zastosować ogólne leczenie podtrzymujące, w tym obserwację czynności serca pod kątem niemiarowości, hipokaliemii
i objawów przedmiotowych i podmiotowych zastoju płynów. Należy również ocenić czynność wątroby.
Grupa farmakoterapeutyczna: Leki stosowane w terapii hormonalnej, inni antagoniści hormonów i ich pochodne, Kod ATC: L02BX03
Mechanizm działania
Abirateronu octan jest zamieniany in vivo do abirateronu, inhibitora biosyntezy androgenów. Abirateron wybiórczo hamuje aktywność enzymu 17α-hydroksylazy i C17,20-liazy (CYP17). Enzym ten wykazuje swoje działanie i jest niezbędny do biosyntezy androgenów w jądrach, nadnerczach
i tkankach nowotworowych gruczołu krokowego. CYP17 jest katalizatorem przemiany pregnenolonu
i progesteronu do prekursorów testosteronu, DHEA i androstendionu, odpowiednio w reakcji
17α-hydroksylacji i rozerwania wiązania C17,20. Hamowanie CYP17 skutkuje także zwiększonym wytwarzaniem mineralokortykosteroidów w nadnerczach (patrz punkt 4.4).
Rak gruczołu krokowego, który jest wrażliwy na androgeny, reaguje na leczenie zmniejszające stężenie androgenów. Terapie supresji androgenowej, takie jak leczenie analogami LHRH lub orchidektomia, zmniejszają wytwarzanie androgenów w jądrach, lecz nie wpływają na wytwarzanie
androgenów w nadnerczach lub przez nowotwór. Leczenie abirateronem zmniejsza stężenie testosteronu w osoczu do wartości nieoznaczalnych (przy zastosowaniu testów komercyjnych), gdy jest stosowany z analogami LHRH (lub orchidektomią).
Rezultat działania farmakodynamicznego
Abirateron zmniejsza stężenie testosteronu i innych androgenów w surowicy do wartości niższych niż uzyskiwane po zastosowaniu samych analogów LHRH lub za pomocą orchidektomii. Wynika to
z wybiórczego hamowania enzymu CYP17 niezbędnego do biosyntezy androgenów. PSA służy jako biomarker u pacjentów z rakiem gruczołu krokowego. W badaniu klinicznym fazy 3 u pacjentów, którzy mieli niepowodzenie wcześniejszej chemioterapii z zastosowaniem taksanów, 38% pacjentów leczonych abirateronu octanem versus 10% otrzymujących placebo uzyskało co najmniej 50% zmniejszenie wartości PSA w porównaniu do wartości wyjściowych.
Skuteczność kliniczna i bezpieczeństwo stosowania
Skuteczność oceniano w trzech randomizowanych, wieloośrodkowych badaniach klinicznych 3 fazy z kontrolą placebo (badania 3011, 302 i 301) u pacjentów z mHSPC i mCRPC. Do badania 3011 włączono pacjentów z nowym rozpoznaniem mHSPC (w okresie 3 miesięcy od randomizacji), którzy mieli czynniki prognostyczne wysokiego ryzyka. Czynniki wysokiego ryzyka określono jako posiadanie co najmniej 2 z 3 następujących czynników ryzyka: (1) suma Gleason’a ≥8; (2) obecność 3 lub więcej zmian w Rtg kości; (3) obecność mierzalnych przerzutów trzewnych (z wyłączeniem węzłów chłonnych). W ramieniu z czynnym leczeniem podawano abirateron w dawce 1 000 mg na dobę, w skojarzeniu z małą dawką prednizonu 5 mg raz na dobę i supresją androgenową (agonista LHRH lub orchidektomia), co było standardem leczenia. Pacjenci w grupie kontrolnej otrzymywali supresję androgenową i placebo zamiast abirateronu i prednizonu. Do badania 302 włączono pacjentów, którzy wcześniej nie otrzymywali docetakselu; podczas gdy do badania 301 włączono pacjentów, którzy wcześniej otrzymywali docetaksel. Pacjenci stosowali analogi LHRH lub mieli wykonaną wcześniej orchidektomię. W czynnie leczonej grupie badanych, abirateronem podawano
w dawce 1 000 mg na dobę, w skojarzeniu z małą dawką prednizonu lub prednizolonu 5 mg dwa razy na dobę. Grupa kontrolna otrzymywała placebo i małą dawkę prednizonu lub prednizolonu 5 mg dwa razy na dobę.
Zmiany stężenia PSA w osoczu, niezależnie od parametru, nie zawsze wskazują na korzystne rezultaty kliniczne. Dlatego we wszystkich badaniach zalecano, aby pacjenci kontynuowali leczenie do momentu spełnienia kryteriów wykluczenia, podanych poniżej dla każdego badania.
Stosowanie spironolaktonu było niedozwolone we wszystkich badaniach, gdyż spironolakton wiąże się z receptorem androgenowym i może zwiększać stężenie PSA.
Badanie 3011 (pacjenci z nowym rozpoznaniem mHSPC wysokiego ryzyka)
W badaniu 3011, (n=1199), mediana wieku pacjentów włączonych do badania wynosiła 67 lat. Liczba pacjentów leczonych abirateronem w podziale na grupy rasowe była następująca: biała (kaukaska) 832 (69,4%), azjatycka 246 (20,5%), czarna lub afroamerykańska 25 (2,1%), inna 80 (6,7%), nieznana i (lub) niezgłoszona 13 (1,1%) oraz Indianie amerykańscy lub rdzenni mieszkańcy Alaski 3 (0,3%). Status wydolności ECOG wynosił 0 lub 1 u 97% pacjentów. Pacjenci ze stwierdzonymi przerzutami do mózgu, niekontrolowanym nadciśnieniem tętniczym, poważną chorobą serca lub niewydolnością serca klasy II do IV NYHA zostali wykluczeni z badania. Pacjenci wcześniej leczeni na raka gruczołu krokowego farmakoterapią, radioterapią lub chirurgicznie zostali wykluczeni z badania, z wyjątkiem tych poddanych terapii ADT do 3 miesięcy lub 1 cyklowi
radioterapii paliatywnej lub terapii chirurgicznej w celu leczenia objawów wynikających z przerzutów. Równorzędnymi, pierwszorzędowymi punktami końcowymi skuteczności były przeżycie całkowite (OS), przeżycie bez progresji radiograficznej (rPFS). Mediana wyjściowej skali bólu, oceniana za pomocą skróconego formularza bólu (BPI-SF), wyniosła 2,0 w obu grupach terapeutycznych i w grupie placebo. Oprócz powyższych punktów końcowych oceniono także korzyści w zakresie czasu do wystąpienia zdarzenia związanego z kośćcem (SRE), czasu do następnej terapii raka gruczołu krokowego, czasu do rozpoczęcia chemioterapii, czasu do progresji bólowej i czasu do progresji PSA.
Leczenie kontynuowano do czasu progresji choroby, wycofania zgody na udział w badaniu, wystąpienia nietolerowanej toksyczności lub zgonu.
Przeżycie bez progresji radiograficznej definiowano jako czas od randomizacji do wystąpienia progresji radiograficznej lub zgonu z jakiejkolwiek przyczyny. Progresja radiograficzna obejmowała progresję w RTG kości (zgodnie ze zmodyfikowanym PCWG2) lub progresję zmian w tkankach miękkich w TK lun NMR (zgodnie z RECIST 1.1).
Stwierdzono istotną różnicę w rPFS pomiędzy grupami terapeutycznymi (patrz Tabela 2 i Wykres 1).
Tabela 2: Przeżycie bez progresji radiograficznej - analiza stratyfikacyjna: populacja z zamiarem leczenia (ITT) (badanie PCR 3011)
Osoby randominizowane | AA-P 597 | Placebo 602 |
Zdarzenie | 239 (40,0%) | 354 (58,8%) |
Ocenzurowano | 358 (60,0%) | 248 (41,2%) |
Czas do zdarzenia (miesiące) | ||
Mediana (95% CI) | 33,02 (29,57, NE) | 14,78 (14,69, 18,27) |
Zakres | (0.0+, 41,0+) | (0,0+, 40,6+) |
Wartość pa Współczynnik ryzyka (95% CI)b | <0,0001 0,466 (0,394, 0,550) |
Uwaga: += obserwacja ocenzurowana, NE= brak możliwości oceny. Progresja radiograficzna i zgon były brane pod uwagę w definiowaniu zdarzenia rPFS. AA-P = Osoby, które otrzymywały abirateronu octan i prednizon.
a Wartość p pochodzi z logarytmicznego testu rang stratyfikowanego według punktacji ECOG PS (0/1 lub 2)
i zmian trzewnych (nieobecność lub obecność).
b Współczynnik ryzyka pochodzi ze stratyfikowanego proporcjonalnego modelu ryzyka. Współczynnik ryzyka
<1 na korzyść AA-P.
Wykres 1: Krzywa przeżycia Kaplana-Meiera bez progresji radiograficznej; populacja ITT (badanie PCR 3011)
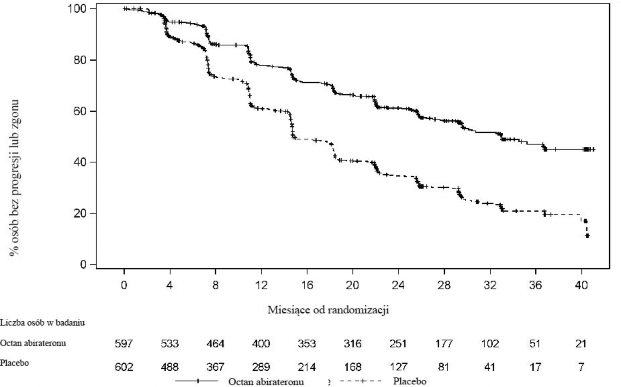
Stwierdzono statystycznie znamienną poprawę OS na korzyść AA-P plus ADT z 34% zmniejszeniem ryzyka zgonu w porównaniu do placebo plus ADT (HR=0,66; 95% CI: 0,56; 0,78; p<0,0001) (patrz Tabela 3 i Wykres 2).
Tabela 3: Całkowite przeżycie pacjentów otrzymujących abirateron lub placebo w badaniu PCR3011 (analiza z zamiarem leczenia)
Całkowite przeżycie (w miesiącach) AA-P (N=597)
Placebo (N=602)
Zgony (%) 275 (46%) 343 (57%)
Mediana przeżycia (w miesiącach)
53,3
36,5
(95% CI)
Iloraz ryzyka (95% CI)1
(48,2; NE)
(33,5; 40,0)
0,66 (0,56; 0,78)
NE= brak możliwości oceny. AA-P = Osoby, które otrzymywały abirateronu octan i prednizon.
1 Współczynnik ryzyka pochodzi ze stratyfikowanego proporcjonalnego modelu ryzyka. Współczynnik ryzyka
<1 na korzyść abirateronu z prednizonem.
Wykres 2: Krzywa Kaplana-Meiera całkowitego przeżycia; Populacja ITT z analizy badania PCR3011
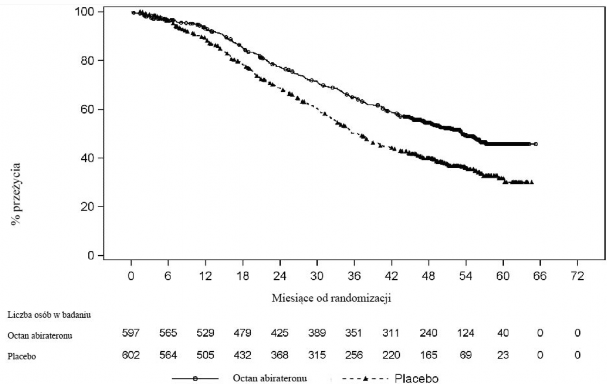
Analizy podgrup spójnie wykazują korzyści leczenia abirateronem. Wyniki leczenia AA-P na rPFS i OS w ustalonych wcześniej podgrupach były korzystne i spójne z całkowitą populacją badania,
z wyjątkiem podgrupy z wynikiem 2 ECOG, gdzie nie stwierdzono korzystnego trendu, jednakże niewielka liczba badanych (n=40) ogranicza możliwości wyciągnięcia wiążących wniosków.
Oprócz stwierdzonej poprawy w przeżyciu całkowitym i rPFS wykazano korzyści stosowania produktu abirateronu w porównaniu z placebo we wszystkich prospektywnie zdefiniowanych drugorzędowych punktach końcowych.
Badanie 302 (pacjenci, którzy wcześniej nie otrzymywali chemioterapii)
Do badania włączono pacjentów bez objawów lub z objawami o nieznacznym lub niewielkim nasileniu, którzy wcześniej nie stosowali chemioterapii i u których zastosowanie chemioterapii nie było jeszcze wskazane klinicznie. Wynik 0-1 w skali BPI-SF (ang. Brief Pain Inventory-Short Form) dla najsilniejszego bólu w ciągu ostatnich 24 godzin uznawano za brak objawów, a wynik 2-3 uznawano za objawy o niewielkim nasileniu.
W badaniu 302 (n=1,088) mediana wieku włączonych pacjentów wyniosła 71 lat dla pacjentów leczonych abirateronem z prednizonem lub prednizolonem oraz 70 lat dla pacjentów otrzymujących placebo z prednizonem lub prednizolonem. Liczby pacjentów leczonych abirateronem w podziale na grupy rasowe były następujące: biała (kaukaska) 520 (95,4%), czarna 15 (2,8%), azjatycka 4 (0,7%) i inne 6 (1,1%). Status wydolności ECOG (ang. Eastern Cooperative Oncology Group) wynosił 0 dla
76% pacjentów i 1 dla 24% pacjentów w obu grupach. 50% pacjentów miało tylko przerzuty do kości, dodatkowe 31% pacjentów miało przerzuty do kości i tkanek miękkich lub do węzłów chłonnych,
a 19% pacjentów miało tylko przerzuty do tkanek miękkich lub do węzłów chłonnych. Wykluczano pacjentów z przerzutami trzewnymi. Współtowarzyszące pierwszorzędowe punkty końcowe to całkowite przeżycie i przeżycie bez radiograficznej progresji (rPFS). Ponadto, oprócz oceny
współtowarzyszących pierwszorzędowych punktów końcowych, oceniano także korzyści
z wykorzystaniem czasu do zastosowania opioidów w bólu nowotworowym, czasu do włączenia chemioterapii cytotoksycznej, czasu do pogorszenia punktacji wydolności ECOG o ≥1 punkt i czasu
% przeżycia do progresji PSA, w oparciu o kryteria PCWG2 (ang. Prostate Cancer Working Group-2). Leczenie odstawiano w momencie stwierdzenia ewidentnej progresji klinicznej. Leczenie mogło być także odstawione w momencie potwierdzonej progresji radiograficznej wg uznania badacza.
Przeżycie bez radiograficznej progresji (rPFS) oceniano z zastosowaniem sekwencyjnych badań obrazowych, definiowanych za pomocą kryteriów PCWG2 (dla uszkodzeń kości) i modyfikowanych kryteriów RECIST (Response Evaluation Criteria In Solid Tumors) (dla uszkodzeń tkanek miękkich). W analizie rPFS wykorzystywano rewidowaną centralnie radiograficzną ocenę progresji.
W zaplanowanej analizie rPFS było 401 zdarzeń, 150 (28%) pacjentów leczonych abirateronem i 251 (46%) pacjentów otrzymujących placebo miało radiograficzne potwierdzenie progresji lub zmarło.
Zaobserwowano istotne różnice w rPFS pomiędzy leczonymi grupami (patrz Tabela 4. i Wykres 3.).
Tabela 4: Badanie 302: Przeżycie bez progresji radiograficznej u pacjentów otrzymujących abirateron lub placebo w skojarzeniu z prednizonem lub prednizolonem oraz analogami LHRH lub po wcześniejszej orchidektomii
Abirateron (N=546) | Placebo (N=542) | |
Przeżycie bez radiograficznej progresji (rPFS) | ||
Progresja lub zgon | 150 (28%) | 251 (46%) |
Mediana rPFS w miesiącach | nie osiągnięto | 8,3% |
(95% CI) | (11,66; NE) | (8,12; 8,54) |
Wartość p* <0,0001 | ||
Współczynnik ryzyka** (95% CI) 0,425 (0,347; 0,522) | ||
NE = nie oceniono
** Współczynnik ryzyka <1 na korzyść abirateronu.
Wykres 5: Krzywe przeżycia Kaplana-Meiera u pacjentów otrzymujących abirateron lub placebo w skojarzeniu z prednizonem lub prednizolonem oraz analogami LHRH lub po wcześniejszej orchidektomii, analiza końcowa
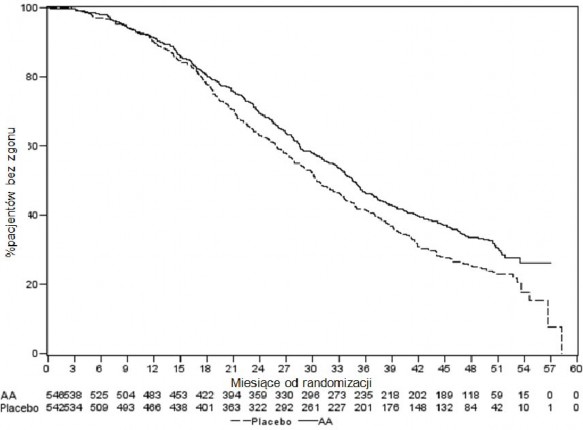
AA = abirateron
Oprócz stwierdzonej poprawy w całkowitym czasie przeżycia i rPFS wykazano korzyści z terapii
abirateronem vs. placebo we wszystkich drugorzędowych punktach końcowych zgodnie z poniższym:
Czas do progresji PSA wg kryteriów PCWG2: mediana czasu do progresji PSA wyniosła
11,1 miesiąca dla pacjentów otrzymujących abirateron i 5,6 miesięcy dla pacjentów otrzymujących placebo (HR=0,488; 95% CI: [0,420, 0,568], p <0,0001). Czas do progresji PSA był około dwukrotnie dłuższy podczas terapii abirateronem (HR=0,488). Odsetek pacjentów z potwierdzoną odpowiedzią PSA był większy w grupie abirateronu niż w grupie placebo (62% vs. 24%, p <0,0001). U pacjentów z mierzalną chorobą tkanek miękkich, podczas terapii abirateronem zaobserwowano znaczące zwiększenie liczby całkowitych lub częściowych odpowiedzi guzów na leczenie.
Czas do zastosowania opioidów w bólu nowotworowym: mediana czasu do zastosowania opioidów
w bólu nowotworowym gruczołu krokowego w czasie analizy końcowej wyniosła 33,4 miesiąca u pacjentów stosujących abirateron, a u pacjentów otrzymujących placebo wyniosła 23,4 miesiąca (HR=0,721; 95% CI: [0,614; 0,846], p <0,0001).
Czas do włączenia cytotoksycznej chemioterapii: mediana czasu do włączenia cytotoksycznej chemioterapii wyniosła 25,2 miesiąca u pacjentów stosujących abirateron, a u pacjentów otrzymujących placebo wyniosła 16,8 miesiąca (HR = 0,580; 95% CI: [0,487; 0,691], p < 0,0001).
Czas do pogorszenia punktacji wydolności ECOG o ≥1 punkt: mediana czasu do pogorszenia punktacji wydolności ECOG o ≥1 punkt wyniosła 12,3 miesiąca u pacjentów stosujących abirateron, a u pacjentów otrzymujących placebo wyniosła 10,9 miesięcy (HR = 0,821; 95% CI: [0,714; 0,943], p=0,0053).
Następujące punkty końcowe wykazały statystycznie znamienną przewagę terapii abirateronem:
Obiektywna odpowiedź: obiektywną odpowiedź definiuje się jako proporcja badanych osób
z mierzalną chorobą, uzyskujących całkowitą lub częściową odpowiedź zgodnie z kryteriami RECIST (wymagana wyjściowa wielkość węzła chłonnego ≥2 cm, by uznać ją za zmianę docelową).
Odsetek badanych z mierzalną chorobą w punkcie wyjścia, którzy mieli obiektywną odpowiedź, wyniósł 36% w grupie abirateronu i 16% w grupie placebo (p <0,0001).
Ból: leczenie abirateronem znacząco zmniejszyło ryzyko progresji średniego nasilenia bólu o 18% w porównaniu z placebo (p=0,0490). Mediana czasu do progresji wyniosła 26,7 miesiąca w grupie abirateronu i 18,4 miesiąca w grupie placebo.
Czas do pogorszenia FACT-P (całkowitego wyniku): leczenie abirateronem zmniejszyło ryzyko pogorszenia FACT-P (całkowitego wyniku) o 22% w porównaniu z placebo (p=0,0028). Mediana czasu do pogorszenia FACT-P (całkowitego wyniku) wyniosła 12,7 miesiąca w grupie abirateronu i 8,3 miesiąca w grupie placebo.
Badanie 301 (pacjenci otrzymujący wcześniej chemioterapię)
Do badania 301 włączono pacjentów, którzy otrzymywali wcześniej docetaksel. Nie było wymagane, by pacjenci wykazywali progresję choroby w trakcie leczenia docetakselem, gdyż toksyczność tej chemioterapii może skutkować przerwaniem leczenia. U pacjentów kontynuowano podawanie badanych leków aż do progresji PSA (potwierdzone 25% zwiększenie wartości w stosunku do wartości wyjściowych/najniższych [nadir]) wspólnie z progresją radiograficzną, definiowaną
wg protokołu i progresją w zakresie objawów klinicznych. Pacjentów z wcześniejszą terapią raka gruczołu krokowego ketokonazolem wyłączono z badania. Pierwszorzędowym punktem końcowym skuteczności był całkowity czas przeżycia.
Mediana wieku włączonych pacjentów wyniosła 69 lat (zakres 39 – 95). Liczba pacjentów leczonych abirateronem w podziale na grupy rasowe była następująca: rasa biała (kaukaska) 737 (93,2%), rasa
czarna 28 (3,5%), rasa azjatycka 11 (1,4%) i inni 14 (1,8%). Jedenaście procent włączonych pacjentów miało punktację wydolności w skali ECOG wynoszącą 2; 70% miało wyniki radiograficzne wskazujące na postęp choroby z lub bez progresji PSA; 70% otrzymało wcześniej jeden cykl cytotoksycznej chemioterapii, a 30% otrzymało dwa cykle. U 11% pacjentów leczonych abirateronem występowały przerzuty do wątroby.
W planowej analizie przeprowadzonej po 552 zgonach stwierdzono, że zmarło 42% (333 z 797) pacjentów leczonych abirateronem w porównaniu z 55% (219 z 398) pacjentów otrzymujących placebo. Wykazano istotną statystycznie poprawę w medianie całkowitego czasu przeżycia
u pacjentów leczonych abirateronem (patrz Tabela 7).
Tabela 7: Całkowity czas przeżycia pacjentów otrzymujących abirateron lub placebo
w skojarzeniu z prednizonem lub prednizolonem oraz analogami LHRH lub po wcześniejszej orchidektomii
Abirateron | Placebo | |
Pierwotna analiza przeżywalności | (N=797) | (N=398) |
Zgony (%) Mediana przeżycia w miesiącach (95% CI) | 333 (42%) 14,8 (14,1; 15,4) | 219 (55%) 10,9 (10,2; 12,0) |
Wartość pa Współczynnik ryzyka (95% CI)b | <0,0001 0,646 (0,543;0,768) | |
Zaktualizowana pierwotna analiza przeżywalności Zgony (%) | 501 (63%) 274 (69%) | |
Mediana przeżycia w miesiącach (95% CI) | 15,8 (14,8; 17,0) | 11,2 (10,4; 13,1) |
Współczynnik ryzyka (95% CI)b | 0,740 (0,638; 0,859) | |
a wartość p pochodzi z logarytmicznego testu rang stratyfikowanego wg punktacji skali wydolności ECOG (0-1 vs. 2), punktacji bólu (nieobecny vs. obecny), liczby wcześniejszych schematów chemioterapii (1 vs. 2) i rodzaju progresji choroby (tylko PSA vs. radiograficzna).
b Współczynnik ryzyka pochodzi ze stratyfikowanego proporcjonalnego modelu ryzyka. Współczynnik ryzyka
<1 na korzyść abirateronu.
We wszystkich ocenianych punktach czasowych, po kilku początkowych miesiącach leczenia, większy odsetek pacjentów leczonych abirateronem pozostawał przy życiu w porównaniu
z pacjentami otrzymującymi placebo (patrz Wykres 6).
Wykres 6: Krzywe przeżycia Kaplana-Meiera u pacjentów otrzymujących abirateron lub placebo w skojarzeniu z prednizonem lub prednizolonem oraz analogami LHRH lub po wcześniejszej orchidektomii
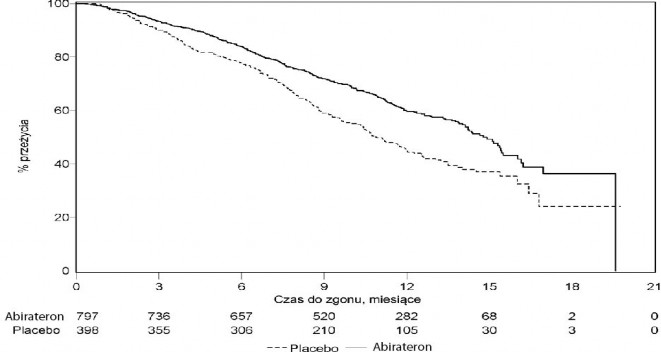
AA = abirateron
Analizy przeżycia w podgrupach zgodnie wykazały korzyści z terapii abirateronem (patrz Wykres 7).
Wykres 7: Całkowity czas przeżycia w podgrupach: współczynnik ryzyka i 95% przedział ufności
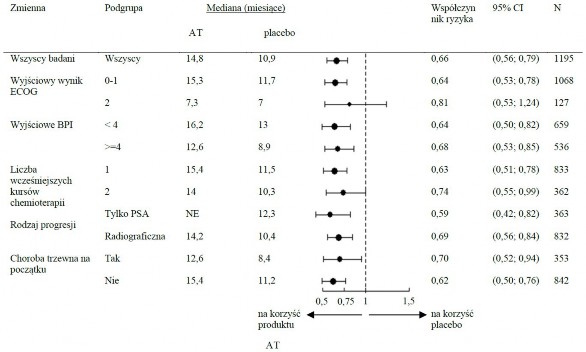
AA = abirateron; BPI = Skala bólu; CI = przedział ufności; ECOG = skala wydolności ECOG (Eastern Cooperative Oncology Group); HR = współczynnik ryzyka; NE = brak możliwości oceny
Oprócz stwierdzonej poprawy całkowitego czasu przeżycia wszystkie drugorzędowe punkty końcowe badania faworyzowały abirateron i były znamienne statystycznie po dostosowaniu do testów wielokrotnych, jak następuje:
Pacjenci otrzymujący abirateron wykazali znacznie większą całkowitą częstość odpowiedzi PSA (definiowaną jako ≥50% zmniejszenie z punktu wyjścia) w porównaniu do pacjentów otrzymujących placebo, 38% vs. 10%, p <0,0001.
Mediana czasu do progresji PSA wynosiła 10,2 miesiąca dla pacjentów leczonych abirateronem
i 6,6 miesiąca dla pacjentów otrzymujących placebo (HR = 0,580; 95% CI: [0,462; 0,728], p <0,0001).
Mediana czasu przeżycia bez radiograficznej progresji wynosiła 5,6 miesiąca dla pacjentów leczonych abirateronem i 3,6 miesiąca dla pacjentów otrzymujących placebo (HR = 0,673; 95% CI: [0,585; 0,776], p <0,0001).
Ból
Odsetek pacjentów z paliacją objawów bólowych był znamiennie statystycznie większy w grupie abirateronu niż w grupie placebo (44% vs. 27%, p=0,0002). Respondent paliacji objawów bólowych był definiowany jako pacjent, który uzyskiwał co najmniej 30% zmniejszenie wyniku BPI-SF nasilenia najgorszego bólu w porównaniu do wartości wyjściowych w ciągu ostatnich 24 godzin, bez żadnego zwiększenia punktacji zastosowania leków przeciwbólowych, stwierdzane w dwóch następujących po sobie badaniach w odstępie czterotygodniowym. Paliację objawów bólowych analizowano tylko u pacjentów (n=512) z wyjściową punktacją bólu ≥4 i co najmniej jednym wynikiem oceny bólu uzyskanym po badaniu wstępnym.
Mniejszy odsetek pacjentów leczonych abirateronem miał progresję bólu w porównaniu do pacjentów otrzymujących placebo w 6 (22% vs. 28%), 12 (30% vs. 38%) i 18 miesiącu (35% vs. 46%). Progresję bólu definiowano jako zwiększenie z punktu wyjścia o ≥30% wyniku BPI-SF nasilenia najgorszego bólu w ciągu ostatnich 24 godzin, bez zmniejszenia punktacji zastosowania leków przeciwbólowych, stwierdzane w dwóch następujących po sobie wizytach lub zwiększenie o ≥30% punktacji zastosowania leków przeciwbólowych, stwierdzane w dwóch następujących po sobie wizytach. Czas do progresji bólu w 25-tym percentylu wynosił 7,4 miesięcy w grupie abirateronu w porównaniu do 4,7 miesięcy w grupie placebo.
Zdarzenia dotyczące kośćca
U mniejszego odsetka pacjentów w grupie abirateronu występowały zdarzenia dotyczące kośćca
w porównaniu do grupy placebo po 6 miesiącach (18% vs. 28%), 12 miesiącach (30% vs. 40%),
i 18 miesiącach (35% vs. 40%) terapii. Czas do wystąpienia pierwszego zdarzenia dotyczącego kośćca w 25-tym percentylu w grupie abirateronu był dwukrotnie dłuższy niż w grupie kontrolnej:
9,9 miesiąca w porównaniu do 4,9 miesiąca. Zdarzenia dotyczące kośćca obejmowały: złamania patologiczne, ucisk rdzenia kręgowego, paliatywną radioterapię kości lub zabiegi chirurgiczne kości.
Dzieci i młodzież
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań abirateronu we wszystkich podgrupach populacji dzieci i młodzieży w zaawansowanym raku gruczołu krokowego. Zastosowanie u dzieci i młodzieży patrz punkt 4.2.
Zbadano farmakokinetykę abirateronu i abirateronu octanu po podaniu abirateronu octanu u zdrowych osób, pacjentów z zaawansowanym rakiem gruczołu krokowego z przerzutami oraz u osób bez raka
z zaburzeniami czynności wątroby i nerek. Abirateronu octan jest szybko zamieniany in vivo do abirateronu, inhibitora biosyntezy androgenów (patrz punkt 5.1).
Wchłanianie
Po doustnym podaniu na czczo abirateronu octanu, czas do osiągnięcia maksymalnego stężenia
w osoczu wynosił około 2 godziny.
Podawanie abirateronu octanu z jedzeniem w porównaniu do podawania na czczo skutkowało nawet 10-krotnym zwiększeniem [AUC] i 17-krotnym [Cmax] zwiększeniem średniego całkowitego wpływu abirateronu na organizm, zależnego od zawartości tłuszczu w posiłku. Biorąc pod uwagę różnorodność zawartości i składu posiłków, przyjmowanie abirateronu z posiłkami może potencjalnie skutkować dużą zmiennością ekspozycji. Dlatego abirateronu nie wolno przyjmować razem z jedzeniem. Należy go przyjmować co najmniej jedną godzinę przed lub co najmniej dwie godziny po posiłku. Tabletki należy połykać w całości, popijając wodą (patrz punkt 4.2).
Dystrybucja
Znakowany 14C-abirateron wiąże się z ludzkimi białkami osocza w 99,8%. Pozorna objętość dystrybucji wynosi około 5,630 l, co sugeruje, że abirateron podlega znacznej dystrybucji w tkankach obwodowych.
Metabolizm
Po doustnym podaniu znakowanego 14C- abirateronu octanu w kapsułkach, abirateronu octan jest hydrolizowany do abirateronu, który następnie podlega metabolizmowi m.in. sulfuryzacji, hydroksylacji i utlenianiu, głównie w wątrobie. Większość krążącej promieniotwórczości (około 92%) jest znajdowane w postaci metabolitów abirateronu. Z 15 wykrytych metabolitów, 2 podstawowe metabolity, siarczan abirateronu i siarczan N-tlenku abirateronu, stanowią około 43% całkowitej promieniotwórczości każdy.
Eliminacja
Na podstawie danych uzyskanych od zdrowych osób średni okres półtrwania abirateronu w osoczu wynosi około 15 godzin. Po doustnym podaniu dawki 1 000 mg znakowanego 14C- abirateronu octanu około 88% dawki promieniotwórczej znajduje się w kale, a około 5% w moczu.
Większość składników znalezionych w kale stanowi niezmieniony abirateronu octan i abirateron
(odpowiednio około 55% i 22% podanej dawki).
Zaburzenia czynności wątroby
Zbadano farmakokinetykę abirateronu octanu u osób z istniejącymi wcześniej łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby (odpowiednio klasa Child-Pugh A i B) oraz
w grupie kontrolnej zdrowych osób. Całkowite narażenie organizmu na abirateron po pojedynczym doustnym podaniu dawki 1 000 mg zwiększało się odpowiednio o 11% i 260% u osób z łagodnymi
i umiarkowanymi zaburzeniami czynności wątroby. Średni okres półtrwania abirateronu wydłużył się do około 18 godzin u osób z łagodnymi zaburzeniami czynności wątroby i do około 19 godzin u osób z umiarkowanymi zaburzeniami czynności wątroby.
W innym badaniu oceniano farmakokinetykę abirateronu u osób (n=8) z wcześniej występującymi ciężkimi zaburzeniami wątroby (klasa C Child-Pugh) oraz w grupie kontrolnej u 8 zdrowych osób z prawidłową czynnością wątroby. AUC abirateronu zwiększyła się o około 600%, a wolna frakcja leku zwiększyła się o 80% u osób z ciężkimi zaburzeniami wątroby w porównaniu z osobami
z prawidłową czynnością wątroby.
Nie jest konieczne dostosowywanie dawki u pacjentów z występującymi wcześniej łagodnymi zaburzeniami czynności wątroby.
Zastosowanie abirateronu octanu należy rozważnie ocenić u pacjentów z umiarkowanymi zaburzeniami czynności wątroby, u których korzyści powinny jasno przeważać nad ryzykiem (patrz punkty 4.2 i 4.4). Nie należy stosować abirateronu octanu u pacjentów z ciężkimi zaburzeniami czynności wątroby (patrz punkty 4.2, 4.3 i 4.4).
U pacjentów, u których wystąpi hepatotoksyczność podczas leczenia, może być konieczne zawieszenie leczenia lub dostosowanie dawki (patrz punkty 4.2 i 4.4).
Zaburzenia czynności nerek
Porównano farmakokinetykę abirateronu octanu u pacjentów z krańcowym stadium choroby nerek, stabilnych na hemodializie z dopasowaną grupą kontrolną osób z prawidłową czynnością nerek.
Całkowite narażenie organizmu na abirateron po pojedynczym doustnym podaniu dawki 1000 mg nie zwiększyło się u dializowanych pacjentów z krańcowym stadium choroby nerek. Nie jest konieczne zmniejszanie podawanej dawki u pacjentów z zaburzeniami czynności nerek, w tym z ciężkimi zaburzeniami czynności nerek (patrz punkt 4.2). Brak danych klinicznych u pacjentów z rakiem gruczołu krokowego i ciężkimi zaburzeniami czynności nerek. Należy zachować ostrożność u tych pacjentów.
We wszystkich badaniach toksyczności u zwierząt stwierdzano znaczne zmniejszenie stężeń krążącego testosteronu. Skutkiem czego, występowało zmniejszenie masy narządów oraz zmiany morfologiczne i (lub) histopatologiczne w narządach rozrodczych, nadnerczach, przysadce i sutkach. Wszystkie zmiany były całkowicie lub częściowo odwracalne. Zmiany w narządach rozrodczych oraz narządach wrażliwych na androgeny są zgodne z farmakologią abirateronu. Wszystkie związane
z leczeniem zmiany hormonalne były odwracalne lub ustępowały po okresie 4 tygodni.
W badaniach nad płodnością, zarówno u samców jak i samic szczurów, abirateronu octan zmniejszał płodność, co było całkowicie odwracalne w ciągu 4 do 16 tygodni od przerwania podawania abirateronu octanu.
W badaniu toksycznego wpływu na rozwój u szczurów, abirateronu octan wpływał na ciążę, m.in. skutkował zmniejszeniem masy płodu i przeżycia. Stwierdzano wpływ na zewnętrzne narządy płciowe, chociaż abirateronu octan nie był teratogenny.
W tych badaniach płodności i toksycznego wpływu na rozwój, przeprowadzonych na szczurach, wszystkie działania były związane z farmakologicznym działaniem abirateronu.
Oprócz zmian w narządach rozrodczych, stwierdzonych we wszystkich badaniach toksyczności u zwierząt, nie ujawniono szczególnego zagrożenia dla człowieka w oparciu o dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań
toksyczności po podaniu wielokrotnym, genotoksyczności i rakotwórczości. Abirateronu octan nie wykazywał działania rakotwórczego w 6-miesięcznym badaniu u transgenicznych myszy (Tg.rasH2). W 24-miesięcznym badaniu rakotwórczości u szczurów, abirateronu octan zwiększał częstość występowania nowotworów komórek interstycjalnych w jądrach. To odkrycie uważa się za związane z działaniem farmakologicznym abirateronu i specyficzne dla szczurów. Abirateronu octan nie był rakotwórczy u samic szczurów.
Substancja czynna, abirateron, stanowi zagrożenie dla środowiska wodnego, w szczególności dla ryb.
Celuloza mikrokrystaliczna typ 102 Kroskarmeloza sodowa
Laktoza jednowodna Magnezu stearynian Hypromeloza 2910
Krzemionka koloidalna bezwodna
Sodu laurylosiarczan
OtoczkaAquaPolish P violet 650.02.PVA:
Żelaza tlenek czarny (E 172) Żelaza tlenek czerwony (E 172)
Kopolimer szczepiony makrogolu i alkoholu poli(winylowego) Talk
Tytanu dwutlenek (E 171)
Nie dotyczy.
3 lata
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Blistry z folii PVC/PVDC/Aluminium pakowane w tekturowe pudełka, zawierające 56, 60, 60 x 1 lub
112 tabletek powlekanych.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie
z lokalnymi przepisami. Ten produkt leczniczy może stanowić zagrożenie dla środowiska wodnego (patrz punkt 5.3).
Aristo Pharma Sp. z o.o. ul. Baletowa 30
02-867 Warszawa
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 27.07.2022
maj 2023











