Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Ketokonazol zwiększał 5-krotnie stężenia w osoczu midazolamu podanego dożylnie, natomiast końcowy okres półtrwania zwiększał około 3-krotnie.
Worykonazol zwiększał 3-krotnie ekspozycję na midazolam podanego dożylnie, natomiast jego okres półtrwania w fazie eliminacji zwiększał prawie 3-krotnie.
Flukonazol i itrakonazol; oba zwiększały 2-3-krotnie stężenie w osoczu midazolamu podanego dożylnie, co wiązało się ze zwiększeniem końcowego okresu półtrwania odpowiednio
2,4-krotnie dla itrakonazolu i 1,5-krotnie dla flukonazolu.
Posakonazol zwiększał około 2-krotnie stężenie w osoczu midazolamu podanego dożylnie.
Antybiotyki makrolidowe:
Erytromycyna zwiększała stężenie w osoczu midazolamu podanego dożylnie około
1,6-2-krotnie, co wiązało się z 1,5-1,8-krotnym zwiększeniem końcowego okresu półtrwania midazolamu.
Klarytromycyna zwiększała stężenie w osoczu midazolamu podanego dożylnie ponad 2,5-krotnie, co wiązało się z 1,5-2-krotnym zwiększeniem końcowego okresu półtrwania.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Epistatus, 10 mg, roztwór do stosowania w jamie ustnej
Każda strzykawka doustna napełniona (1 ml) zawiera midazolamu maleinian w ilości odpowiadającej 10 mg midazolamu.
Substancje pomocnicze o znanym działaniu Etanol 197 mg/ml
Maltitol ciekły qs do 1 ml (675 mg).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do stosowania w jamie ustnej. Przezroczysty, bezbarwny do jasnożółtego roztwór. Wartość pH: 4,6 do 5,6.
Produkt Epistatus jest wskazany w leczeniu przedłużonych, ostrych napadów drgawkowych u dzieci i młodzieży w wieku od 10 lat do mniej niż 18 lat.
Pacjentom, u których rozpoznano padaczkę, produkt Epistatus mogą podawać wyłącznie rodzice lub opiekunowie.
Dawkowanie
Dzieci i młodzież w wieku od 10 lat do mniej niż 18 lat Standardowa dawka wynosi 10 mg (1 ml).
Opiekunowie mogą podać jedynie pojedynczą dawkę midazolamu. Jeśli napady nie ustąpią szybko po podaniu midazolamu, należy skontaktować się z pogotowiem ratunkowym, biorąc pod uwagę zalecenia przekazane przez lekarza, który przepisał ten produkt leczniczy oraz lokalne wytyczne.
Należy przekazać pracownikowi służby zdrowia pustą strzykawkę, aby wiedział, jaką dawkę i jaki lek otrzymał pacjent.
Po otrzymaniu midazolamu pacjenci powinni pozostawać pod nadzorem opiekuna, który powinien pozostać przy pacjencie.
Jeśli po wstępnej odpowiedzi ponownie wystąpią drgawki, nie należy podawać drugiej dawki ani kolejnych bez uprzedniej konsultacji z lekarzem (patrz punkt 5.2).
Dzieci i młodzież
Ten produkt leczniczy należy stosować tylko u dzieci i młodzieży w wieku od 10 lat do mniej niż 18 lat.
Osoby z otyłością
Nie opisano badań dotyczących skuteczności podawania midazolamu u dzieci z otyłością. W związku z tym brak jest dostępnych danych.
Zaburzenia czynności nerek
Nie opisano badań dotyczących skuteczności midazolamu u dzieci z przewlekłą niewydolnością nerek. Dawki wielokrotne midazolamu podawane pacjentom z przewlekłą niewydolnością nerek mogą powodować opóźnienie eliminacji midazolamu i wydłużenie jego działania. Jednak, w przypadku leczenia ostrych napadów drgawkowych, kiedy stosuje się jedną lub dwie dawki midazolamu, kumulacja związku macierzystego lub jego metabolitów jest mało prawdopodobna, aby mogła spowodować istotne klinicznie wydłużenie działania farmakologicznego.
Zaburzenia czynności wątroby
Nie opisano badań dotyczących skuteczności midazolamu u dzieci z przewlekłą niewydolnością wątroby.
Zaburzenia czynności wątroby powodują zmniejszenie klirensu midazolamu, czego następstwem jest wydłużony końcowy okres półtrwania. W rezultacie, działanie kliniczne może być silniejsze
i przedłużone, dlatego u pacjentów z zaburzeniami czynności wątroby po podaniu midazolamu zaleca się dokładne monitorowanie działania klinicznego oraz parametrów życiowych (patrz punkt 4.4).
Produkt Epistatus jest przeciwwskazany u pacjentów z ciężkimi zaburzeniami czynności wątroby (patrz punkt 4.3).
Pacjenci krytycznie chorzy
Nie opisano badań dotyczących skuteczności midazolamu u dzieci krytycznie chorych.
Niewydolność serca
Nie opisano badań dotyczących skuteczności midazolamu u dzieci z niewydolnością serca.
Sposób podawania
Produkt Epistatus należy podawać na śluzówkę jamy ustnej. Należy go stosować tylko w jamie ustnej.
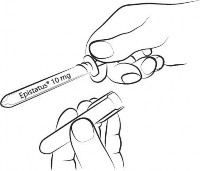
Przed użyciem należy zdjąć bursztynową osłonkę.
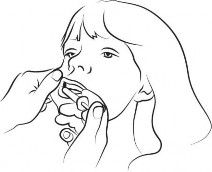
Za pomocą dostarczonej napełnionej strzykawki doustnej do każdej jamy policzkowej (przestrzeni między dziąsłem a policzkiem), należy podać w czasie 2-3 sekund około połowy przepisanej dawki. Należy unikać podania do gardła lub tchawicy, aby zapobiec przypadkowej aspiracji roztworu.
W przypadku szczególnych trudności z umieszczeniem strzykawki w jamie ustnej, całą dawkę należy podać do jednej jamy policzkowej w ciągu 4-5 sekund.
Instrukcja dotycząca sposobu podawania produktu leczniczego, patrz poniżej.
Nie stosować, jeśli roztwór nie jest klarowny (np. obecne są zmętnienia lub białe cząstki).
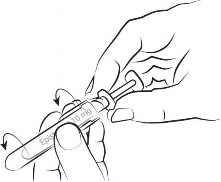
| Krok 1 Wyciągnij znajdujące się z boku zabezpieczenie wskazujące na naruszenie opakowania zewnętrznego z polipropylenu, otwórz opakowanie i wyjmij strzykawkę. |
| Krok 2 Trzymając za przezroczyste uchwyty strzykawki, odkręć bursztynową osłonę w kierunku przeciwnym do ruchu wskazówek zegara i zdejmij ją. |
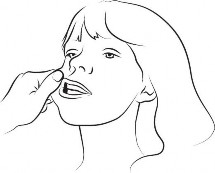
| Krok 3 Palcem wskazującym i kciukiem delikatnie ściśnij i odciągnij policzek pacjenta. Umieścić końcówkę strzykawki w tylnej części przestrzeni między wewnętrzną powierzchnią policzka a dolnym dziąsłem (jama policzkowa). |
| Krok 4 Powoli podawaj około połowy objętości roztworu do jamy policzkowej po jednej stronie jamy ustnej, a następnie powoli podawaj resztę po drugiej stronie, naciskając tłok strzykawki, aż się zatrzyma. Jeśli szczególnie trudno jest wprowadzić strzykawkę do jamy policzkowej po jednej stronie, wówczas należy podać całą dawkę, w ciągu 4–5 sekund po jednej stornie jamy ustnej. Bezpiecznie wyrzucić strzykawkę i nasadkę. |
Nadwrażliwość na substancję czynną, benzodiazepiny lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Miastenia gravis (nużliwość mięśni). Ciężka niewydolność oddechowa.
Zespół bezdechu sennego.
Ciężkie zaburzenia czynności wątroby.
Do strzykawki doustnej nie należy przyłączać igły, cewników dożylnych ani innych urządzeń przeznaczonych do podania pozajelitowego. Produkt Epistatus należy podawać wyłącznie na śluzówkę jamy ustnej.
Podczas podawania produktu należy zachować ostrożność, aby uniknąć u pacjenta ryzyka zadławienia.
Niewydolność oddechowa:
Midazolam należy stosować z zachowaniem ostrożności u pacjentów z przewlekłą niewydolnością oddechową, ponieważ może on dodatkowo hamować czynność oddechową.
Zaburzenia eliminacji midazolamu:
Midazolam należy stosować z zachowaniem ostrożności u pacjentów z przewlekłą niewydolnością nerek, zaburzeniami czynności wątroby lub serca. Midazolam może się kumulować u pacjentów
z przewlekłą niewydolnością nerek, zaburzeniami czynności wątroby, natomiast u pacjentów z zaburzeniami czynności serca może zmniejszyć się klirens midazolamu.
Jednoczesne stosowanie z innymi benzodiazepinami:
Osłabieni pacjenci są bardziej podatni na działanie benzodiazepin na ośrodkowy układ nerwowy (OUN) (patrz punkt 4.5).
Ryzyko związane z jednoczesnym stosowaniem opioidów:
Jednoczesne stosowanie produktu Epistatus i opioidów może powodować sedację, depresję oddechową, śpiączkę i śmierć. Ze względu na to ryzyko, jednoczesne przepisywanie leków uspokajających, takich jak benzodiazepiny lub leku podobnego do produktu Epistatus i opioidów, należy ograniczyć dla pacjentów, u których alternatywne opcje leczenia nie są możliwe. W przypadku podjęcia decyzji o przepisaniu produktu Epistatus jednocześnie z opioidami, należy stosować najmniejszą skuteczną dawkę opioidów i przez możliwie najkrótszy czas.
Pacjentów należy uważnie obserwować pod kątem oznak i objawów depresji oddechowej i sedacji.
W związku z tym, zdecydowanie zaleca się poinformowanie pacjentów i ich opiekunów (w stosownych przypadkach), aby zwracali uwagę na te objawy (patrz punkt 4.5).
Nadużywanie alkoholu lub leków w wywiadzie:
Należy unikać stosowania midazolamu u pacjentów nadużywających alkoholu lub leków w wywiadzie.
Niepamięć:
Midazolam może powodować niepamięć następczą.
Substancje pomocnicze o znanym działaniu:
MALTITOL
Produkt Epistatus zawiera maltitol. Pacjentom z rzadkimi dziedzicznymi zaburzeniami związanymi z nietolerancją fruktozy nie należy podawać tego leku.
ETANOL
Produkt Epistatus zawiera 197 mg etanolu w każdej dawce, co jest równoważne 25% objętościowych. Ilość alkoholu w dawce tego leku jest równoważna mniej niż 5 ml piwa lub 2 ml wina.
Mała ilość alkoholu w tym leku nie będzie powodowała zauważalnych skutków.
SÓD
Produkt Epistatus zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy lek uznaje się za
„wolny od sodu”.
Midazolam jest metabolizowany przez izoenzym 3A4 cytochromu P450 (CYP3A4). Substancje hamujące i pobudzające CYP3A4 mogą, odpowiednio, zwiększać lub zmniejszać stężenia midazolamu w osoczu i w konsekwencji działanie midazolamu, co wymaga odpowiedniego dostosowania dawki.
Farmakokinetyczne interakcje z substancjami hamującymi lub pobudzającymi CYP3A4 są bardziej nasilone w przypadku doustnie podawanego midazolamu, w porównaniu do podania na śluzówkę jamy ustnej lub pozajelitowego, ponieważ enzymy CYP3A4 znajdują się również w górnym odcinku przewodu pokarmowego. Po podaniu na śluzówkę jamy ustnej, zmienia się jedynie klirens ogólnoustrojowy. Po podaniu na śluzówkę jamy ustnej pojedynczej dawki midazolamu, wpływ na maksymalne działanie kliniczne związane z zahamowaniem CYP3A4 będzie niewielki, natomiast czas działania może być wydłużony. Dlatego podczas stosowania midazolamu z substancją hamującą CYP3A4, nawet po podaniu pojedynczej dawki, zaleca się uważne monitorowanie działania klinicznego oraz parametrów życiowych.
Produkty lecznicze o działaniu znieczulającym i narkotyczne leki przeciwbólowe: fentanyl może zmniejszać klirens midazolamu.
Leki przeciwpadaczkowe: jednoczesne podawanie z midazolamem może powodować zwiększoną sedację, depresję oddechową lub sercowo-naczyniową. Midazolam może wchodzić w interakcję z innymi produktami leczniczymi metabolizowanymi w wątrobie, np. z fenytoiną, nasilając ich działanie.
Leki dopaminergiczne: midazolam może powodować hamowanie działania lewodopy.
Leki zwiotczające mięśnie: np. baklofen. Midazolam może nasilać działanie leków zwiotczających mięśnie i zwiększać działanie hamujące na OUN.
Nabilon: jednoczesne podawanie z midazolamem może powodować zwiększoną sedację lub depresję oddechową i sercowo-naczyniową.
Opioidy:
Jednoczesne stosowanie leków uspokajających, takich jak benzodiazepiny lub leków podobnych, takich jak produkt Epistatus z opioidami, zwiększa ryzyko sedacji, depresji oddechowej, śpiączki i śmierci z powodu addytywnego działania hamującego na OUN. Należy ograniczyć dawki i czas jednoczesnego stosowania leków (patrz punkt 4.4).
Produkty lecznicze stosowane w leczeniu choroby wrzodowej: wykazano, że cymetydyna, ranitydyna i omeprazol zmniejszają klirens midazolamu oraz innych benzodiazepin, co może nasilać ich działanie.
Ksantyny: ksantyny przyspieszają metabolizm midazolamu i innych benzodiazepin.
Inhibitory CYP3A4
Interakcje midazolamu podanego na śluzówkę jamy ustnej z innymi produktami leczniczymi są prawdopodobnie podobne do tych, obserwowanych po podaniu dożylnym midazolamu, a nie po podaniu doustnym.
Pokarm:
Sok grejpfrutowy: zmniejsza klirens midazolamu oraz nasila jego działanie.
Azole o działaniu przeciwgrzybiczym:
Inhibitory proteazy HIV (sakwinawir i inne inhibitory proteazy):
Jednoczesne podawanie z inhibitorami proteaz (np. sakwinawirem i innymi inhibitorami proteazy HIV) może powodować znaczne zwiększenie stężenia midazolamu. Po podaniu z rytonawirem
w połączeniu z lopinawirem, stężenie w osoczu midazolamu podanego dożylnie zwiększało się 5,4-krotnie, co wiązało się z podobnym zwiększeniem końcowego okresu półtrwania.
Blokery kanału wapniowego:
Diltiazem: po pojedynczej dawce diltiazemu stężenie w osoczu dożylnie podanego midazolamu zwiększało się o mniej więcej 25%, a końcowy okres półtrwania wydłużał się o 43%.
Werapamil: Werapamil, który jest inhibitorem enzymu CYP3A4, jeżeli jest stosowany jednocześnie może powodować zwiększenie stężenia midazolamu.
Inne produkty lecznicze:
Atorwastatyna powodowała 1,4-krotne zwiększenie stężenia w osoczu midazolamu podanego dożylnie w porównaniu do grupy kontrolnej.
Produkty lecznicze pobudzające CYP3A4
Ryfampicyna (600 mg raz na dobę przez 7 dni) zmniejszała stężenie w osoczu midazolamu podanego dożylnie mniej więcej o 60%. Końcowy okres półtrwania zmniejszył się mniej więcej o 50-60%.
Leki ziołowe:
Dziurawiec zwyczajny zmniejszał stężenia midazolamu w osoczu mniej więcej o 20-40%, czemu towarzyszyło zmniejszenie końcowego okresu półtrwania mniej więcej o 15-17%. Działanie pobudzające CYP3A4 może się różnić, w zależności od właściwości danego wyciągu z dziurawca.
Interakcje farmakodynamiczne z innymi produktami leczniczymi (DDI, ang. Drug-Drug Interactions) Jednoczesne podawanie midazolamu z innymi produktami leczniczymi uspokajającymi i (lub) nasennymi i działającymi hamująco na ośrodkowy układ nerwowy, a także z alkoholem, może powodować nasiloną sedację oraz depresję oddechową.
Do takich produktów należą: opioidy (stosowane jako leki przeciwbólowe, przeciwkaszlowe lub w leczeniu zastępczym), leki przeciwpsychotyczne, inne benzodiazepiny stosowane jako leki przeciwlękowe lub nasenne (patrz punkt 4.4), barbiturany, propofol, ketamina, etomidat, leki przeciwdepresyjne o działaniu uspokajającym, starsze leki przeciwhistaminowe działające przez receptor H1 oraz działające ośrodkowo leki przeciwnadciśnieniowe.
Alkohol (w tym produkty lecznicze zawierające alkohol) może znacząco nasilać działanie uspokajające midazolamu. Należy zdecydowanie unikać spożywania alkoholu w przypadku stosowania midazolamu (patrz punkt 4.4).
Disulfiram: produkt Epistatus zawiera niewielką ilość alkoholu, dlatego nie należy go stosować jednocześnie z disulfiramem.
Midazolam zmniejsza minimalne stężenie pęcherzykowe (MAC) wziewnych anestetyków.
U dzieci działanie inhibitorów CYP3A4 może być większe, ponieważ część dawki podana na śluzówkę jamy ustnej jest prawdopodobnie połknięta i wchłonięta z przewodu pokarmowego.
Ciąża
Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania midazolamu u kobiet w okresie ciąży. Badania na zwierzętach nie wykazały działania teratogennego midazolamu, ale obserwowano toksyczny wpływ na płód, podobnie jak w przypadku innych benzodiazepin. Brak danych dotyczących ekspozycji na midazolam w pierwszych dwóch trymestrach ciąży.
Odnotowano, że duże dawki midazolamu podawane w ostatnim trymestrze ciąży lub podczas porodu, wywoływały działania niepożądane u matki lub płodu (ryzyko aspiracji płynów oraz zawartości żołądka u matki w trakcie porodu, niemiarowa czynność serca u płodu, obniżenie ciśnienia tętniczego, słaby odruch ssania, hipotermia oraz depresja oddechowa u noworodka).
Midazolam może być stosowany w okresie ciąży, jeżeli jest to niezbędnie konieczne. Jeśli midazolam jest podawany w trzecim trymestrze ciąży, należy brać pod uwagę ryzyko dla noworodków.
Karmienie piersią
Midazolam przenika do mleka ludzkiego w małych ilościach (0,6%). Przerwanie karmienia piersią po podaniu pojedynczej dawki midazolamu może zatem nie być konieczne.
Płodność
Badania na zwierzętach nie wykazały szkodliwego wpływu na płodność (patrz punkt 5.3).
Produkt Epistatus wywiera znaczny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Uspokojenie, zaburzenia pamięci, zaburzenia uwagi oraz zaburzenia pracy mięśni mogą niekorzystnie wpływać na zdolność prowadzenia pojazdów, jazdy na rowerze lub obsługiwania maszyn. Należy ostrzec pacjenta, aby po zastosowaniu midazolamu nie prowadził pojazdów ani nie obsługiwał maszyn do czasu powrotu do całkowitej sprawności.
W opublikowanych badaniach klinicznych, midazolam stosowany na śluzówkę jamy ustnej był podany 443 dzieciom z padaczką. Depresja oddechowa występuje z częstością do 5%, chociaż jest znanym następstwem napadów drgawkowych, jak również jest związana ze stosowaniem benzodiazepin.
W tabeli poniżej wymieniono działania niepożądane zgłoszone po podaniu midazolamu na śluzówkę jamy ustnej u dzieci w badaniach klinicznych.
Częstość działań niepożądanych sklasyfikowana jest następująco:
Często: ≥1/100 do <1/10
Niezbyt często: ≥1/1000 do <1/100 Bardzo rzadko: <1/10 000
Częstość nieznana: częstość nie może być określona na podstawie dostępnych danych.
W obrębie każdej grupy o określonej częstości występowania objawy niepożądane wymieniono zgodnie ze zmniejszającym się nasileniem
W każdej grupie o określonej częstości występowania, działania niepożądane wymieniono zgodnie ze zmniejszającym się nasileniem.
Klasyfikacja układów i narządów | Częstość: działanie niepożądane |
Zaburzenia psychiczne | Niezbyt często: Omamy*, pobudzenie* Bardzo rzadko: Agresja*, zaburzenia ruchowe*, napaść fizyczna* Częstość nieznana: Złość*, stan splątania*, wrogość*, euforia*. |
Zaburzenia układu nerwowego | Często: Uspokojenie, senność, zmniejszony poziom świadomości, depresja oddechowa, ataksja*, zawroty głowy*, ból głowy*. Niezbyt często: Niepamięć następcza*. Bardzo rzadko: Napady padaczkowe*, reakcje paradoksalne*. |
Zaburzenia serca | Bardzo rzadko: Bradykardia*, zatrzymanie czynności serca*, niedociśnienie*, rozszerzenie naczyń*. |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Bardzo rzadko: Bezdech*, duszność* Częstość nieznana: Zakrzepica, skurcz krtani*, zatrzymanie czynności oddechowej*. |
Zaburzenia żołądka i jelit | Często: Nudności i wymioty Bardzo rzadko: Zaparcia*, suchość w jamie ustanej*. |
Zaburzenia skóry i tkanki podskórnej | Niezbyt często: Świąd, wysypka i pokrzywka. Częstość nieznana: Obrzęk naczynioruchowy** |
Zaburzenia ogólne i stany w miejscu podania | Często: Zmęczenie* Bardzo rzadko: Czkawka* |
* Działania niepożądane, które odnotowano po zastosowaniu midazolamu we wstrzyknięciu u dzieci i (lub) dorosłych i które mogą wystąpić w przypadku podania na śluzówkę jamy ustnej.
** Działanie niepożądane poznane po dopuszczeniu produktu do obrotu.
Opis wybranych działań niepożądanych
U osób stosujących benzodiazepiny odnotowano zwiększoną częstość upadków i złamań. Ryzyko upadków i złamań jest zwiększone u osób stosujących jednocześnie produkty uspokajające (w tym napoje alkoholowe) oraz u osób w podeszłym wieku.
Zagrażające życiu działania mogą być częstsze u pacjentów z występującymi wcześniej zaburzeniami czynności układu oddechowego lub zaburzeniami czynności serca, zwłaszcza gdy podawane są duże dawki midazolamu (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, Tel:
+ 48 22 49 21 301, Faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie midazolamu nie powinno stanowić zagrożenia życia, chyba że u pacjenta występuje niewydolność oddechowa, niewydolność serca lub jednocześnie zastosowano inne produkty działające hamująco na OUN (w tym alkohol).
Objawy
Przedawkowanie benzodiazepin objawia się zazwyczaj różnego stopnia zahamowaniem czynności ośrodkowego układu nerwowego, od senności do śpiączki. W łagodnych przypadkach objawy obejmują senność, splątanie oraz letarg, a w cięższych - ataksję, zmniejszone napięcie mięśniowe, niedociśnienie, zahamowanie czynności oddechowej, rzadziej śpiączkę oraz bardzo rzadko - zgon.
Postępowanie
W postępowaniu po przedawkowaniu jakiegokolwiek produktu leczniczego należy wziąć pod uwagę, że pacjent mógł przyjąć wiele leków.
Po przedawkowaniu midazolamu w postaci doustnej, należy u przytomnego pacjenta wywołać wymioty (w ciągu jednej godziny) lub, jeśli pacjent jest nieprzytomny, należy przeprowadzić płukanie żołądka zabezpieczając jednocześnie drogi oddechowe. Jeśli nie ma poprawy po opróżnieniu żołądka, należy podać węgiel aktywowany w celu zmniejszenia wchłaniania. W ramach intensywnej opieki należy zwrócić szczególną uwagę na czynności układu oddechowego i sercowo-naczyniowego.
Jako antidotum można zastosować flumazenil.
Grupa farmakoterapeutyczna: Leki nasenne i uspokajające (pochodne benzodiazepiny), kod ATC: N05CD08
Mechanizm działania
Midazolam jest pochodną produktów z grupy imidazobenzodiazepiny. Wolna zasada jest substancją lipofilną i jest słabo rozpuszczalna w wodzie. Zasadowy azot znajdujący się w pozycji 2 pierścienia imidazobenzodiazepinowego umożliwia reakcję midazolamu z kwasami i tworzenie soli. Dzięki temu otrzymywany jest stabilny roztwór odpowiedni do podania na śluzówkę jamy ustnej.
Działanie farmakodynamiczne
Działanie farmakologiczne midazolamu jest krótkotrwałe z powodu szybkiej przemiany metabolicznej. Midazolam ma działanie przeciwdrgawkowe. Wykazuje również działanie uspokajające i nasenne o znacznym nasileniu, przeciwlękowe i zwiotczające mięśnie.
Skuteczność kliniczna i bezpieczeństwo stosowania
W 5 badaniach z grupą kontrolną otrzymującą diazepam doodbytniczo oraz 2 badaniach z grupą kontrolowaną otrzymującą diazepam dożylnie, u całkowitej liczby 478 dzieci otrzymujących midazolam na śluzówkę jamy ustnej, ustąpienie widocznych objawów napadów w ciągu 10 minut obserwowano u 65% do 78% dzieci. Ponadto, w 3 z tych badań, ustąpienie widocznych objawów napadów w ciągu 10 minut bez nawrotu w ciągu 1 lub 2 godziny po podaniu, było obserwowane
u 56% do 70% pacjentów. Częstość oraz stopień ciężkości działań niepożądanych zgłaszanych dla midazolamu podawanego na śluzówkę jamy ustnej w opublikowanych badaniach klinicznych były podobne jak w przypadku działań niepożądanych zgłaszanych dla grupy kontrolnej diazepamu podawanego doodbytniczo.
Wchłanianie
Po podaniu na śluzówkę jamy ustnej midazolam jest szybko wchłaniany. Maksymalne stężenie w osoczu jest osiągane w ciągu 30 minut. Całkowita biodostępność midazolamu po podaniu na śluzówkę jamy ustnej u zdrowych dorosłych wynosi około 75%. Biodostępność midazolamu po
podaniu na śluzówkę jamy ustnej u dzieci z ciężką postacią malarii i drgawkami jest szacowana na 87%.
Dystrybucja
Midazolam jest wysoce lipofilny i jego dystrybucja jest znacząca. Objętość dystrybucji w stanie stacjonarnym po podaniu na śluzówkę jamy ustnej szacuje się na 5,3 l/kg.
Około 96 do 98% midazolamu wiąże się z białkami osocza. Główną frakcją białek wiążących są albuminy. Midazolam przenika wolno i w nieznacznym stopniu do płynu mózgowo-rdzeniowego. Wykazano, że u ludzi midazolam wolno przenika przez barierę łożyskową do krążenia płodowego. Niewielkie ilości midazolamu znajdowane są w mleku ludzkim.
Metabolizm
Midazolam jest usuwany prawie całkowicie na drodze biotransformacji. Frakcję dawki metabolizowaną w wątrobie szacuje się na 30-60%. Midazolam jest hydroksylowany przez izoenzym CYP3A4, a głównym aktywnym metabolitem jest 1-hydroksymidazolam oraz dwa mniej istotne metabolity: 4-hydroky metabolit i 1,4-hydroky metabolit. Na podstawie stosunku powierzchni pola pod krzywą (AUC) dla 1-hydroksymidazolamu i midazolamu u dzieci po podaniu na śluzówkę jamy ustnej można stwierdzić, że 40% midazolamu jest metabolizowane do 1-hydroksymidazolamu.
W badaniu dostępności biologicznej produktu Epistatus, współczynnik metabolizmu wynosił 22%, a szacowany okres półtrwania wynosił 2,7 godziny. W raportach opublikowanych w literaturze,
50-70% midazolamu jest metabolizowane do głównego metabolitu, a okres półtrwania jest szacowany
na 1-3 godziny. Te odmienne wartości można wytłumaczyć dużą zmiennością osobniczą farmakokinetyczną midazolamu.
Eliminacja
U dzieci w wieku powyżej 12 miesięcy, okres półtrwania midazolamu podawanego pozajelitowo wynosił 0,8 do 1,8 godziny, co było wartością podobną lub mniejszą niż u dorosłych (zakres 1,7 do 2,6 godziny). Klirens osoczowy u dzieci w wieku powyżej 12 miesięcy wynosił 4,7 do 19,7 ml/min/kg mc., co było wartością podobną lub większą niż u dorosłych (zakres 6,4 do 11,0 ml/min/kg mc.).
Różnica jest wynikiem zwiększonego klirensem metabolicznego u dzieci. Midazolam jest wydalany głównie przez nerki (60–80% wstrzykniętej dawki) i w postaci sprzężonego z kwasem glukuronowym 1-hydroksymidazolamu.
Mniej niż 1% dawki jest wydalane z moczem w postaci niezmienionej. Średni okres półtrwania w fazie eliminacji 1-hydroksymidazolamu wynosił 5,6 godziny u zdrowych dorosłych.
Farmakokinetyka w szczególnych grupach pacjentów
Osoby otyłe
Średni okres półtrwania jest dłuższy u osób otyłych niż u osób z prawidłową masą ciała (5,9 vs. 2,3 godziny). Jest to związane ze zwiększeniem o około 50% objętości dystrybucji, skorygowanej względem całkowitej masy ciała. Klirens u osób otyłych nie różni się znacząco od klirensu
u pacjentów z prawidłową masą ciała.
Pacjenci z zaburzeniami czynności wątroby
Okres półtrwania w fazie eliminacji u pacjentów z marskością wątroby może być dłuższy, a klirens mniejszy w porównaniu do wartości u zdrowych ochotników (patrz punkt 4.4).
Pacjencie z zaburzeniami czynności nerek
Okres półtrwania w fazie eliminacji u pacjentów z przewlekłą niewydolnością nerek jest podobny do tego u zdrowych ochotników.
Pacjenci krytycznie chorzy
Okres półtrwania w fazie eliminacji midazolamu u pacjentów krytycznie chorych jest dłuższy nawet do sześciu razy.
Pacjenci z niewydolnością serca
Okres półtrwania w fazie eliminacji jest wydłużony u pacjentów z zastoinową niewydolnością serca, w porównaniu do osób zdrowych (patrz punkt 4.4).
Kumulacja po podaniu dawek wielokrotnych
Dożylne dawki midazolamu, powtarzane przez 4 do 6 dni u pacjentów wentylowanych mechanicznie w oddziale intensywnej terapii, spowodowały wyraźną kumulację i przedłużoną sedację oraz depresję oddechową (wymagającą przedłużonej wentylacji). Okres półtrwania w fazie końcowej midazolamu wynosił od 8,9 do 19,4 godziny (patrz punkt 4.2).
W badaniach płodności u szczurów po podaniu dawek do 10 razy większych niż dawki terapeutyczne, nie obserwowano szkodliwego wpływu na płodność zwierząt.
Nie ma innych istotnych, dodatkowych danych przedklinicznych mających znaczenie dla przepisującego ten produkt, poza wymienionymi w pozostałych punktach ChPL.
Etanol
Sacharyna sodowa (E 954) Glicerol
Woda oczyszczona
Sodu wodorotlenek (do ustalenia pH) Maltitol ciekły
Nie dotyczy.
18 miesięcy
Nie przechowywać w temperaturze powyżej 25oC. Nie przechowywać w lodówce ani nie zamrażać.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
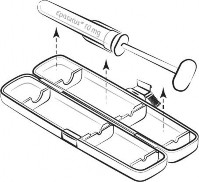
Produkt Epistatus jest dostępny w strzykawce doustnej napełnionej 1 mL roztworu, z silikonowym cylindrem, z końcówką tłoka z termoplastycznego elastomeru i z osłonką z cyklicznego polimeru olefinowego (COP). Produkt jest dostarczany w postaci opakowania jednodawkowego
w polipropylenowym pojemniku (PP), który zawiera jedną strzykawkę zawierającą 1 mL produktu.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
SERB SA
Avenue Louise 480
1050 Brussels Belgia
Pozwolenie nr 26156
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 23.12.2020
21.09.2022