Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania Astma
u pacjentów, u których wziewne kortykosteroidy wraz ze stosowanymi doraźnie krótko działającymi wziewnymi agonistami receptora β2-adrenergicznego nie zapewniają wystarczającej kontroli objawów choroby
lub
u pacjentów, u których wystarczającą kontrolę objawów choroby zapewniają zarówno wziewne kortykosteroidy, jak i długo działający agoniści receptora β2-adrenergicznego.
Przewlekła obturacyjna choroba płuc (POChP)
Oxodil Combo jest wskazany w objawowym leczeniu dorosłych w wieku 18 lat i starszych, z POChP z natężoną objętością wydechową pierwszosekundową (FEV1) <70% wartości należnej (po podaniu leku rozszerzającego oskrzela) i zaostrzeniem choroby w wywiadzie mimo systematycznej terapii
lekami rozszerzającymi oskrzela (patrz także punkt 4.4).
Dawkowanie i sposób podawania
Oxodil Combo w leczeniu podtrzymującym
Produkt Oxodil Combo stosowany jest regularnie jako leczenie podtrzymujące, a doraźnie podawany jest osobno szybko działający lek rozszerzający oskrzela.
Oxodil Combo w leczeniu podtrzymującym i doraźnym
Oxodil Combo w leczeniu podtrzymującym
Należy zalecić pacjentowi, aby zawsze miał przy sobie osobny, szybko działający lek rozszerzający oskrzela do zastosowania w razie konieczności.
Zalecane dawki:
Dorośli (w wieku 18 lat i powyżej): 1-2 inhalacje dwa razy na dobę. U niektórych pacjentów może być konieczne zwiększenie dawki maksymalnie do 4 inhalacji dwa razy na dobę.
Młodzież (w wieku od 12 do 17 lat): 1-2 inhalacje dwa razy na dobę.
W praktyce, jeśli dawkowanie dwa razy na dobę zapewniło kontrolę objawów, w ramach ustalania najmniejszej skutecznej dawki można zastosować produkt Oxodil Combo raz na dobę, jeśli w opinii lekarza utrzymanie kontroli objawów wymaga podawania długo działającego leku rozszerzającego oskrzela w skojarzeniu z wziewnym kortykosteroidem.
Zwiększenie zapotrzebowania na stosowanie doraźne szybko działającego leku rozszerzającego oskrzela wskazuje na pogorszenie przebiegu choroby i wymaga ponownej oceny leczenia astmy.
Dzieci w wieku poniżej 12 lat: ze względu na brak dostępnych danych, nie zaleca się stosowania produktu Oxodil Combo u dzieci w wieku poniżej 12 lat.
Oxodil Combo w leczeniu podtrzymującym i doraźnym
niewystarczającą kontrolą objawów astmy i częstą potrzebą stosowania leku rozszerzającego oskrzela
zaostrzeniami objawów astmy w przeszłości, które wymagały interwencji medycznej.
U pacjentów, którzy często stosują doraźnie dużą ilość inhalacji produktu Oxodil Combo, należy ściśle kontrolować występowanie działań niepożądanych zależnych od dawki.
Zalecane dawki:
Dorośli i młodzież (w wieku 12 lat i powyżej): zalecana dawka podtrzymująca to 2 inhalacje na dobę, podawane jako 1 inhalacja rano i 1 inhalacja wieczorem lub jako 2 inhalacje podawane albo rano, albo wieczorem. U niektórych pacjentów odpowiednia może być dawka podtrzymująca w postaci 2
inhalacji dwa razy na dobę. W razie wystąpienia objawów pacjent powinien przyjąć doraźnie 1 dodatkową inhalację. Jeśli po kilku minutach objawy nie ustąpią, należy przyjąć dodatkową inhalację. Nie wolno przyjmować jednorazowo więcej niż 6 inhalacji.
Zazwyczaj nie jest konieczne przyjmowanie więcej niż 8 inhalacji na dobę, ale przez ograniczony czas można stosować do 12 inhalacji na dobę. Pacjentom, którzy stosują więcej niż 8 inhalacji na dobę, należy zdecydowanie zalecić skontaktowanie się z lekarzem prowadzącym. Należy ponownie ocenić stan pacjenta i rozważyć zmianę leczenia podtrzymującego.
Dzieci w wieku poniżej 12 lat: nie zaleca się stosowania produktu Oxodil Combo u dzieci w leczeniu podtrzymującym i doraźnym.
POChP
Zalecane dawki:
Dorośli: 2 inhalacje dwa razy na dobę.
Informacje ogólne
Szczególne grupy pacjentów:
Nie ma szczególnych zaleceń dotyczących dawkowania u osób w podeszłym wieku. Nie ma danych dotyczących stosowania produktu Oxodil Combo u pacjentów z zaburzeniami czynności wątroby lub nerek. Ponieważ budezonid i formoterol eliminowane są z organizmu głównie poprzez metabolizm wątrobowy, u pacjentów z ciężką marskością wątroby spodziewane jest zwiększenie ekspozycji na obie substancje czynne.
Sposób podawania
Instrukcja stosowania
Pacjentowi należy zademonstrować sposób stosowania inhalatora i systematycznie kontrolować, czy używany jest prawidłowo.
W inhalatorze znajduje się 60 dawek produktu leczniczego w postaci proszku w zwiniętym pasku foliowym. Inhalator ma licznik dawek, który wskazuje, ile dawek pozostało, odliczając od 60 do 0. Oznakowanie ostatnich 10 dawek pojawia się na czerwonym tle.
Inhalator nie jest przeznaczony do ponownego napełnienia – po opróżnieniu inhalator należy wyrzucić i wymienić na nowy.
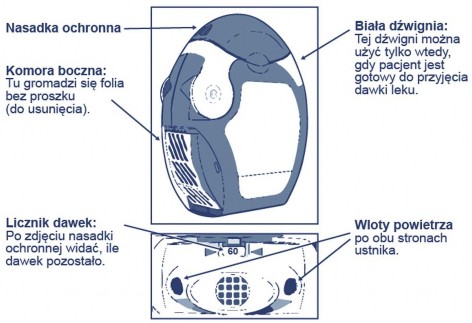
Przed użyciem inhalatora
Otworzyć przezroczystą pokrywę komory bocznej.
Pasek folii należy usunąć z komory bocznej, ostrożnie odrywając pasek na całej jego długości wykorzystując ząbkowaną krawędź, jak pokazano poniżej na rysunku. Paska nie należy
ciągnąć ani szarpać.
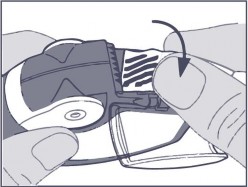
Zamknąć pokrywę komory bocznej i wyrzucić oderwany pasek folii.
Uwaga: W miarę używania inhalatora, komora boczna stopniowo wypełnia się zużytymi paskami folii. Paski folii z czarnymi kreskami nie zawierają produktu leczniczego. Na końcu w komorze pojawią się numerowane odcinki paska. Nie należy dopuszczać, aby w komorze bocznej
znajdowało się więcej niż 2 paski, ponieważ może to spowodować zatkanie inhalatora. Należy oderwać delikatnie pasek folii, jak pokazano powyżej na rysunku i w bezpieczny sposób go usunąć.
Stosowanie inhalatora
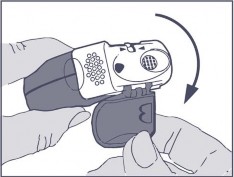
Inhalator należy trzymać w dłoniach w sposób pokazany na rysunkach.
Otwarcie
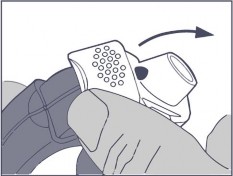
Odsłonić ustnik, pociągając w dół nasadkę ochronną.
Sprawdzić w okienku licznika, ile dawek leku pozostało.
Przygotowanie dawki leku
Oxodil Combo, (160 mikrogramów + 4,5 mikrogramów)/dawkę dostarczoną, proszek do inhalacji, podzielony
Każda dawka dostarczona (dawka inhalacyjna) zawiera 160 mikrogramów budezonidu (Budesonidum) i 4,5 mikrogramów formoterolu fumaranu dwuwodnego (Formoteroli fumaras dihydricus).
Każda dawka odmierzona (dawka produktu w blistrze przed podaniem) zawiera 194,7 mikrograma budezonidu i 6,1 mikrograma formoterolu fumaranu dwuwodnego.
Substancja pomocnicza o znanym działaniu
Każda dawka dostarczona zawiera 4,2 mg laktozy (w postaci laktozy jednowodnej), a każda dawka odmierzona zawiera 5,1 mg laktozy (w postaci laktozy jednowodnej).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek do inhalacji, podzielony.
Biały, prawie biały lub jasnożółty jednorodny proszek.
Oxodil Combo jest wskazany w regularnym leczeniu astmy u dorosłych i młodzieży (w wieku 12 lat i starszych), u których właściwe jest stosowanie leczenia skojarzonego (wziewnego kortykosteroidu i długo działającego agonisty receptora β2-adrenergicznego):
Droga podawania: podanie wziewne.
Dawkowanie
Astma
Produkt Oxodil Combo nie jest przeznaczony do rozpoczynania leczenia astmy. Wymaganą dawkę składników produktu Oxodil Combo należy ustalać indywidualnie, zależnie od ciężkości choroby.
Należy to brać pod uwagę nie tylko podczas rozpoczynania leczenia złożonym produktem leczniczym, ale również podczas ustalania dawki podtrzymującej. Jeśli u danego pacjenta konieczne jest
zastosowanie produktu złożonego w dawkach innych niż dostępne w inhalatorze z produktem Oxodil Combo, należy uzupełnić dawki przepisując wziewnych agonistów receptorów β2-adrenergicznych
i (lub) kortykosteroidów w osobnych inhalatorach.
Dawkę należy ustalać tak, aby uzyskać najmniejszą dawkę zapewniającą skuteczną kontrolę objawów. Lekarz prowadzący powinien systematycznie oceniać stan pacjenta, aby sprawdzić, czy dawka budezonidu z formoterolu fumaranem pozostaje optymalna. Jeśli najmniejsza zalecana dawka pozwoliła na długotrwałe opanowanie objawów choroby, następnym krokiem może być próba leczenia samym wziewnym kortykosteroidem.
Jeśli wskazane jest zmniejszenie dawki lub przepisanie dawki większej niż dostarczona przez produkt Oxodil Combo, konieczna jest zmiana na inne połączenie budezonidu i formoterolu fumaranu
o ustalonej dawce zawierające odpowiednio mniejszą lub większą dawkę wziewnego kortykosteroidu.
Produkt leczniczy Oxodil Combo można stosować na dwa sposoby:
Produkt Oxodil Combo stosowany jest regularnie jako leczenie podtrzymujące oraz doraźnie w odpowiedzi na występujące objawy.
Pacjent przyjmuje produkt Oxodil Combo codziennie w leczeniu podtrzymującym oraz dodatkowo w razie potrzeby, w odpowiedzi na występujące objawy. Należy zalecić pacjentowi, aby zawsze miał przy sobie produkt Oxodil Combo do zastosowania w razie konieczności.
Podawanie produktu Oxodil Combo w leczeniu podtrzymującym i doraźnym należy rozważyć szczególnie u pacjentów z:
Unieść krawędź białej dźwigni. Upewnić się, że komora boczna jest zamknięta.
Uwaga: białej dźwigni należy użyć wtedy, gdy pacjent jest już gotowy do przyjęcia dawki produktu leczniczego. Jeśli pacjent bawi się białą dźwignią, zmarnuje dawki.
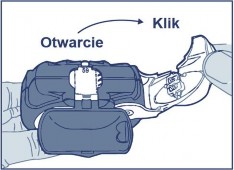
Otwarcie: białą dźwignię pociągnąć do oporu aż do słyszalnego kliknięcia, co spowoduje załadowanie dawki produktu leczniczego i ukazanie się jej numeru w liczniku dawek.
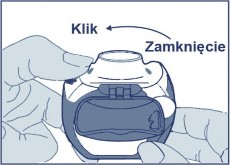
Zamknięcie: Następnie białą dźwignię dokładnie zamknąć tak, aby słyszalne było kliknięcie, a dźwignia znalazła się w swoim pierwotnym położeniu. Inhalator jest gotowy do
natychmiastowego użycia.
Inhalacja dawki
Z dala od ustnika wykonać możliwie głęboki wydech. Nigdy nie należy wydychać powietrza bezpośrednio do wnętrza inhalatora, gdyż może to zmienić wielkość dawki produktu leczniczego.
Inhalator trzymać nasadką ochronną skierowaną do dołu.
Ustami ściśle objąć ustnik.
Pacjent powinien wykonać tak głęboki i mocny wdech ustami (nie nosem), jak to możliwe.
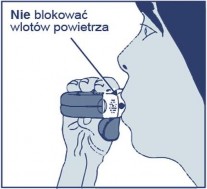
Wyjąć inhalator z ust i wstrzymać oddech na 5-10 sekund lub na tak długo, jak to jest możliwe bez odczucia dyskomfortu.
Następnie pacjent powinien zrobić powolny wydech, ale nie w kierunku inhalatora.
Zamknąć nasadkę chroniącą ustnik.
Jamę ustną wypłukać wodą, którą następnie należy wypluć. Pomoże to zapobiec rozwojowi zakażenia grzybiczego w jamie ustnej i wystąpieniu chrypki.
Czyszczenie
W razie konieczności zewnętrzną część ustnika wytrzeć czystą, suchą chusteczką.
Inhalatora nie wolno rozkładać ani do czyszczenia, ani w żadnym innym celu!
Części inhalatora nie wolno czyścić wodą lub wilgotnymi chusteczkami, ponieważ wilgoć może zmienić wielkość dawki leku!
Nigdy nie wkładać igły lub innych ostrych narzędzi do ustnika bądź innej części inhalatora, gdyż może to spowodować jego uszkodzenie!
Przeciwwskazania
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
W razie przerywania leczenia zaleca się zmniejszanie dawki. Leczenia nie należy przerywać w sposób nagły.
Jeśli pacjent stwierdzi brak skuteczności leczenia lub jeśli przekracza największą zalecaną dawkę produktu Oxodil Combo, powinien zwrócić się do lekarza (patrz punkt 4.2). Nagłe i postępujące pogorszenie kontroli astmy lub POChP może zagrażać życiu, dlatego należy pilnie zbadać stan
pacjenta. W takiej sytuacji należy brać pod uwagę konieczność intensywnej terapii kortykosteroidami np. cykl leczenia doustnymi kortykosteroidami lub antybiotykami w przypadku zakażenia.
Pacjentom należy zalecić, aby przez cały czas mieli przy sobie wziewny lek rozszerzający oskrzela do stosowania doraźnego, albo produkt leczniczy Oxodil Combo (pacjenci z astmą stosujący produkt Oxodil Combo w leczeniu podtrzymującym i doraźnym) lub osobny szybko działający lek
rozszerzający oskrzela (wszyscy pacjenci stosujący produkt Oxodil Combo wyłącznie w leczeniu podtrzymującym).
Pacjentom należy przypominać o konieczności stosowania dawki podtrzymującej produktu Oxodil Combo zgodnie z zaleceniami, nawet przy braku objawów. Nie badano stosowania produktu leczniczego Oxodil Combo w zapobieganiu objawom, np. przed wysiłkiem. Dodatkowe inhalacje produktu Oxodil Combo należy stosować w razie wystąpienia objawów astmy, lecz nie są one przeznaczone do regularnego stosowania profilaktycznego, np. przed wysiłkiem. Do tego celu należy rozważyć zastosowanie szybko działającego leku rozszerzającego oskrzela.
Po opanowaniu objawów astmy można rozważyć stopniowe zmniejszanie dawki produktu Oxodil Combo. Podczas stopniowego zmniejszania dawki ważne jest regularne kontrolowanie stanu
pacjentów. Należy stosować najmniejszą skuteczną dawkę produktu Oxodil Combo (patrz punkt 4.2).
Nie należy rozpoczynać stosowania produktu Oxodil Combo podczas zaostrzenia choroby, znacznego lub ostrego pogorszenia przebiegu astmy.
Podczas leczenia produktem Oxodil Combo mogą wystąpić ciężkie działania niepożądane
i zaostrzenia związane z astmą. Pacjentom należy zalecić kontynuowanie leczenia i zwrócenie się do lekarza w razie nieuzyskania kontroli objawów astmy lub nasilenia jej objawów po rozpoczęciu stosowania produktu Oxodil Combo.
Nie ma danych z badań klinicznych dotyczących stosowania budezonidu z formoterolu fumaranem u pacjentów z POChP, u których wartość FEV1 przed podaniem leku rozszerzającego oskrzela wynosiła >50% wartości należnej, a po podaniu leku rozszerzającego oskrzela wynosiła <70%
wartości należnej (patrz punkt 5.1).
Tak jak podczas stosowania innych wziewnych produktów leczniczych, może wystąpić paradoksalny skurcz oskrzeli z nasileniem świszczącego oddechu i duszności bezpośrednio po przyjęciu dawki produktu leczniczego. Jeśli u pacjenta wystąpi paradoksalny skurcz oskrzeli, należy natychmiast przerwać stosowanie produktu Oxodil Combo, ocenić stan pacjenta i w razie konieczności wdrożyć inne leczenie. Paradoksalny skurcz oskrzeli reaguje na szybko działające wziewne leki rozszerzające oskrzela i należy go leczyć natychmiast (patrz punkt 4.8).
Podczas stosowania wszystkich wziewnych kortykosteroidów, zwłaszcza w dużych dawkach przez długi czas, mogą wystąpić objawy ogólne. Prawdopodobieństwo ich wystąpienia po zastosowaniu wziewnych kortykosteroidów jest znacznie mniejsze niż po podaniu kortykosteroidów doustnych. Do możliwych działań ogólnoustrojowych należą: zespół Cushinga, wystąpienie cech cushingoidalnych, zahamowanie czynności nadnerczy, opóźnienie tempa wzrostu u dzieci i młodzieży, zmniejszenie gęstości mineralnej kości, zaćma i jaskra oraz znacznie rzadziej szereg zaburzeń psychicznych lub
zmian zachowania, w tym nadmierna aktywność psychoruchowa, zaburzenia snu, lęk, depresja lub agresja (szczególnie u dzieci) (patrz punkt 4.8).
Możliwość wpływu na gęstość mineralną kości należy brać pod uwagę szczególnie u pacjentów stosujących długotrwale duże dawki leku, u których współistnieją czynniki ryzyka rozwoju
osteoporozy. Długoterminowe badania z zastosowaniem u dzieci wziewnego budezonidu w średniej dawce dobowej 400 mikrogramów (dawka odmierzona) lub u dorosłych w dawce dobowej
800 mikrogramów (dawka odmierzona) nie wykazały istotnego wpływu na gęstość mineralną kości. Brak dostępnych informacji dotyczących działania produktu Oxodil Combo w większych dawkach.
W razie jakichkolwiek przypuszczeń, że wcześniejsze leczenie steroidami o działaniu ogólnym spowodowało zaburzenia czynności nadnerczy, należy zachować ostrożność podczas zmiany leczenia na produkt Oxodil Combo.
Korzystne działanie wziewnego budezonidu minimalizuje zwykle zapotrzebowanie pacjenta na steroidy doustne, ale u pacjentów zmieniających leczenie z steroidów doustnych na wziewnie istnieje nadal ryzyko utrzymywania się przez dłuższy czas zmniejszonej rezerwy nadnerczowej. Powrót do właściwego stanu może nastąpić po długim czasie od przerwania leczenia doustnymi steroidami, dlatego zmiana terapii z doustnych steroidów na wziewny budezonid może wiązać się z ryzykiem wynikającym z zaburzeń czynności nadnerczy przez dłuższy czas. W takiej sytuacji należy regularnie kontrolować czynność osi HPA (podwzgórze-przysadka-nadnercza).
Długotrwałe stosowanie wziewnych kortykosteroidów w dużych dawkach, zwłaszcza większych niż zalecane, może również powodować klinicznie znaczące zahamowanie czynności nadnerczy. Dlatego w okresach stresu, takiego jak ostre zakażenie lub zabieg chirurgiczny w trybie planowym, należy rozważyć dodatkowe zastosowanie kortykosteroidów o działaniu ogólnym. Szybkie zmniejszenie
dawki steroidów może spowodować ostry przełom nadnerczowy. Podmiotowe i przedmiotowe objawy występujące podczas ostrego przełomu nadnerczowego mogą być w pewnym stopniu maskowane, ale mogą to być: jadłowstręt, ból brzucha, zmniejszenie masy ciała, zmęczenie, ból głowy, nudności, wymioty, zaburzenia świadomości, drgawki, niedociśnienie tętnicze i hipoglikemia.
Nie należy przerywać w sposób nagły leczenia uzupełniającego steroidami ogólnoustrojowymi lub wziewnym budezonidem.
Podczas zmiany leczenia doustnego na Oxodil Combo występuje zwykle osłabienie działania ogólnego steroidów, co może być przyczyną pojawienia się objawów alergii lub zapalenia stawów,
takich jak zapalenie błony śluzowej nosa, wyprysk oraz ból mięśni i stawów. W takiej sytuacji należy rozpocząć leczenie objawowe. Należy podejrzewać możliwość niewystarczającego działania glikokortykosteroidów, jeśli rzadko wystąpią takie objawy, jak zmęczenie, ból głowy, nudności
i wymioty. W takich przypadkach niekiedy konieczne jest czasowe zwiększenie dawki doustnych glikokortykosteroidów.
W celu zminimalizowania ryzyka zakażeń grzybiczych jamy ustnej i gardła (patrz punkt 4.8), należy zalecić pacjentowi wypłukanie jamy ustnej wodą po każdej inhalacji dawki podtrzymującej. W razie wystąpienia pleśniawek w obrębie jamy ustnej i gardła pacjent powinien wypłukać jamę ustną wodą także po przyjęciu dawki stosowanej doraźnie.
Należy unikać jednoczesnego stosowania z itrakonazolem, rytonawirem lub innymi silnymi inhibitorami CYP3A4 (patrz punkt 4.5). Jeśli nie jest to możliwe, należy zachować jak najdłuższą
przerwę między zastosowaniem produktów leczniczych, które mogą na siebie oddziaływać. Nie zaleca się stosowania produktu Oxodil Combo w leczeniu podtrzymującym i doraźnym u pacjentów
stosujących silne inhibitory CYP3A4.
Spodziewane jest, że jednoczesne leczenie inhibitorami CYP3A, w tym produktami leczniczymi
zawierającymi kobicystat, zwiększy ryzyko ogólnoustrojowych działań niepożądanych. Należy unikać takiego połączenia, chyba że korzyść przewyższa zwiększone ryzyko ogólnoustrojowych działań
niepożądanych kortykosteroidów.
Produkt leczniczy Oxodil Combo należy stosować ostrożnie u pacjentów z nadczynnością tarczycy, guzem chromochłonnym nadnerczy, cukrzycą, nieleczoną hipokaliemią, kardiomiopatią przerostową
zawężającą, idiopatycznym podzastawkowym zwężeniem aorty, ciężkim nadciśnieniem tętniczym, tętniakiem lub innymi ciężkimi chorobami układu sercowo-naczyniowego, takimi jak choroba niedokrwienna serca, tachyarytmia lub ciężka niewydolność serca.
Należy zachować ostrożność podczas leczenia pacjentów z wydłużeniem odstępu QTc. Sam formoterol może powodować wydłużenie odstępu QTc.
U pacjentów z czynną lub przebytą gruźlicą płuc, grzybiczymi lub wirusowymi zakażeniami dróg oddechowych należy ponownie rozważyć konieczność stosowania kortykosteroidów wziewnych oraz ich dawkę.
Stosowanie dużych dawek agonistów receptorów β2-adrenergicznych może spowodować wystąpienie ciężkiej hipokaliemii. Jeśli agonista receptorów β2-adrenergicznych i produkty lecznicze, które mogą spowodować hipokaliemię lub nasilić działanie hipokaliemiczne, np. pochodne ksantyny, steroidy
i leki moczopędne stosowane są jednocześnie, możliwe jest zwiększenie hipokaliemicznego działania agonisty receptorów β2-adrenergicznych. Szczególną ostrożność zaleca się u pacjentów z niestabilną astmą, którzy stosują zmienne dawki leków rozszerzających oskrzela, u pacjentów z ostrą, ciężką
astmą, gdyż ryzyko może być zwiększone przez niedotlenienie i inne stany, w których
prawdopodobne jest wystąpienie hipokaliemii. W tych przypadkach zaleca się kontrolowanie stężenia potasu w surowicy.
Tak jak podczas stosowania innych agonistów receptorów β2-adrenergicznych, u pacjentów z cukrzycą należy rozważyć dodatkowe kontrole stężenia glukozy w surowicy.
Zaburzenia widzenia
Podczas ogólnego i miejscowego stosowania kortykosteroidów mogą wystąpić zaburzenia widzenia. Jeśli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których mogą należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (CSCR), którą
zgłaszano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
Dzieci i młodzież
Zaleca się regularne kontrolowanie wzrostu dzieci otrzymujących długotrwale wziewne kortykosteroidy. W razie spowolnienia tempa wzrostu należy zweryfikować leczenie w celu zmniejszenia dawki wziewnego kortykosteroidu, jeśli to możliwe do najmniejszej dawki
zapewniającej kontrolę objawów astmy. Należy dokładnie ocenić korzyści wynikające z leczenia kortykosteroidem i ryzyko związane ze spowolnieniem wzrostu. Ponadto należy rozważyć skierowanie pacjenta do pediatry pulmonologa.
Ograniczone dane z długotrwałych badań wskazują, że większość dzieci i młodzieży leczonych wziewnym budezonidem osiąga spodziewany wzrost w wieku dorosłym. Obserwowano jednak na początku leczenia niewielkie, przemijające spowolnienie wzrostu (około 1 cm), które występuje zazwyczaj w pierwszym roku leczenia.
Zapalenie płuc u pacjentów z POChP
U pacjentów z POChP otrzymujących wziewne kortykosteroidy obserwowano zwiększoną częstość zapalenia płuc, w tym zapalenia płuc wymagającego hospitalizacji. Istnieją pewne dowody na
zwiększenie ryzyka zapalenia płuc wraz ze zwiększeniem dawki steroidów, ale nie wykazano tego jednoznacznie we wszystkich badaniach.
Nie ma rozstrzygających dowodów klinicznych na istnienie różnic między wziewnymi kortykosteroidami w odniesieniu do ryzyka zapalenia płuc.
Lekarze powinni szczególnie wnikliwie obserwować, czy u pacjentów z POChP nie rozwija się zapalenie płuc, ponieważ kliniczne objawy takich zakażeń oraz zaostrzenia POChP często się nakładają.
Do czynników ryzyka zapalenia płuc u pacjentów z POChP należą: aktualne palenie tytoniu, podeszły wiek, niski wskaźnik masy ciała (BMI) i ciężka postać POChP.
Produkt leczniczy Oxodil Combo zawiera laktozę (4,2 mg/dawkę dostarczoną)
Taka ilość laktozy nie stanowi zwykle problemu u pacjentów z nietolerancją laktozy. Laktoza, substancja pomocnicza, zawiera małe ilości białek mleka, które mogą wywoływać reakcje alergiczne.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Interakcje farmakokinetyczne
Silne inhibitory CYP3A4 (np. ketokonazol, itrakonazol, worykonazol, pozakonazol, klarytromycyna, telitromycyna, nefazodon, kobicystat i inhibitory proteazy HIV) mogą znacząco zwiększać stężenie budezonidu w osoczu, dlatego należy unikać jednoczesnego stosowania. Jeśli nie jest to możliwe,
przerwa między podaniem inhibitora i budezonidu powinna być możliwie najdłuższa (patrz punkt 4.4).
Nie zaleca się stosowania produktu leczniczego Oxodil Combo w leczeniu podtrzymującym i doraźnym u pacjentów przyjmujących silne inhibitory CYP3A4.
Ketokonazol (silny inhibitor izoenzymu CYP3A4) w dawce 200 mg raz na dobę zwiększał około
sześciokrotnie stężenie w osoczu jednocześnie przyjętego doustnie budezonidu (w pojedynczej dawce 3 mg). Gdy ketokonazol podawany był po 12 godzinach od zastosowania budezonidu, stężenie w osoczu zwiększało się średnio tylko trzykrotnie, co wskazuje, że odstęp między zastosowaniem obu produktów leczniczych może zredukować zwiększenie stężenia w osoczu. Ograniczona liczba danych na temat tej interakcji w odniesieniu do dużych dawek wziewnego budezonidu wskazuje, że znaczące zwiększenie stężenia w osoczu (około czterokrotne) może wystąpić, jeśli itrakonazol w dawce 200 mg raz na dobę podaje się jednocześnie z wziewnym budezonidem (w pojedynczej dawce 1000 μg).
Interakcje farmakodynamiczne
β-adrenolityki mogą zmniejszać lub hamować działanie formoterolu, dlatego produktu leczniczego Oxodil Combo nie należy stosować razem z β-adrenolitykami (również w kroplach do oczu), chyba że istnieją bardzo istotne przyczyny.
Jednoczesne leczenie chinidyną, dyzopiramidem, prokainamidem, pochodnymi fenotiazyny, lekami przeciwhistaminowymi (terfenadyną) oraz trójpierścieniowymi lekami przeciwdepresyjnymi może spowodować wydłużenie odstępu QTc i zwiększać ryzyko komorowych zaburzeń rytmu.
Ponadto lewodopa, lewotyroksyna, oksytocyna i alkohol mogą zmniejszyć tolerancję mięśnia sercowego na β2-sympatykomimetyki.
Jednoczesne stosowanie z inhibitorami monoaminooksydazy, w tym z lekami o podobnych właściwościach takie jak furazolidon i prokarbazyna, może powodować zwiększenie ciśnienia tętniczego.
Istnieje zwiększone ryzyko arytmii u pacjentów poddawanych jednocześnie znieczuleniu ogólnemu z zastosowaniem węglowodorów halogenowych.
Jednoczesne stosowanie innych produktów leczniczych o działaniu β-adrenolitycznym lub cholinolitycznym może mieć addytywne działanie rozszerzające oskrzela.
Hipokaliemia może zwiększać skłonność do zaburzeń rytmu serca u pacjentów leczonych glikozydami naparstnicy.
Hipokaliemia może być skutkiem leczenia agonistą receptorów β2-adrenergicznych i mogą ją nasilać jednocześnie stosowane pochodne ksantyny, kortykosteroidy i leki moczopędne (patrz punkt 4.4).
Nie obserwowano interakcji budezonidu i formoterolu z innymi produktami leczniczymi stosowanymi w leczeniu astmy oskrzelowej.
Dzieci i młodzież
Badania dotyczące interakcji przeprowadzono wyłącznie u dorosłych.
Wpływ na płodność, ciążę i laktację
Ciąża
Nie ma dostępnych danych klinicznych dotyczących stosowania złożonego produktu leczniczego zawierającego budezonid i formoterolu fumaran lub jednoczesnego stosowania budezonidu
i formoterolu u kobiet w ciąży. Dane z badania dotyczącego rozwoju zarodka i płodu szczura nie wykazały dodatkowego wpływu połączenia budezonidu z formoterolem.
Brak odpowiednich danych dotyczących stosowania formoterolu u kobiet w ciąży. U zwierząt formoterol wywoływał działania niepożądane w badaniach nad rozrodczością przy bardzo dużej ekspozycji ogólnoustrojowej (patrz punkt 5.3).
Dane dotyczące około 2000 kobiet stosujących wziewnie budezonid w czasie ciąży nie wskazują na zwiększone ryzyko działania teratogennego. W badaniach na zwierzętach wykazano, że glikokortykosteroidy powodują wady rozwojowe (patrz punkt 5.3). Jest mało prawdopodobne, aby dane te miały znaczenie u ludzi stosujących budezonid w zalecanych dawkach.
Badania na zwierzętach wykazały również wpływ nadmiernej (ale przy ekspozycjach poniżej zakresu dawek o działaniu teratogennym) dawki glikokortykosteroidów w okresie prenatalnym na zwiększone ryzyko opóźnienia rozwoju wewnątrzmacicznego, wystąpienia chorób sercowo-naczyniowych
w wieku dorosłym, trwałych zmian wysycenia receptora glikokortykosteroidowego oraz zmian w obrocie i działaniu neuroprzekaźników.
Produkt Oxodil Combo można stosować w okresie ciąży tylko wtedy, gdy korzyści przewyższają możliwe ryzyko. Należy zastosować najmniejszą skuteczną dawkę budezonidu, która zapewnia odpowiednią kontrolę astmy.
Karmienie piersią
Budezonid przenika do mleka kobiecego, jednak stosowany w dawkach leczniczych nie powinien mieć wpływu na dziecko karmione piersią. Nie wiadomo, czy formoterol przenika do mleka
kobiecego. U szczurów wykazano małe stężenie formoterolu w mleku karmiących samic. Stosowanie produktu Oxodil Combo u kobiet karmiących piersią można rozważać tylko wtedy, gdy spodziewane korzyści dla matki przewyższają jakiekolwiek ryzyko dla dziecka.
Płodność
Nie ma dostępnych danych na temat możliwego wpływu budezonidu na płodność.
Badania na zwierzętach dotyczące wpływu formoterolu na reprodukcję wykazały niewielkie
zmniejszenie płodności u samców szczurów przy ekspozycji ogólnoustrojowej na duże dawki (patrz punkt 5.3).
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Produkt Oxodil Combo nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Działania niepożądane
Ponieważ produkt Oxodil Combo zawiera zarówno budezonid, jak i formoterol, mogą wystąpić tego samego rodzaju działania niepożądane, jakie zgłaszano po zastosowaniu tych substancji czynnych. Nie odnotowano zwiększonej częstości działań niepożądanych po jednoczesnym podaniu obu tych
substancji. Najczęściej występującymi działaniami produktu leczniczego są farmakologicznie
przewidywalne działania niepożądane typowe dla agonistów receptorów β2-adrenergicznych, takie jak drżenie i kołatanie serca. Są one łagodne i zwykle ustępują w ciągu kilku dni leczenia.
Poniższe działania niepożądane związane z budezonidem lub formoterolem wymieniono zgodnie
z klasyfikacją układów i narządów oraz częstością. Częstości zdefiniowano następująco: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do
<1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych).
Częstości ustalono na podstawie danych z badań klinicznych. Nie brano pod uwagę częstości po podaniu placebo.
Tabela 1
Klasyfikacja układów i narządów | Częstość | Działanie niepożądane |
Zakażenia i zarażenia pasożytnicze | Często | Kandydoza jamy ustnej i gardła Zapalenie płuc (u pacjentów z POChP) |
Zaburzenia układu immunologicznego | Rzadko | Natychmiastowa lub opóźniona reakcja nadwrażliwości, np. wykwity skórne, pokrzywka, świąd, zapalenie skóry, obrzęk naczynioruchowy i reakcja anafilaktyczna |
Zaburzenia endokrynologiczne | Bardzo rzadko | Zespół Cushinga Zahamowanie czynności nadnerczy Opóźnienie wzrostu Zmniejszenie gęstości mineralnej kości |
Zaburzenia metabolizmu i odżywiania | Rzadko | Hipokaliemia |
Bardzo rzadko | Hiperglikemia | |
Zaburzenia psychiczne | Niezbyt często | Agresja Nadmierna aktywność psychoruchowa Niepokój Zaburzenia snu |
Bardzo rzadko | Depresja Zmiany zachowania (głównie u dzieci) | |
Zaburzenia układu nerwowego | Często | Ból głowy Drżenie |
Niezbyt często | Zawroty głowy | |
Bardzo rzadko | Zaburzenia smaku | |
Zaburzenia oka | Niezbyt często | Nieostre widzenie (patrz także punkt 4.4) |
Bardzo rzadko | Zaćma i jaskra | |
Zaburzenia serca | Często | Kołatanie serca |
Niezbyt często | Tachykardia | |
Rzadko | Zaburzenia rytmu serca, np. migotanie przedsionków, częstoskurcz nadkomorowy, skurcze dodatkowe | |
Bardzo rzadko | Dławica piersiowa Wydłużenie odstępu QTc | |
Zaburzenia naczyniowe | Bardzo rzadko | Zmiany ciśnienia tętniczego |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Często | Niewielkie podrażnienie gardła Kaszel Dysfonia, w tym chrypka |
Rzadko | Skurcz oskrzeli | |
Zaburzenia żołądka i jelit | Niezbyt często | Nudności |
Zaburzenia skóry i tkanki podskórnej | Niezbyt często | Łatwe powstawanie siniaków |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Niezbyt często | Kurcze mięśni |
Osadzanie się produktu leczniczego powoduje zakażenia drożdżakowe (kandydozę) jamy ustnej
i gardła. Należy doradzić pacjentom, aby po zastosowaniu każdej dawki podtrzymującej przepłukiwali jamę ustną wodą, co pozwoli zminimalizować ryzyko takich zakażeń. Zakażenia drożdżakowe jamy ustnej i gardła ustępują zwykle po miejscowym zastosowaniu leków przeciwgrzybiczych bez
konieczności przerywania stosowania wziewnego kortykosteroidu. W razie wystąpienia pleśniawek w jamie ustnej i gardle, pacjent powinien płukać jamę ustną wodą także po inhalacjach doraźnych.
Tak jak w przypadku innych wziewnych produktów leczniczych, bardzo rzadko (u mniej niż 1 na 10 000 osób) może wystąpić paradoksalny skurcz oskrzeli z nasileniem świstów oskrzelowych
i dusznością bezpośrednio po przyjęciu dawki leku. Paradoksalny skurcz oskrzeli ustępuje po zastosowaniu krótko działającego wziewnego leku rozszerzającego oskrzela i należy go leczyć
natychmiast. Należy natychmiast przerwać stosowanie produktu Oxodil Combo, ocenić stan pacjenta i, w razie konieczności, wdrożyć inne leczenie (patrz punkt 4.4).
Po zastosowaniu wziewnych kortykosteroidów, zwłaszcza w dużych dawkach i przez długi czas, mogą wystąpić objawy ogólnoustrojowe. Prawdopodobieństwo ich wystąpienia jest znacznie mniejsze po zastosowaniu kortykosteroidów wziewnych niż doustnych. Do możliwych objawów ogólnoustrojowych należą: zespół Cushinga, cechy cushingoidalne, zahamowanie czynności kory nadnerczy, spowolnienie wzrostu u dzieci i młodzieży, zmniejszenie gęstości mineralnej kości, zaćma i jaskra. Może też wystąpić zwiększona podatność na zakażenia oraz mniejsza zdolność
przystosowania się do sytuacji stresowych. Działania takie zależą prawdopodobnie od dawki, czasu ekspozycji, jednoczesnej i wcześniejszej ekspozycji na steroidy oraz od indywidualnej wrażliwości.
Leczenie agonistami receptorów β2-adrenergicznych może powodować zwiększenie stężenia insuliny, wolnych kwasów tłuszczowych, glicerolu i ciał ketonowych we krwi.
Dzieci i młodzież
U dzieci otrzymujących przez długi czas wziewnie kortykosteroidy zaleca się regularne kontrolowanie wzrostu (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie
Przedawkowanie formoterolu może prawdopodobnie wywołać objawy typowe dla agonistów
receptorów β2-adrenergicznych, takie jak drżenie, ból głowy i kołatanie serca. Sporadycznie zgłaszano przypadki tachykardii, hiperglikemii, hipokaliemii, wydłużenia odstępu QTc, zaburzeń rytmu serca, nudności i wymioty. Wskazane może być leczenie podtrzymujące i objawowe. Podanie
90 mikrogramów formoterolu w ciągu 3 godzin pacjentom z ostrym skurczem oskrzeli nie stwarzało zagrożenia dla bezpieczeństwa pacjenta.
Ostre przedawkowanie budezonidu, nawet po zastosowaniu nadmiernych dawek, nie powinno
stanowić problemu klinicznego. Budezonid stosowany długotrwale w zbyt dużych dawkach może spowodować wystąpienie ogólnoustrojowych działań glikokortykosteroidów, takich jak hiperkortycyzm i zahamowanie czynności nadnerczy.
Jeśli przerwanie stosowania produktu Oxodil Combo jest konieczne ze względu na przedawkowanie formoterolu, składnika tego produktu leczniczego, należy rozważyć zapewnienie odpowiedniego leczenia samym kortykosteroidem wziewnym.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Grupa farmakoterapeutyczna: leki stosowane w chorobach obturacyjnych dróg oddechowych: leki adrenergiczne, wziewne, kod ATC: R03AK07
Mechanizm działania i działanie farmakodynamiczne
Ten produkt leczniczy zawiera formoterol i budezonid, substancje, które mają różny mechanizm działania i działają addycyjnie w odniesieniu do zmniejszenia liczby zaostrzeń astmy. Szczególne właściwości budezonidu i formoterolu pozwalają na stosowanie ich połączenia w leczeniu
podtrzymującym i doraźnym lub w podtrzymującym leczeniu astmy.
Budezonid
Budezonid jest glikokortykosteroidem, który po podaniu wziewnym wykazuje zależne od dawki działanie przeciwzapalne w drogach oddechowych, powodując złagodzenie objawów astmy
i zmniejszenie liczby jej zaostrzeń. Budezonid podawany wziewnie wywołuje słabsze działania niepożądane niż kortykosteroidy o działaniu ogólnym. Dokładny mechanizm przeciwzapalnego działania glikokortykosteroidów nie jest znany.
Formoterol
Formoterol jest wybiórczym agonistą receptora β2-adrenergicznego, który po podaniu wziewnym powoduje szybki i długo utrzymujący się rozkurcz mięśni gładkich oskrzeli u pacjentów
z odwracalnym zwężeniem dróg oddechowych. Działanie rozszerzające oskrzela jest zależne od dawki, a jego początek następuje w ciągu 1 do 3 minut i po inhalacji pojedynczej dawki utrzymuje się przez co najmniej 12 godzin.
Skuteczność kliniczna i bezpieczeństwo stosowania
Astma
Skuteczność kliniczna budezonidu z formoterolem w leczeniu podtrzymującym
Badania kliniczne u dorosłych wykazały, że dodanie formoterolu do budezonidu powoduje poprawę objawów astmy i czynności płuc oraz zmniejszenie liczby zaostrzeń choroby. W dwóch 12- tygodniowych badaniach klinicznych wpływ budezonidu z formoterolem na czynność płuc był taki sam, jak wpływ jednocześnie podanych, osobnych produktów leczniczych zawierających formoterol i budezonid oraz większy niż samego budezonidu. Pacjenci we wszystkich grupach badań stosowali w razie konieczności krótko działający lek z grupy agonistów receptorów β2-adrenergicznych. Nie odnotowano osłabienia działania przeciwastmatycznego z upływem czasu.
Przeprowadzono dwa 12-tygodniowe badania kliniczne, w których 265 dzieci w wieku od 6 do 11 lat otrzymywało dawki podtrzymujące budezonidu z formoterolem [2 inhalacje po (80 μg + 4,5 μg) na dawkę dostarczoną dwa razy na dobę] i w razie konieczności krótko działający lek z grupy agonistów receptorów β2-adrenergicznych. W obu badaniach nastąpiła poprawa czynności płuc, a leczenie było dobrze tolerowane w porównaniu ze stosowaniem równoważnej dawki budezonidu w monoterapii.
Skuteczność kliniczna budezonidu z formoterolem w leczeniu podtrzymującym i doraźnym
W 5 oceniających skuteczność i bezpieczeństwo badaniach klinicznych z podwójnie ślepą próbą, które trwały 6 lub 12 miesięcy, uczestniczyło łącznie 12 076 pacjentów (4447 z nich przydzielono losowo do grupy otrzymującej budezonid z formoterolem w leczeniu podtrzymującym i doraźnym).
Warunkiem włączenia do badania było występowanie u pacjenta objawów klinicznych mimo stosowania wziewnych glikokortykosteroidów.
Jak wskazują wszystkie porównania danych ze wszystkich 5 badań, podtrzymujące i doraźne leczenie budezonidem z formoterolem powodowało znaczące statystycznie i klinicznie zmniejszenie liczby
ciężkich zaostrzeń. Dotyczyło to porównania połączenia budezonidu z formoterolem stosowanego w większej dawce podtrzymującej i terbutaliny stosowanej doraźnie (badanie 735) oraz połączenia budezonidu z formoterolem w tej samej dawce podtrzymującej i formoterolu albo terbutaliny stosowanych doraźnie (badanie 734) (Tabela 2). W badaniu 735 czynność płuc, kontrola objawów i zużycie leków stosowanych doraźnie były podobne we wszystkich badanych grupach. W badaniu 734 objawy i zużycie leków stosowanych doraźnie były mniejsze, a czynność płuc poprawiła się
w porównaniu z obiema grupami otrzymującymi leki porównawcze. Łączne wyniki 5 badań wskazują, że pacjenci otrzymujący budezonid z formoterolem w leczeniu podtrzymującym i doraźnym nie stosowali dawek doraźnych średnio przez 57% dni leczenia. Nie stwierdzono oznak rozwoju tolerancji wraz z upływem czasu.
Tabela 2 Przegląd ciężkich zaostrzeń odnotowanych w badaniach klinicznych
Nr badania Czas trwania | Grupy terapeutyczne | n | Ciężkie zaostrzeniaa | |
Zdarzenia | Zdarzenia/ pacjentolata | |||
Badanie 735 6 miesięcy | Budezonid + formoterol 160 μg + 4,5 μg dwa razy na dobę + doraźnie | 1103 | 125 | 0,23b |
Budezonid + formoterol 320 μg + 9 μg dwa razy na dobę + terbutalina 0,4 mg doraźnie | 1099 | 173 | 0,32 | |
Salmeterol + flutykazon 2 x 25 μg + 125 μg dwa razy na dobę + terbutalina 0,4 mg doraźnie | 1119 | 208 | 0,38 | |
Badanie 734 12 miesięcy | Budezonid + formoterol 160 μg + 4,5 μg dwa razy na dobę + doraźnie | 1107 | 194 | 0,19b |
Budezonid + formoterol 160 μg + 4,5 μg dwa razy na dobę + formoterol 4,5 μg doraźnie | 1137 | 296 | 0,29 | |
Budezonid + formoterol 160 μg + 4,5 μg dwa razy na dobę + terbutalina 0,4 mg doraźnie | 1138 | 377 | 0,37 | |
a Hospitalizacja lub leczenie na oddziale ratunkowym, lub leczenie doustnymi steroidami.
b Zmniejszenie częstości zaostrzeń jest znaczące statystycznie (p <0,01) dla obu porównań.
W 6 badaniach z podwójnie ślepą próbą (na które składało się 5 wymienionych wyżej badań oraz dodatkowe badanie z zastosowaniem większej dawki podtrzymującej 160 μg + 4,5 μg wziewnie dwa razy na dobę) wykazano porównywalną skuteczność i bezpieczeństwo stosowania u młodzieży
i u dorosłych. Podstawą oceny były dane od łącznie 14 385 pacjentów z astmą, z których 1847 należało do grupy młodzieży. Ograniczona była liczba pacjentów z grupy młodzieży stosujących więcej niż 8 inhalacji w co najmniej jednym dniu w ramach podtrzymującego i doraźnego leczenia budezonidem z formoterolem, a stosowanie takie było rzadkie.
W innych 2 badaniach z udziałem pacjentów zgłaszających się do lekarza z powodu objawów ostrego napadu astmy budezonid z formoterolem szybko i skutecznie zmniejszał skurcz oskrzeli, w sposób
zbliżony do działania salbutamolu i formoterolu.
POChP
W dwóch trwających 12 miesięcy badaniach oceniano wpływ na czynność płuc i częstość zaostrzeń choroby (definiowanych jako cykle leczenia doustnymi steroidami i (lub) antybiotykami i (lub) hospitalizacja) u pacjentów z umiarkowaną do ciężkiej postacią POChP. Kryterium włączenia do obu badań była wartość FEV1 <50% wartości należnej przed podaniem leku rozszerzającego oskrzela.
Mediana wartości FEV1 przy włączeniu do badania (po podaniu leku rozszerzającego oskrzela) wynosiła 42% wartości należnej.
Średnia liczba zaostrzeń w roku (zgodnie z powyższą definicją) była istotnie mniejsza po
zastosowaniu budezonidu z formoterolem w porównaniu z grupą stosującą sam formoterol lub placebo (średnio 1,4 w porównaniu z 1,8-1,9 w grupie placebo lub formoterolu). Średnia liczba dni
przyjmowania doustnych kortykosteroidów w przeliczeniu na 1 pacjenta podczas 12 miesięcy badania była nieznacznie mniejsza w grupie stosującej budezonid z formoterolem (7-8 dni/pacjenta/rok
w porównaniu z 11-12 dniami w grupie otrzymującej placebo i 9-12 dniami w grupie formoterolu). Nie wykazano przewagi budezonidu z formoterolem nad samym tylko formoterolem w odniesieniu do zmian parametrów czynności płuc, takich jak FEV1.
Wchłanianie
Wykazano biorównoważność połączenia stałych dawek budezonidu i formoterolu oraz produktów leczniczych zawierających te pojedyncze substancje czynne w odniesieniu do ogólnoustrojowej
ekspozycji na budezonid i formoterol. Mimo to nieco większe zahamowanie wytwarzania kortyzolu obserwowano po podaniu złożonego produktu leczniczego niż po jednoczesnym podaniu produktów leczniczych zawierających pojedyncze substancje czynne. Uważa się, że różnica ta nie wpływa na bezpieczeństwo kliniczne pacjenta.
Nie ma dowodów na interakcje farmakokinetycznych między budezonidem a formoterolem.
Parametry farmakokinetyczne poszczególnych substancji czynnych były porównywalne po podaniu budezonidu i formoterolu w osobnych produktach leczniczych oraz po podaniu w postaci produktu złożonego o ustalonej dawce. Po podaniu produktu złożonego odnotowano nieznacznie większą
wartość AUC dla budezonidu, jego szybsze wchłanianie oraz większe maksymalne stężenie w osoczu.
W przypadku formoterolu maksymalne stężenie w osoczu było podobne po podaniu pojedynczego leku i po podaniu produktu złożonego. Podany wziewnie budezonid jest szybko wchłaniany i osiąga maksymalne stężenie w osoczu w ciągu 30 minut. W badaniach klinicznych średnia odkładania się
budezonidu w płucach po podaniu wziewnym z użyciem inhalatora proszkowego wynosiła od 32% do 44% dostarczonej dawki. Biodostępność ogólnoustrojowa wynosi około 49% dostarczonej dawki.
U dzieci w wieku od 6 do 16 lat odkładanie się w płucach zmniejsza się w tym samym stopniu, co
u pacjentów dorosłych po podaniu takiej samej dawki. Nie określono uzyskanego stężenia w osoczu.
Podany wziewnie formoterol jest szybko wchłaniany i osiąga maksymalne stężenie w osoczu w ciągu 10 minut po inhalacji. W badaniach klinicznych średnia odkładania się formoterolu w płucach po podaniu wziewnym z użyciem inhalatora proszkowego wynosiła od 28% do 49% dostarczonej dawki, a jego biodostępność ogólnoustrojowa około 61% dostarczonej dawki.
Dystrybucja i metabolizm
Formoterol wiąże się z białkami osocza w około 50%, a budezonid w 90%. Objętość dystrybucji formoterolu wynosi około 4 l/kg, a budezonidu 3 l/kg. Formoterol jest unieczynniany w procesie sprzęgania (powstają czynne metabolity O-demetylowane i deformylowane, ale stwierdza się je głównie jako nieaktywne związki sprzężone). Budezonid podlega znacznemu (około 90%)
metabolizmowi pierwszego przejścia przez wątrobę, z wytworzeniem związków o małej aktywności glikokortykosteroidowej. Aktywność glikokortykosteroidowa głównych metabolitów (6-beta-
hydroksybudezonidu i 16-alfa-hydroksyprednizolonu) wynosi mniej niż 1% aktywności budezonidu.
Nie stwierdzono żadnych reakcji metabolicznych ani reakcji wypierania pomiędzy formoterolem a budezonidem.
Eliminacja
Większa część dawki formoterolu jest metabolizowana w wątrobie, a następnie wydalana przez nerki. Po inhalacji od 8% do 13% dostarczonej dawki formoterolu jest wydalane w moczu w niezmienionej postaci. Formoterol ma duży klirens ogólnoustrojowy (około 1,4 l/min), a końcowy okres półtrwania w fazie eliminacji wynosi średnio 17 godzin.
Budezonid jest eliminowany w procesie metabolizmu głównie z udziałem izoenzymu CYP3A4.
Metabolity budezonidu są wydalane w moczu w postaci niezmienionej lub sprzężonej. Tylko
nieznaczna ilość budezonidu wykrywana jest w moczu w postaci niezmienionej. Budezonid ma duży klirens ogólnoustrojowy (około 1,2 l/min), a okres półtrwania w osoczu w fazie eliminacji po podaniu dożylnym wynosi średnio 4 godziny.
Nieznana jest farmakokinetyka budezonidu i formoterolu u pacjentów z niewydolnością nerek. Ekspozycja na budezonid i formoterol może być zwiększona u pacjentów z chorobami wątroby.
Liniowość lub nieliniowość
Ogólnoustrojowa ekspozycja zarówno na budezonid, jak i formoterol jest proporcjonalna do zastosowanej dawki.
Toksyczność obserwowana w badaniach na zwierzętach po zastosowaniu budezonidu i formoterolu (podawanych w skojarzeniu lub oddzielnie) wynikała ze skutków nasilonego działania farmakologicznego.
Badania na zwierzętach dotyczące reprodukcji wykazały, że kortykosteroidy takie jak budezonid powodują wady rozwojowe (rozszczep podniebienia, zniekształcenia układu kostnego). Nie wydaje się jednak, aby wyniki tych doświadczeń na zwierzętach można było odnieść do ludzi otrzymujących
zalecane dawki. Badania wpływu formoterolu na rozrodczość zwierząt wykazały nieco zmniejszoną płodność u samców szczura przy dużej ekspozycji ogólnoustrojowej, mniejszą liczbę implantacji
zarodków, zmniejszenie przeżywalności młodych we wczesnym okresie po urodzeniu i zmniejszenie masy urodzeniowej przy ekspozycjach ogólnoustrojowych znacznie większych niż osiągane
w warunkach klinicznych. Jednak nie wydaje się, aby wyniki tych doświadczeń na zwierzętach miały znaczenie dla ludzi.
Laktoza jednowodna (zawiera białka mleka)
Nie dotyczy.
2 lata
Nie przechowywać w temperaturze powyżej 30°C.
Czerwono-biały plastikowy inhalator zawierający blister OPA/Aluminium/PVC/Aluminium z 60 podzielonymi dawkami proszku do inhalacji w tekturowym pudełku.
Wielkości opakowań: 1, 2, 3, 4 i 6 inhalatorów (każdy po 60 dawek). Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Zakłady Farmaceutyczne POLPHARMA S.A. ul. Pelplińska 19
83-200 Starogard Gdański
Pozwolenie nr
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











