Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Krok 1: Obliczenie dawki LE na podstawie leków zawierających lewodopę stosowanych w okresie aktywności pacjenta.
Krok 2: Określenie godzinowej szybkości infuzji produktu leczniczego Produodopa.
Krok 3: Określenie objętości dawki nasycającej.
Krok 1: Obliczenie dawki LE na podstawie leków zawierających lewodopę stosowanych w okresie aktywności pacjenta.
Ilość lewodopy ze wszystkich postaci zawierających lewodopę stosowanych w okresie aktywności pacjenta w ciągu dnia (zwykle 16 godzin/dobę) należy przeliczyć na LE, stosując odpowiedni mnożnik dawki z Tabeli 1, a następnie zsumować. W tych obliczeniach należy uwzględnić tylko lewodopę i inhibitory COMT. W obliczeniach nie należy uwzględniać lewodopy podawanej w ramach terapii ratunkowej ani żadnych innych leków lub terapii przeciwparkinsonowskich, w tym leków przyjmowanych poza okresem aktywności (np. w nocy). Jeśli w ciągu 24 godzin przyjmowane są jakiekolwiek inhibitory COMT, niezależnie od dawki inhibitora COMT, do sumy LE należy zastosować współczynnik korygujący, jak przedstawiono w Tabeli 1.
Tabela 1. Obliczanie dawek równoważnych lewodopy (LE)
Postać lewodopy
Mnożnik dawki
Produkty o natychmiastowym uwalnianiu, w tym zawiesina dojelitowa
1
Produkty o stopniowym uwalnianiu, o kontrolowanym
uwalnianiu lub o przedłużonym uwalnianiua
0,75
Jeśli stosowany jest jakikolwiek inhibitor COMT, należy pomnożyć sumę obliczonych dawek LE z powyższego punktu przez
1,33a
a Lewodopa zawarta w produktach złożonych LD/CD/inhibitor COMT jest zaliczana do lewodopy o natychmiastowym uwalnianiu i należy ją dodać do dawki LE ze wszystkich innych źródeł lewodopy przed pomnożeniem sumy przez współczynnik korygujący dla inhibitorów COMT (tzn. nie należy stosować współczynnika korygującego COMT do pojedynczej dawki LE).
CD = karbidopa; LD = lewodopa; COMT = katecholo-O-metylotransferaza; LE = dawka
równoważna lewodopy.
Krok 2: Określenie godzinowej szybkości infuzji produktu leczniczego Produodopa.
Sugerowaną początkową szybkość infuzji produktu leczniczego Produodopa na podstawie dawki LE
obliczonej w kroku 1 przedstawiono w Tabeli 2.
Godzinowa szybkość infuzji produktu leczniczego Produodopa w Tabeli 2 jest oparta na dawce LE przyjmowanej przez pacjenta podczas typowego 16-godzinnego okresu aktywności (LE16).
Jeśli w kroku 1 dawka LE była określona na podstawie okresu aktywności dłuższym lub krótszym niż 16 godzin, dawka LE powinna zostać dostosowana do okresu 16-godzinnego. Aby dostosować dawkę do okresu 16-godzinnego, należy dawkę LE obliczoną w kroku 1 podzielić przez liczbę godzin,
w których pacjent zazwyczaj nie śpi, a następnie pomnożyć przez 16. Następnie należy odnieść się do Tabeli 2, w której podano sugerowane początkowe szybkości infuzji produktu leczniczego Produodopa.
Godzinowa szybkość infuzji określona w tym kroku powinna zostać wprowadzona jako podstawowa szybkość infuzji podczas programowania pompy (szczegółowe informacje znajdują się w instrukcji obsługi pompy).
Tabela 2. Sugerowana początkowa godzinowa szybkość infuzji produktu leczniczego Produodopa
LE16 (dawki LE wszystkich doustnych leków
zawierających LD, przyjmowanych w ciągu 16-godzinnego okresu aktywności (mg))
Sugerowana początkowa godzinowa szybkość
infuzji produktu leczniczego Produodopa (ml/godz)a podawanego w ciągu 24 godzin
< 400
0,15
400–499
0,15–0,17
500–599
0,17–0,20
600–699
0,20–0,24
700–799
0,24–0,27
800–899
0,27–0,30
900–999
0,30–0,34
1000–1099
0,34–0,37
1100–1199
0,37–0,40
1200–1299
0,40–0,44
1300–1399
0,44–0,47
1400–1499
0,47–0,51
1500–1599
0,51–0,54
1600–1699
0,54–0,57
1700–1799
0,57–0,61
1800–1899
0,61–0,64
1900–1999
0,64–0,68
2000–2099
0,68–0,71
2100–2199
0,71–0,74
2200–2299
0,74–0,78
2300–2399
0,78–0,81
2400–2499
0,81–0,84
2500–2599
0,84–0,88
2600–2699
0,88–0,91
2700–2799
0,91–0,94
2800–2899
0,94–0,98
2900–2999
0,98–1,01
3000–3099
1,01–1,04
> 3100
1,04
a Godzinową szybkość infuzji można obliczyć według następującego wzoru, gdzie X oznacza liczbę godzin aktywności pacjenta użytą do określenia dawki LE (np. X = 16 w powyższej tabeli).
Godzinowa szybkość infuzji (ml/godz) = [(LE ∙ 0,92 ∙ 1,41) ∕ 240] ∕ X
Założenia wykorzystane do wygenerowania „Sugerowanej początkowej godzinowej szybkości infuzji
produktu leczniczego Produodopa”:
dawkowanie 24-godzinne
dojelitowo
a następnie dzieli przez 16 godzin w celu ustalenia godzinowej szybkości infuzji
LE = dawka równoważna lewodopy; LD = lewodopa.
Całkowita dobowa dawka LE w ciągu 16 godzin jest zwiększona o 50%, aby uwzględnić
Foslewodopa do podania podskórnego jest o 8% bardziej biodostępna niż lewodopa podawana
Stosunek masy cząsteczkowej foslewodopy i lewodopy wynosi 1,41:1
Jeden mililitr produktu leczniczego Produodopa zawiera 240 mg foslewodopy i 12 mg foskarbidopy
Większość pacjentów z chorobą Parkinsona jest leczona doustnymi lekami przeciwparkinsonowskimi w okresie aktywności (okres leczenia zazwyczaj 16 godzin/dobę); po obliczeniu ilości foslewodopy potrzebnej w ciągu 16-godzinnego okresu, wynik dzieli się przez 240 mg, aby określić liczbę mililitrów potrzebnych w ciągu 16-godzinnego okresu,
Krok 3: Określenie objętości dawki nasycającej.
Dawkę nasycającą można podać bezpośrednio przed rozpoczęciem godzinowej infuzji w celu szybkiego osiągnięcia kontroli objawów w przypadku rozpoczynania leczenia produktem leczniczym Produodopa w stanie OFF (lub jeśli pompa była wyłączona przez ponad 3 godziny). Dawki nasycające można podawać za pomocą pompy lub doustnych tabletek karbidopy i lewodopy o natychmiastowym uwalnianiu.
W Tabeli 3 podano zalecaną objętość dawki nasycającej (ml) produktu leczniczego Produodopa, którą należy zaprogramować w pompie (szczegółowe informacje znajdują się w instrukcji obsługi pompy) oraz odpowiadającą jej ilość lewodopy o natychmiastowym uwalnianiu (mg), niezależnie od tego, czy podawany jest jednocześnie obwodowy inhibitor dekarboksylazy DOPA (np. karbidopa, benserazyd).
Tabela 3. Określenie objętości produktu leczniczego Produodopa zalecanej do podania dawki nasycającej
Zalecana objętość dawki nasycającej (ml), którą należy zaprogramować w pompie
Przybliżona odpowiadająca ilość lewodopy
(mg)
0,6
100
0,9–1,2
150–200
1,5–1,8
250–300
2,0
350
0,1 ml produktu leczniczego Produodopa zawiera 24 mg foslewodopy (co odpowiada około 17 mg lewodopy). Pompa może podawać dawkę nasycającą w zakresie od 0,1 ml do maksymalnie
3,0 ml, w odstępach co 0,1 ml.
Optymalizacja i konserwacja
Personel medyczny może dostosować początkową godzinową szybkość infuzji w celu uzyskania optymalnej odpowiedzi klinicznej u danego pacjenta. Godzinowa szybkość infuzji powinna być stosowana w sposób ciągły w czasie 24-godzinnej infuzji. W razie potrzeby personel medyczny może zaprogramować i umożliwić 2 różne szybkości godzinowej infuzji (niska/wysoka). Wszystkie szybkości infuzji mogą być dostosowywane w odstępach co 0,01 ml/godzinę (co odpowiada około 1,7 mg lewodopy/godzinę) i nie powinny przekraczać 1,04 ml/godzinę (lub około 4260 mg lewodopy na dobę [6000 mg foslewodopy na dobę]). W pompie zastosowano funkcję bezpiecznego dostępu do konfiguracji dawki, aby uniemożliwić pacjentom wprowadzanie zmian w zaprogramowanych wartościach przepływu lub w funkcji dawki dodatkowej.
Produkt leczniczy Produodopa może być przyjmowany samodzielnie lub, w razie konieczności, jednocześnie z innymi produktami leczniczymi stosowanymi w chorobie Parkinsona, w zależności od oceny lekarza. Podczas infuzji produktu leczniczego Produodopa można rozważyć zmniejszenie dawki innych jednocześnie stosowanych leków stosowanych w chorobie Parkinsona, a następnie dostosowanie dawki produktu leczniczego Produodopa. Nie badano jednoczesnego stosowania produktu leczniczego Produodopa z innymi lekami zawierającymi lewodopę lub z produktami leczniczymi, które w istotny sposób regulują synaptyczne stężenie dopaminy (takie jak inhibitory COMT).
Inna prędkość przepływu
Pompa umożliwia również zaprogramowanie dwóch innych szybkości infuzji dla pacjenta (niska/wysoka). Inne szybkości infuzji muszą być włączone i wstępnie zaprogramowane przez personel medyczny i mogą być wybierane przez pacjentów w celu uwzględnienia zmian
w zapotrzebowaniu funkcjonalnym, np. obniżenia dawki w nocy lub zwiększenia dawki w przypadku długotrwałej intensywnej aktywności (szczegółowe informacje znajdują się w instrukcji obsługi pompy).
Dawki dodatkowe
Jeśli lekarz wyrazi na to zgodę, pacjent może samodzielnie podać sobie dodatkową dawkę w celu opanowania ostrych objawów OFF występujących podczas ciągłej infuzji. Objętość dawki dodatkowej można wybrać spośród 5 opcji (patrz Tabela 4). Funkcja dawki dodatkowej jest ograniczona do maksymalnie 1 dawki dodatkowej na godzinę. Jeśli pacjent zużyje 5 lub więcej dodatkowych dawek w ciągu 24-godzinnego/dobowego okresu leczenia, należy rozważyć zmianę podstawowej szybkości infuzji. Możliwość włączenia tej funkcji, jak również minimalny czas wymagany między dawkami dodatkowymi, jest określana przez lekarza i nie może być modyfikowana przez pacjenta (szczegółowe informacje na temat programowania funkcji dodatkowej dawki znajdują się w instrukcji obsługi pompy).
Tabela 4. Opcja dawki dodatkowej produktu leczniczego Produodopa
Objętość produktu leczniczego
Produodopa (ml)
Dawka równoważna lewodopy
(mg)
0,10
17
0,15
25,5
0,20
34
0,25
42,5
0,30
51
Sposób podawania
Produkt leczniczy Produodopa jest podawany podskórnie, najlepiej w brzuch, omijając obszar
o promieniu 5 cm od pępka. Podczas przygotowywania i podawania tego produktu należy stosować technikę aseptyczną. Zestaw infuzyjny (kaniula) może pozostać na miejscu nawet przez 3 dni, jeśli lek jest podawany w sposób ciągły. Należy zmieniać miejsce infuzji i używać nowego zestawu infuzyjnego przynajmniej co 3 dni. Zaleca się, aby nowe miejsca infuzji były oddalone o co najmniej 2,5 cm od miejsc używanych w ciągu ostatnich 12 dni. Produktu leczniczego Produodopa nie należy podawać w miejsca, które są tkliwe, zasinione, zaczerwienione lub twarde w dotyku. Do podawania produktu leczniczego Produodopa należy stosować wyłącznie pompę Vyafuser (szczegółowe informacje znajdują się w instrukcji obsługi pompy) z użyciem sterylnych, jednorazowych elementów infuzyjnych (strzykawka, zestaw infuzyjny i adapter fiolki) zakwalifikowanych do użytku. Pacjenci powinni zostać przeszkoleni w zakresie prawidłowego stosowania produktu leczniczego Produodopa oraz systemu podawania (pompa, fiolka z roztworem, adapter fiolki, strzykawka, zestaw infuzyjny, akcesoria do przenoszenia, akumulator i ładowarka) przed rozpoczęciem leczenia produktem leczniczym Produodopa oraz, w razie potrzeby, po jego zakończeniu.
W badaniu krzyżowym farmakokinetyki podawanie produktu leczniczego Produodopa w ramię i udo powodowało prawie taką samą ekspozycję na lek jak w przypadku brzucha (patrz punkt 5.2 Wchłanianie). Nie oceniano długoterminowego bezpieczeństwa i skuteczności podawania leku
w ramię i udo.
Lek należy przechowywać i używać w sposób opisany w punkcie 6.4, Specjalne środki ostrożności podczas przechowywania. Fiolki z lekiem są przeznaczone wyłącznie do jednorazowego użytku. Po przeniesieniu zawartości fiolki do strzykawki, zawartość strzykawki należy podać w ciągu 24 godzin. Zużyte fiolki i strzykawki z lekiem należy usuwać zgodnie z lokalnymi przepisami. Strzykawki należy wyrzucić, nawet jeśli pozostały w nich resztki produktu, zgodnie z zaleceniami personelu medycznego (patrz punkt 6.6 Specjalne środki ostrożności dotyczące usuwania).
Przerwanie leczenia
Zasadniczo należy unikać nagłego przerwania stosowania produktu leczniczego Produodopa lub szybkiego zmniejszania jego dawki, bez zastosowania alternatywnego leczenia dopaminergicznego (patrz punkt 4.4).
Podawanie produktu leczniczego Produodopa można przerwać bez podejmowania dalszych działań na krótki okres, np. gdy pacjent bierze prysznic. W przypadku przerw dłuższych niż jedna godzina należy użyć nowego zestawu infuzyjnego (zgłębnika i kaniuli) i zmienić miejsce infuzji. Jeśli infuzja została przerwana na dłużej niż 3 godziny, pacjent może również samodzielnie podać sobie dawkę nasycającą, jeśli zezwoli na to lekarz, w celu szybkiego przywrócenia kontroli objawów.
Jeśli leczenie produktem leczniczym Produodopa zostanie przerwane na dłuższy czas (> 24 godzin) lub zostanie trwale przerwane, lekarz powinien określić odpowiednie alternatywne leczenie dopaminergiczne (np. doustna lewodopa/karbidopa). Leczenie produktem leczniczym Produodopa może być wznowione w dowolnym czasie, zgodnie z instrukcjami dotyczącymi rozpoczęcia leczenia tym produktem (patrz punkt 4.2 Rozpoczęcie leczenia).
Szczególne populacje
Farmakokinetyka produktu leczniczego Produodopa nie była oceniana w żadnej szczególnej populacji. Produkt leczniczy Produodopa jest przeznaczony do stosowania u pacjentów z chorobą Parkinsona, którzy przyjmują już stałą dawkę lewodopy doustnie. Różnice w ekspozycji nie są uważane za klinicznie istotne, ponieważ dawka produktu leczniczego Produodopa jest optymalizowana po rozpoczęciu leczenia. W związku z tym nie oczekuje się, że efekty zmiennych towarzyszących będą miały wpływ na skuteczność kliniczną lub bezpieczeństwo. Więcej informacji na temat farmakokinetyki lewodopy i karbidopy w szczególnych populacjach, patrz punkt 5.2.
Przeciwwskazania
nadwrażliwością na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną
w punkcie 6.1
jaskrą z wąskim kątem przesączania
ciężką niewydolnością serca
ostrym udarem
ciężkimi zaburzeniami rytmu serca
przeciwwskazane jest stosowanie z produktem leczniczym Produodopa nieselektywnych inhibitorów MAO i selektywnych inhibitorów MAO typu A. Należy przerwać podawanie tych inhibitorów co najmniej na 2 tygodnie przed rozpoczęciem leczenia produktem leczniczym Produodopa. Produkt leczniczy Produodopa można podawać równocześnie z zalecaną przez wytwórcę dawką inhibitora MAO o wybiórczym działaniu na MAO typu B (np. selegiliny chlorowodorek) (patrz punkt 4.5).
chorobami, w których podawanie leków adrenomimetycznych jest przeciwwskazane, np. guz
chromochłonny, nadczynność tarczycy oraz zespół Cushinga.
Lewodopa może aktywować czerniaka złośliwego i dlatego nie należy stosować produktu leczniczego
Produodopa u pacjentów z podejrzanymi, nierozpoznanymi zmianami skórnymi lub z czerniakiem w wywiadzie.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Produkt leczniczy Produodopa nie jest zalecany w leczeniu polekowych reakcji pozapiramidowych.
Należy zachować ostrożność, podając produkt leczniczy Produodopa pacjentom z ciężką chorobą sercowo-naczyniową lub płuc, astmą oskrzelową, chorobą nerek, wątroby lub endokrynną, lub z chorobą wrzodową albo drgawkami w wywiadzie.
U pacjentów z zawałem mięśnia sercowego w wywiadzie, u których utrzymują się zaburzenia rytmu serca, pochodzące z węzła przedsionkowo-komorowego lub komorowe, podczas początkowego dostosowania dawki należy szczególnie dokładnie monitorować czynność serca.
Wszystkich pacjentów leczonych produktem leczniczym Produodopa należy dokładnie monitorować pod kątem rozwoju zaburzeń psychicznych, depresji z tendencjami samobójczymi i innych poważnych zaburzeń psychicznych. Należy zachować ostrożność podczas leczenia pacjentów z psychozami występującymi w przeszłości lub obecnie. Większa częstość omamów może wystąpić u pacjentów leczonych agonistami dopaminy i (lub) innymi lekami dopaminergicznymi zawierającymi lewodopę w tym produkt leczniczy Produodopa. W takich przypadkach zaleca się przeanalizowanie stosowanego leczenia.
Należy zachować ostrożność przy równoczesnym podawaniu leków przeciwpsychotycznych o właściwościach blokowania receptorów dopaminowych, szczególnie antagonistów receptora D2, a pacjenci powinni być dokładnie obserwowani pod kątem utraty skuteczności działania przeciwparkinsonowskiego lub nasilenia objawów parkinsonizmu (patrz punkt 4.5).
Pacjentów z przewlekłą jaskrą z szerokim kątem przesączania można leczyć produktem leczniczym Produodopa z zachowaniem ostrożności, pod warunkiem, że ciśnienie wewnątrzgałkowe jest dobrze kontrolowane, a pacjent jest dokładnie monitorowany w kierunku zmian ciśnienia wewnątrzgałkowego.
Produkt leczniczy Produodopa może wywoływać niedociśnienie ortostatyczne. Dlatego należy zachować ostrożność, jeśli produkt leczniczy Produodopa jest podawany pacjentom przyjmującym inne produkty lecznicze mogące powodować niedociśnienie ortostatyczne (patrz punkt 4.5).
U pacjentów z chorobą Parkinsona stosowanie lewodopy wiązano z sennością i epizodami nagłego zasypiania. Dlatego należy zachować ostrożność podczas prowadzenia pojazdów lub obsługiwania maszyn (patrz punkt 4.7).
Po nagłym odstawieniu leków przeciwparkinsonowskich obserwowano objawy przypominające złośliwy zespół neuroleptyczny (ang. Neuroleptic Malignant Syndrome, NMS), w tym sztywność mięśni, podwyższoną temperaturę ciała oraz zmiany stanu psychicznego
(np. pobudzenie, splątanie, śpiączka), a także zwiększoną aktywność fosfokinazy kreatynowej w surowicy. U pacjentów z chorobą Parkinsona rzadko obserwowano rabdomiolizę, wtórną do złośliwego zespołu neuroleptycznego, lub ciężkich dyskinez. Dlatego po nagłym zmniejszeniu dawki lub przerwaniu podawania lewodopy z karbidopą należy dokładnie obserwować pacjentów, a szczególnie pacjentów przyjmujących leki przeciwpsychotyczne. Nie zgłaszano występowania NMS ani rabdomiolizy w związku z podawaniem produktu leczniczego Produodopa.
Należy regularnie monitorować pacjentów pod kątem rozwoju zaburzeń kontroli impulsów. Należy poinformować pacjentów i ich opiekunów, że u osób leczonych agonistami dopaminy i (lub) innymi produktami dopaminergicznymi zawierającymi lewodopę, w tym produktem leczniczym Produodopa, mogą wystąpić behawioralne objawy zaburzeń kontroli impulsów,
a w tym: uzależnienie od hazardu, zwiększone libido i hiperseksualność, kompulsywne wydawanie pieniędzy lub kupowanie oraz kompulsywne lub napadowe objadanie się. W takich przypadkach zaleca się przeanalizowanie stosowanego leczenia.
Badania epidemiologiczne wykazały, że u pacjentów z chorobą Parkinsona, w porównaniu do populacji ogólnej, występuje zwiększone ryzyko rozwoju czerniaka. Nie wyjaśniono, czy zaobserwowane zwiększone ryzyko było spowodowane chorobą Parkinsona czy innymi czynnikami, takimi jak leki stosowane w chorobie Parkinsona. Dlatego podczas stosowania produktu leczniczego Produodopa, w każdym ze wskazań, zaleca się pacjentom i personelowi medycznemu regularną kontrolę w celu wykluczenia czerniaka. Najbardziej właściwe jest prowadzenie przez specjalistów (np. dermatologów) okresowych badań skóry.
Zespół dysregulacji dopaminowej (ang. Dopamine Dysregulation Syndrome, DDS) jest
uzależnieniem prowadzącym do nadmiernego stosowania produktu, obserwowanym
u niektórych pacjentów leczonych karbidopą z lewodopą. Przed rozpoczęciem leczenia należy ostrzec pacjenta i jego opiekunów o możliwym ryzyku DDS.
W celu uniknięcia dyskinez wywołanych przez lewodopę może być konieczne zmniejszenie
dawki produktu leczniczego Produodopa.
Podczas długookresowej terapii produktem leczniczym Produodopa zaleca się okresową kontrolę czynności wątroby, układu krwiotwórczego, układu sercowo-naczyniowego oraz nerek.
Produkt leczniczy Produodopa zawiera hydrazynę, produkt rozpadu foskarbidopy, która może być genotoksyczna i potencjalnie kancerogenna. Mediana dawki dobowej produktu leczniczego Produodopa wynosi około 2541 mg/dobę foslewodopy i 127 mg/dobę foskarbidopy. Maksymalna zalecana dawka dobowa wynosi 6000 mg foslewodopy i 300 mg foskarbidopy. Obejmuje to hydrazynę przy medianie ekspozycji do 0,2 mg/dobę i maksymalnej dawce
0,5 mg/dobę. Znaczenie kliniczne takiej ekspozycji na hydrazynę nie jest znane.
Obniżona zdolność do obsługiwania systemu podawania leku może prowadzić do powikłań. W przypadku takich pacjentów, choremu powinien pomagać opiekun (np. pielęgniarka lub bliski krewny).
Nagłe lub stopniowe nasilenie bradykinezji może wskazywać na niedrożność urządzenia
i wymaga sprawdzenia w celu ustalenia przyczyny.
U pacjentów leczonych produktami zawierającym lewodopę z karbidopą notowano polineuropatię. Przed rozpoczęciem leczenia należy określić, czy u pacjenta w przeszłości występowały objawy polineuropatii oraz znane czynniki ryzyka, a następnie regularnie obserwować.
U pacjentów otrzymujących produkt leczniczy Produodopa zgłaszano zdarzenia w miejscu infuzji (patrz punkt 4.8). W celu zmniejszenia ryzyka zaleca się przestrzeganie zasad aseptyki podczas stosowania tego leku oraz częste zmienianie miejsca infuzji. W badaniach klinicznych u niewielu pacjentów, u których wystąpiły reakcje w miejscu infuzji, wystąpiły również zakażenia w miejscu infuzji. Dlatego zaleca się uważne monitorowanie ciężkich reakcji
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Produodopa, 240 mg/ml + 12 mg/ml, roztwór do infuzji
1 ml zawiera 240 mg foslewodopy i 12 mg foskarbidopy.
10 ml zawiera 2400 mg foslewodopy i 120 mg foskarbidopy.
Foslewodopa i foskarbidopa są prolekami równoważnymi około 170 mg lewodopy i 9 mg karbidopy
na 1 ml.
Substancja pomocnicza o znanym działaniu
Produodopa zawiera około 1,84 mmol (42,4 mg) sodu na ml. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do infuzji (infuzja).
Produkt leczniczy Produodopa jest przezroczystym do lekko opalizującego roztworem w szklanej fiolce. Roztwór nie powinien zawierać cząstek stałych. Produkt leczniczy Produodopa może być bezbarwny, żółty lub brązowy i może mieć fioletowy lub czerwony odcień. Różnice w zabarwieniu są spodziewane i nie mają wpływu na jakość produktu. Roztwór może przybrać ciemniejsze zabarwienie po przekłuciu korka fiolki lub gdy jest w strzykawce.
pH wynosi około 7,4. Osmolalność wynosi około 2200 do 2500 mOsmol/kg, ale może wynosić do
2700 mOsmol/kg.
Leczenie zaawansowanej choroby Parkinsona odpowiadającej na lewodopę u pacjentów, u których występują ciężkie fluktuacje ruchowe oraz hiperkinezy i (lub) dyskinezy, w przypadku gdy dostępne połączenia leków stosowanych w chorobie Parkinsona nie przynoszą zadowalających wyników.
Dawkowanie
Produkt leczniczy Produodopa jest podawany w postaci ciągłego wlewu podskórnego, przez 24 godziny na dobę.
Zalecana początkowa szybkość infuzji produktu leczniczego Produodopa jest określana poprzez przeliczenie dobowej dawki przyjmowanej lewodopy na dawkę równoważną lewodopy (ang. levodopa equivalents, LE), a następnie zwiększenie jej w celu uwzględnienia 24-godzinnego podawania produktu (patrz Rozpoczęcie leczenia). Dawkę można dostosować w celu uzyskania odpowiedzi klinicznej, która maksymalizuje okres dobrej sprawności ruchowej (faza „włączenia” – ON) oraz
minimalizuje liczbę i czas trwania epizodów „wyłączenia” – OFF oraz epizodów ON z uciążliwymi dyskinezami. Maksymalna zalecana dawka dobowa foslewodopy wynosi 6000 mg (lub 25 ml produktu leczniczego Produodopa na dobę, co odpowiada około 4260 mg lewodopy na dobę).
Produodopa zastępuje leki zawierające lewodopę i inhibitory katecholo-O-metylotransferazy
(ang. catechol-O-methyl transferase, COMT). W razie potrzeby można stosować jednocześnie inne
klasy produktów leczniczych stosowanych w leczeniu choroby Parkinsona.
Rozpoczęcie leczenia
Pacjenci zakwalifikowani do leczenia produktem leczniczym Produodopa powinni być w stanie zrozumieć działanie systemu podawania i stosować go samodzielnie lub z pomocą opiekuna.
Pacjenci powinni zostać przeszkoleni w zakresie prawidłowego stosowania produktu leczniczego Produodopa i systemu podawania (patrz Sposób podawania) przed rozpoczęciem leczenia produktem leczniczym Produodopa oraz, w razie potrzeby, w późniejszym okresie.
Rozpoczęcie leczenia produktem leczniczym Produodopa wymaga wykonania trzech czynności.
Produkt leczniczy Produodopa jest przeciwwskazany u pacjentów z:
Specjalne ostrzeżenia i środki ostrożności dotyczące produktu leczniczego Produodopa
w miejscu infuzji i zakażeń w miejscu infuzji.
Produodopa zawiera sód
Produkt leczniczy Produodopa zawiera 42,4 mg (około 1,84 mmol) sodu na ml, co odpowiada 2,1% zalecanej przez WHO maksymalnej dobowej dawki sodu. Maksymalna dawka dobowa tego leku zawiera 54% zalecanej przez WHO maksymalnej dobowej dawki sodu.
Produodopa zawiera dużą ilość sodu. Należy to wziąć pod uwagę zwłaszcza u pacjentów stosujących dietę o niskiej zawartości soli.
Nie przeprowadzono badań dotyczących interakcji z produktem leczniczym Produodopa. Wymienione poniżej interakcje odnotowano podczas stosowania odtwórczego produktu zawierającego lewodopę
z karbidopą.
Należy zachować ostrożność podczas jednoczesnego stosowania produktu leczniczego Produodopa z następującymi produktami leczniczymi.
Leki przeciwnadciśnieniowe
Objawowe niedociśnienie ortostatyczne występowało, gdy lewodopa oraz inhibitor dekarboksylazy zostały dodatkowo zastosowane w leczeniu pacjentów otrzymujących już leki przeciwnadciśnieniowe. Konieczne może być dostosowanie dawki leku przeciwnadciśnieniowego.
Leki przeciwdepresyjne
Rzadko informowano o działaniach niepożądanych, w tym nadciśnieniu tętniczym i dyskinezach spowodowanych jednoczesnym podawaniem trójpierścieniowych leków przeciwdepresyjnych (np. amoksapiny i trimipraminy) i produktów zawierających karbidopę z lewodopą.
Inhibitory COMT (np. tolkapon, entakapon, opikapon)
Jednoczesne stosowanie inhibitorów COMT (katecholo-O-metylotransferazy) oraz produktu leczniczego Produodopa może zwiększać biodostępność lewodopy. Konieczne może być dostosowanie dawki produktu leczniczego Produodopa.
Inne produkty lecznicze
Antagoniści receptorów dopaminy (niektóre leki przeciwpsychotyczne, np. pochodne fenotiazyny, butyrofenonu, rysperydon oraz leki przeciwwymiotne, np. metoklopramid), pochodne benzodiazepiny, izoniazyd, fenytoina i papaweryna mogą osłabiać działanie terapeutyczne lewodopy. Pacjenci przyjmujący powyższe produkty lecznicze jednocześnie z produktem leczniczym Produodopa powinni być dokładnie obserwowani w kierunku utraty odpowiedzi terapeutycznej.
Inhibitory MAO są przeciwwskazane u pacjentów przyjmujących produkt leczniczy Produodopa, z wyjątkiem selektywnych inhibitorów MAO typu B (np. selegiliny chlorowodorek). Może być konieczne zmniejszenie dawki lewodopy, jeśli dodany jest selektywny inhibitor MAO typu B.
Jednoczesne stosowanie selegiliny oraz lewodopy z karbidopą było związane z występowaniem ciężkiego niedociśnienia ortostatycznego.
Amantadyna działa synergistycznie z lewodopą i może nasilać działania niepożądane związane z przyjmowaniem lewodopy. Może być konieczne dostosowanie dawki produktu leczniczego Produodopa.
Sympatykomimetyki (np. leki adrenergiczne, nie tylko salbutamol, fenylefryna, izoproterenol, dobutamina) mogą nasilać działania niepożądane ze strony układu sercowo-naczyniowego związane z przyjmowaniem lewodopy.
Foskarbidopa została zidentyfikowana jako potencjalny czynnik indukujący CYP1A2 in vitro. Należy zachować ostrożność podczas przepisywania produktu leczniczego Produodopa w skojarzeniu
z wrażliwymi substratami CYP1A2 (np. fluwoksamina, klozapina, kofeina, teofilina, duloksetyna i melatonina). Nie przeprowadzono badań klinicznych interakcji z innymi lekami, aby ocenić znaczenie kliniczne tego odkrycia.
Możliwości hamowania białek transportowych OATP1B1, OATP1B3, OCT1, OAT1, OAT3, OCT2, MATE1 i MATE2K przez foslewodopę nie zostały w pełni ocenione in vitro i nie można wykluczyć potencjalnego klinicznie istotnego wpływu na ekspozycję na substrat.
Ciąża
Brak danych dotyczących stosowania produktu leczniczego Produodopa u kobiet w ciąży. Badania lewodopy z karbidopą na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Produkt leczniczy Produodopa nie jest zalecany do stosowania w okresie ciąży oraz u kobiet w wieku rozrodczym nie stosujących skutecznej metody antykoncepcji, chyba że korzyści dla matki przeważają nad możliwym ryzykiem dla płodu.
Karmienie piersią
Lewodopa, a być może także metabolity lewodopy przenikają do mleka ludzkiego. Istnieją dowody, że w czasie leczenia lewodopą laktacja ulega hamowaniu.
Nie wiadomo, czy karbidopa lub jej metabolity przenikają do mleka ludzkiego. Badania na zwierzętach wykazały przenikanie karbidopy do mleka.
Brak wystarczających danych dotyczących działania produktu leczniczy Produodopa lub jego metabolitów u noworodków i niemowląt. Podczas leczenia produktem leczniczym Produodopa należy przerwać karmienie piersią.
Płodność
W badaniach wpływu na reprodukcję nie wykazano oddziaływania na płodność szczurów otrzymujących lewodopę/karbidopę.
Produkt leczniczy Produodopa może wywierać znaczny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Lewodopa i karbidopa mogą powodować zawroty głowy i niedociśnienie
ortostatyczne. Dlatego należy zachować ostrożność podczas prowadzenia pojazdów oraz obsługiwania maszyn. Pacjentów leczonych produktem leczniczym Produodopa, u których występuje senność
i (lub) epizody nagłego zasypiania, należy poinformować o konieczności unikania prowadzenia pojazdów lub wykonywania czynności, podczas których osłabienie czujności mogłoby stanowić zagrożenie dla nich samych lub dla innych osób, z ryzykiem ciężkich obrażeń lub śmierci (np. podczas obsługiwania maszyn), dopóki takie nawracające epizody i senność nie ustąpią (patrz także punkt 4.4).
Podsumowanie profilu bezpieczeństwa
Najczęstszymi działaniami niepożądanymi (≥ 10%) były zdarzenia w miejscu infuzji (rumień w miejscu infuzji, guzek w miejscu infuzji, zapalenie tkanki łącznej w miejscu infuzji, obrzęk w miejscu infuzji, ból w miejscu infuzji i reakcja w miejscu infuzji), omamy, upadek, niepokój i zawroty głowy.
Tabelaryczne zestawienie działań niepożądanych
(≥ 1/100 do < 1/10), niezbyt często (≥ 1/1 000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1 000) lub
bardzo rzadko (< 1/10 000).
Tabela 5. Tabelaryczne zestawienie działań niepożądanych
Klasyfikacja układów i narządów | Częstość występowania | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Bardzo często | Ropień w miejscu infuzji Zapalenie tkanki łącznej w miejscu infuzji |
Częstoa | Zakażenie w miejscu infuzji | |
Zaburzenia krwi i układu chłonnego | Często | Niedokrwistośćb |
Niezbyt często | Leukopeniab Trombocytopeniab | |
Zaburzenia metabolizmu i odżywiania | Często | Zmniejszenie apetytu |
Zaburzenia psychiczne | Bardzo często | Niepokój Omamyc |
Często | Nietypowe snyb Pobudzenieb Stan splątania Złudzenia Depresja Zaburzenie kontroli impulsów Bezsenność Zaburzenie psychotyczne Napady snub Zaburzenie snub Myśli samobójcze | |
Niezbyt często | Samobójstwo dokonaneb Otępienieb Zespół dysregulacji dopaminowej Nastrój euforycznyb Strachb Zwiększone libidob Paranoja Próba samobójczab |
Zaburzenia układu nerwowego | Bardzo często | Zawroty głowy |
Często | Zaburzenia funkcji poznawczych Ortostatyczne zawroty głowy Dyskinezy Dystonia Bóle głowy Hipestezja Zjawisko ON-OFF Parestezje Polineuropatiad Senność Omdlenia Drżenieb | |
Niezbyt często | Ataksjab Drgawkib Zaburzenia chodub | |
Zaburzenia oka | Niezbyt często | Jaskra z zamkniętym kątem przesączaniab Kurcz powiekb Podwójne widzenieb Niedokrwienna neuropatia nerwu wzrokowegob Niewyraźne widzenieb |
Zaburzenia serca | Często | Nieregularna częstość pracy sercab |
Niezbyt często | Kołatanie serca | |
Zaburzenia naczyniowe | Często | Nadciśnienie tętnicze Niedociśnienie tętnicze Niedociśnienie ortostatyczne |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Często | Duszność |
Niezbyt często | Dysfoniab | |
Zaburzenia żołądka i jelit | Często | Rozdęcie brzuchab Bóle brzucha Zaparcia Biegunka Suchość w jamie ustnej Zaburzenie smakub Niestrawnośćb Utrudnione połykanieb Wzdęcie z oddawaniem gazówb Nudności Wymioty |
Niezbyt często | Nadmierne wydzielanie ślinyb | |
Rzadko | Bruksizmb Przebarwienie ślinyb Ból językab Czkawkab | |
Zaburzenia skóry i tkanki podskórnej | Często | Kontaktowe zapalenie skóryb Nadmierna potliwośćb Świąd Wysypka |
Niezbyt często | Łysienieb Rumieńb Pokrzywkab |
Rzadko | Przebarwienie potub Czerniak złośliwyb | |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Często | Skurcze mięśni |
Zaburzenia nerek i dróg moczowych | Często | Nietrzymanie moczu Zatrzymanie moczu |
Niezbyt często | Niewłaściwe zabarwienie moczub | |
Rzadko | Priapizmb | |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Rumień w miejscu infuzji Reakcja w miejscu infuzji Guzek w miejscu infuzji Obrzęk w miejscu infuzji Ból w miejscu infuzji |
Częstoa | Astenia Uczucie zmęczenia Zasinienie w miejscu infuzji Złuszczenie w miejscu infuzji Wynaczynienie w miejscu infuzji Krwiak w miejscu infuzji Krwotok w miejscu infuzji Stwardnienie w miejscu infuzji Stan zapalny w miejscu infuzji Podrażnienie w miejscu infuzji Naciek w miejscu infuzji Grudka w miejscu infuzji Świąd w miejscu infuzji Wysypka w miejscu infuzji Opuchlizna w miejscu infuzji Złe samopoczucie Obrzęk obwodowy Bólb | |
Niezbyt często | Bóle w klatce piersiowejb | |
Badania diagnostyczne | Często | Obniżona zawartość witaminy B6 Zmniejszenie masy ciała |
Urazy, zatrucia i powikłania po zabiegach | Bardzo często | Upadki |
a Wspólne działania niepożądane odnoszące się do zdarzeń w miejscu infuzji włączono, jeśli częstość występowania ≥ 2%. b Te działania niepożądane stwierdzono w przypadku produktu leczniczego Duodopa żel dojelitowy jako działania niepożądane związane ze stosowaniem leku. Jednakże nie były to działania niepożądane produktu leczniczego Produodopa. c Omamy obejmują omamy, omamy wzrokowe, omamy słuchowe, omamy węchowe i omamy mieszane. d Polineuropatia obejmuje neuropatię obwodową, polineuropatię, osłabienie czucia wibracji, nerwoból, zaburzenia czucia, utratę czucia. | ||
Opis wybranych działań niepożądanych
Zakażenie w miejscu infuzji
W badaniach klinicznych obserwowano zdarzenia w miejscu infuzji, w tym reakcje w miejscu infuzji i zakażenia, często występujące w przypadku infuzji podskórnej produktu leczniczego Produodopa. Większość zdarzeń w miejscu infuzji nie była ciężka, miała łagodne lub umiarkowane nasilenie
i ustępowała samoistnie lub po zastosowaniu leczenia, takiego jak antybiotyki i (lub) nacięcie i drenaż. U trzech uczestników z zakażeniami w miejscu infuzji wystąpiło powikłanie w postaci posocznicy, które skutkowało hospitalizacją. Należy monitorować wszelkie zmiany na skórze w miejscu infuzji, które mogą wskazywać na potencjalne zakażenie, takie jak zaczerwienienie połączone z ciepłem, obrzęk, ból i odbarwienie po uciśnięciu. Podczas stosowania tego leku należy przestrzegać zasad aseptyki i rozważyć częstszą niż co 3 dni zmianę miejsca infuzji, używając nowego zestawu do infuzji, jeśli pojawią się takie zmiany na skórze. Zaleca się, aby nowe miejsca infuzji były oddalone
o co najmniej 2,5 cm od miejsc używanych w ciągu ostatnich 12 dni.
Badania laboratoryjne: Zgłaszano następujące nieprawidłowości w badaniach laboratoryjnych podczas leczenia lewodopą z karbidopą, które należy brać pod uwagę podczas leczenia pacjentów produktem leczniczym Produodopa: podwyższone stężenie azotu mocznikowego we krwi, zwiększona aktywność fosfatazy alkalicznej, zwiększenie aktywności AspAT, AlAT, LDH, zwiększone stężenie bilirubiny, glukozy we krwi, kreatyniny, kwasu moczowego, dodatni odczyn Coombsa oraz zmniejszenie stężenia hemoglobiny i wartości hematokrytu. Notowano obecność leukocytów, bakterii oraz krwi w moczu. Lewodopa z karbidopą, a zatem również produkt leczniczy Produodopa, mogą powodować fałszywie dodatni wynik, gdy stosowany jest test paskowy do wykrywania ciał ketonowych w moczu; reakcja ta nie ulega zmianie pod wpływem gotowania próbki moczu.
Zastosowanie testu na obecność glukozy w moczu z oksydazą glukozową może dać fałszywie ujemne
wyniki.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C PL-02 222 Warszawa
tel.: + 48 22 49 21 301
faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W przypadku przedawkowania produktu leczniczego Produodopa należy natychmiast przerwać infuzję. Postępowanie w przypadku ostrego przedawkowania podczas leczenia produktem leczniczym Produodopa jest ogólnie takie samo jak w przypadku ostrego przedawkowania lewodopy. Pirydoksyna nie jest jednak skuteczna w odwracaniu działania produktu leczniczego Produodopa. Należy zastosować monitorowanie EKG i dokładnie obserwować pacjenta w kierunku wystąpienia zaburzeń rytmu serca, a w razie konieczności zastosować odpowiednią terapię przeciwarytmiczną. Pacjentów należy również monitorować pod kątem niedociśnienia tętniczego. Należy uwzględnić możliwość przyjęcia przez pacjenta innych leków oprócz produktu leczniczego Produodopa.
Mechanizm działania
Produodopa (foslewodopa/foskarbidopa) 240 mg/12 mg na ml roztwór do infuzji jest prolekiem
składającym się z monofosforanu lewodopy i monofosforanu karbidopy (w stosunku 20:1)
w roztworze do podawania w ciągłej infuzji podskórnej przez 24 godziny na dobę u pacjentów
z zaawansowaną chorobą Parkinsona, którzy nie są odpowiednio kontrolowani za pomocą aktualnego leczenia. Foslewodopa i foskarbidopa są przekształcane w warunkach in vivo do lewodopy
i karbidopy. Lewodopa łagodzi objawy choroby Parkinsona po dekarboksylacji do dopaminy
w mózgu. Karbidopa, która nie przekracza bariery krew-mózg, hamuje pozamózgową dekarboksylację lewodopy do dopaminy, co oznacza, że większa ilość lewodopy jest dostępna do transportu do mózgu i przekształcenia w dopaminę.
Działanie farmakodynamiczne
Wykazano, że produkt leczniczy Produodopa podawany podskórnie i produkt leczniczy Duodopa podawany dojelitowo mają porównywalne wartości Cmax, AUC i stopień fluktuacji, co przemawia za porównywalnym profilem skuteczności. Uzyskując takie samo stężenie lewodopy jak przy stosowaniu produktu Duodopa, produkt leczniczy Produodopa zmniejsza fluktuacje ruchowe i wydłuża czas trwania fazy ON u pacjentów z zaawansowaną chorobą Parkinsona reagujących na lewodopę.
Fluktuacje ruchowe oraz hiperkinezy lub dyskinezy ulegają redukcji, ponieważ stężenie lewodopy w osoczu jest utrzymywane na stałym poziomie w ramach indywidualnego okna terapeutycznego. Efekt terapeutyczny na objawy ruchowe (stan ON) jest osiągany podczas pierwszego dnia leczenia.
Skuteczność kliniczna i bezpieczeństwo stosowania
Badania dotyczące produktu Duodopa w postaci żelu dojelitowego
Skuteczność produktu Duodopa żel dojelitowy potwierdzono w dwóch badaniach fazy III
o identycznym schemacie, trwających 12 tygodni, randomizowanych, wieloośrodkowych badaniach z zastosowaniem metody podwójnie ślepej próby i podwójnego maskowania, z równoległą grupą z aktywną kontrolą, oceniających skuteczność, bezpieczeństwo i tolerowanie produktu Duodopa żel dojelitowy w porównaniu do lewodopy z karbidopą w postaci tabletek 100 mg + 25 mg. Badania przeprowadzono u pacjentów z zaawansowaną chorobą Parkinsona, odpowiadających na lewodopę, u których utrzymywały się fluktuacje ruchowe mimo optymalnego leczenia doustnymi postaciami lewodopy z karbidopą oraz innymi dostępnymi lekami przeciwparkinsonowskimi. Wzięło w nich udział łącznie 71 pacjentów. Wyniki tych dwóch badań połączono i przeprowadzono ich pojedynczą analizę.
W zakresie pierwszorzędowego punktu końcowego skuteczności zmiany w znormalizowanym czasie trwania fazy OFF (od wartości wyjściowych do punktu końcowego), w oparciu o dane z „Dzienniczka choroby Parkinsona” z wykorzystaniem przenoszenia ostatniej dostępnej obserwacji (ang. last observation carried forward), wykazano metodą najmniejszych kwadratów (ang. least square, LS) statystycznie istotną średnią różnicę na korzyść grupy otrzymującej produkt Duodopa (Tabela 6).
Wyniki uzyskane dla pierwszorzędowego punktu końcowego potwierdzono za pomocą analizy stosującej model mieszany pomiarów powtarzanych (ang. Mixed Model Repeated Measures, MMRM), użyty do zbadania zmiany od wartości wyjściowych do każdej z kolejnych wizyt po włączeniu do badania. W 4. tygodniu analiza czasu trwania fazy OFF wykazała statystycznie istotnie większą poprawę w grupie otrzymującej produkt Duodopa w porównaniu do grupy z aktywną kontrolą. Wykazano, że poprawa ta była istotna statystycznie także w 8., 10. i 12. tygodniu.
Powyższa zmiana w czasie trwania fazy OFF wiązała się z wyznaczoną metodą LS istotną statystycznie średnią różnicą w porównaniu do wartości wyjściowych w zakresie znormalizowanego średniego dobowego czasu trwania fazy ON bez dolegliwych dyskinez pomiędzy grupą otrzymującą produkt Duodopa żel dojelitowy, a aktywną grupą kontrolną na podstawie danych
uzyskanych z „Dzienniczków choroby Parkinsona”. Wyjściowe dane zebrano trzy dni przed randomizacją i po 28 dniach standaryzacji terapii doustnej.
Tabela 6. Zmiana w czasie trwania fazy OFF i w czasie trwania fazy ON bez uciążliwych dyskinez od wartości wyjściowych do punktu końcowego
Leczona grupa | N | Średnia wartość wyjściowa (SD) (godziny) | Punkt końcowy (SD) (godziny) | Średnia zmiana wyznaczona metodą LS (SE) (godziny) | Średnia różnica wyznaczona metodą LS (SE) (godziny) | Wartość p |
Kryterium pierwszorzędowe: Czas trwania fazy OFF | ||||||
Aktywna kontrolaa | 31 | 6,90 (2,06) | 4,95 (2,04) | -2,14 (0,66) | ||
Duodopa żel dojelitowy | 35 | 6,32 (1,72) | 3,05 (2,52) | -4,04 (0,65) | -1,91 (0,57) | 0,0015 |
Kluczowe kryterium drugorzędowe: Czas trwania fazy ON bez uciążliwych dyskinez | ||||||
Aktywna kontrola | 31 | 8,04 (2,09) | 9,92 (2,62) | 2,24 (0,76) | ||
Duodopa żel dojelitowy | 35 | 8,70 (2,01) | 11,95 (2,67) | 4,11 (0,75) | 1,86 (0,65) | 0,0059 |
SD = odchylenie standardowe; SE = błąd standardowy a.Aktywna kontrola, lewodopa z karbidopą w postaci tabletek doustnych 100 mg + 25 mg [tabletki Sinemet umieszczone w kapsułkach (ang. over-encapsulated)] | ||||||
Analizy innych drugorzędowych punktów końcowych skuteczności, wykorzystujące hierarchiczną organizację procedury testowania, wykazały statystycznie istotne wyniki dla produktu Duodopa żel dojelitowy w porównaniu do lewodopy z karbidopą w postaci doustnej w następujących ocenach:
„Sumaryczny wskaźnik kwestionariusza choroby Parkinsona” (ang. Parkinson’s Disease Questionnaire (PDQ-39) Summary Index – ocena jakości życia w chorobie Parkinsona), „Ogólna ocena stanu klinicznego” (ang. Clinical Global Impression-Improvement, CGI-I) oraz „Ujednolicona skala choroby Parkinsona” (ang. Unified Parkinson’s Disease Rating Scale, UPDRS) część II
(ang. Activities of Daily Living, ADL – czynności życia codziennego). Sumaryczny wskaźnik PDQ-39 w 12. tygodniu zmniejszył się o 10,9 punktów w stosunku do wartości wyjściowej. Inne drugorzędowe punkty końcowe, ocena w skali UPDRS część III, sumaryczny wskaźnik EQ-5D (kwestionariusz oceny jakości życia, ang. EuroQol 5-dimension Questionnaire, EQ-5D) i całkowita ocena ZBI
(ang. Zarit Burden Interview – obciążenie opiekuna na podstawie wywiadu wg Zarita), nie spełniały kryterium istotności statystycznej na podstawie hierarchicznej organizacji procedury testowania.
Wieloośrodkowe badanie fazy III, otwarte, z pojedynczym ramieniem, przeprowadzono
u 354 pacjentów w celu oceny długookresowego bezpieczeństwa i tolerowania produktu Duodopa przez 12 miesięcy. Populację docelową stanowili pacjenci z zaawansowaną chorobą Parkinsona
i fluktuacjami ruchowymi pomimo optymalnej terapii dostępnymi lekami przeciw chorobie Parkinsona. Średni dobowy znormalizowany czas trwania fazy OFF uległ zmianie o -4,44 godziny od wartości wyjściowej do punktu końcowego (6,77 godzin w punkcie wyjściowym i 2,32 godziny w punkcie końcowym) z odpowiadającym mu wydłużeniem o 4,8 godziny czasu trwania fazy ON: bez uciążliwych dyskinez.
Przeprowadzono trwające 12 tygodni, randomizowane, wieloośrodkowe badanie fazy III
z zastosowaniem metody otwartej próby obejmujące 61 pacjentów, mające na celu ocenę wpływu produktu Duodopa żel dojelitowy na dyskinezy w porównaniu z optymalną terapią (ang. optimized medical treatment, OMT). Populacja docelowa obejmowała reagujących na lewodopę pacjentów
z zaawansowaną chorobą Parkinsona i fluktuacjami ruchowymi niewystarczająco kontrolowanymi OMT, z wyjściową łączną oceną w ujednoliconej skali oceny dyskinez UDysRS (ang. Unified Dyskinesia Rating Scale, UDysRS) wynoszącą ≥ 30. Dla zmiany łącznej oceny w skali UDysRS od wartości wyjściowej do 12. tygodnia (pierwszorzędowy punkt końcowy skuteczności) wykazano metodą najmniejszych kwadratów (LS) istotną statystycznie średnią różnicę (-15,05; p < 0,0001) na korzyść grupy leczonej produktem Duodopa w porównaniu z grupą OMT. Analiza drugorzędowych
kryteriów oceny skuteczności z zastosowaniem stałej sekwencji testowania wykazała istotne statystycznie wyniki na korzyść produktu Duodopa w porównaniu z OMT w zakresie czasu trwania stanów ON bez uciążliwych dyskinez, ocenianego wg Dzienniczka choroby Parkinsona, sumarycznego wskaźnika wg kwestionariusza choroby Parkinsona (ang. Parkinson’s Disease Questionnaire-8, PDQ-8), oceny w skali ogólnego wrażenia zmiany stanu klinicznego (ang. Clinical Global Impression Change, CGI-C), oceny w części II skali UPDRS oraz czasu trwania stanów OFF ocenianego wg Dzienniczka choroby Parkinsona. Różnica w zakresie oceny w części III UPDRS nie osiągnęła istotności statystycznej.
Badania dotyczące produktu leczniczego Produodopa
Produodopa jest prolekiem składającym się z monofosforanu lewodopy i monofosforanu karbidopy (w stosunku 20:1) w postaci roztworu przeznaczonego do podawania w ciągłej infuzji podskórnej przez 24 godziny na dobę. Wykazano, że produkt leczniczy Produodopa podawany podskórnie
i produkt Duodopa podawany dojelitowo mają porównywalne wartości Cmax i parametry AUC, co przemawia za porównywalnym profilem skuteczności. W badaniu wykazano stabilną ekspozycję na lewodopę z wartościami fluktuacji wynoszącymi 0,262 i 0,404, odpowiednio dla produktów leczniczych Produodopa i Duodopa.
Po podaniu produktu leczniczego Produodopa zdrowym ochotnikom stan stacjonarny lewodopy osiągany jest szybko, zwykle w ciągu 2 godzin i utrzymuje się przez cały okres infuzji. Na Rycinie 1 poniżej przedstawiono ekspozycję na lewodopę po 24-godzinnym podawaniu produktu leczniczego Produodopa.
Rycina 1. Średnia ekspozycja na lewodopę po 24-godzinnej infuzji produktu leczniczego
Produodopa
Średnie stężenie lewodopy w osoczu (ng/ml)
Czas (godz.)
Czas (godz.)
Produodopa
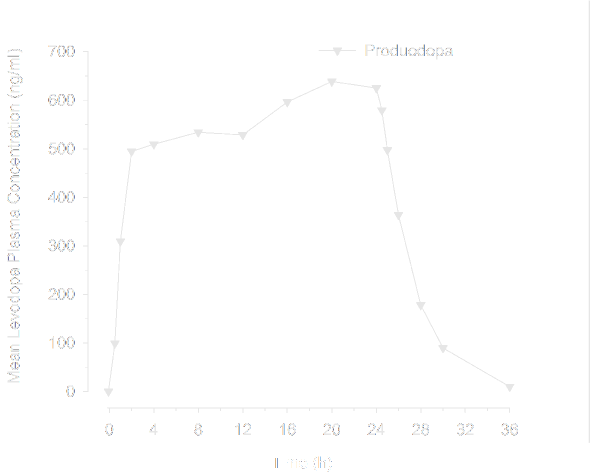
Średnie stężenie lewodopy w osoczu (ng/ml)
Produodopa
Wyniki dodatkowego badania porównawczego farmakokinetyki wykazały, że ekspozycja na lewodopę była porównywalna pomiędzy produktami leczniczymi Produodopa i Duodopa, gdy oba produkty były podawane w ciągu 24 godzin.
Badanie fazy III, otwarte, z pojedynczym ramieniem, przeprowadzono u 244 pacjentów w celu oceny bezpieczeństwa i tolerowania 24-godzinnej ekspozycji na ciągłą podskórną infuzję produktu leczniczego Produodopa przez 52 tygodnie. 12 pacjentów kontynuowało leczenie, a 125 pacjentów ukończyło 52-tygodniowe badanie. Populacja docelowa obejmowała reagujących na lewodopę pacjentów z chorobą Parkinsona, u których objawy ruchowe były niewystarczająco kontrolowane za pomocą dotychczasowego leczenia i u których faza OFF trwała co najmniej 2,5 godziny na dobę, co oceniano na podstawie Dzienniczków choroby Parkinsona. Zamiana dawki leków doustnych na produkt leczniczy Produodopa została dokonana podczas jednej wizyty ambulatoryjnej.
Podsumowanie profilu bezpieczeństwa stosowania produktu leczniczego Produodopa z tego badania przedstawiono w punkcie 4.8 (patrz punkt 4.8 Działania niepożądane). Drugorzędowe punkty końcowe skuteczności obejmowały średni dobowy znormalizowany czas trwania fazy OFF i fazy ON, co oceniano na podstawie Dzienniczków choroby Parkinsona. W 52. tygodniu dane z Dzienniczka były dostępne dla 104/244 (42,6%) pacjentów. Badanie jest w toku.
Dzieci i młodzież
Nie ustalono bezpieczeństwa produktu leczniczego Produodopa u pacjentów w wieku poniżej 18 lat. Nie zaleca się jego stosowania u pacjentów w wieku poniżej 18 lat.
Wchłanianie
Produkt leczniczy Produodopa jest podawany bezpośrednio do przestrzeni podskórnej i jest szybko wchłaniany oraz przekształcany w lewodopę i karbidopę. W badaniu fazy I u zdrowych ochotników, lewodopa i karbidopa były wykrywalne w osoczu w ciągu 30 minut w pierwszym punkcie gromadzenia danych farmakokinetycznych. U większości uczestników stan stacjonarny był osiągany w ciągu 2 godzin, gdy produkt leczniczy Produodopa był podawany w dawce nasycającej, a następnie w postaci ciągłego wlewu.
W celu określenia wchłaniania produktu leczniczego Produodopa w różnych miejscach podskórnych, zdrowym ochotnikom podawano produkt leczniczy Produodopa w brzuch, ramię i udo, stosując schemat trójstronny krzyżowy. Analiza farmakokinetyczna przeprowadzona w tym badaniu wykazała, że ekspozycja na lewodopę i karbidopę w tych 3 miejscach jest niemal identyczna, co wskazuje, że wchłanianie produktu leczniczego Produodopa jest podobne w różnych miejscach podskórnych.
Produkt leczniczy Produodopa omija jelita, więc pokarm nie zmienia wchłaniania ani ekspozycji
lewodopy i karbidopy. Dystrybucja
Objętość dystrybucji lewodopy jest umiarkowanie mała. Stosunek podziału dystrybucji lewodopy między erytrocytami a osoczem wynosi około 1. Stopień wiązania lewodopy z białkami w osoczu jest niewielki (< 10%). Lewodopa jest transportowana do mózgu przy użyciu mechanizmu transportu wielkocząsteczkowych aminokwasów obojętnych.
Karbidopa wiąże się z białkami osocza w około 36%. Karbidopa nie przechodzi przez barierę
krew-mózg.
Zarówno foslewodopa, jak i foskarbidopa w niewielkim stopniu wiążą się z białkami w osoczu
(24%–26%).
Metabolizm i eliminacja
Proleki foslewodopa i foskarbidopa są szybko przekształcane przez fosfatazy alkaliczne w lewodopę i karbidopę. Główną drogą eliminacji jest metabolizm z udziałem enzymów – dekarboksylazy aromatycznej aminokwasów (AAAD) i katecholo-O-metylotransferazy (COMT). Inne szlaki
metaboliczne to transaminacja i oksydacja. Dekarboksylacja lewodopy do dopaminy przez AAAD jest głównym szlakiem enzymatycznym, gdy nie podaje się w skojarzeniu inhibitora enzymu. W wyniku O-metylacji lewodopy przez COMT tworzy się 3-O-metylodopa. Gdy lewodopę podaje się
w skojarzeniu z karbidopą, okres półtrwania lewodopy w fazie eliminacji wynosi około 1,5 godziny.
Karbidopa jest metabolizowana do dwóch głównych metabolitów (kwasu α-metylo-3-metoksy-4-hydroksyfenylopropionowego i kwasu
α-metylo-3,4-dihydroksyfenylopropionowego). Te dwa metabolity są wydalane głównie w moczu
w postaci niezmienionej lub jako koniugaty glukuronidowe. Karbidopa w postaci niezmienionej stanowi 30% całkowitej ilości wydalanej z moczem. Okres półtrwania karbidopy w fazie eliminacji wynosi około 2 godziny.
Szczególne populacje
Produkt leczniczy Produodopa jest przeznaczony do stosowania u pacjentów z chorobą Parkinsona, którzy przyjmują już stałą dawkę lewodopy doustnie, a dawka produktu leczniczego Produodopa jest optymalizowana po rozpoczęciu leczenia.
Osoby w podeszłym wieku
Nie oceniano wpływu wieku na farmakokinetykę lewodopy po podaniu produktu leczniczego Produodopa. Badania dotyczące lewodopy wskazują na umiarkowane zmniejszenie klirensu lewodopy wraz z wiekiem.
Zaburzenia czynności nerek lub wątroby
Nie ustalono farmakokinetyki produktu leczniczego Produodopa u osób z zaburzeniami czynności nerek i (lub) wątroby.
Przewidywane dobowe obciążenie fosforem w przypadku największej proponowanej dawki klinicznej foslewodopy/foskarbidopy (6000/300 mg/dobę foslewodopy/foskarbidopy) wynosi około 700 mg, co jest wartością znacznie mniejszą niż górna granica referencyjnego spożycia pokarmu według amerykańskiej Narodowej Akademii Nauk, która wynosi 3000 mg/dobę. Nie ma jednak danych farmakokinetycznych ani danych dotyczących bezpieczeństwa stosowania produktu leczniczego Produodopa u pacjentów ze schyłkową niewydolnością nerek wymagających dializy. Dlatego należy zachować ostrożność u pacjentów ze schyłkową niewydolnością nerek, dializowanych, wymagających leczenia produktem leczniczym Produodopa ze względu na zmniejszoną zdolność nerek do eliminacji fosforanów.
Masa ciała
Nie oceniano wpływu masy ciała na farmakokinetykę lewodopy po podaniu produktu leczniczego Produodopa. We wcześniejszych badaniach nad lewodopą wykazano, że masa ciała zwiększa objętość dystrybucji i może zmniejszać ekspozycję na lewodopę.
Płeć lub rasa
Po podaniu produktu leczniczego Produodopa ekspozycja na karbidopę i lewodopę zarówno
u Japończyków, jak i Chińczyków Han była porównywalna z ekspozycją u osób rasy kaukaskiej.
Nie oceniano wpływu płci na farmakokinetykę lewodopy po podaniu produktu leczniczego Produodopa. Oceniano wpływ płci na farmakokinetykę lewodopy, a badania wskazują, że nie ma
istotnej klinicznie różnicy w narażeniu na lewodopę w zależności od płci. Po podaniu produktu leczniczego Produodopa ekspozycja na lewodopę po uwzględnieniu masy ciała była większa u kobiet o około 18% na podstawie AUC.
Dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności i potencjalnego działania rakotwórczego nie ujawniają żadnego szczególnego zagrożenia dla człowieka. W badaniach toksycznego wpływu na rozmnażanie, zarówno lewodopa, jak i połączenie lewodopy z karbidopą, powodowały u królików malformacje trzewi i kośćca.
Hydrazyna jest produktem rozpadu foskarbidopy. W badaniach na zwierzętach, hydrazyna wykazała znaczną toksyczność układową, zwłaszcza przy ekspozycji wziewnej. Wyniki tych badań wykazały, że hydrazyna jest hepatotoksyczna, ma działanie toksyczne na ośrodkowy układ nerwowy (nieopisywane jednak po podaniu doustnym), jest genotoksyczna, jak również karcynogenna (patrz także punkt 4.4).
Sodu wodorotlenek 10N (do ustalenia pH) Kwas solny stężony (do ustalenia pH) Woda do wstrzykiwań
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności.
Przed pierwszym otwarciem: 20 miesięcy. Po pierwszym otwarciu: użyć natychmiast.
Od przeniesienia produktu z fiolki do strzykawki: 24 godziny.
Przechowywać i przewozić w stanie schłodzonym (2°C – 8°C). Nie zamrażać. Przechowywać fiolki w opakowaniu zewnętrznym w celu ochrony przed pęknięciem.
Produkt może być przechowywany w temperaturze pokojowej maksymalnie do 30°C jednorazowo przez okres do 28 dni. Po przechowywaniu fiolki w temperaturze pokojowej nie należy jej ponownie umieszczać w lodówce. Należy zapisać datę pierwszego wyjęcia produktu leczniczego Produodopa z lodówki w wyznaczonym miejscu na opakowaniu zewnętrznym.
Warunki przechowywania produktu leczniczego po pierwszym otwarciu, patrz punkt 6.3.
Przed infuzją lek powinien mieć temperaturę pokojową. W przypadku przechowywania w lodówce przed użyciem fiolkę należy wyjąć z lodówki i pozostawić na 30 minut w temperaturze pokojowej,
w miejscu nienarażonym na bezpośrednie działanie światła słonecznego. Jeśli lek był schłodzony, nie
należy go ogrzewać (w fiolce lub strzykawce) w sposób inny niż pozostawienie w temperaturze pokojowej. Na przykład nie wolno go podgrzewać w kuchence mikrofalowej ani w gorącej wodzie.
Całkowita ilość 10 ml w fiolce z bezbarwnego, przezroczystego szkła typu I, zamykanej szarym korkiem z gumy bromobutylowej, aluminiowym wieczkiem i turkusowym plastikowym kapslem typu flip-off.
Opakowanie zewnętrzne (tekturowe pudełko) zawiera 7 fiolek.
Sterylne, jednorazowe elementy do infuzji (strzykawka, zestaw infuzyjny i adapter fiolki), które
zostały zakwalifikowane do użytku, są dostarczane oddzielnie.
Fiolki są przeznaczone wyłącznie do jednorazowego użytku. Całą zawartość fiolki należy przenieść do strzykawki w celu podania produktu. Nie należy rozcieńczać roztworu ani napełniać strzykawki żadnym innym roztworem. Wyrzucić fiolkę po przeniesieniu produktu leczniczego do strzykawki.
Nie używać ponownie wcześniej otwartej fiolki.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie
z lokalnymi przepisami.
Wyrzucić fiolkę, jeśli nie zostanie użyta w ciągu 28-dniowego przechowywania w temperaturze
pokojowej.
Wyrzucić strzykawkę i niezużyty produkt znajdujący się w strzykawce po 24 godzinach od podania produktu leczniczego. Nie należy stosować produktu z tej samej fiolki lub tej samej strzykawki dłużej niż 24 godziny.
Podsumowanie instrukcji użycia leku znajduje się w ulotce dołączonej do opakowania.
DOPUSZCZENIE DO OBROTU
AbbVie Sp. z o.o. ul. Postępu 21B 02-676 Warszawa
27625
I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











