Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
mL roztworu zawiera 10 mg paracetamolu i 3 mg ibuprofenu w postaci ibuprofenu sodowego dwuwodnego.
Każda fiolka o objętości 100 mL zawiera 1000 mg paracetamolu i 300 mg ibuprofenu w postaci ibuprofenu sodowego dwuwodnego.
Substancja pomocnicza o znanym działaniu Sód 35 mg na 100 mL (0,35 mg/mL).
Sód 1,52 mmola na 100 mL (0,0152 mmol/mL).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
u pacjentów ze stwierdzoną nadwrażliwością na paracetamol, ibuprofen, inne NLPZ lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1;
u pacjentów z ciężką niewydolnością serca (klasa IV wg skali NYHA [ang. New York Heart Association]);
u pacjentów z czynną chorobą alkoholową, ponieważ przewlekłe, nadmierne spożywanie alkoholu może predysponować do hepatotoksyczności (ze względu zawartość paracetamolu);
u pacjentów, u których wystąpiła astma, pokrzywka lub reakcje typu alergicznego po zastosowaniu kwasu acetylosalicylowego lub innego NLPZ;
u pacjentów z krwawieniem lub perforacją przewodu pokarmowego związaną z wcześniejszym leczeniem NLPZ w wywiadzie;
u pacjenta z czynną lub nawracającą chorobą wrzodową lub krwotokiem (dwa lub więcej istotnych epizodów potwierdzonego owrzodzenia lub krwawienia);
u pacjentów z ciężką niewydolnością wątroby lub ciężką niewydolnością nerek (patrz punkt 4.4);
u pacjentów z krwawieniem naczyniowo-mózgowym lub innym czynnym krwawieniem,
u pacjentów z zaburzeniami krzepnięcia krwi i w przypadku zwiększonej skłonności do krwawień;
u pacjentów z ciężkim odwodnieniem (spowodowanym wymiotami, biegunką lub niewystarczającym przyjmowaniem płynów);
w trzecim trymestrze ciąży (patrz punkt 4.6);
u pacjentów w wieku poniżej 18 lat.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
sprawdzić, czy inne produkty lecznicze nie zawierają paracetamolu lub NLPZ;
przestrzegać maksymalnych zalecanych dawek (patrz punkt 4.2).
Sercowo-naczyniowe zdarzenia zatorowo-zakrzepowe
Badania kliniczne wskazują, że stosowanie ibuprofenu, zwłaszcza w dużej dawce (2400 mg/dobę), może być związane z niewielkim zwiększeniem ryzyka wystąpienia tętniczych incydentów zatorowo- zakrzepowych (na przykład zawału mięśnia sercowego lub udaru mózgu). W ujęciu ogólnym, badania epidemiologiczne nie wskazują, że przyjmowanie ibuprofenu w małych dawkach (np. 1200 mg/dobę) jest związane ze zwiększeniem ryzyka wystąpienia tętniczych incydentów zatorowo-zakrzepowych. W przypadku pacjentów z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca (klasa II-III wg skali NYHA), rozpoznaną chorobą niedokrwienną serca, chorobą naczyń obwodowych i (lub) chorobą naczyń mózgowych, leczenie ibuprofenem należy stosować po starannym rozważeniu stosunku potencjalnego ryzyka do korzyści, przy czym należy unikać stosowania dużych dawek (2400 mg/dobę).
Należy również starannie rozważyć rozpoczęcie długotrwałego leczenia pacjentów, u których występują czynniki ryzyka incydentów sercowo-naczyniowych (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu), zwłaszcza jeśli wymagane są duże dawki ibuprofenu (2400 mg/dobę).
Niewydolność wątroby
Stosowanie paracetamolu w dawkach większych niż zalecane może prowadzić do hepatotoksyczności, a nawet niewydolności wątroby i zgonu. U pacjentów z niewydolnością wątroby lub z chorobą wątroby w wywiadzie, a także u pacjentów długotrwale leczonych ibuprofenem lub paracetamolem należy wykonywać w regularnych odstępach czasu badania kontrolne czynności wątroby, ponieważ zgłaszano możliwość niewielkiego i przemijającego wpływu ibuprofenu na enzymy wątrobowe.
Zaleca się zmniejszenie dawki u pacjentów z objawami pogorszenia czynności wątroby. Leczenie należy przerwać, jeżeli u pacjenta wystąpi ciężka niewydolność wątroby (patrz punkt 4.3).
Po stosowaniu ibuprofenu, podobnie jak innych NLPZ, rzadko obserwowano ciężkie reakcje dotyczące wątroby, w tym przypadki żółtaczki i zapalenia wątroby prowadzącego do zgonu. W razie utrzymywania się lub pogorszenia nieprawidłowych wyników badań czynności wątrobowy lub wystąpienia objawów przedmiotowych i podmiotowych wskazujących na chorobę wątroby, lub pojawienia się objawów ogólnoustrojowych (np. eozynofilii, wysypki skórnej itp.), należy przerwać stosowanie ibuprofenu. W przypadku obu tych substancji czynnych, a zwłaszcza paracetamolu, zgłaszano działanie hepatotoksyczne i występowanie niewydolności wątroby.
Niewydolność nerek
Paracetamol może być stosowany u pacjentów z przewlekłą chorobą nerek bez konieczności modyfikacji dawkowania. U pacjentów z umiarkowaną lub ciężką niewydolnością nerek ryzyko wystąpienia toksyczności paracetamolu jest niewielkie. Jednak z powodu zawartości ibuprofenu
w produkcie leczniczym Paracetamol + Ibuprofen Mercapharm, należy zachować ostrożność podczas rozpoczynania leczenia pacjentów odwodnionych. Dwa główne metabolity ibuprofenu są wydalane przede wszystkim z moczem i pogorszenie czynności nerek może spowodować ich kumulację. Nie wiadomo, jak istotne jest znaczenie tego zjawiska. Zgłaszano, że NLPZ charakteryzują się nefrotoksycznością występującą w różnych formach, wywołując m.in. śródmiąższowe zapalenie nerek, zespół nerczycowy i niewydolność nerek. Pogorszenie czynności nerek w wyniku stosowania ibuprofenu jest zazwyczaj odwracalne. Należy zachować ostrożność u pacjentów z niewydolnością nerek, serca lub wątroby, stosujących leki moczopędne i inhibitory konwertazy angiotensyny oraz
u osób w podeszłym wieku, ponieważ stosowanie niesteroidowych leków przeciwzapalnych może spowodować pogorszenie wydolności nerek. U tych pacjentów należy stosować możliwie jak najmniejszą dawkę skuteczną i monitorować czynność nerek. W przypadku wystąpienia ciężkiej niewydolności nerek, leczenie należy przerwać (patrz punkt 4.3).
Jednoczesne stosowanie inhibitorów konwertazy angiotensyny lub antagonistów receptora angiotensyny, leków przeciwzapalnych i tiazydowych leków moczopędnych
Jednoczesne stosowanie leku hamującego konwertazę angiotensyny (inhibitora konwertazy lub antagonisty receptora angiotensyny), leku przeciwzapalnego (NLPZ lub inhibitora COX-2)
i tiazydowego leku moczopędnego zwiększa ryzyko wystąpienia niewydolności nerek. Dotyczy to również stosowania produktów złożonych zawierających leki z różnych grup terapeutycznych.
Podczas jednoczesnego stosowania tych leków, należy częściej kontrolować stężenie kreatyniny w surowicy krwi, zwłaszcza w początkowym okresie jednoczesnego stosowania tego skojarzenia. Należy zachować ostrożność podczas jednoczesnego stosowania leków z tych trzech grup terapeutycznych, zwłaszcza u osób w podeszłym wieku lub pacjentów z niewydolnością nerek.
Osoby w podeszłym wieku
Należy stosować możliwie najmniejszą dawkę przez możliwie najkrótszy czas, niezbędną do opanowania objawów. Należy zachować ostrożność podczas stosowania ibuprofenu, ponieważ ze względu na zwiększone ryzyko wystąpienia działań niepożądanych nie należy go stosować u osób w wieku powyżej 65 lat bez uwzględnienia występujących chorób współistniejących i stosowanych
jednocześnie leków, a szczególnie stwierdzonej niewydolności serca, choroby wrzodowej i niewydolności nerek.
Działania hematologiczne
Rzadko zgłaszano przypadki zaburzeń składu krwi (dyskrazji). U pacjentów długotrwale leczonych ibuprofenem należy regularnie wykonywać badania kontrolne krwi.
Reakcje rzekomoanafilaktyczne
Jako standardowe postępowanie podczas infuzji dożylnej, zaleca się ścisłe monitorowanie pacjenta, zwłaszcza na początku infuzji, w celu wykrycia jakiejkolwiek reakcji anafilaktycznej wywołanej przez substancję czynną lub substancje pomocnicze.
Bardzo rzadko obserwuje się ciężkie, ostre reakcje nadwrażliwości (np. wstrząs anafilaktyczny). W przypadku wystąpienia pierwszych objawów nadwrażliwości po podaniu produktu leczniczego Paracetamol + Ibuprofen Mercapharm, należy przerwać infuzję i rozpocząć leczenie objawowe.
W zależności od występujących objawów, wyspecjalizowany personel powinien wdrożyć odpowiednie procedury medyczne.
Zaburzenia krzepnięcia krwi
Podobnie jak inne NLPZ, ibuprofen może hamować agregację płytek krwi. U zdrowych osób wydłuża on czas krwawienia (jednak w zakresie normy). Wydłużenie czasu krwawienia może być większe
u pacjentów z istniejącymi zaburzeniami hemostazy, tak więc produkty zawierające ibuprofen należy stosować ostrożnie u pacjentów z istniejącymi zaburzeniami krzepnięcia i leczonych przeciwzakrzepowo. Należy monitorować pacjentów z zaburzeniami krzepnięcia krwi lub poddawanych zabiegowi chirurgicznemu. Należy zachować szczególną ostrożność podczas stosowania u pacjentów bezpośrednio po dużych zabiegach chirurgicznych.
Zaburzenia żołądkowo-jelitowe
Zgłaszano krwawienie z przewodu pokarmowego, owrzodzenie lub perforację, które mogą zakończyć się zgonem po wszystkich NLPZ w dowolnym momencie leczenia, u pacjentów z objawami ostrzegawczymi lub bez tych objawów lub u pacjentów z poważnymi zdarzeniami dotyczącymi przewodu pokarmowego w wywiadzie.
Ryzyko krwawienia, owrzodzenia lub perforacji przewodu pokarmowego zwiększa się wraz ze zwiększaniem dawek NLPZ u pacjentów z owrzodzeniem w wywiadzie, szczególnie powikłanym krwotokiem lub perforacją (patrz punkt 4.3) oraz u osób w podeszłym wieku. U tych pacjentów leczenie należy rozpocząć od najmniejszej dostępnej dawki.
U pacjentów, a także u pacjentów wymagających jednoczesnego podawania małych dawek kwasu acetylosalicylowego lub innych produktów leczniczych, które mogą zwiększać ryzyko działań niepożądanych ze strony przewodu pokarmowego (patrz poniżej oraz punkt 4.5), należy rozważyć jednoczesne leczenie produktami leczniczymi o działaniu osłaniającym (np. mizoprostolem lub inhibitorami pompy protonowej). Pacjentów z działaniami toksycznymi ze strony przewodu pokarmowego w wywiadzie, zwłaszcza w podeszłym wieku, należy poinformować, aby zgłaszali wszelkie nietypowe objawy w obrębie jamy brzusznej (zwłaszcza krwawienie z przewodu pokarmowego), szczególnie w początkowej fazie leczenia.
Należy zachować ostrożność u pacjentów stosujących jednocześnie leki, które mogą zwiększać ryzyko owrzodzenia lub krwawienia, takie jak doustne kortykosteroidy, leki przeciwzakrzepowe, jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub leki przeciwpłytkowe, takie jak kwas acetylosalicylowy (patrz punkt 4.5).
Ze względu na zawartość ibuprofenu, produkt leczniczy Paracetamol + Ibuprofen Mercapharm należy stosować ostrożnie u pacjentów z chorobą przewodu pokarmowego w wywiadzie (wrzodziejące zapalenie jelita grubego, choroba Leśniowskiego-Crohna) oraz u pacjentów z porfirią.
U osób w podeszłym wieku zwiększa się częstość występowania działań niepożądanych po podaniu NLPZ, zwłaszcza krwawienia z przewodu pokarmowego i perforacji, które mogą zakończyć się zgonem (patrz punkt 4.2).
Stosowanie tego produktu leczniczego należy przerwać, jeśli wystąpią jakiekolwiek objawy krwawienia z przewodu pokarmowego lub owrzodzenia.
Nadciśnienie tętnicze
Stosowanie NLPZ może prowadzić do wystąpienia nadciśnienia tętniczego lub pogorszenia istniejącego nadciśnienia tętniczego. Pacjenci stosujący jednocześnie leki przeciwnadciśnieniowe
i NLPZ mogą gorzej reagować na leczenie nadciśnienia. Należy zachować ostrożność w przypadku przepisywania NLPZ pacjentom z nadciśnieniem tętniczym. Ciśnienie krwi należy monitorować szczególnie dokładnie w trakcie rozpoczynania leczenia NLPZ, a następnie należy je regularnie monitorować.
Niewydolność serca
U niektórych pacjentów stosujących NLPZ obserwowano zatrzymywanie płynów i obrzęki; w związku z tym należy zachować ostrożność u pacjentów z zatrzymaniem płynów lub niewydolnością serca.
Ciężkie reakcje skórne
Niesteroidowe leki przeciwzapalne mogą bardzo rzadko powodować ciężkie zdarzenia niepożądane dotyczące skóry, takie jak złuszczające zapalenie skóry, martwica toksyczno-rozpływna naskórka (ang, toxic epidermal necrolysis, TEN) i zespół Stevensa-Johnsona, które mogą wystąpić bez objawów ostrzegawczych i mogą prowadzić do zgonu. Podczas stosowania produktów zawierających ibuprofen może wystąpić ostra uogólniona osutka krostkowa (ang. acute generalized exanthematous pustulosis, AGEP). Wydaje się, że największe ryzyko wystąpienia tych reakcji jest na początku leczenia, w większości przypadków reakcje niepożądane występują w ciągu pierwszego miesiąca leczenia.
Należy poinformować pacjentów o objawach podmiotowych i przedmiotowych związanych
z ciężkimi reakcjami skórnymi i o konieczności konsultacji z lekarzem w przypadku wystąpienia po raz pierwszy wysypki skórnej lub jakichkolwiek innych objawów nadwrażliwości.
Wyjątkowo, ospa wietrzna może powodować ciężkie powikłania infekcyjne skóry i tkanek miękkich. Obecnie nie można wykluczyć udziału NLPZ w nasileniu tych zakażeń. Dlatego należy unikać stosowania produktu leczniczego Paracetamol + Ibuprofen Mercapharm w przypadku ospy wietrznej.
Wcześniej rozpoznana astma oskrzelowa
Nie należy stosować produktów zawierających ibuprofen u pacjentów z astmą indukowaną kwasem acetylosalicylowym oraz należy zachować ostrożność w przypadku stosowania u pacjentów
z wcześniej rozpoznaną astmą oskrzelową.
Wpływ na oczy
Obserwowano występowania działań niepożądanych dotyczących oka podczas stosowania NLPZ; w związku z tym w przypadku wystąpienia zaburzenia widzenia podczas stosowania produktów leczniczych zawierającymi ibuprofen, należy wykonać badania okulistyczne.
Aseptyczne zapalenie opon mózgowo-rdzeniowych
Rzadko opisywano aseptyczne zapalenie opon mózgowo-rdzeniowych podczas stosowania produktów zawierających ibuprofen, zazwyczaj, ale nie zawsze, u pacjentów z toczniem rumieniowatym układowym lub z innymi chorobami tkanki łącznej.
Potencjalny wpływ na badania laboratoryjne
W przypadku obecnie stosowanych systemów analitycznych, paracetamol nie wpływa na wyniki badań laboratoryjnych. Istnieją jednak niektóre niżej opisane metody, na które lek może mieć wpływ.
Badania moczu
Paracetamol w dawkach terapeutycznych może wpływać na oznaczenia kwasu
5-hydroksyindolooctowego (5HIAA), powodując fałszywie dodatnie wyniki. Fałszywym wynikom można zapobiec nie stosując paracetamolu przez kilka godzin przed rozpoczęciem i w trakcie prowadzenia zbiórki moczu.
Maskowanie objawów współistniejących zakażeń
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm może maskować objawy zakażenia, co może opóźnić rozpoczęcia odpowiedniego leczenia i pogorszyć przebieg zakażenia. Zaobserwowano to
w przypadku pozaszpitalnych bakteryjnych zapaleń płuc i powikłań bakteryjnych ospy wietrznej. W przypadku podawania produktu leczniczego Paracetamol + Ibuprofen Mercapharm w celu złagodzenia bólu podczas zakażenia, należy monitorować jego przebieg. W warunkach pozaszpitalnych, należy zalecić skonsultowanie się z lekarzem w przypadku utrzymywania lub nasilenia się objawów.
Długotrwałe stosowanie leków przeciwbólowych
Podczas długotrwałego stosowania leków przeciwbólowych, mogą wystąpić bóle głowy, których nie należy leczyć zwiększeniem dawki tego produktu leczniczego.
Flukloksacylina
Należy zachować ostrożność podczas jednoczesnego stosowania paracetamolu i flukloksacyliny, ze względu na zwiększone ryzyko rozwoju kwasicy metabolicznej z dużą luką anionową (HAGMA, ang. high anion gap metabolic acidosis), szczególnie u pacjentów z ciężkimi zaburzeniami czynności nerek, posocznicą, niedożywieniem i innymi przyczynami niedoboru glutationu (np. przewlekły alkoholizm), a także u pacjentów stosujących maksymalne dawki dobowe paracetamolu. Zaleca się ścisłą obserwację pacjenta, w tym wykonywanie badań wykrywających 5-oksoprolinę w moczu.
Szczególne środki ostrożności
Istnieją pewne dane wskazujące, że produkty lecznicze hamujące cyklooksygenazę/syntezę prostaglandyn mogą powodować zmniejszenie płodności u kobiet poprzez wpływ na owulacje. Działanie to jest odwracalne po zakończeniu stosowania produktu leczniczego.
U pacjentów z wrodzonymi zaburzeniami metabolizmu porfiryny (np. ostra porfiria przerywana), ibuprofen należy stosować wyłącznie po dokładnej ocenie stosunku korzyści do ryzyka.
Spożywanie alkoholu podczas jednoczesnego stosowania NLPZ może nasilać działania niepożądane związane z substancją czynną, szczególnie dotyczące przewodu pokarmowego lub ośrodkowego układu nerwowego.
Należy zachować ostrożność u pacjentów z pewnymi stanami, które mogą ulec pogorszeniu:
U pacjentów z alergią na inne substancje, ponieważ ryzyko reakcji nadwrażliwości podczas stosowania produktu leczniczego Paracetamol + Ibuprofen Mercapharm jest u nich większe.
U pacjentów z katarem siennym, polipami nosa lub przewlekłą obturacyjną chorobą płuc, ponieważ ryzyko reakcji alergicznej jest u nich większe. Mogą to być ataki astmy (tzw. astma analgetyczna), obrzęk Quinckego lub pokrzywka.
Ten produkt leczniczy zawiera 35,06 mg sodu na 100 mL roztworu (jedna fiolka), co odpowiada 1,75% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Grupa dikumarolu: NLPZ mogą nasilać działanie leków przeciwzakrzepowych, takich jak warfaryna. W badaniach eksperymentalnych wykazano, że ibuprofen zwiększa wpływ warfaryny na czas krwawienia. NLPZ i grupa dikumarolu są metabolizowane przez ten sam enzym CYP2C9.
Leki przeciwpłytkowe: NLPZ nie należy stosować w skojarzeniu z lekami przeciwpłytkowymi, takimi jak tyklopidyna, ze względu na addytywne hamowanie czynności płytek (patrz poniżej).
Metotreksat: NLPZ hamują wydzielanie kanalikowe metotreksatu i w rezultacie mogą wystąpić pewne interakcje metaboliczne związane ze zmniejszonym klirensem metotreksatu. Ryzyko potencjalnej interakcji NLPZ z metotreksatem należy również wziąć pod uwagę podczas leczenia małymi dawkami metotreksatu, zwłaszcza u pacjentów z zaburzeniami czynności nerek. W każdym przypadku leczenia skojarzonego należy monitorować czynność nerek. Należy zachować ostrożność, jeśli zarówno NLPZ, jak i metotreksat są podawane
w ciągu 24 godzin, ponieważ stężenie metotreksatu w osoczu może być zwiększone, powodując jego zwiększoną toksyczność. Odpowiednio, w przypadku leczenia dużymi dawkami metotreksatu należy zawsze unikać przepisywania NLPZ.
Kwas acetylosalicylowy: nie zaleca się jednoczesnego podawania ibuprofenu i kwasu acetylosalicylowego ze względu na możliwość nasilenia działań niepożądanych. Dane eksperymentalne sugerują, że w przypadku jednoczesnego stosowania ibuprofen może kompetycyjnie hamować wpływ małych dawek kwasu acetylosalicylowego na agregację płytek krwi. Chociaż nie ma pewności czy dane te można ekstrapolować na sytuację kliniczną, nie można wykluczyć, że regularne, długotrwałe stosowanie ibuprofenu może zmniejszyć kardioprotekcyjne działanie małych dawek kwasu acetylosalicylowego. Nie uważa się za prawdopodobne, aby sporadycznie stosowany ibuprofen miał istotne klinicznie działanie (patrz punkt 5.1).
Lit: ibuprofen zmniejsza klirens nerkowy litu, co może spowodować zwiększenie stężenia litu w surowicy. Należy unikać tego skojarzenia, chyba że można często sprawdzać stężenie litu w surowicy i można będzie zmniejszyć dawki litu.
Glikozydy nasercowe: NLPZ mogą nasilać niewydolność serca, zmniejszać filtrację kłębuszkową i zwiększać stężenie glikozydów nasercowych (np. digoksyny) w osoczu.
Mifepryston: może teoretycznie wystąpić zmniejszenie jego skuteczności z powodu właściwości przeciwprostaglandynowych niesteroidowych leków przeciwzapalnych (NLPZ), w tym kwasu acetylosalicylowego. Ograniczone dowody sugerują, że jednoczesne stosowanie NLPZ w dniu podania prostaglandyny nie wpływa niekorzystnie na działanie mifeprystonu lub prostaglandyny na dojrzewanie szyjki macicy lub kurczliwość macicy i nie zmniejsza skuteczności klinicznej farmakologicznego przerywania ciąży.
Inhibitory ACE i antagoniści angiotensyny II: w przypadku jednoczesnego stosowania inhibitorów ACE lub antagonistów angiotensyny II z NLPZ, w tym z selektywnymi
inhibitorami cyklooksygenazy-2, zwiększa się ryzyko ostrej niewydolności nerek, zwykle odwracalnej, u pacjentów z zaburzeniami czynności nerek (np. odwodnionych i (lub) pacjentów w podeszłym wieku). Dlatego skojarzenie to należy stosować ostrożnie u pacjentów z zaburzeniami czynności nerek, zwłaszcza u pacjentów w podeszłym wieku. Należy odpowiednio nawodniać pacjentów i rozważyć kontrolę czynności nerek po rozpoczęciu leczenia skojarzonego oraz w regularnych odstępach czasu w trakcie leczenia (patrz punkt 4.4).
Leki beta-adrenolityczne: NLPZ zmniejszają działanie hipotensyjne leków blokujących receptory beta-adrenergiczne.
Pochodne sulfonylomocznika: istnieją rzadkie doniesienia dotyczące wystąpienia hipoglikemii u pacjentów stosujących pochodne sulfonylomocznika, którzy otrzymywali ibuprofen.
Zydowudyna: istnieją dowody na zwiększone ryzyko krwawień do stawów i krwiaka
u chorych na hemofilię zakażonych wirusem HIV, którzy otrzymują jednocześnie zydowudynę i ibuprofen.
Antybiotyki chinolonowe: dane z badań na zwierzętach wskazują, że NLPZ mogą zwiększać ryzyko drgawek związanych z antybiotykami chinolonowymi. U pacjentów, którzy przyjmują NLPZ i chinolony ryzyko drgawek może być zwiększone.
Tiazydy, pochodne tiazydów i diuretyki pętlowe: NLPZ mogą zmniejszać działanie diuretyczne furosemidu i bumetanidu, prawdopodobnie poprzez hamowanie syntezy prostaglandyn. Mogą również zmniejszać działanie hipotensyjne tiazydów.
Leki moczopędne oszczędzające potas: jednoczesne stosowanie może powodować wystąpienie hiperkaliemii.
Aminoglikozydy: NLPZ mogą zmniejszać wydalanie aminoglikozydów.
Selektywne inhibitory wychwytu zwrotnego serotoniny (ang. Selective Serotonin Re-uptake Inhibitors, SSRI): jednoczesne stosowanie SSRI i NLPZ wiąże się ze zwiększonym ryzykiem krwawienia, np. z przewodu pokarmowego. Ryzyko to jest zwiększone w trakcie jednoczesnego stosowania. Mechanizm tej interakcji jest prawdopodobnie związany ze zmniejszonym wychwytem serotoniny w płytkach krwi (patrz punkt 4.4).
Cyklosporyna: uważa się, że równoczesne podawanie NLPZ i cyklosporyny może zwiększać ryzyko nefrotoksyczności z powodu zmniejszonej syntezy prostacykliny w nerkach.
W związku z tym w trakcie leczenia skojarzonego należy ściśle monitorować czynność nerek.
Kaptopryl: badania eksperymentalne wskazują, że ibuprofen zmniejsza wpływ kaptoprylu na wydalanie sodu.
Takrolimus: uważa się, że jednoczesne podawanie NLPZ i takrolimusu może zwiększać ryzyko nefrotoksyczności z powodu zmniejszonej syntezy prostacykliny w nerkach.
W związku z tym podczas leczenia skojarzonego należy ściśle monitorować czynność nerek.
Kortykosteroidy: jednoczesne leczenie zwiększa ryzyko owrzodzenia lub krwawienia z przewodu pokarmowego.
Inhibitory CYP2C9: jednoczesne podawanie ibuprofenu z inhibitorami CYP2C9 może zwiększać ekspozycję na ibuprofen (substrat CYP2C9). W badaniu z worykonazolem
i flukonazolem (inhibitorami CYP2C9) wykazano zwiększoną ekspozycję na S(+)-ibuprofen średnio od 80 do 100%. Należy rozważyć zmniejszenie dawki ibuprofenu podczas jednoczesnego stosowania z silnymi inhibitorami CYP2C9, szczególnie w przypadku podawania dużych dawek ibuprofenu z worykonazolem lub flukonazolem.
Fenytoina: podczas jednoczesnego leczenia ibuprofenem może zwiększyć się stężenie fenytoiny w osoczu i w związku z tym może zwiększyć się ryzyko toksyczności.
Probenecyd i sulfinpirazon: produkty lecznicze, które zawierają probenecyd lub sulfinpirazon mogą opóźniać wydalanie ibuprofenu.
Wyciągi roślinne: Ginkgo biloba może nasilać ryzyko krwawienia po podaniu NLPZ.
Paracetamol:
Probenecyd hamuje wiązanie paracetamolu z kwasem glukuronowym, co prowadzi do około dwukrotnego zmniejszenia klirensu paracetamolu. U pacjentów przyjmujących jednocześnie probenecyd, należy zmniejszyć dawkę paracetamolu.
Produkty lecznicze indukujące enzymy, takie jak niektóre leki przeciwpadaczkowe (fenytoina, fenobarbital, karbamazepina) w badaniach farmakokinetycznych zmniejszały AUC paracetamolu w osoczu do około 60%. Inne substancje o właściwościach indukowania enzymów (np. ryfampicyna, ziele dziurawca) również mogą powodować zmniejszenie stężenia paracetamolu. Ponadto, ryzyko uszkodzenia wątroby podczas leczenia maksymalną zalecaną dawką paracetamolu jest prawdopodobnie większe u pacjentów otrzymujących leki indukujące enzymy.
Zydowudyna może wpływać na metabolizm paracetamolu i odwrotnie, co może zwiększać toksyczność obu substancji.
Leki przeciwzakrzepowe (warfaryna) – może być konieczne zmniejszenie dawkowania, jeśli paracetamol i leki przeciwkrzepliwe są stosowane przez dłuższy czas.
Zgłaszano przypadki ciężkiej hepatotoksyczności po zastosowaniu paracetamolu w dawkach terapeutycznych lub umiarkowanym przedawkowaniu u pacjentów leczonych izoniazydem w monoterapii, lub łącznie z innymi lekami przeciwgruźliczymi.
Paracetamol może wpływać na farmakokinetykę chloramfenikolu. Zaleca się monitorowanie stężenia chloramfenikolu w osoczu, w przypadku jednoczesnego stosowania paracetamolu
z chloramfenikolem we wstrzyknięciach.
Alkohol etylowy nasila toksyczność paracetamolu, prawdopodobnie przez indukowanie wytwarzania w wątrobie hepatotoksycznych metabolitów paracetamolu.
Należy zachować ostrożność podczas jednoczesnego stosowania paracetamolu
Wpływ na płodność, ciążę i laktację
toksyczność sercowo-płucną (przedwczesne zwężenie lub zamknięcie przewodu tętniczego i nadciśnienie płucne);
zaburzenie czynności nerek (patrz powyżej);
matkę pod koniec ciąży i płód na:
możliwe wydłużenie czasu krwawienia, działanie antyagregacyjne, które może wystąpić nawet po podaniu bardzo małych dawek;
hamowanie skurczów macicy skutkujące opóźnieniem lub przedłużeniem porodu.
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata.
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Paracetamol + Ibuprofen Mercapharm, (10 mg+3 mg)/mL, roztwór do infuzji
Roztwór do infuzji
Klarowny, bezbarwny roztwór, wolny od widocznych cząstek stałych, o pH 6,3 - 7,3 i osmolalności 285 - 320 mOsmol/kg.
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm jest wskazany u dorosłych w krótkotrwałym, objawowym leczeniu ostrego bólu o umiarkowanym nasileniu, gdy podanie drogą dożylną jest klinicznie uzasadnione i (lub) gdy podanie innymi drogami nie jest możliwe.
Dawkowanie
Do podawania dożylnego i krótkotrwałego stosowania maksymalnie nie dłużej niż przez 2 doby. Działania niepożądane można zminimalizować stosując najmniejszą skuteczną dawkę przez jak najkrótszy czas niezbędny do opanowania objawów (patrz punkt 4.4).
Dorośli (o masie ciała > 50 kg)
W razie potrzeby, należy podawać jedną fiolkę (100 ml) produktu leczniczego Paracetamol + Ibuprofen Mercapharm co 6 godzin w infuzji trwającej 15 minut. Nie należy przekraczać całkowitej dawki dobowej czterech fiolek (400 mL), co odpowiada 4000 mg (4 g) paracetamolu i 1200 mg ibuprofenu.
Dorośli (o masie ciała ≤ 50 kg)
W razie potrzeby, dorosłym o masie ciała 50 kg lub mniejszej, należy podawać dawkę zależną od masy ciała, która wynosi 1,5 mL/kg mc. (15 mg/kg mc. paracetamolu + 4,5 mg/kg mc. ibuprofenu) i jest podawana co 6 godzin w infuzji trwającej 15 minut. Odpowiada to maksymalnej pojedynczej
dawce 75 mL roztworu (niewykorzystane resztki roztworu należy usunąć) i całkowitej dawce dobowej 3000 mg (3 g) paracetamolu i 900 mg ibuprofenu.
Dzieci i młodzież
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm jest przeciwwskazany u pacjentów w wieku poniżej 18 lat (patrz punkt 4.3).
Szczególne grupy pacjentów
Osoby w podeszłym wieku
Należy zachować ostrożność ustalając dawkę u osób w podeszłym wieku, zwykle rozpoczynając od dolnej granicy zakresu dawkowania, ponieważ w tej grupie pacjentów częściej występują zaburzenia czynności wątroby, nerek lub serca, choroby współistniejące lub jednocześnie stosowane są inne produkty lecznicze.
U osób w podeszłym wieku występuje zwiększone ryzyko poważnych konsekwencji działań niepożądanych. Jeżeli podanie niesteroidowych leków przeciwzapalnych (NLPZ) zostanie uznane za konieczne, należy stosować najmniejszą skuteczną dawkę przez możliwie najkrótszy czas. Leczenie należy kontrolować w regularnych odstępach czasu i należy je przerwać w przypadku braku korzyści lub wystąpienia nietolerancji. Podczas leczenia NLPZ, należy regularnie monitorować czy u pacjenta nie występuje krwawienie z przewodu pokarmowego.
Zaburzenia czynności nerek
Należy zachować ostrożność podczas ustalania dawki ibuprofenu u pacjentów z zaburzeniami czynności nerek. Produkt leczniczy Paracetamol + Ibuprofen Mercapharm jest przeciwwskazany u pacjentów z ciężką niewydolnością nerek (patrz punkt 4.3).
Dawkowanie należy ustalić indywidualnie. U pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności nerek, dawkę początkową należy zmniejszyć. Należy stosować możliwie najmniejszą dawkę, przez możliwie najkrótszy czas niezbędny do opanowania objawów. Należy monitorować czynność nerek (patrz punkty 4.3 i 4.4).
Zaburzenia czynności wątroby
Stosowanie paracetamolu w dawkach większych niż zalecane może prowadzić do hepatotoksyczności, a nawet niewydolności wątroby i zgonu. U pacjentów z dodatkowymi czynnikami ryzyka hepatotoksyczności, takimi jak zaburzenia czynności komórek wątroby, przewlekły alkoholizm, przewlekłe niedożywienie (małe rezerwy glutationu w wątrobie) lub odwodnienie, nie należy przekraczać całkowitej dawki dobowej 3000 mg (3 g) paracetamolu.
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm jest przeciwwskazany u pacjentów z ciężką niewydolnością wątroby (patrz punkt 4.3). W przypadku wystąpienia objawów podmiotowych i (lub) przedmiotowych wskazujących na zaburzenia czynności wątroby lub stwierdzenia nieprawidłowych wyników badań wątrobowych u pacjentów leczonych ibuprofenem, należy przeprowadzić diagnostykę w celu wykrycia cięższej reakcji ze strony wątroby i jednocześnie przerwać leczenie produktem leczniczym Paracetamol + Ibuprofen Mercapharm. Jeśli wystąpią objawy kliniczne wskazujące na uszkodzenie wątroby lub jeśli wystąpią objawy ogólnoustrojowe (np. eozynofilia, wysypka itp.), leczenie produktem leczniczym Paracetamol + Ibuprofen Mercapharm należy przerwać.
Sposób podawania
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm należy podawać w infuzji dożylnej trwającej 15 minut.
W przypadku wszystkich roztworów do infuzji w szklanych fiolkach, należy pamiętać, że konieczna jest ścisła kontrola, zwłaszcza pod koniec infuzji, niezależnie od drogi podania. Monitorowanie pod
koniec wlewu dotyczy szczególnie podawania do wkłuć centralnych, aby uniknąć zatoru powietrznego.
Ten produkt leczniczy jest przeciwwskazany do stosowania:
Działania niepożądane można zminimalizować stosując najmniejszą skuteczną dawkę skuteczną przez jak najkrótszy czas niezbędny do opanowania objawów. Ten produkt leczniczy jest przeznaczony do krótkotrwałego stosowania i nie zaleca się jego stosowania dłużej niż przez 2 doby.
Należy unikać jednoczesnego stosowania produktu leczniczego Paracetamol + Ibuprofen Mercapharm z innymi NLPZ, w tym selektywnymi inhibitorami cyklooksygenazy-2.
W celu uniknięcia ryzyka przedawkowania, należy:
Nie należy stosować tego produktu leczniczego z innymi produktami leczniczymi zawierającymi paracetamol, ibuprofen, kwas acetylosalicylowy, salicylany lub z innymi niesteroidowymi lekami przeciwzapalnymi (NLPZ), chyba że lekarz tak zaleci.
Ibuprofen:
Podobnie, jak w przypadku innych produktów leczniczych zawierających ibuprofen, należy unikać stosowania w skojarzeniu z następującymi lekami:
i flukloksacyliny, ponieważ może to się wiązać z rozwojem kwasicy metabolicznej z dużą luką anionową, zwłaszcza u pacjentów z czynnikami ryzyka (patrz punkt 4.4).
Wpływ na badania laboratoryjne
Przyjmowanie paracetamolu może wpływać na wyniki badań kwasu moczowego z użyciem kwasu fosforowolframowego oraz stężenia cukru we krwi z zastosowaniem oksydazy-glukozy-peroksydazy.
Dzieci i młodzież
Badania interakcji przeprowadzono tylko u osób dorosłych.
Ciąża
Brak jest doświadczeń dotyczących stosowania tego produktu leczniczego u kobiet w ciąży. Ze względu na obecność ibuprofenu, produkt leczniczy Paracetamol + Ibuprofen Mercapharm jest przeciwwskazany w trzecim trymestrze ciąży (patrz poniżej).
Dla ibuprofenu
Hamowanie syntezy prostaglandyn może niekorzystnie wpływać na przebieg ciąży i (lub) rozwój zarodka i (lub) płodu. Dane z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia oraz wad rozwojowych serca i wytrzewienia po zastosowaniu inhibitora syntezy prostaglandyn we wczesnej ciąży. Bezwzględne ryzyko wad rozwojowych układu sercowo-naczyniowego zwiększyło się z mniej niż 1% do około 1,5%. Uważa się, że ryzyko zwiększa się wraz z dawką i czasem trwania leczenia. U zwierząt wykazano, że podawanie inhibitora syntezy prostaglandyn powoduje zwiększoną utratę ciąż oraz zwiększoną śmiertelność zarodków i płodów zarówno w fazie przedimplementacyjnej jak i poimplantacyjnej. Ponadto u zwierząt, którym w okresie organogenezy podawano inhibitor syntezy prostaglandyn, zgłaszano zwiększoną częstość występowania różnych wad rozwojowych,
w tym wad układu sercowo-naczyniowego.
Od 20. tygodnia ciąży stosowanie produktu leczniczego Paracetamol + Ibuprofen Mercapharm może powodować małowodzie wynikające z zaburzeń czynności nerek płodu. Może ono wystąpić wkrótce po rozpoczęciu leczenia i zwykle ustępuje po jego odstawieniu. Ponadto, zgłaszano przypadki zwężenia przewodu tętniczego po zastosowaniu tego leczenia w drugim trymestrze ciąży, z których większość ustąpiła po zaprzestaniu leczenia. W związku z tym, produktu leczniczego Paracetamol +
Ibuprofen Mercapharm nie należy stosować w pierwszym i drugim trymestrze ciąży, jeśli nie jest to bezwzględnie konieczne. Jeśli Paracetamol + Ibuprofen Mercapharm stosuje kobieta, która planuje zajść w ciążę lub jest w pierwszym lub drugim trymestrze ciąży, dawka powinna być możliwe najmniejsza, a czas stosowania jak najkrótszy. Od 20. tygodnia ciąży, po ekspozycji na produkt leczniczy Paracetamol + Ibuprofen Mercapharm przez kilka dni, należy rozważyć monitorowanie przedporodowe pod kątem małowodzia i zwężenia przewodu tętniczego. Należy odstawić produkt leczniczy Paracetamol + Ibuprofen Mercapharm w przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego.
W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą narażać płód na:
W związku z tym, stosowanie produktu leczniczego Paracetamol + Ibuprofen Mercapharm jest przeciwwskazane w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3).
Dla paracetamolu
Duża liczba danych dotyczących kobiet w ciąży stosujących paracetamol wskazuje na to, że nie wywołuje on wad rozwojowych ani nie działa toksycznie na płód lub noworodka. Wyniki badań epidemiologicznych dotyczące rozwoju układu nerwowego u dzieci narażonych na działanie paracetamol w okresie płodowym (in utero) są niejednoznaczne. Paracetamol można stosować
w okresie ciąży, jeżeli jest to klinicznie uzasadnione, jednak należy stosować najmniejszą skuteczną dawkę przez możliwie najkrótszy czas i z możliwie najmniejszą częstością.
Karmienie piersią
Paracetamol przenika do mleka ludzkiego, jednak w ilości nie mającej znaczenia klinicznego,
a dostępne opublikowane dane wskazuję, że nie jest on przeciwwskazaniem do karmienia piersią, o ile nie przekracza się zalecanej dawki.
Ibuprofen i jego metabolity mogą w bardzo małych ilościach przenikać do mleka ludzkiego. Po zastosowaniu w dawkach terapeutycznych przez krótki czas, ryzyko wpływu na niemowlę wydaje się mało prawdopodobne.
W świetle powyższych dowodów nie ma konieczności przerywania karmienia piersią podczas krótkotrwałego leczenia produktem leczniczym Paracetamol + Ibuprofen Mercapharm w zalecanych dawkach.
Płodność
Stosowanie tego produktu leczniczego może zaburzać płodność kobiet i nie jest zalecane u kobiet planujących ciążę. U kobiet, które mają trudności z zajściem w ciążę lub są w trakcie badania niepłodności, należy rozważyć odstawienie tego produktu.
Po zastosowaniu NLPZ mogą wystąpić działania niepożądane, takie jak zawroty głowy, senność, zmęczenie i zaburzenia widzenia. W przypadku wystąpienia tych działań nie należy prowadzić pojazdów ani obsługiwać maszyn.
Badania kliniczne dotyczące produktu leczniczego Paracetamol + Ibuprofen Mercapharm oraz tabletek powlekanych zawierających paracetamol 500 mg i ibuprofen 150 mg, nie wykazały żadnych innych działań niepożądanych poza tymi, które występują po podaniu samego paracetamolu lub ibuprofenu.
Poniżej wymieniono działania niepożądane zgodnie preferowaną terminologią MedDRA według klasyfikacji układów i narządów oraz bezwzględnej częstości ich występowania: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do
<1/1000); bardzo rzadko (<1/10 000); częstość nieznana (nie może być oszacowana na podstawie dostępnych danych).
Zakażenia i zarażenia pasożytnicze | Bardzo rzadko: opisywano zaostrzenie stanu zapalnego związanego z zakażeniem (np. rozwój martwiczego zapalenia powięzi) w związku ze stosowaniem NLPZ. |
Zaburzenia krwi i układu chłonnego | Niezbyt często: zmniejszenie stężenia hemoglobiny i wartości hematokrytu. W trakcie stosowania produktu leczniczego, zgłaszano przypadki występowania krwawień (np. krwawienia z nosa, bardzo obfite krwawienie miesiączkowe), jednak nie ustalono związku przyczynowo-skutkowego. Bardzo rzadko: po zastosowaniu ibuprofenu opisywano występowanie zaburzeń hematopoezy (agranulocytoza, niedokrwistość, niedokrwistość aplastyczna, niedokrwistość hemolityczna, leukopenia, neutropenia, pancytopenia i małopłytkowość z plamicą lub bez plamicy), które mogły jednak nie mieć związku przyczynowego z tym lekiem. |
Zaburzenia układu immunologicznego | Bardzo rzadko: opisywano reakcje nadwrażliwości, w tym wysypki skórne i nadwrażliwość krzyżową z leki sympatykomimetycznymi. Niezbyt często: zgłaszano występowanie innych reakcji alergicznych: choroby posurowiczej, zespołu tocznia rumieniowatego, choroby Schönleina-Henocha, obrzęku naczynioruchowego, jednak nie ustalono związku przyczynowo-skutkowego. |
Zaburzenia metabolizmu i odżywiania | Bardzo rzadko: w przypadku kwasicy metabolicznej związek przyczynowy nie został potwierdzony, ponieważ reakcja wystąpiła po przyjęciu więcej niż jednego leku. Opisano przypadek kwasicy metabolicznej po przyjęciu 75 gramów paracetamolu, 1,95 grama kwasu acetylosalicylowego i niewielkiej ilości płynnego środka czyszczącego stosowanego w gospodarstwie domowym. Pacjent miał również napady drgawkowe w wywiadzie, które według autorów zgłoszenia mogły się przyczynić do zwiększonego stężenia mleczanów świadczących o kwasicy metabolicznej. Działania niepożądane dotyczące metabolizmu obejmują hipokaliemię. Opisywano działania niepożądane w zakresie metabolizmu, w tym kwasicę metaboliczną po znacznym przedawkowaniu paracetamolu. Niezbyt często: ginekomastia, reakcja hipoglikemiczna. |
Zaburzenia układu nerwowego | Często: zawroty głowy, ból głowy, nerwowość. Niezbyt często: depresja, bezsenność, splątanie, chwiejność emocjonalna, senność, aseptyczne zapalenie opon mózgowo- rdzeniowych z gorączką i śpiączką. Rzadko: parestezje, omamy, nietypowe marzenia senne. Bardzo rzadko: paradoksalne pobudzenie, zapalenie nerwu wzrokowego, pogorszenie sprawności psychomotorycznej, pozapiramidowe działania niepożądane, drżenia i drgawki. |
Zaburzenia oka | Niezbyt często: niedowidzenie (niewyraźne widzenie i (lub) pogorszenie widzenia, mroczki i (lub) zmiany widzenia barw), które jest na ogół odwracalne po zaprzestaniu leczenia. U pacjenta z objawami zaburzeń widzenia należy wykonać badanie okulistyczne, obejmujące ocenę centralnego pola widzenia. |
Zaburzenia ucha i błędnika | Bardzo rzadko: zawroty głowy pochodzenia błędnikowego. Często: szumy uszne (w przypadku produktów leczniczych zawierających ibuprofen). |
Zaburzenia serca | Często: obrzęki, zatrzymanie płynów; zatrzymanie płynów zazwyczaj szybko ustępuje po zaprzestaniu stosowania leku. Bardzo rzadko: kołatania serca, częstoskurcz, arytmia i inne zaburzenia rytmu serca. Zgłaszano występowanie nadciśnienia i niewydolności serca w związku z leczeniem NLPZ. |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Niezbyt często: zagęszczenie wydzieliny z układu oddechowego. U dzieci poddawanych wycięciu migdałków zgłaszano stridor (świst krtaniowy). Raportowano też hipoksemię. Bardzo rzadko: reakcje ze strony układu oddechowego, w tym astma, zaostrzenie astmy, skurcz oskrzeli i duszność. |
Zaburzenia żołądka i jelit | Często: ból brzucha, biegunka, niestrawność, nudności, dolegliwości żołądkowe i wymioty, wzdęcie, zaparcie, niewielka utrata krwi z przewodu pokarmowego, która w wyjątkowych przypadkach może powodować anemię. Niezbyt często: wrzód trawienny/owrzodzenie żołądka lub jelit, perforacja lub krwawienie z przewodu pokarmowego ze smolistymi stolcami, niekiedy prowadzące do zgonu, zwłaszcza u osób w podeszłym wieku. Po podaniu produktu leczniczego zgłaszano przypadki wrzodziejące zapalenie błony śluzowej jamy ustnej oraz zaostrzenie zapalenia okrężnicy i choroby Leśniowskiego-Crohna. Rzadziej zgłaszano zapalenie błony śluzowej żołądka i zapalenie trzustki. Zgłaszano przypadki choroby wrzodowej związanej z nadprodukcją kwasu. Bardzo rzadko: zapalenie przełyku, tworzenie się zwężeń podobnych do przepony jelitowej. |
Zaburzenia wątroby i dróg żółciowych | Bardzo rzadko: uszkodzenie wątroby, zwłaszcza podczas długotrwałego leczenia, niewydolność wątroby. Nieprawidłowa czynność wątroby, zapalenie wątroby i żółtaczka. Przedawkowanie paracetamolu może spowodować ostrą niewydolność, niewydolność, martwicę i uszkodzenie wątroby. |
Zaburzenia skóry i tkanki podskórnej | Często: wysypka (w tym typu plamisto-grudkowego), świąd. Bardzo rzadko: łysienie, nadmierna potliwość, plamica i nadwrażliwość na światło. Reakcje pęcherzowe, w tym rumień wielopostaciowy, zespół Stevensa Johnsona i martwica toksyczno- rozpływna naskórka. Zgłaszano bardzo rzadkie przypadki ciężkich reakcji skórnych. W wyjątkowych przypadkach podczas zakażenia wirusem ospy wietrznej mogą wystąpić ciężkie zakażenia skóry i powikłania w obrębie tkanek miękkich. Częstość nieznana: reakcja polekowa z eozynofilią i objawami ogólnoustrojowymi (zespół DRESS, ang. drug reaction with eosinophilia and systemic symptoms), ostra uogólniona osutka krostkowa (ang. acute generalised exanthematous pustulosis, AGEP) |
Zaburzenia nerek i dróg moczowych | Niezbyt często: zatrzymanie moczu. Rzadko: uszkodzenie tkanki nerkowej (martwica brodawek nerkowych), szczególnie podczas długotrwałego leczenia. |
Bardzo rzadko: różne postaci nefrotoksyczności, w tym śródmiąższowe zapalenie nerek, zespół nerczycowy oraz ostra i przewlekła niewydolność nerek. Działania niepożądane dotyczące nerek są obserwowane najczęściej po przedawkowaniu, po przewlekłym nadużywaniu leku (często kilku leków przeciwbólowych) lub w połączeniu z hepatotoksycznością indukowaną paracetamolem. Ostra martwica kanalików nerkowych zazwyczaj występuje w połączeniu z niewydolnością wątroby, ale w rzadkich przypadkach obserwowano ją jako izolowany objaw. Z przewlekłym stosowaniem paracetamolu wiąże się również możliwe zwiększenie ryzyka wystąpienia raka nerkowokomórkowego. Jedno kontrolowane badanie kliniczne z udziałem pacjentów ze schyłkową niewydolnością nerek sugeruje, , że długotrwałe stosowanie paracetamolu może istotnie zwiększać ryzyko schyłkowej niewydolności nerek, zwłaszcza u pacjentów przyjmujących ponad 1000 mg na dobę. | |
Zaburzenia ogólne i stany w miejscu podania | Niezbyt często: gorączka. Bardzo rzadko: uczucie zmęczenia i złe samopoczucie. |
Urazy, zatrucia i powikłania po zabiegach | Niezbyt często: zgłaszano krwotoki pooperacyjne po usunięciu migdałków. |
Badania diagnostyczne | Często: zwiększenie aktywności aminotransferazy alaninowej, zwiększenie aktywności gamma-glutamylotransferazy i nieprawidłowe wyniki prób wątrobowych w związku ze stosowaniem paracetamolu. Zwiększenie stężenia kreatyniny i mocznika we krwi. Niezbyt często: zwiększenie aktywności aminotransferazy asparaginianowej, zwiększenie aktywności fosfatazy zasadowej we krwi, zwiększenie aktywności fosfokinazy kreatynowej we krwi, zmniejszenie stężenia hemoglobiny i zwiększenie liczby płytek krwi. Rzadko: zwiększone stężenie kwasu moczowego we krwi. |
Wyniki badań klinicznych sugerują, że stosowanie ibuprofenu, szczególnie w dużych dawkach (2400 mg/dobę) może wiązać się z niewielkim zwiększeniem ryzyka wystąpienia tętniczych zdarzeń zakrzepowych (na przykład zawału mięśnia sercowego lub udaru) (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa tel.:
+ 48 22 49 21 301, faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy
Paracetamol
Po przedawkowaniu paracetamolu może dojść do uszkodzenia, a nawet niewydolności wątroby. Objawy, które występują w trakcie pierwszych 24 godzin po przedawkowaniu paracetamolu to: bladość skóry, nudności, wymioty, jadłowstręt i ból brzucha. Objawy uszkodzenia wątroby mogą
wystąpić 12 do 48 godzin po zażyciu paracetamolu. Mogą wystąpić zaburzenia metabolizmu glukozy i kwasica metaboliczna. W ciężkim zatruciu, niewydolność wątroby może doprowadzić do encefalopatii, śpiączki i zgonu. Może wystąpić ostra niewydolność nerek z ostrą martwicą kanalików nerkowych nawet bez ciężkiego uszkodzenia wątroby. Zgłaszano przypadki zaburzeń rytmu serca.
Uszkodzenie wątroby może wystąpić u dorosłych po zażyciu 10 g paracetamolu lub większej dawki z powodu zbyt dużej ilości toksycznego metabolitu.
Ibuprofen
Objawy obejmują nudności, ból brzucha i wymioty, zawroty głowy, drgawki i rzadko utratę przytomności. Obrazem klinicznym przedawkowania ibuprofenu może być zahamowanie czynności ośrodkowego układu nerwowego i układu oddechowego.
W ciężkim zatruciu może wystąpić kwasica metaboliczna. Postępowanie
Paracetamol
Po przedawkowaniu paracetamolu konieczne jest szybkie leczenie nawet jeśli nie występują objawy, ze względu na ryzyko uszkodzenia wątroby, które występuje z opóźnieniem kilku godzin lub nawet dni. Zaleca się niezwłoczne rozpoczęcie leczenia u każdego pacjenta, który zażył paracetamol
w dawce 7,5 g lub większej w czasie ostatnich 4 godzin. Należy jak najszybciej wdrożyć swoiste leczenie przeciwdziałające uszkodzeniu wątroby stosując antidotum, np. acetylocysteinę (dożylnie), metioninę (doustnie) lub węgiel aktywowany.
Leczenie przedawkowania paracetamolem należy prowadzić zgodnie z wytycznymi krajowymi.
Ciężkie objawy mogą wystąpić dopiero po 4 lub 5 dniach po przedawkowaniu i w związku z tym należy ściśle obserwować pacjentów przez dłuższy okres.
Ibuprofen
Należy zastosować leczenie objawowe i podtrzymujące oraz uwzględnić w nim utrzymywanie drożności dróg oddechowych i monitorowanie czynności serca oraz czynności życiowych do czasu ustabilizowania stanu pacjenta. Ponieważ lek ma odczyn kwaśny i jest wydalany z moczem, teoretycznie korzystne jest podawanie zasad i wymuszenie diurezy. Poza leczeniem wspomagającym, można zastosować doustnie węgiel aktywowany w celu zmniejszenia wchłaniania i reabsorpcji ibuprofenu.
Grupa farmakoterapeutyczna: inne leki przeciwbólowe i przeciwgorączkowe, anilidy; kod ATC: N02BE51
Mechanizm działania
Dokładne miejsce i mechanizm działania przeciwbólowego paracetamolu nie są dokładnie poznane, wydaje się, że działanie przeciwbólowe wynika z podniesienia progu bólowego. Potencjalny mechanizm może polegać na zahamowaniu szlaku tlenku azotu, którego mediatorami są różnorodne receptory dla neuroprzekaźników, w tym N-metylo-D-asparaginianu i substancji P.
Ibuprofen jest pochodną kwasu propionowego o działaniu przeciwbólowym, przeciwzapalnym i przeciwgorączkowym. Działanie terapeutyczne leku jako NLPZ wynika z hamowania enzymu cyklooksygenazy, co prowadzi do zmniejszenia syntezy prostaglandyn.
Dane doświadczalne wskazują, że ibuprofen może kompetycyjnie hamować działanie małych dawek kwasu acetylosalicylowego polegające na hamowaniu agregacji płytek krwi, gdy leki te są podawane jednocześnie. Niektóre badania farmakodynamiczne wykazały, że po podaniu pojedynczej dawki 400 mg ibuprofenu w ciągu 8 godzin przed podaniem 81 mg kwasu acetylosalicylowego w postaci
farmaceutycznej o natychmiastowym uwalnianiu lub 30 minut po jej podaniu, występuje zmniejszenie wpływu kwasu acetylosalicylowego na powstawanie tromboksanu lub agregację płytek. Pomimo braku pewności czy dane te można ekstrapolować do sytuacji klinicznych, nie można wykluczyć, że regularne, długotrwałe stosowanie ibuprofenu może zmniejszyć działanie kardioprotekcyjne małych dawek kwasu acetylosalicylowego. Nie uważa się za prawdopodobne, aby sporadycznie stosowany ibuprofen miał istotne klinicznie działanie (patrz punkt 4.5).
Badania kliniczne
Do badań klinicznych produktu leczniczego Paracetamol + Ibuprofen Mercapharm nie włączono osób w wieku 65 lat i starszych w celu potwierdzenia, czy odpowiadają oni inaczej na leczenie niż osoby młodsze.
W badaniu III fazy dotyczącym skuteczności działania z udziałem 276 pacjentów z łagodnym do umiarkowanego bólem po zabiegu ścięcia przyśrodkowej wyrośli kostnej (buninektomii), produkt leczniczy Paracetamol + Ibuprofen Mercapharm zapewniał zmniejszenie bólu większe niż placebo lub porównywalne paracetamolu lub ibuprofenu stosowanych w monoterapii.
Analiza sumowanej różnicy w natężeniu bólu (ang. Summed Pain Intensity Difference, SPID) skorygowana w czasie 0-48 godzin wykazała, że produkt leczniczy Paracetamol + Ibuprofen Mercapharm (średnia=23,41; SE=2,50)) skuteczniej łagodził ból niż placebo (średnia= -1,30; SE=3,07), paracetamol (średnia =10,42; SE=2,50) lub ibuprofen (średnia=9,51; SE=2,49), z wysokim poziomem istotności statystycznej (p<0,001).
Tabela 1: Podsumowanie SPID skorygowanego względem czasu (0-48 godzin) według grupy leczenia
Paracetamol + Ibuprofen Mercapharm | Ibuprofen | Paracetamol | Placebo | |
n=75 | n=76 | n=75 | n=50 | |
n | 75 | 76 | 75 | 50 |
Średnia (SE) | 23,41 (2,89) | 9,51 (2,53) | 10,42 (2,49) | -1,30 (2,08) |
Mediana | 23,10 | 5,40 | 3,45 | -4,00 |
Min; Maks. | -34,08 ; 74,17 | -30,68 ; 79,98 | -26,78 ; 65,43 | -22,42 ; 47,50 |
Średnia szacunkowa (SE) | 23,41 (2,50) | 9,51 (2,49) | 10,42 (2,50) | -1,30 (3,07) |
95% przedział ufności | 18,48 ; 28,34 | 4,61 ; 14,40 | 5,49 ; 15,35 | -7,33 ; 4,74 |
Różnica oszacowana (SE) | - | 13,90 (3,53) | 12,99 (3,54) | 24,71 (3,96) |
95% przedział ufności | - | 6,95 ; 20,85 | 6,02 ; 19,96 | 16,92 ; 32,50 |
Wartość p | - | <0,001 | <0,001 | <0,001 |
Wykres 1: Skorygowany w czasie SPID48 do pierwszej dawki leku ratunkowego
Średnia szacunkowa i 95% przedział ufności
Paracetamol + Ibuprofen Ibuprofen Paracetamol Placebo
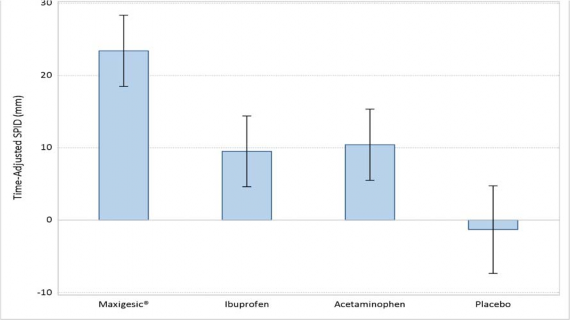
Skorygowana czasem sumowana różnica w intensywności bólu (SPID) (mm)
Wchłanianie
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm podaje się w postaci 15-minutowej infuzji, a maksymalne stężenie każdej substancji czynnej w osoczu jest osiągane pod koniec infuzji. Dwie substancje czynne zawarte w produkcie Paracetamol + Ibuprofen Mercapharm osiągają maksymalne stężenia w osoczu w tym samym czasie i mają w osoczu podobny okres półtrwania (paracetamol 2,39
± 0,27 godziny, ibuprofen 1,88 ± 0,28 godziny).
Parametry farmakokinetyczne produktu leczniczego Paracetamol + Ibuprofen Mercapharm, określono w badaniu z udziałem 29 zdrowych ochotników i przedstawiono w Tabeli 2.
Tabela 2: Średnie (SD) parametry farmakokinetyczne paracetamolu i ibuprofenu w każdej leczonej grupie
Leczenie (Średnia ± SD) | ||||
Paracetamol | Paracetamol + Ibuprofen Mercapharm iv infuzja, 15 min | Paracetamol iv infuzja, 15 min | Paracetamol + Ibuprofen Mercapharm Pół dawki iv infuzja, 15 min | Paracetamol/ Ibuprofen tabletki doustne |
Cmax (ng/ml) | 26709,57 | 26236,06 | 12880,39 | 14907,16 |
± 5814,74 | ± 5430,52 | ± 2553,15 | ± 6255,10 | |
AUC0-t (ng.h/ml) | 37553,97 | 35846,20 | 18327,40 | 34980,80 |
± 9816,96 | ± 8734,15 | ± 4758,34 | ± 9430,21 | |
AUC0-∞ (ng.h/ml) | 39419,95 | 37651,43 | 19337,01 | 37023,82 |
± 10630,63 | ± 9454,60 | ± 5146,46 | ± 10388,31 | |
Tmax (h) | 0,25 (koniec infuzji) | 0,25 (koniec infuzji) | 0,25 (koniec infuzji) | 0,73 ± 0,42 |
t1/2 (h) | 2,39 ± 0,27 | 2,38 ± 0,25 | 2,44 ± 0,25 | 2,51 ± 0,33 |
Ibuprofen | Paracetamol + Ibuprofen Mercapharm iv infuzja, 15 min | Ibuprofen iv infuzja, 15 min | Paracetamol + Ibuprofen Mercapharm Pół dawki iv infuzja, 15 min | Paracetamol/ Ibuprofen tabletki doustne |
Cmax (ng/ml) | 39506,69 | 40292,97 | 20352,05 | 19637,38 |
± 6874,06 | ± 7460,04 | ± 3090,87 | ± 5178,29 | |
AUC0-t (ng.h/ml) | 73492,69 | 72169,59 | 39642,48 | 70417,75 |
± 16509,61 | ± 15608,70 | ± 9679,16 | ± 16260,16 | |
AUC0-∞ (ng.h/ml) | 74743,31 | 73410,65 | 40333,88 | 72202,48 |
± 17388,69 | ± 16500,76 | ± 10240,30 | ± 17445,46 | |
Tmax (h) | 0,25 (koniec infuzji) | 0,25 (koniec infuzji) | 0,25 (koniec infuzji) | 1,49 ± 0,89 |
t1/2 (h) | 1,88 ± 0,28 | 1,87 ± 0,27 | 1,88 ± 0,30 | 1,99 ± 0,36 |
Uwaga: Paracetamol/Ibuprofen tabletki = paracetamol 500 mg + ibuprofen 150 mg, tabletki powlekane
Parametry farmakokinetyczne były podobne po podaniu pojedynczej dawki produktu leczniczego Paracetamol + Ibuprofen Mercapharm dożylnie lub doustnie, z wyjątkiem Cmax dla produktu dożylnego, które było dwukrotnie większe niż dla produktu doustnego i, jak się spodziewano, Tmax po podaniu dożylnym był osiągnięty znacznie szybciej (w 15 minut) niż po podaniu produktu doustnego.
Dystrybucja
Paracetamol jest dystrybuowany do większości tkanek organizmu. Ibuprofen wiąże się z białkami osocza w znacznym stopniu (90-99%).
Metabolizm
Paracetamol podlega intensywnemu metabolizmowi w wątrobie i wydalany jest z moczem, głównie jako nieczynne koniugaty glukuronidowe i siarczanowe. Mniej niż 5% jest wydalane w postaci niezmienionej. Metabolity paracetamolu to m. in. drugorzędny hydroksylowany produkt pośredni, który ma działanie hepatotoksyczne. Ten czynny produkt pośredni zostaje pozbawiony toksyczności poprzez sprzęganie z glutationem; jednak może się kumulować po przedawkowaniu paracetamolu, które jeśli nie jest leczone, może spowodować ciężkie, a nawet nieodwracalne uszkodzenie wątroby.
Ibuprofen podlega intensywnemu metabolizmowi w wątrobie do nieczynnych związków, głównie poprzez glukuronidację.
W badaniu klinicznym ibuprofenu po podaniu pojedynczej dawki na czczo u zdrowych ochotników, oceniano jego wpływ na metabolizm oksydacyjny paracetamolu. Wyniki badań wskazują, że ibuprofen nie zmienia ilości paracetamolu podlegającego oksydacyjnemu metabolizmowi, ponieważ ilość paracetamolu i jego metabolitów (merkapturanu-, cysteiny-, glukuronidu- i siarczanu paracetamolu) była podobna, jak po podaniu wyłącznie paracetamolu lub jednoczesnym podaniu paracetamolu i ibuprofenu w postaci produktu złożonego.
Eliminacja
Okres półtrwania paracetamolu w fazie eliminacji wynosi od około 1 do 3 godzin.
Zarówno nieczynne metabolity, jak i niewielka ilość niezmienionego ibuprofenu są szybko
i całkowicie wydalane przez nerki, przy czym 95% podanej dawki jest wydalane z moczem w ciągu czterech godzin od jego przyjęcia. Okres półtrwania w fazie eliminacji ibuprofenu mieści się
w zakresie od 1,9 do 2,2 godziny.
W badaniach toksyczności po podaniu jednorazowej dawki i dawek wielokrotnych, przeprowadzonych na szczurach, równoczesne podawanie paracetamolu i ibuprofenu w stosunku odpowiadającym temu w produkcie leczniczym Paracetamol + Ibuprofen Mercapharm (tj. stosunku paracetamolu do ibuprofenu wynoszącym 3,3 do 1) i w dawkach porównywalnych do tych, które otrzymywaliby pacjenci przyjmujący produkt Paracetamol + Ibuprofen Mercapharm w maksymalnej zalecanej dawce, nie zwiększało ryzyka toksycznego działania na przewód pokarmowy lub nerki.
W badaniu wpływu pojedynczych dawek dożylnych lub okołożylnych produktu leczniczego Paracetamol + Ibuprofen Mercapharm na wystąpienie ostre miejscowe podrażnienie u samców królików wykazano, że produkt Paracetamol + Ibuprofen Mercapharm ma niewielki potencjał wywoływania miejscowego podrażnienia po podaniu dożylnym (iv) w zalecanej dawce. Ponadto, w przeprowadzonej in vitro ocenie zgodności krwi, nie zaobserwowano dodatkowej hemolizy,
flokulacji/wytrącania białek osocza ani agregacji płytek krwi po zastosowaniu produktu Paracetamol
+ Ibuprofen Mercapharm w porównaniu do zastosowania wyłącznie paracetamolu dożylnie lub wyłącznie ibuprofenu dożylnie.
Ibuprofen
W badaniach toksyczności podprzewlekłej i przewlekłej ibuprofenu na zwierzętach obserwowano głównie uszkodzenia i owrzodzenia przewodu pokarmowego. Badania in vitro i in vivo nie dostarczyły klinicznie istotnych dowodów na mutagenny potencjał ibuprofenu. W badaniach na szczurach i myszach nie znaleziono dowodów na rakotwórcze działanie ibuprofenu. Ibuprofen spowodował zahamowanie owulacji u królików, a także zaburzenia implantacji u różnych gatunków zwierząt (królików, szczurów, myszy). Badania eksperymentalne wykazały, że ibuprofen przenika przez łożysko. Po podaniu dawek toksycznych dla matki zaobserwowano zwiększoną częstość występowania wad rozwojowych (ubytków przegrody międzykomorowej).
Paracetamol
Paracetamol w dawkach hepatotoksycznych wykazywał potencjał genotoksyczny i rakotwórczy u myszy i szczurów (guzy wątroby i pęcherza moczowego). Uważa się jednak, że działanie genotoksyczne i rakotwórcze jest związane ze zmianami w metabolizmie paracetamolu podanego w dużych dawkach/stężeniach i nie stanowi zagrożenia w zastosowaniu klinicznym u ludzi.
Nie są dostępne wyniki konwencjonalnych badań oceny toksycznego wpływu na reprodukcję i rozwój zgodnych z obecnie obowiązującymi standardami.
Cysteiny chlorowodorek jednowodny Disodu fosforan dwuwodny Mannitol (E 421)
Kwas solny (do ustalenia pH)
Sodu wodorotlenek (do ustalenia pH) Woda do wstrzykiwań
Ze względu na brak badań zgodności, tego produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi.
Przechowywać w temperaturze poniżej 25°C. Nie przechowywać w lodówce ani nie zamrażać. Przechowywać fiolkę w opakowaniu zewnętrznym w celu ochrony przed światłem.
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm jest dostarczany w fiolkach ze szkła bezbarwnego typu II o pojemności 100 mL, zamkniętych szarym korkiem z gumy bromobutylowej i aluminiowym wieczkiem typu flip-off, w opakowaniach po 10 fiolek w tekturowym pudełku.
W celu pobrania roztwór z fiolki, należy użyć igły 0,8 mm (igła nr 21G) nakłuwając pionowo korek w oznaczonym miejscu.
U pacjentów o masie ciała poniżej 50 kg, u których nie jest konieczne podanie całej fiolki (100 mL), należy podać odpowiednią ilość, a niewykorzystane resztki roztworu usunąć.
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm należy ocenić wizualnie przed podaniem, aby upewnić się że w roztworze nie ma cząstek stałych i przebarwień, o ile pozwala na to roztwór
i pojemnik. Roztworu nie należy używać, jeśli widoczne są nieprzezroczyste cząstki, przebarwienia lub inne ciała obce.
Ze względu na brak badań zgodności, tego produktu leczniczego nie należy mieszać
z rozcieńczalnikami. Jeśli do podania pojedynczej dawki potrzebna jest część zawartości fiolki, należy podać odpowiednią ilość, a niewykorzystane resztki roztworu usunąć (patrz także punkt 4.2).
Produkt leczniczy Paracetamol + Ibuprofen Mercapharm należy stosować u jednego pacjenta wyłącznie jeden raz. Ten produkt nie zawiera przeciwbakteryjnych środków konserwujących. Wszelkie niewykorzystane resztki roztworu należy usunąć.
Mercapharm Sp. z o.o. ul. Świętopełka 39
81-524 Gdynia
Pozwolenie nr
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











