Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Nafpenzal DC, maść dowymieniowa dla bydła
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii: Intervet International B.V.
Wim de Körverstraat 35 5831 AN Boxmeer Holandia
Nafpenzal DC, maść dowymieniowa dla bydła
1 tubostrzykawka (3 g) zawiera:
Substancje czynne:
Benzylopenicylina prokainowa 300 mg
Nafcylina (w postaci nafcyliny sodowej) 100 mg Dihydrostreptomycyna (w postaci dihydrostreptomycyny siarczanu) 100 mg
Leczenie istniejących zakażeń wymienia (mastitis) w okresie zasuszenia oraz ochrona przed przyszłymi zakażeniami w okresie zasuszenia. Wrażliwe mikroorganizmy: Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis oraz Escherichia coli.
Nie stosować w przypadkach nadwrażliwości na substancję czynną (penicylinę, nafcylinę, dihydrostreptomycynę) lub na dowolną substancję pomocniczą.
Bardzo rzadko obserwowano występowanie reakcji alergicznych.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
O wystąpieniu działań niepożądanych po podaniu tego produktu lub zaobserwowaniu jakichkolwiek niepokojących objawów niewymienionych w ulotce (w tym również objawów u człowieka na skutek kontaktu z lekiem), należy powiadomić właściwego lekarza weterynarii, podmiot odpowiedzialny lub Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.
Formularz zgłoszeniowy należy pobrać ze strony internetowej http://www.urpl.gov.pl (Pion Produktów Leczniczych Weterynaryjnych).
Bydło
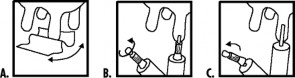
Zawartość jednej tubostrzykawki należy delikatnie wprowadzić do strzyku każdej części gruczołu mlekowego jednokrotnie w okresie zasuszenia. Stosować wyłączenie dowymieniowo.
Przed wprowadzeniem produktu należy dokładnie zdoić gruczoł mlekowy. Strzyk i okolicę jego ujścia należy odpowiednio wyczyścić i zdezynfekować przy użyciu załączonej chusteczki (A). Należy nie dopuścić do zanieczyszczenia konusa tubostrzykawki. Odłamać koniec nasadki i wprowadzić ostrożnie 5 mm końcówki tubostrzykawki (B) lub usunąć całą nasadkę i wprowadzić ostrożnie całą końcówkę tubostrzykawki (C) do kanału strzykowego. Produkt należy rozprowadzić delikatnie
masując strzyk i wymię. Tubostrzykawka przeznaczona jest wyłącznie do jednokrotnego zastosowania.
Tkanki jadalne: 14 dni.
Mleko: 36 godzin od wycielenia przy okresie zasuszenia co najmniej 42 dni. Jeśli okres zasuszenia był krótszy niż 42 dni, przed przeznaczeniem do spożycia mleko należy poddać badaniu na obecność
antybiotyków.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Przechowywać w temperaturze poniżej 25°C. Nie zamrażać.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na etykiecie po upływie EXP.
Okres ważności po pierwszym otwarciu opakowania bezpośredniego: zużyć natychmiast.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Produkt powinien być stosowany w oparciu o wyniki badania lekowrażliwości bakterii
wyizolowanych od zwierzęcia. Jeśli nie jest to możliwe, leczenie powinno być prowadzone w oparciu o lokalne (regionalne, poziom fermy) informacje epidemiologiczne dotyczące wrażliwości wyizolowanych bakterii.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Osoby o znanej nadwrażliwości na penicyliny, inne antybiotyki beta-laktamowe, antybiotyki
aminoglikozydowe lub na dowolną substancję pomocniczą nie powinny stosować tego produktu.
Benzylopenicylina, nafcylina i dihydrostreptomycyna mogą wywoływać nadwrażliwość (alergię) w przypadku wstrzyknięcia, inhalacji, połknięcia lub kontaktu ze skórą. Nadwrażliwość na
cefalosporyny może prowadzić do wystąpienia krzyżowej nadwrażliwości na penicyliny i odwrotnie. Reakcje alergiczne na te substancje mogą mieć niekiedy poważny przebieg. Produktem należy posługiwać się ostrożnie w celu uniknięcia ekspozycji. Produktu leczniczego weterynaryjnego nie powinny podawać kobiety w ciąży.
Jeżeli po stosowaniu produktu wystąpią objawy, takie jak świąd skóry (pokrzywka), należy zwrócić się o pomoc medyczną pokazując lekarzowi niniejsze ostrzeżenie. Obrzęk twarzy, warg czy oczu lub trudności w oddychaniu są poważniejszymi objawami i wymagają niezwłocznego udzielenia pomocy medycznej.
Należy umyć ręce po zastosowaniu chusteczek do higieny strzyków. Jeżeli podejrzewa się lub występuje nadwrażliwość na alkohol izopropylowy, należy stosować rękawiczki ochronne.
Ciąża:
Produkt przeznaczony jest do stosowania w okresie ciąży. Nie obserwowano toksycznego działania na płód.
Laktacja:
Nie stosować w okresie laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Występuje synergizm pomiędzy antybiotykami beta-laktamowymi oraz aminoglikozydami. Może dochodzić do wystąpienia działania antagonistycznego Nafpenzal DC oraz produktów wykazujących działanie bakteriostatyczne. Może dochodzić do powstania szczepów bakterii krzyżowo opornych na inne antybiotyki beta-laktamowe lub aminoglikozydowe.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Nie stwierdzono.
Główne niezgodności farmaceutyczne: Nieznane.
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii. Pomogą one chronić środowisko.
Wielkości opakowań:
Pudełko tekturowe zawierające 4 tubostrzykawki w jednej saszetce wielowarstwowej
(PET/Aluminium/PE) oraz 4 chusteczki do higieny strzyków nasączone 70% roztworem alkoholu izopropylowego i wody oczyszczonej, pakowane pojedynczo w saszetki z folii wielowarstwowej (papier/PE/Aluminium/żywica jonomerowa).
Pudełko tekturowe zawierające 20 tubostrzykawek w jednej saszetce wielowarstwowej
(PET/Aluminium/PE) oraz 20 chusteczek do higieny strzyków nasączonych 70% roztworem alkoholu izopropylowego i wody oczyszczonej, pakowanych pojedynczo w saszetki z folii wielowarstwowej (papier/PE/Aluminium/żywica jonomerowa).
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z podmiotem odpowiedzialnym.











