Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ I INNYCH SUBSTANCJI Opis
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA(-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE Właściwości farmakodynamiczne
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Phenoleptil 25 mg tabletki dla psów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ I INNYCH SUBSTANCJI Opis
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 zwierząt wykazujących działanie(a) niepożądane w jednym cyklu leczenia)
często (więcej niż 1 ale mniej niż 10 na 100 zwierząt)
niezbyt często (więcej niż 1 ale mniej niż 10 na 1000 zwierząt)
rzadko (więcej niż 1 ale mniej niż 10 na 10000 zwierząt)
bardzo rzadko (więcej niż 1 na 10000 zwierząt, włączając pojedyncze raporty).
Można również zgłosić działania niepożądane poprzez krajowy system raportowania (www.urpl.gov.pl)
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA(-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
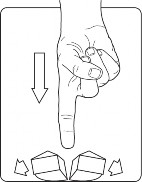
Umieścić tabletkę na płaskiej powierzchni okrągłą stroną do dołu.
Przełamać tabletkę na cztery równe części, naciskając na nią od góry kciukiem lub innym palcem.
OKRES KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
Podmiot odpowiedzialny:
Nazwa: LeVet B.V. Adres: Wilgenweg 7
3421 TV Oudewater Holandia
Wytwórca odpowiedzialny za zwolnienie serii:
Nazwa: LelyPharma B.V. Adres: Zuiveringweg 42
8243 PZ Lelystad Holandia
Phenoleptil 25 mg tabletki dla psów Fenobarbital
Biała do białawej, okrągła, wypukła tabletka z brązowymi cętkami i linią podziału na jednej stronie (8 mm średnicy).
Tabletki mogą być dzielone na dwie lub cztery równe części.
Substancja czynna w 1 tabletce
Fenobarbital 25 mg
Zapobieganie napadom spowodowanym uogólnioną padaczką u psów.
Nie stosować w przypadku nadwrażliwości na substancję czynną lub inne barbiturany. Nie stosować u zwierząt z poważnie upośledzoną funkcją wątroby.
Nie stosować u zwierząt z poważną niewydolnością nerek lub układu sercowo-naczyniowego. Nie stosować u psów ważących mniej niż 2,5 kg.
Podczas rozpoczęcia terapii mogą bardzo rzadko wystąpić ataksja, ospałość, obniżenie aktywności i zawroty głowy, ale efekty te są zwykle przejściowe i u większości, ale nie wszystkich, pacjentów znikają w czasie trwania leczenia.
Niektóre zwierzęta mogą bardzo rzadko wykazywać paradoksalną nadpobudliwość, szczególnie po rozpoczęciu terapii.
Jeżeli ta nadpobudliwość nie jest związana z przedawkowaniem nie ma potrzeby redukcji dawki. Poliuria, polidypsja i polifagia mogą bardzo rzadko wystąpić przy przeciętnych lub wyższych niż terapeutyczne stężeniach aktywnych w surowicy; efekty te mogą zostać zmniejszone poprzez ograniczenie poboru zarówno wody jak i pokarmu.
Sedacja i ataksja często stają się znaczącym problemem (występującym bardzo rzadko), gdy poziomy w surowicy osiągną górne granice dawki leczniczej.
Wysokie stężenia w surowicy mogą być związane z hepatotoksycznością (bardzo rzadko). Fenobarbital może wykazywać działanie uszkadzające na komórki macierzyste szpiku kostnego. Konsekwencjami są pancytopenia tła immunotoksycznego i/lub neutropenia (bardzo rzadko), które ustępują po wycofaniu leczenia.
Leczenie psów fenobarbitalem może obniżyć poziom TT4 lub FT4 w surowicy, jednakże nie może to być oznaką hipotyroidyzmu. Leczenie suplementami hormonów tarczycy powinno być wdrożone
jedynie w przypadku obecności objawów klinicznych tej choroby.
Jeżeli skutki uboczne są poważne, zalecane jest obniżenie podawanej dawki.
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Psy
Droga podania
Do podania doustnego.
Dawkowanie
Zalecana dawka początkowa wynosi 2,5 mg fenobarbitalu na kg m.c. dwa razy dziennie.
Tabletki należy podawać każdego dnia o tej samej porze w celu osiągnięcia skutecznego leczenia.
Ewentualne dostosowywanie tej dawki powinno być wykonane na podstawie skuteczności klinicznej, stężeń we krwi i występowania działań niepożądanych. Wymagana dawka będzie się różnić
w pewnym stopniu między poszczególnymi zwierzętami oraz w zależności od charakteru i stopnia nasilenia choroby.
Linia podziału znajdująca się po jednej stronie tabletki pozwala na podzielenie tabletki na dwie (każda część po 12,5 mg fenobarbitalu) lub cztery (każda część po 6,25 mg fenobarbitalu) równe części.

Stężenia fenobarbitalu w surowicy powinny być mierzone po osiągnięciu ustabilizowanego stanu. Próbki krwi można pobrać w tym samym czasie, aby umożliwić oznaczenie stężenia fenobarbitalu w osoczu najlepiej w najniższym poziomie, krótko przed wymaganą następną dawką fenobarbitalu.
Idealny zakres terapeutyczny fenobarbitalu w surowicy krwi wynosi pomiędzy 15 a 40 µg/ml. Jeżeli stężenia fenobarbitalu w surowicy są niższe niż 15 µg/ml lub napady padaczkowe nie są kontrolowane dawka może zostać zwiększona o 20%, z powiązanym monitorowaniem poziomu fenobarbitalu w surowicy do maksymalnego poziomu fenobarbitalu w surowicy wynoszącym 45 µg/ml. Ostateczne dawki mogą się znacząco różnić (sięgając od 1 mg do 15 mg na kg m.c. dwa razy dziennie) z powodu różnic w wydalaniu fenobarbitalu i różnic wrażliwości wśród pacjentów.
Jeżeli napady padaczkowe nie są dostatecznie kontrolowane i jeżeli maksymalne stężenie wynosi około 40µg/ml, należy ponownie rozważyć postawione rozpoznanie i/lub inny lek przeciwpadaczkowy (taki jak bromek) powinien zostać dołączony do protokołu leczenia.
U ustabilizowanych pacjentów padaczkowych nie jest zalecane przejście z innej postaci fenobarbitalu na tabletki Phenoleptil. Jednakże, jeżeli jest to nieuniknione to należy powziąć dodatkowe środki ostrożności. Zaleca się próbę osiągnięcia dawek podobnych jak to tylko możliwe w porównaniu z poprzednią zastosowaną postacią biorąc pod uwagę obecne pomiary stężenia w surowicy. Protokoły stabilizacji powinny być przestrzegane jak protokoły leczenia początkowego. Zobacz również punkt 12.
Nie dotyczy
Nie przechowywać w temperaturze powyżej 30 ºC.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Przechowywać zawartość w opakowaniu zewnętrznym w celu ochrony przed światłem. Nie stosować po upływie terminu ważności podanym na blistrze i na opakowaniu.
Każdą podzieloną tabletkę należy umieścić w otwartym blistrze i zużyć w ciągu 48 godzin.
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Decyzja o rozpoczęciu leczenia przeciwpadaczkowego przy zastosowaniu fenobarbitalu powinna zostać poddana ocenie dla każdego indywidualnego przypadku i zależeć od liczby, częstotliwości, czasu trwania i ciężkości napadów padaczkowych u psów.
Ogólne zalecenia dotyczące terapii początkowej obejmują pojedynczy napad padaczki występujący
częściej niż co każde 4-6 tygodni, napady padaczkowe gromadne (to jest więcej niż jeden atak w ciągu 24h) lub stan padaczkowy niezależnie od częstotliwości.
Część psów podczas leczenia jest wolnych od napadów padaczkowych, ale część psów wykazuje tylko redukcję napadów padaczkowych lub nie reaguje na podany lek.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Dawki dla mniejszych psów nie mogą być ustalone zgodnie z 20% schematem dawkowania, a zatem należy zwrócić szczególną uwagę na te zwierzęta. Patrz również punkt 9.
Wycofanie fenobarbitalu lub przejście na inny typ lub z innego typu terapii przeciwpadaczkowej powinno być przeprowadzane stopniowo w celu uniknięcia wzrostu częstotliwości napadów padaczkowych.
Zalecana jest ostrożność u zwierząt z upośledzoną funkcją nerek, hipowolemią, anemią i niewydolnością serca lub niewydolnością oddechową.
Przed rozpoczęciem leczenia należy przeprowadzić monitorowanie parametrów wątrobowych. Prawdopodobieństwo działań niepożądanych w postaci hepatotoksyczności może zostać zmniejszone lub oddalone poprzez zastosowanie najniższej jak to możliwe skutecznej dawki. Zalecane jest monitorowanie parametrów wątrobowych w przypadku przedłużonej terapii.
Zalecana jest kliniczna ocena stanu pacjenta 2-3 tygodnie po rozpoczęciu leczenia, a następnie co
każde 4-6 miesięcy np. ocena aktywności enzymów wątrobowych i kwasów żółciowych w surowicy. Ważne jest aby wiedzieć, że skutki niedotlenienia mogą powodować wzrost aktywności enzymów wątrobowych po napadzie padaczkowym.
Fenobarbital może zwiększać aktywność fosfatazy alkalicznej i transaminaz w surowicy. Może to dowodzić zmian niepatologicznych, ale może również reprezentować hepatotoksyczność, tak że
zalecane są badania funkcjonowania wątroby. Zwiększona aktywność enzymów wątrobowych może nie zawsze wymagać redukcji dawki fenobarbitalu, jeżeli poziom kwasów żółciowych w surowicy znajduje się w zakresie referencyjnym.
W świetle pojedynczych doniesień opisujących hepatotoksyczność związaną ze skojarzonym leczeniem przeciwdrgawkowym zaleca się:
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE Właściwości farmakodynamiczne
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii. Pozwolą one na lepszą ochronę środowiska.
Przeciwdrgawkowe działanie fenobarbitalu jest prawdopodobnie wynikiem przynajmniej dwóch mechanizmów będących: obniżonym przekaźnictwem monosynaptycznym, który przypuszczalnie skutkuje zredukowanym pobudzeniem neuronalnym oraz wzrostem progu motorycznego kory dla stymulacji elektrycznej.
Właściwości farmakokinetyczne
Po podaniu doustnym fenobarbitalu psom lek jest natychmiast wchłaniany i maksymalne stężenie w surowicy osiągane jest w ciągu 4-8 godzin. Biodostępność wynosi pomiędzy 86-96%, pozorna objętość dystrybucji wynosi 0,75 l/kg i stabilne stężenie w surowicy osiągane jest na 2-3 tygodnie po rozpoczęciu leczenia.
Około 45% stężenia w surowicy stanowi wiązanie z białkami. Metabolizm zachodzi poprzez
aromatyczną hydroksylację grupy fenylowej w pozycji para (p-hydroksyfenobarbital) i około 25% leku jest wydalane w postaci niezmienionej z moczem. Usuwanie produktu w okresie półtrwania różni się znacząco u poszczególnych osobników i waha się w zakresie 40-90 godzin.
Rodzaj i wielkość opakowania:
100 tabletek w pudełku tekturowym zawierającym 10 blistrów Aluminium/PVC po 10 tabletek. 500 tabletek w pudełku tekturowym zawierającym 50 blistrów Aluminium/PVC po 10 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego:
Dechra Veterinary Products Sp. z o.o. ul. Modlińska 61
03-199 Warszawa
Tel: +48 22 431 28 90
Polska











