Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Canergy vet 100 mg tabletki dla psów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
INNE INFORMACJE
Podmiot odpowiedzialny:
Le Vet Beheer B.V.
Wilgenweg 7
3421 TV Oudewater
Holandia
Wytwórca odpowiedzialny za zwolnienie serii:
Artesan Pharma GmbH & Co KG Wendlandstrasse 1
29439 Lüchow
Niemcy
Lelypharma B.V.
Zuiveringweg 42
8243 PZ Lelystad Holandia
Canergy vet 100 mg tabletki dla psów propentofilina
Tabletka zawiera:
Substancja czynna: Propentofilina 100 mg
Jasnobrązowa z brązowymi kropkami, okrągła i wypukła, aromatyzowana tabletka z linią podziału w kształcie krzyża z jednej strony.
Tabletki można podzielić na 2 lub 4 równe części.
Poprawa krążenia krwi w naczyniach obwodowych i mózgowych. Poprawa stanu w apatii, ospałości
oraz ogólnego zachowania psów.
Nie stosować u psów o masie ciała poniżej 5 kg.
Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą..
Patrz również punkt 12.
W rzadkich przypadkach (więcej niż u 1, ale mniej niż u 10 na 10 000 leczonych zwierząt) zgłaszano alergiczne reakcje skórne, wymioty i zaburzenia pracy serca. W takich przypadkach należy przerwać leczenie.
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Psy
Podstawowe dawkowanie to 6-10 mg propentofiliny na kg masy ciała na dobę, podzielone na dwie dawki w następujący sposób:
Tabletki 100 mg | ||||
Masa ciała (kg) | Rano | Wieczór | Całkowita liczba tabletek na dobę | Całkowita dawka dobowa (mg/kg) |
5 kg-8 kg |
|
| ½ | 6,25-10,0 |
>8 kg-10 kg |
|
| ¾ | 7,5-9,4 |
>10 kg-15 kg |
|
| 1 | 6,7-10,0 |
>15 kg-25 kg |
|
| 1 ½ | 6,0-10,0 |
>25 kg-33 kg |
|
| 2 | 6,1-8,0 |
>33 kg-49 kg |
|
| 3 | 6,1-9,1 |
>49 kg-66 kg |
|
| 4 | 6,1-8,2 |
>66 kg-83 kg |
|
| 5 | 6,0-7,6 |

= ¼ tabletki  = ½ tabletki
= ½ tabletki  = ¾ tabletki
= ¾ tabletki  = 1 tabletka
= 1 tabletka
Przed rozpoczęciem leczenia należy ustalić masę ciała zwierzęcia, aby zapewnić podanie prawidłowej
dawki.
Tabletki można podawać bezpośrednio doustnie, na tył języka psa, lub można zmieszać z małą kulką
pokarmu i należy podawać co najmniej 30 minut przed karmieniem.
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni ze strona z linią podziału była skierowana do góry, a strona wypukła (zaokrąglona) skierowana do powierzchni.
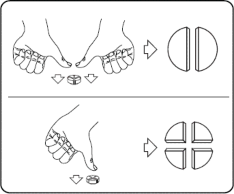
Połówki: nacisnąć kciukami po obu stronach tabletki. Ćwiartki: nacisnąć kciukiem na środek tabletki.
Nie dotyczy
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Okres ważności podzielonych tabletek po pierwszym otwarciu opakowania bezpośredniego: 4 dni. Brak specjalnych środków ostrożności dotyczących temperatury przechowywania produktu leczniczego.
Niezużyta część tabletki powinna być przechowywana w blistrze i umieszczona w tekturowym pudełku
do momentu kolejnego podania.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na pudełku i blistrze po upływie "Termin ważności". Termin ważności oznacza ostatni dzień danego miesiąca.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Należy odpowiednio leczyć swoiste choroby (np. chorobę nerek).
Należy zwrócić uwagę na racjonalizację leczenia psów leczonych już z powodu zastoinowej
niewydolności serca lub choroby oskrzeli.
W przypadku niewydolności nerek konieczne jest zmniejszenie dawki.
Tabletki są aromatyzowane. W celu uniknięcia przypadkowego spożycia, tabletki należy przechowywać w miejscu niedostępnym dla zwierząt.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Należy zachować ostrożność, aby uniknąć przypadkowego połknięcia.
Po przypadkowym połknięciu produktu należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie. Umyć ręce po użyciu.
Niezużyta część tabletki powinna być przechowywana w blistrze i umieszczona w tekturowym
pudełku do momentu kolejnego podania.
Ciąża i laktacja:
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego w czasie ciąży i (lub) laktacji nie zostało określone. Nie zaleca się stosowania u suk w czasie laktacji lub zwierząt hodowlanych.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki):
Tachykardia pobudzeniowa, niedociśnienie tętnicze, zaczerwienienie błon śluzowych i wymioty. Przerwanie leczenia prowadzi do samoistnego ustąpienia tych objawów.
Główne niezgodności farmaceutyczne:
Nie dotyczy
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z
obowiązującymi przepisami.
Blister Aluminium/PA/Aluminium/PVC
Pudełko tekturowe zawierające 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 25 lub 50 blistrów po 10 tabletek
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego:
Dechra Veterinary Products Sp. z o.o.
ul. Modlinska 61
03-199 Warszawa Polska
Tel: +48 22 431 28 90



























