Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Strona 1 z 16
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
Canergy vet 100 mg tabletki dla psów
Każda tabletka zawiera:
Substancja czynna:
Propentofilina 100 mg
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Jasnobrązowa z brązowymi kropkami, okrągła i wypukła, aromatyzowana tabletka z linią podziału w kształcie krzyża z jednej strony.
Tabletki można podzielić na 2 lub 4 równe części.
Psy.
Poprawa krążenia krwi w naczyniach obwodowych i mózgowych. Poprawa stanu w apatii,
ospałości oraz ogólnego zachowania psów.
Nie stosować u psów o masie ciała poniżej 5 kg.
Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Patrz także punkt 4.7
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt Należy odpowiednio leczyć swoiste choroby (np. chorobę nerek).
Należy zwrócić uwagę na racjonalizację terapii psów leczonych już z powodu zastoinowej
niewydolności serca lub choroby oskrzeli.
W przypadku niewydolności nerek konieczne jest zmniejszenie dawki.
Tabletki są aromatyzowane. W celu uniknięcia przypadkowego spożycia, tabletki należy przechowywać w miejscu niedostępnym dla zwierząt.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Należy zachować ostrożność, aby uniknąć przypadkowego połknięcia.
Po przypadkowym połknięciu tabletek należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie. Umyć ręce po użyciu.
Niezużyta część tabletki powinna być przechowywana w blistrze i umieszczona w tekturowym
pudełku do momentu kolejnego podania.
W rzadkich przypadkach (więcej niż u 1, ale mniej niż u 10 na 10 000 leczonych zwierząt) zgłaszano alergiczne reakcje skórne, wymioty i zaburzenia pracy serca. W takich przypadkach należy przerwać leczenie.
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego w czasie ciąży i (lub) laktacji nie zostało określone. Nie zaleca się z tego powodu stosowania u suk w czasie laktacji lub zwierząt hodowlanych.
Nieznane.
Przed leczeniem należy ustalić masę ciała zwierzęcia, aby zapewnić podanie prawidłowej dawki Podstawowe dawkowanie to 6-10 mg propentofiliny/kg masy ciała na dobę, podzielone na dwie dawki w następujący sposób:
Tabletki 100 mg | ||||
Masa ciała (kg) | Rano | Wieczór | Całkowita liczba tabletek na dobę | Całkowita dawka dobowa (mg/kg) |
5 kg-8 kg |
|
| ½ | 6,25-10,0 |
>8 kg-10 kg |
|
| ¾ | 7,5-9,4 |
>10 kg-15 kg |
|
| 1 | 6,7-10,0 |
>15 kg-25 kg |
|
| 1 ½ | 6,0-10,0 |
>25 kg-33 kg |
|
| 2 | 6,1-8,0 |
>33 kg-49 kg |
|
| 3 | 6,1-9,1 |
>49 kg-66 kg |
|
| 4 | 6,1-8,2 |
>66 kg-83 kg |
|
| 5 | 6,0-7,6 |
 = ¼ tabletki
= ¼ tabletki  = ½ tabletki
= ½ tabletki  = ¾ tabletki
= ¾ tabletki  = 1 tabletka
= 1 tabletka
Tabletki można podawać bezpośrednio doustnie, na tył języka psa, lub można zmieszać z małą kulką pokarmu i należy podawać co najmniej 30 minut przed karmieniem.
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni, tak aby strona z linią podziału była skierowana do góry, a strona wypukła (zaokrąglona) skierowana do powierzchni.
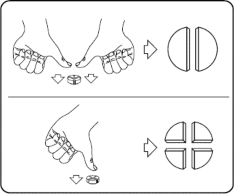
Połówki: nacisnąć kciukami po obu stronach tabletki.
Ćwiartki: nacisnąć kciukiem na środek tabletki.
Tachykardia pobudzeniowa, niedociśnienie tętnicze, zaczerwienienie błon śluzowych i
wymioty.
Przerwanie leczenia prowadzi do samoistnego ustąpienia tych objawów.
Nie dotyczy
Grupa farmakoterapeutyczna: lek rozszerzający naczynia obwodowe; pochodne puryny;
propentofilina
Kod ATCvet: QC04AD90
5.1. Właściwości farmakodynamiczne
Wykazano, że propentofilina zwiększa przepływ krwi, zwłaszcza w sercu i mięśniach szkieletowych. Zwiększa również przepływ krwi w mózgu, a tym samym jego zaopatrzenie w tlen, bez zwiększania zapotrzebowania mózgu w glukozę. Ma niewielkie działanie chronotropowe dodatnie i znaczne działanie inotropowe dodatnie. Ponadto wykazano, że ma działanie znoszące arytmię serca u psów z chorobą niedokrwienną mięśnia sercowego oraz działanie rozszerzające oskrzela odpowiadające działaniu aminofiliny.
Propentofilina hamuje agregację płytek krwi i poprawia właściwości przepływu erytrocytów. Ma bezpośrednie działanie na serce i zmniejsza opór naczyń obwodowych, tym samym zmniejszając obciążenie serca.
Propentofilina może zwiększać gotowość do wysiłku fizycznego i tolerancję wysiłku, zwłaszcza
u starszych psów.
5.2 Właściwości farmakokinetyczne
Po podaniu doustnym propentofilina jest szybko i całkowicie wchłaniana i szybko rozprowadzana w tkankach. Maksymalne stężenie w osoczu osiąga 15 minut po podaniu doustnym psom.
Okres półtrwania wynosi około 30 minut, a biodostępność związku macierzystego wynosi około 30%. Występuje wiele czynnych metabolitów, a biotransformacja odbywa się głównie w
wątrobie. 80-90% propentofiliny jest wydalane w postaci metabolitów przez nerki. Pozostała
część jest wydalana z kałem. Nie występuje bioakumulacja.
Laktoza jednowodna Skrobia kukurydziana Krospowidon
Talk
Krzemionka koloidalna bezwodna Wapnia behenian
Drożdże dezaktywowane Sztuczny aromat wołowiny
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata Okres ważności podzielonych tabletek po pierwszym otwarciu opakowania bezpośredniego: 4 dni.
6,4. Specjalne środki ostrożności podczas przechowywania
Brak specjalnych środków ostrożności dotyczących temperatury przechowywania produktu
leczniczego.
Niezużyta część tabletki powinna być przechowywana w blistrze i umieszczona w tekturowym
pudełku do momentu kolejnego podania.
Blister Aluminium/PA/Aluminium/PVC
Pudełko tekturowe zawierające 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 25 lub 50 blistrów po 10 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Le Vet Beheer B.V.
Wilgenweg 7
3421 TV Oudewater
Holandia
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: {DD/MM/RRRR}
10 DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
{MM/RRRR}



























