Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Cepritect 250 mg Zawiesina dowymieniowa dla krów w okresie zasuszenia
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane podczas leczenia)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii: Norbrook Laboratories Limited,
Newry, County Down,
Irlandia Północna BT35 6JP
Cepritect 250 mg Zawiesina dowymieniowa dla krów w okresie zasuszenia Cefalon (w postaci cefalonu dwuwodnego)
Każda 3g tubostrzykawka dowymieniowa zawiera
Substancja czynna:
Cefalon (w postaci cefalonu dwuwodnego) 250 mg Homogenna zawiesina w kolorze białym do beżowego.
Do leczenia subklinicznego mastitis przy zasuszaniu i do zapobiegania nowym infekcjom bakteryjnym wymienia w okresie poza laktacją, wywołanym przez Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis, Trueperella pyogenes, Escherichia coli i Klebsiella spp. wrażliwe na cefalon.
Nie stosować u zwierząt ze znaną nadwrażliwością na cefalosporyny, inne antybiotyki β-laktamowe lub na dowolną substancję pomocniczą.
W bardzo rzadkich przypadkach obserwowano reakcje nadwrażliwości u niektórych zwierząt (niepokój, drżenie, obrzęk gruczołu mlekowego, powiek i warg). Reakcje te mogą prowadzić do śmierci.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania (www.urpl.gov.pl)
Bydło w okresie zasuszenia (krowa zasuszona)
Dowymieniowo
Jednorazowe podanie dowymieniowe
250 mg cefalon tj. zawartość jednej tubostrzykawki powinna zostać wprowadzona do kanału strzykowego każdej ćwiartki wymienia bezpośrednio po ostatnim dojeniu w laktacji.
Zawartość jednej tubostrzykawki powinna zostać wprowadzona do kanału strzykowego każdej ćwiartki wymienia bezpośrednio po ostatnim dojeniu w laktacji. Unikać zanieczyszczenia końcówki po zdjęciu nasadki. Przed wprowadzeniem dokładnie wyczyścić i zdezynfekować strzyk za pomocą dołączonej chusteczki do dezynfekcji.
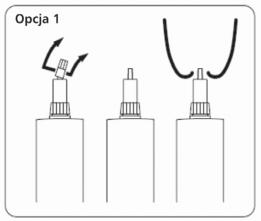
Opcja 1: Do podania dowymieniowego przez krótką kaniulę przytrzymać korpus tubostrzykawki i podstawę nasadki w jednej ręce i odkręcić małą górną część nasadki powyżej zaznaczonego wcięcia (część podstawy nasadki pozostaje na tubostrzykawce). Zachować ostrożność aby nie zanieczyścić krótkiej odkrytej części kaniuli.
Opcja 1: Do podania dowymieniowego przez krótką kaniulę.
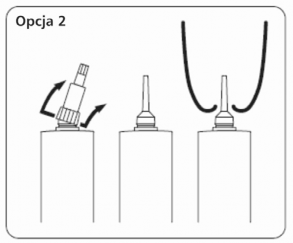
Opcja 2: Do podania dowymieniowego przez długą kaniulę zdjąć całą nasadkę. Trzymając mocno w jednej ręce korpus tubostrzykawki kciukiem odgiąć w bok i do góry całą nasadkę aż odpadnie od kaniuli. Zachować ostrożność aby nie zanieczyścić kaniuli.
Opcja 2: Do podania dowymieniowego przez długą kaniulę
Włóż kaniulę do kanału strzykowego i naciśnij tłoczek tubostrzykawki utrzymując stały nacisk aż zostanie wprowadzona pełna dawka. Trzymając jedną ręką końcówkę strzyka drugą delikatnie masuj go w górę aby rozprowadzić antybiotyk w ćwiartce.
Po wprowadzeniu zaleca się zanurzenie strzyków w preparacie antyseptycznym przeznaczonym specjalnie do tego celu.
Tkanki jadalne: 21 dni Mleko:
96 godzin po wycieleniu jeśli okres zasuszenia był dłuższy niż 54 dni
58 dni po podaniu produktu jeśli okres zasuszenia był krótszy lub równy 54 dni.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Nie przechowywać w temperaturze powyżej 25°C.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na etykiecie i pudełku, po upływie {EXP}.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Stosowanie produktu powinno być oparte na badaniu wrażliwości bakterii wyizolowanych od zwierząt. Jeśli nie jest to możliwe, leczenie powinno opierać się na lokalnych (regionalnych, na poziomie gospodarstwa) informacjach epidemiologicznych na temat wrażliwości docelowych bakterii. Stosowanie produktu w sposób odbiegający od instrukcji podanych w tej ulotce informacyjnej może zwiększyć częstość występowania bakterii opornych na cefalon i może zmniejszyć skuteczność leczenia innymi beta-laktamami.
Skuteczność produktu jest ustalona tylko w odniesieniu do patogenów wymienionych w tej ulotce informacyjnej w dziale dotyczącym wskazań. W konsekwencji po zasuszeniu może pojawić się ostre zapalenie wymienia (potencjalnie śmiertelne) wywołane przez inne patogeny, szczególnie przez Pseudomonas aeruginosa.
W celu zmniejszenia tego ryzyka należy starannie przestrzegać dobrej praktyki higienicznej.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom: Po użyciu umyć ręce.
Penicylina i cefalosporyny mogą powodować uczulenie (alergię) po wstrzyknięciu, wdychaniu, połknięciu lub kontakcie ze skórą. Wrażliwość na penicylinę może prowadzić do krzyżowej wrażliwości na cefalosporynę i odwrotnie. Reakcje alergiczne na te substancje mogą okazjonalnie być poważne.
Osoba u której stwierdzono nadwrażliwość na produkt lub której doradzono unikanie kontaktu z tym rodzajem leku, nie powinna podawać produktu. Aby uniknąć narażenia należy ostrożnie obchodzić się z tym produktem, zachowując wszystkie zalecane środki ostrożności.
W przypadku wystąpienia objawów po narażeniu, takich jak wysypka skórna, należy zasięgnąć porady lekarskiej i pokazać lekarzowi to ostrzeżenie. Obrzęk twarzy, warg lub oczu, trudności z oddychaniem są poważniejszymi objawami i wymagają pilnej interwencji medycznej.
Chusteczki do higieny strzyków dostarczone z produktem dowymieniowym zawierają alkohol izopropylowy.
Należy nosić rękawice ochronne w przypadku podejrzenia wystąpienia podrażnienia skóry przez alkohol izopropylowy.
Unikać kontaktu z oczami, ponieważ alkohol izopropylowy może powodować podrażnienie oczu.
Ciąża:
Przeznaczony do stosowania w ostatnim trymestrze ciąży u krów w okresie zasuszenia. Nie ma negatywnego wpływu na płód.
Laktacja:
Nie stosować u krów w okresie laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Cefalosporyn nie należy podawać jednocześnie z bakteriostatycznymi lekami przeciwbakteryjnymi. Jednoczesne stosowanie cefalosporyn i leków nefrotoksycznych może zwiększać toksyczne oddziaływanie na nerki.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Dawki powtórzone u bydła przez trzy kolejne dni nie wywołały żadnych działań niepożądanych.
Główne niezgodności farmaceutyczne:
Brak znanych niezgodności farmaceutycznych
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
05/2018
24 x 3 g tubostrzykawki
60 x 3 g tubostrzykawki
120 x 3 g tubostrzykawki
Niektóre wielkości opakowań mogą nie być dostępne w obrocie .
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego:
ScanVet Poland Sp. z o.o.
Skiereszewo
ul. Kiszkowska 9
62-200 Gniezno
tel. 61 4264920











