Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY Substancja czynna:
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane podczas leczenia)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Cepritect 250 mg Zawiesina dowymieniowa dla krów w okresie zasuszenia [AT, BG, CZ, EE, FR, HU, IE, IT, LV, LT, PT, SK, ES].
Stapenor DCef 250 mg Intramammary Suspension for Dry Cows [DE].
Każda 3g tubostrzykawka dowymieniowa zawiera
Cefalon (w postaci cefalonu dwuwodnego) 250 mg Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Zawiesina dowymieniowa
Homogenna zawiesina w kolorze białym do beżowego.
Bydło w okresie zasuszenia (krowa zasuszona)
Do leczenia subklinicznego mastitis przy zasuszaniu i do zapobiegania nowym infekcjom bakteryjnym wymienia w okresie poza laktacją, wywołanym przez Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis, Trueperella pyogenes, Escherichia coli i Klebsiella spp.wrażliwe na cefalon.
Nie stosować u zwierząt ze znaną nadwrażliwością na cefalosporyny, inne antybiotyki β-laktamowe lub na dowolną substancję pomocniczą.
Patrz punkt 4.7
Brak
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Stosowanie produktu powinno być oparte na badaniu wrażliwości bakterii wyizolowanych od zwierząt. Jeśli nie jest to możliwe, leczenie powinno opierać się na lokalnych (regionalnych, na
poziomie gospodarstwa) informacjach epidemiologicznych na temat wrażliwości docelowych bakterii.
Stosowanie produktu w sposób odbiegający od instrukcji podanych w ChPLW może zwiększyć częstość występowania bakterii opornych na cefalon i może zmniejszyć skuteczność leczenia innymi beta-laktamami.
Skuteczność produktu jest ustalona tylko w odniesieniu do patogenów wymienionych w punkcie 4.2 ChPLW. W konsekwencji po zasuszeniu może pojawić się ostre zapalenie wymienia (potencjalnie śmiertelne) wywołane przez inne patogeny, szczególnie przez Pseudomonas aeruginosa.
W celu zmniejszenia tego ryzyka należy starannie przestrzegać dobrej praktyki higienicznej. Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Po użyciu umyć ręce.
Penicylina i cefalosporyny mogą powodować uczulenie (alergię) po wstrzyknięciu, wdychaniu, połknięciu lub kontaktcie ze skórą. Wrażliwość na penicylinę może prowadzić do krzyżowej wrażliwości na cefalosporynę i odwrotnie. Reakcje alergiczne na te substancje mogą okazjonalnie być poważne.
Osoba u której stwierdzono nadwrażliwość na produkt lub której doradzono unikanie kontaktu z tym rodzajem leku, nie powinna podawać produktu.
Aby uniknąć narażenia należy ostrożnie obchodzić się z tym produktem, zachowując wszystkie zalecane środki ostrożności.
W przypadku wystąpienia objawów po narażeniu, takich jak wysypka skórna, należy zasięgnąć porady lekarskiej i pokazać lekarzowi to ostrzeżenie. Obrzęk twarzy, warg lub oczu, trudności z oddychaniem są poważniejszymi objawami i wymagają pilnej interwencji medycznej.
Chusteczki do higieny strzyków dostarczone z produktem dowymieniowym zawierają alkohol izopropylowy.
Należy nosić rękawice ochronne w przypadku podejrzenia wystąpienia podrażnienia skóry przez alkohol izopropylowy.
Unikać kontaktu z oczami, ponieważ alkohol izopropylowy może powodować podrażnienie oczu.
W bardzo rzadkich przypadkach obserwowano reakcje nadwrażliwości u niektórych zwierząt (niepokój, drżenie, obrzęk gruczołu mlekowego, powiek i warg). Reakcje te mogą prowadzić do śmierci.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Przeznaczony do stosowania w ostatnim trymestrze ciąży u krów w okresie zasuszenia. Nie ma negatywnego wpływu na płód.
Nie stosować u krów w okresie laktacji.
Cefalosporyn nie należy podawać jednocześnie z bakteriostatycznymi lekami przeciwbakteryjnymi. Jednoczesne stosowanie cefalosporyn i leków nefrotoksycznych może zwiększać toksyczne oddziaływanie na nerki.
Dowymieniowo
Zawartość jednej strzykawki powinna zostać wprowadzona do kanału strzykowego każdej ćwiartki wymienia bezpośrednio po ostatnim dojeniu w laktacji. Unikać zanieczyszczenia końcówki po zdjęciu nasadki. Przed wprowadzeniem dokładnie wyczyścić i zdezynfekować strzyk za pomocą dołączonej chusteczki dezynfekcyjnej.
Opcja 1: Do podania dowymieniowego przez krótką kaniulę przytrzymać korpus tubostrzykawki i podstawę nasadki w jednej ręce i odkręcić małą górną część nasadki powyżej zaznaczonego wcięcia (część podstawy nasadki pozostaje na tubostrzykawce). Zachować ostrożność aby nie zanieczyścić krótkiej odkrytej części kaniuli.
Opcja 1: Do podania dowymieniowego przez krótką kaniulę.
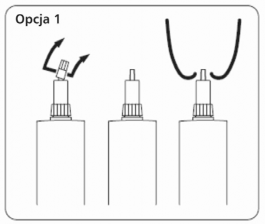
Opcja 2: Do podania dowymieniowego przez długą kaniulę zdjąć całą nasadkę. Trzymając mocno w jednej ręce korpus tubostrzykawki kciukiem odgiąć w bok i do góry całą nasadkę aż odpadnie od kaniuli. Zachować ostrożność aby nie zanieczyścić kaniuli.
Opcja 2: Do podania dowymieniowego przez długą kaniulę
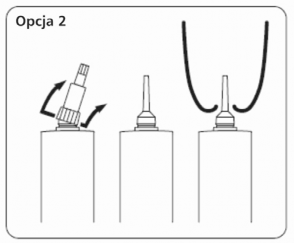
Włóż kaniulę do kanału strzykowego i naciśnij tłoczek tubostrzykawki utrzymując stały nacisk aż zostanie wprowadzona pełna dawka. Trzymając jedną ręką końcówkę strzyka drugą delikatnie masuj go w górę aby rozprowadzić antybiotyk w ćwiartce.
Po wprowadzeniu zaleca się zanurzenie strzyków w preparacie antyseptycznym przeznaczonym specjalnie do tego celu.
Dawki powtórzone u bydła przez trzy kolejne dni nie wywołały żadnych działań niepożądanych.
Tkanki jadalne: 21 dni Mleko:
96 godzin po wycieleniu jeśli okres zasuszenia był dłuższy niż 54 dni
58 dni po podaniu produktu jeśli okres zasuszenia był krótszy lub równy 54 dni.
Grupa farmakoterapeutyczna: Preparaty antybakteryjne dowymieniowe, pierwsza generacja cefalosporyn.
Kod ATC vet: QJ51DB90
Cefalon jest lekiem antybakteryjnym z grupy cefalosporyn pierwszej generacji, działającym przez zahamowanie syntezy ściany komórkowej (bakteriobójcza droga działania). Działanie przeciwbakteryjne nie jest zaburzone w obecności mleka.
Znane są trzy mechanizmy oporności na cefalosporynę: zmniejszona przepuszczalność ściany komórkowej, enzymatyczna inaktywacja i brak specyficznych miejsc wiążących penicylinę. W bakteriach Gram-dodatnich, a zwłaszcza gronkowcach, głównym mechanizmem oporności na cefalosporynę jest zmiana białek wiążących penicylinę. W bakteriach Gram-ujemnych oporność bakterii może polegać na wytwarzaniu β-laktamaz, zwłaszcza β-laktamaz o rozszerzonym spektrum.
Cefalon jest aktywny przeciw: Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis, Trueperella pyogenes, Escherichia coli i Klebsiella spp.
Cefalon jest intensywnie, ale powoli wchłaniany z wymienia i wydalany głównie z moczem. Od 7 do 13% substancji czynnej jest wydalane w moczu w każdym z pierwszych trzech dni po podaniu, podczas gdy dzienne wydalanie w kale wynosi <1% w tym samym okresie.
Średnie stężenie we krwi utrzymuje się na stałym poziomie w ciągu około 10 dni po podaniu, co jest zgodne z powolną, ale długotrwałą absorpcją cefalonu z wymienia.
Długotrwałe utrzymywanie się cefalonu w zasuszonym wymieniu badano w czasie 10 tygodni po podaniu. Skuteczne poziomy cefalonu w wydzielinie wymienia utrzymują się do 10 tygodni po podaniu.
Glinu dwustearynian Parafina płynna
Nieznane
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata.
Nie przechowywać w temperaturze powyżej 25°C.
Jednodawkowe 3g białe tubostrzykawki dowymieniowe z LDPE z podwójnym białym zamknięciem z LDPE typu push-fit
Pudełka tekturowe z 24 i 60 tubostrzykawkami lub pojemniki tekturowe ze 120 tubostrzykawkami zawierającymi 24, 60 lub 120 indywidualnie zapakowanych chusteczek do higieny strzyków nasączonych alkoholem izopropylowym.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Norbrook Laboratories Limited Station Works
Newry
Co. Down, BT35 6JP
Irlandia Północna
05/2018











