Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRESY KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LUB POCHODZĄCYCH Z NIEGO ODPADÓW
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Cefabactin 50 mg tabletki dla psów i kotów
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
Zakażenia dróg oddechowych, szczególnie odoskrzelowe zapalenie płuc, wywołane przez
Staphylococcus aureus, Streptococcus spp., Escherichia coli i Klebsiella spp.
Zakażenia dróg moczowych wywołane przez Escherichia coli, Proteus spp. i Staphylococcus
spp.
Zakażenia skóry u kotów wywołane przez Staphylococcus spp. i Streptococcus spp. oraz
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1 ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1 ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1 ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRESY KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LUB POCHODZĄCYCH Z NIEGO ODPADÓW
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Cefabactin 50 mg tabletki dla psów i kotów Cefaleksyna
Każda tabletka zawiera:
Cefaleksyna (jako cefaleksyna jednowodna) 50 mg
Jasnobrązowa z brązowymi plamkami, okrągła i wypukła tabletka aromatyzowana z liniami podziału
w kształcie krzyża po jednej stronie.
Tabletki mogą być podzielone na 2 lub 4 równe części.
Do leczenia następujących zakażeń:
zakażenia skóry u psów wywołane przez Staphylococcus spp.
Nie stosować w przypadku nadwrażliwości na substancję czynną, na inne cefalosporyny, na inne substancje z grupy β-laktamów lub na dowolną substancję pomocniczą.
Nie stosować w przypadku stwierdzonej oporności na cefalosporyny lub penicyliny. Nie stosować u królików, świnek morskich, chomików i myszoskoczków.
Bardzo często u kotów opisywano przypadki wymiotów i biegunki o łagodnym nasileniu
i przemijającym charakterze nawet przy najniższym zalecanym schemacie dawkowania. U większości kotów objawy te ustępowały bez leczenia objawowego. U psów leczonych produktami zawierającymi cefaleksynę sporadycznie obserwowano wymioty. Podobnie jak przy podawaniu innych antybiotyków, może wystąpić biegunka. W przypadku nawracających wymiotów i (lub) nawracającej biegunki podawanie produktu należy przerwać, a następnie zwrócić się o poradę do prowadzącego lekarza weterynarii. Bardzo rzadko może wystąpić ospałość.
Rzadko może dochodzić do reakcji nadwrażliwości. W przypadku wystąpienia reakcji nadwrażliwości leczenie należy przerwać.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania
(www.urpl.gov.pl).
Psy i koty.
Podanie doustne.
Dawka zalecana wynosi 15–30 mg cefaleksyny na kg masy ciała dwa razy na dzień przez co najmniej 5 kolejnych dni. Prowadzący lekarz weterynarii może wydłużyć okres stosowania produktu
w przypadku np. zakażeń dróg moczowych lub bakteryjnego zapalenia skóry.
W celu zapewnienia prawidłowego dawkowania, aby uniknąć podawania zbyt niskiej dawki masę ciała należy ustalić jak najdokładniej.
Poniższą tabelę przygotowano jako instrukcję podawania produktu w dawce wynoszącej 15 mg cefaleksyny na kg masy ciała dwa razy na dobę:
Podawanie dwa razy na dobę | |||||
Masa ciała | Dawka w mg | Cefabactin 50 mg | Cefabactin 250 mg | Cefabactin 500 mg | Cefabactin 1000 mg |
>0,5 kg – 0,8 kg | 12,5 |
| - | - | - |
>0,8 kg – 1,6 kg | 25 |
| - | - | - |
>1,6 kg – 2,5 kg | 37,5 |
| - | - | - |
>2,5 kg – 3,3 kg | 50 |
| - | - | - |
>3,3 kg – 5 kg | 75 |
| - | - | - |
>5 kg – 6,6 kg | 100 |
| - | - | - |
>6,6 kg – 8 kg | 125 |
|
| - | |
>8 kg – 10 kg | 150 |
| - - | - | |
>10 kg – 12,5 kg | 188 | - |
| - | - |
>12,5 kg – 16,6 kg | 250 | - |
|
| - |
>16,6 kg – 20 kg | 313 |
| |||
>20 kg – 25 kg | 375 | - | - | - | |
>25 kg – 29 kg | 438 | - | - | - | |
>29 kg – 33 kg | 500 | - |
|
| |
>33 kg – 41 kg | 625 | - | - | - | |
>41 kg – 50 kg | 750 | - | - |
| |
>50 kg – 58 kg | 875 | - | - | - | |
>58 kg – 66 kg | 1000 | - | - |
| |
>66 kg – 83 kg | 1250 | - | - - |
| |











= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
Tabletkę można podzielić na 2 lub 4 równe części, aby zapewnić dokładne dawkowanie. Położyć tabletkę na płaskiej powierzchni nacięciem do góry.
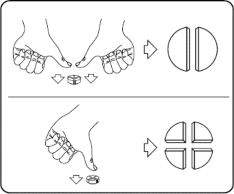
Połówki: docisnąć kciukami obie strony tabletki. Ćwiartki: Nacisnąć kciukiem środek tabletki.
Nie dotyczy.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Okres ważności podzielonych tabletek po pierwszym otwarciu opakowania bezpośredniego: 4 dni.
Nie przechowywać w temperaturze powyżej 25°C.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na na
pudełku po “Termin ważności (EXP)”. „EXP” oznacza ostatni dzień danego miesiąca.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Ze względu na prawdopodobną zmienność (w czasie, geograficzną) występowania oporności bakterii
Podczas stosowania produktu leczniczego weterynaryjnego należy uwzględniać oficjalne krajowe
i regionalne zalecenia dotyczące stosowania substancji przeciwdrobnoustrojowych.
Stosowanie produktu niezgodnie z zaleceniami zawartymi w ulotce informacyjnej może skutkować zwiększeniem częstości występowania oporności bakterii na cefaleksynę i zmniejszeniem skuteczności leczenia innymi antybiotykami beta-laktamowymi ze względu na możliwość wystąpienia oporności krzyżowej.
W przypadku przewlekłej niewydolności nerek należy obniżyć dawkę lub wydłużyć odstęp między
kolejnymi podaniami.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom: Penicyliny i cefalosporyny mogą wywoływać nadwrażliwość (alergię) po wstrzyknięciu, inhalacji, spożyciu lub kontakcie ze skórą. Nadwrażliwość na penicyliny może prowadzić do nadwrażliwości krzyżowej na cefalosporyny i odwrotnie. Reakcje alergiczne na te substancje sporadycznie mogą być ciężkie. Produktu nie powinny podawać osobyze stwierdzoną nadrważliwością lub którym zalecono, by nie pracowały z takimi produktami.
Aby uniknąć przypadkowego połknięcia przez dziecko, podzielone lub niezużyte tabletki należy włożyć z powrotem do otwartego blistra i umieścić z powrotem w opakowaniu zewnętrznym.
Ciąża i laktacja:
Badania laboratoryjne u szczurów i myszy nie wykazały działania teratogennego.
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego u psów i kotów w czasie ciąży i laktacji nie zostało określone. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
W celu zapewnienia skuteczności leczenia, nie należy stosować produktu leczniczego weterynaryjnego w połączeniu z antybiotykami bakteriostatycznymi (makrolidy, sulfonamidy i tetracykliny).
Jednoczesne stosowanie cefalosporyn pierwszej generacji z antybiotykami aminoglikozydowymi lub
niektórymi lekami moczopędnymi, np. furosemidem, może zwiększać ryzyko nefrotoksyczności.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Działania niepożądane inne niż te wymienione w punkcie “Działania niepożądane” nie są znane.
W przypadku przedawkowania należy zastosować leczenie objawowe.
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii. Pomogą one chronić środowisko.
Pudełko tekturowe zawierające 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 lub 25 blistrów po 10 tabletek.
Pudełko tekturowe zawierające 10 oddzielnych pudełek tekturowych, każde zawierające 1 blister po 10 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Podzielna tabletka.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego:
Dechra Veterinary Products sp. z o.o., ul. Modlińska 61, 03-199 Warszawa, Polska
































