Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Hedylon 25 mg, tabletki dla psów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
z zakażeniem wirusowym, grzybiczym lub pasożytniczym, które nie są kontrolowane za pomocą odpowiedniego leczenia
cukrzycą
hiperadrenokortycyzmem
osteoporozą
niewydolnością serca
niewydolnością nerek
owrzodzeniem rogówki
wrzodami przewodu pokarmowego
jaskrą
Nie stosować jednocześnie z atenuowanymi żywymi szczepionkami
Nie stosować w przypadkach nadwrażliwości na substancję czynną, na inne kortykosteroidy lub na dowolną substancję pomocniczą.
Patrz punkty „Ciąża i laktacja” i „Interakcje z innymi produktami leczniczymi lub inne rodzaje interakcji”.
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10 000 leczonych zwierząt włączając pojedyncze raporty).
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania
{www.urpl.gov.pl}.
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
Prednizolon lub inne kortykosteroidy mogą powodować nadwrażliwość (reakcje uczuleniowe).
Osoby o znanej nadwrażliwości na prednizolon lub inne kortykosteroidy, lub na którąkolwiek substancję pomocniczą produktu powinny unikać kontaktu z produktem.
W celu uniknięcia przypadkowego połknięcia, zwłaszcza przez dziecko, niezużyte części tabletki należy włożyć z powrotem do otwartego blistra a następnie do pudełka.
Po przypadkowym połknięciu, szczególnie przez dziecko, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub etykietę.
Kortykosteroidy mogą powodować wady rozwojowe płodu. W związku z tym zaleca się, by kobiety w ciąży unikały kontaktu z produktem leczniczym weterynaryjnym.
Natychmiast po podaniu tabletek należy dokładnie umyć ręce.
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Podmiot odpowiedzialny:
LIVISTO Int’l, S.L.
Av. Universitat Autònoma, 29 08290 Cerdanyola del Vallès (Barcelona), Hiszpania
Wytwórca odpowiedzialny za zwolnienie serii: Industrial Veterinaria, S.A.
Esmeralda, 19
E-08950 Esplugues de Llobregat (Barcelona) Hiszpania
aniMedica GmbH Im Südfeld 9
48308 Senden-Bösensell Niemcy
aniMedica Herstellungs GmbH Im Südfeld 9
48308 Senden-Bösensell Niemcy
Hedylon 25 mg, tabletki dla psów Prednizolon
Każda tabletka zawiera:
Substancja czynna:
Prednizolon 25 mg
Białe okrągłe tabletki z linią podziału w kształcie krzyżyka po jednej stronie i wytłoczoną liczbą 25 po drugiej stronie.
Tabletki można podzielić na 2 lub 4 równe części
Leczenie objawowe lub jako leczenie wspomagające stanu zapalnego i chorób o podłożu immunologicznym u psów.
Nie stosować u zwierząt z:
Wiadomo, że kortykosteroidy o działaniu przeciwzapalnym, takie jak prednizolon, wywołują wiele działań niepożądanych. Pojedyncze, duże dawki są na ogół dobrze tolerowane, jednak ich długotrwałe stosowanie może wywołać ciężkie działania niepożądane.
Odnotowana w trakcie leczenia, zależna od dawki, znaczna supresja wydzielania kortyzolu jest wynikiem zahamowania osi podwzgórze-przysadka-nadnercza po podaniu dawki skutecznej. Po zaprzestaniu leczenia, mogą wystąpić oznaki niewydolności kory nadnerczy, co może spowodować, że zwierzę nie będzie w stanie właściwie reagować w sytuacjach stresowych.
Odnotowany znaczny wzrost stężenia trójglicerydów może być objawem możliwego jatrogennego hiperadrenokortycyzmu (zespół Cushinga) powodującego istotne zmiany w metabolizmie tłuszczów, węglowodanów, białek i minerałów, które mogą prowadzić na przykład do redystrybucji tłuszczów w organizmie, przyrostu masy ciała, osłabienia i zaniku mięśni oraz osteoporozy. Supresja wydzielania kortyzolu i zwiększenie stężenia trójglicerydów w osoczu jest bardzo często występującym działaniem niepożądanym leków zawierających kortykosteroidy (więcej niż 1 na 10 zwierząt).
Obserwowano zmiany w parametrach biochemicznych, hematologicznych i wątrobowych prawdopodobnie związane ze stosowaniem prednizolonu, obejmujące znaczny wpływ na fosfatazę alkaliczną (wzrost), dehydrogenazę mleczanową (obniżenie), albuminy (wzrost), eozynofile, limfocyty (spadek), neutrofile segmentowe (wzrost) oraz enzymy wątrobowe w surowicy (wzrost).
Obserwowano również zmniejszenie aktywności aminotransferazy asparaginianowej. Ogólnoustrojowo podawane kortykosteroidy mogą powodować poliurię, polidypsję i polifagię, szczególnie w początkowym okresie leczenia. Niektóre kortykosteroidy podczas długotrwałego stosowania mogą powodować zatrzymywanie sodu i wody w organizmie oraz hipokaliemię.
Ogólnoustrojowe kortykosteroidy powodowały odkładanie się wapnia w skórze (wapnica skóry). Stosowanie kortykosteroidów może opóźniać gojenie ran, a ich działanie immunosupresyjne może osłabiać odporność lub nasilać istniejące infekcje.
U zwierząt leczonych kortykosteroidami zgłaszano owrzodzenie układu pokarmowego. Steroidy mogą powodować zaostrzenie owrzodzenia układu pokarmowego u zwierząt, którym podaje się niesteroidowe leki przeciwzapalne i u zwierząt z urazem rdzenia kręgowego.
Inne działania niepożądane, które mogą wystąpić obejmują: zahamowanie wzrostu kości na długość, zanik skóry, cukrzycę, zaburzenia zachowania (ekscytacja i depresja), zapalenie trzustki, spadek syntezy hormonu tarczycy, zwiększenie syntezy hormonu przytarczyc. Patrz także punkt „Ciąża i laktacja”.
Częstość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Psy
Podanie doustne.
Dawkę i całkowity okres leczenia, w dopuszczalnym zakresie dawkowania, ustala lekarz weterynarii indywidualnie dla każdego przypadku w zależności od nasilenia objawów.
Dawka początkowa: 0,5 - 2,0 mg na kg masy ciała na dobę.
Przy powyższych poziomach dawkowania może być wymagane podawanie przez okres od jednego do trzech tygodni. W przypadku długotrwałego leczenia: w momencie, gdy po okresie codziennego podawania dawki uzyskano pożądany efekt, dawkę należy zmniejszać do czasu uzyskania najniższej skutecznej dawki. Zmniejszanie dawki powinno się odbywać z zastosowaniem leczenia co drugi dzień i (lub) zmniejszeniem dawki o połowę co 5-7 dni do momentu uzyskania najniższej skutecznej dawki. Leczenie u psów należy stosować rano ze względu na różnice w rytmie dnia.
Poniższa tabela zawiera wskazówki dotyczące podawania produktu w minimalnej dawce 0,5 mg/kg
m.c. i maksymalnej dawce 2 mg/kg m.c.:
Liczba tabletek | ||
Hedylon 25 mg dla psów | ||
Masa ciała (kg) | Minimalna dawka 0,5 mg/kg m.c. | Maksymalna dawka 2 mg/kg m.c. |
> 10 - 12,5 kg | ¼ | 1 |
>12,5 - 25 kg | ½ | 1-2 |
>25 - 37,5 kg | ¾ | 2-3 |
> 37,5 - 50 kg | 1 | 3-4 |
> 50 - 62,5 kg | 1 ¼ | 4-5 |
> 62,5 - 75 kg | 1 ½ | 5-6 |
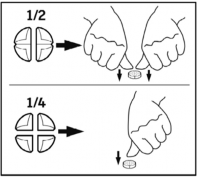
= ¼ tabletki  = ½ tabletki
= ½ tabletki  = ¾ tabletki
= ¾ tabletki  = 1 tabletka
= 1 tabletka
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania.
Nie dotyczy.
Przechowywać w temperaturze poniżej 25°C.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Przechowywać blister w opakowaniu zewnętrznym w celu ochrony przed światłem.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na pudełku po "Termin ważności (EXP)". Termin ważności oznacza ostatni dzień danego miesiąca.
Każdą niewykorzystaną część tabletki należy ponownie umieścić w blistrze i zużyć w ciągu 4 dni.
Specjalne środki ostrożności dla każdego z docelowych gatunków zwierząt:
Podawanie kortykosteroidów ma na celu spowodowanie poprawy w zakresie objawów klinicznych, a nie wyleczenie. Leczenie powinno być skojarzone z leczeniem choroby podstawowej i (lub) kontrolą środowiska.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
W przypadkach obecności infekcji bakteryjnej, produkt należy stosować w skojarzeniu z odpowiednim leczeniem antybakteryjnym. Farmakologicznie czynne poziomy dawek mogą powodować niewydolność kory nadnerczy. Tego typu niewydolność może się ujawnić zwłaszcza po zakończeniu leczenia kortykosteroidem. Niewydolność kory nadnerczy można zminimalizować wprowadzając leczenie co drugi dzień, jeśli jest to możliwe. Dawkę należy zmniejszać i wycofywać stopniowo, aby uniknąć wystąpienia niewydolności kory nadnerczy (patrz punk „Dawkowanie dla każdego gatunku, droga(i) podania i sposób podania”).
Kortykosteroidy, takie jak prednizolon, nasilają katabolizm białek. W związku z tym produkt należy stosować ostrożnie u starych lub niedożywionych zwierząt.
Kortykosteroidy, takie jak prednizolon, należy stosować ostrożnie u zwierząt z nadciśnieniem, padaczką, oparzeniami, uprzednio występującą miopatią steroidową, u zwierząt o obniżonej odporności i u młodych zwierząt, ponieważ kortykosteroidy mogą powodować opóźnienie wzrostu.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Ciąża i laktacja:
Nie stosować u zwierząt w okresie ciąży. Badania laboratoryjne wykazały, że podawanie na początku ciąży może powodować nieprawidłowości u płodu. Stosowanie w późniejszych okresach ciąży może powodować poronienie lub przedwczesny poród.
Glikokortykosteroidy przechodzą do mleka matki i mogą powodować zaburzenia wzrostu u ssących młodych zwierząt. W związku z tym produkt powinien być stosowany u suk w okresie laktacji jedynie
po dokonaniu przez lekarza weteryanrii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Fenytoina, barbiturany, efedryna i ryfampicyna mogą przyspieszać klirens metaboliczny kortykosteroidów, zmniejszając ich stężenie we krwi i osłabiając ich działanie fizjologiczne. Jednoczesne podawanie tego produktu leczniczego weterynaryjnego z niesteroidowymi lekami przeciwzapalnymi może zaostrzać owrzodzenie przewodu pokarmowego.
Podanie prednizolonu może wywołać hipokaliemię i w związku z tym zwiększać ryzyko wystąpienia toksyczności po podaniu glikozydów nasercowych. Ryzyko hipokaliemii może wzrosnąć w przypadku jednoczesnego stosowania prednizolonu z diuretykami obniżającymi poziom potasu.
Należy zachować ostrożność w przypadku jednoczesnego stosowania z insuliną.
Leczenie produktem leczniczym weterynaryjnym może zmieniać skuteczność szczepienia. W przypadku szczepienia atenuowanymi żywymi szczepionkami należy zachować dwutygodniowy odstęp przed lub po leczeniu.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Przedawkowanie nie powoduje innych działań niepożądanych niż wymienione w punkcie „Działania niepożądane”.
Brak swoistego antidotum. Objawy przedawkowania należy leczyć objawowo.
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
O sposoby usunięcia bezużytecznych leków zapytaj lekarza weterynarii lub farmaceutę. Pozwolą one na lepszą ochronę środowiska.
12/01/2022
Blister z nieprzezroczystego PVC/aluminium. Wielkości opakowań:
Pudełko zawierające 1, 3, 5, 10, lub 25 blistrów po 10 tabletek. Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego:
LIVISTO Sp. z o.o.
ul. Chwaszczyńska 198a PL - 81-571 Gdynia











